 , 张南, 杨亚威, 陶雨萌, 吕培
, 张南, 杨亚威, 陶雨萌, 吕培
 , 花日茂
, 花日茂

安徽农业大学, 资源与环境学院, 安徽省农产品质量安全重点实验室, 合肥 230036
收稿日期: 2021-05-26; 修回日期: 2021-06-21; 录用日期: 2021-06-21
基金项目: 国家自然科学基金(No.31672058);国家重点研发计划项目(No.2016YFD0200205)
作者简介: 郑小玉(1990—), 女, E-mail: 646378648@qq.com
通讯作者(责任作者): 吕培, 男, 博士, 副教授, 硕士生导师, 研究领域为污染物光催化降解与农药环境毒理. E-mail: lvpei@ahau.edu.cn
花日茂, 男, 博士, 教授, 博士生导师, 研究领域为污染物在环境中的降解与修复、农药残留分析与环境毒理、农药科学应用与风险评估. E-mail: rimaohua@ahau.edu.cn
摘要:为研究百菌清的光化学降解,研究了两种外源物质(天然提取物儿茶素和表儿茶素没食子酸酯)在不同条件下对百菌清的光化学降解作用效应和降解途径.结果表明:百菌清(1.88 μmol)水溶液中分别加入10物质的量比的儿茶素和表儿茶素没食子酸酯,在太阳光、紫外灯、高压汞灯照射下百菌清的光降解半衰期分别为12.4、15.4 min,10.7、12.8 min和6.2、2.3 min,儿茶素和表儿茶素没食子酸酯作用下的百菌清降解速率分别提高10.8~37.6和10.0~18.6倍.在稻田水、池塘水和田沟水3种自然水中,百菌清在3种光源下的降解半衰期分别为22.4~86.6、21.7~99.0和14.8~86.6 min;当添加10当量儿茶素时,百菌清的光降解速率分别提高3.0~5.9、1.5~3.0和1.8~2.9倍;当添加10当量表儿茶素没食子酸酯时,百菌清的光降解速率分别提高1.4~4.8、1.6~5.0和2.0~4.3倍.百菌清在儿茶素、表儿茶素没食子酸酯作用下主要降解产物为5-氯-1,3-二氰苯,避免了高毒降解产物4-羟基百菌清的产生;作用机理表现为发生光还原脱氯反应.研究结果可为百菌清使用过程中产生的水体污染修复提供技术参考.
关键词:百菌清儿茶素表儿茶素没食子酸酯水光降解
Photodegradation of chlorothalonil by catechin and (-)-Epicatechin gallate in water
ZHENG Xiaoyu
 , ZHANG Nan, YANG Yawei, TAO Yumeng, Lü Pei
, ZHANG Nan, YANG Yawei, TAO Yumeng, Lü Pei
 , HUA Rimao
, HUA Rimao

Key Laboratory of Agri-food Safety of Anhui Province, School of Resource and Environment, Anhui Agricultural University, Hefei 230036
Received 26 May 2021; received in revised from 21 June 2021; accepted 21 June 2021
Abstract: To study the photodegradation of chlorothalonil, the effect of photolysis and degradation pathway of chlorothalonil with two natural compounds (catechin and (-)-epicatechin gallate) under different conditions were investigated. The results showed that, the half-lives (T1/2) of chlorothalonil were 12.4 and 15.4 min at the presence of catechin and (-)-epicatechin gallate under sunlight, 10.7 and 12.8 min under UV and 6.2 and 2.3 min under high-pressure mercury lamp (HPML) irradiation, respectively. The degradation rates increased 10.8~7.6 and 10.0~18.6 folds compared to the negative controls. In paddy water, pond water and ditch water, the degradation half-lives of chlorothalonil were 22.4~86.6, 21.7~99.0 and 14.8~86.6 min, respectively. After the 10 equivalents of catechin was added, the photodegradation rate of chlorothalonil increased 3.0~5.9, 1.5~3.0 and 1.8~2.9 folds, respectively. After the 10 equivalents of (-)-epicatechin gallate was added, the photodegradation rate of chlorothalonil increased 1.4~4.8, 1.6~5.0 and 2.0~4.3 folds, respectively. The main degradation products of chlorothalonil with catechin and (-)-epicatechin gallate was 5-chloro isophthalonitrile. This pathway avoided the production of 4-hydroxyl chlorothalonil, which is highly toxic. The photodegradation mechanism of chlorothalonil with catechin and (-)-epicatechin was reductive dechlorination reaction. The results could provide technical reference for the remediation of chlorothalonil in water.
Keywords: chlorothalonilcatechin(-) Epicatechin gallatewaterphotodegradation
1 引言(Introduction)百菌清(Chlorothalonil, 英文缩写CTL; 化学名称, 四氯间苯二甲腈, 结构式见图 1a)是一种广谱、高效、非内吸性的多氯芳烃类植物杀菌剂.百菌清的作用机理是与植物病原真菌细胞中的三磷酸甘油醛脱氢酶中含有的半胱氨酸的蛋白质发生作用, 使三磷酸甘油醛脱氢酶失去活性, 阻止真菌的新陈代谢, 进而失去生命力(Mozzachio et al., 1975;Sherrard et al., 2004).
图 1(Fig. 1)
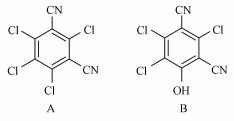 |
| 图 1 百菌清(a)与四羟基百菌清(b)的化学结构 Fig. 1The structure of chlorothalonil (a) and 4-hydroxy chlorothalonil(b) |
百菌清对虹鳟鱼和斑马鱼96 h LC50分别为69和52 μg·L-1, 对其他鱼类等水生动物和两栖动物均具有较强急性毒性和慢性毒性(Yu et al., 2013;Lv et al., 2017;Reyna et al., 2021).在天然水体中百菌清自身降解缓慢, 半衰期为46~52 d(Putnam et al., 2003).据报道, 地下水样品中和城市再生水厂出水中已检测到百菌清和其代谢物4-羟基百菌清(图 1b)(Callicott et al., 2019;王龙等, 2021), 且该代谢物在地下水中比百菌清更具持久性与毒性(Chaves et al., 2008).除了水解(李学德等, 2004)和生物降解(Wang et al., 2011;唐丽伟等, 2016)外, 光化学降解是影响百菌清的环境行为的重要因素之一(Sakkas et al., 2002).百菌清在环境中光降解速度缓慢(Wu et al., 2002;Chaves et al., 2002), 且光降解的主要产物为4-羟基百菌清, 但通过添加外源物质可以加快百菌清的光降解.Affam等分别报道了利用TiO2作为光催化剂降解水溶液中百菌清(Sakkas et al., 2003;Affam et al., 2013).Tan等(2013)研究了锐钛矿型纳米二氧化钛对水溶液中和植物表面上百菌清光降解的影响, 结果表明纳米二氧化钛对水溶液和辣椒表面百菌清均有较强的光敏化降解作用.利用光催化和高级氧化法降解虽然能够快速将百菌清等多氯芳烃降解, 但是在降解过程中容易形成邻氯苯酚类物质4-羟基百菌清, 邻氯苯酚类物质在紫外光条件下能够形成毒性更大、持久性更强的二噁英化合物和二苯并呋喃类化合物(Choudhry et al., 1982;Vollmuth et al., 1994).Porras等(2014)发现腐殖质可以通过光催化还原和能量转移的方式提高百菌清的降解速率;随后研究报道表没食子儿茶素没食子酸酯(EGCG)、原花青素(OPC)以及黄酮类天然提取物对水中百菌清的光降解具有明显促进作用, 且能避免高毒代谢物4-羟基百菌清的产生(Tan et al., 2014;Lv et al., 2017;2020).
黄酮类化合物属植物次生代谢产物, 广泛存在于水果、蔬菜、植物的叶片中(Barreca et al., 2010a;2010b).由于水生植物及农作物秸秆废弃物中黄酮类化合物的转移, 自然水体中也含有不同浓度的黄酮类化合物.前期课题组发现花青素等黄酮类化合物具有促进百菌清光降解的作用, 本文以不同水源和光源作为变量, 利用高效液相色谱(HPLC)外标法研究了儿茶素、表儿茶素没食子酸酯对百菌清在水体中的光化学降解作用效应, 为利用农田水环境中的黄酮类化合物自然光降解农药污染物提供理论指导.
2 材料与方法(Materials and methods)2.1 药剂、试剂和仪器百菌清(chlorothalonil)标准品(纯度≥99%, 上海百灵威科技有限公司);儿茶素(纯度≥98%, Shanghai yuanye Bio-Technology Co., Ltd);表儿茶素没食子酸酯(纯度≥98%, Shanghai yuanye Bio-Technology Co., Ltd);4-羟基百菌清标准品(纯度≥99%, 上海安谱科学仪器有限公司);N, N-二甲基对亚硝基苯胺(PNDA) (纯度≥99%, ANPEL Laboratory Technologies);甲醇、乙腈(色谱纯, 美国天地有限公司);丙酮、正己烷(分析纯, 西陇科学股份有限公司);2, 4, 5-三氯-1, 3-二氰苯、2, 5-二氯-1, 3-二氰苯、5-氯-1, 3-二氰苯通过制备液相分离获得(Lv et al., 2020).
高效液相色谱仪(HPLC, Ultimate3000液相色谱仪, 美国Agilent1260);电子天平(FA1104型, Shanghai Tianping Instrument Factory);紫外-可见分光光度计(UV-1800, 岛津);走马灯旋转式石英水冷光解仪(安徽农业大学设计).
2.2 儿茶素、表儿茶素没食子酸酯对纯水中百菌清光化学降解实验2.2.1 百菌清的光降解实验将百菌清溶液中分别添加儿茶素和表儿茶素没食子酸酯, 配置成物质的量浓度比为1∶0、1∶1、1∶5、1∶10的水反应液, 其中百菌清物质的量浓度为1.88 μmol·L-1 (0.5 mg·L-1), 定容、超声.分别将上述反应液移取10 mL至带磨口石英管中并盖管塞, 分别置于150 W高压汞灯-光强为7600~8900 lx、8 W紫外灯-光强为165~210 lx、太阳光-光强为69000~82000 lx下.光解仪使用循环冷凝水进行控温, 石英管与光源之间的距离为10 cm, 水温度为29~32 ℃, 转速为4 r·min-1, 光照60 min.每间隔10 min进行取样.反应液过0.22 μm水相滤膜后放置、待测.太阳光(31°52′ N, 117°17′ E)下石英管以30°的角度与水平面倾斜.与此同时, 设置对照组为无光条件.
2.2.2 儿茶素和表儿茶素没食子酸酯对纯水中百菌清代谢产物的光化学降解实验分别将4-羟基百菌清、2, 5-二氯-1,3-二氰苯、5-氯-1,3-二氰苯与儿茶素、表儿茶素没食子酸酯分别配置成物质的量浓度比为1∶0、1∶5或1∶10的反应体系, 其中4-羟基百菌清的浓度为0.1 mg·L-1、2, 5-二氯-1,3-二氰苯、5-氯-1,3-二氰苯的浓度为0.5 mg·L-1.定容、超声.分别将上述反应液移取10 mL至光解石英管中并密封, 后置于太阳光、紫外灯和高压汞灯条件下光照60 min.每间隔10 min进行取样.反应液过0.22 μm水相滤膜后待测.
2.3 儿茶素和表儿茶素没食子酸酯对百菌清在自然水中的光化学降解实验本实验中分别采集合肥地区稻田水、田沟水、塘水3个自然水样, 采集后于实验室4 ℃保藏备用, 使用时进行室温放置恢复.将百菌清与儿茶素、表儿茶素没食子酸酯分别配置成物质的量浓度比为1∶0、1∶10的反应体系, 其中百菌清物质的量浓度取值为1.88 μmol·L-1 (0.5 mg·L-1).定容、超声.分别将上述反应液移取10 mL至光解石英管中并盖管塞, 后置于高压汞灯下光照60 min.每隔10 min进行取样.反应液过0.22 μm水相滤膜后待测.
2.4 仪器检测条件百菌清、2, 4, 5-三氯-1, 3-二氰苯、2, 5-二氯-1, 3-二氰苯、5-氯-1, 3-二氰苯检测的色谱条件:ODS-C18色谱柱(250 mm × 4.6 mm, 5 μm);柱温30 ℃;检测波长236 nm;流动相为V(水)∶ V(乙腈)=40∶60;流速1 mL·min-1, 进样量为20 μL;保留时间分别为9.6、6.8、5.3和4.5 min.
4-OH百菌清的检测条件:C18色谱柱(250 mm×4.6 mm, 5 μm);柱温30 ℃;检测波长236 nm;流动相为V(0.5%磷酸水溶液)∶V(乙腈)=40∶60;进样量为20 μL;保留时间为7.6 min.
2.5 计算方法光降解半衰期T1/2符合一级动力学方程, 见式(1)~(2).
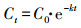 | (1) |
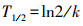 | (2) |
3 结果与讨论(Results and discussion)3.1 儿茶素、表儿茶素没食子酸酯和百菌清的光吸收特征在水溶液中, 百菌清的最大吸收波长为234 nm, 添加儿茶素和表儿茶素没食酸酯后, 溶液中在波长为202 nm和234 nm出现两个最大吸收峰, 202 nm处吸收为儿茶素和表儿茶素没食酸酯的吸收(图 2).在儿茶素和表儿茶素没食酸酯作用下百菌清在波长234 nm处具有更大吸收.百菌清在水溶液中的吸收光谱覆盖了太阳光、紫外和高压汞灯的辐射波长, 因此百菌清在这3种光源下较容易发生光降解.
图 2(Fig. 2)
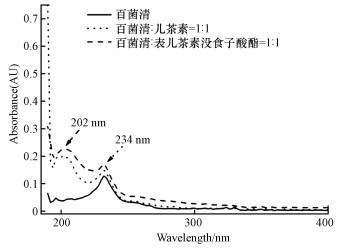 |
| 图 2 水溶液中百菌清、百菌清添加儿茶素和表儿茶素没食酸酯紫外吸收光谱 (百菌清、儿茶素和表儿茶素没食酸酯浓度为1.88 μmol·L-1) Fig. 2Absorption spectra of chlorothalonil, chlorothalonil with catechin and Epicatechin gallate in water at 1.88 μmol·L-1 (with a 1 cm opticalpath) |
3.2 不同物质的量儿茶素和表儿茶素没食子酸酯对于百菌清的光降解促进效应在百菌清的纯水溶液中(1.88 μmol·L-1)分别添加儿茶素、表儿茶素没食子酸酯2种物质, 使百菌清与儿茶素、表儿茶素没食子酸酯物质的量浓度比分别为1∶1、1∶5和1∶10, 然后分别置于高压汞灯、紫外光和太阳光下进行照射.结果表明, 百菌清在高压汞灯、紫外灯、太阳光3种光源下的降解半衰期分别为86.6、138.6和231 min.由表 1可知, 当百菌清与儿茶素和表儿茶素没食子酸酯物质的量浓度比分别为1∶1时, 在高压汞灯、紫外灯、太阳光3种光源下百菌清的光降解半衰期分别为15.1、49.5、173.3 min;当百菌清与表儿茶素没食子酸酯物质的量浓度为1∶1时, 百菌清在高压汞灯、紫外灯、太阳光3种光源下的光降解半衰期分别为26.7、77.0、173.3 min;儿茶素和表儿茶素没食子酸酯对百菌清的光降解均有明显的促进作用, 儿茶素对百菌清的光降解促进作用强于表儿茶素没食子酸酯.
表 1(Table 1)
| 表 1 儿茶素和表儿茶素没食子酸酯对百菌清(1.88 μmol·L-1)光降解的影响 Table 1 Effects of catechin and (-) Epicatechin gallate on the photodegradation of chlorothalonil | |||||||||||||||||||||||||||||||||||||||||||||||
表 1 儿茶素和表儿茶素没食子酸酯对百菌清(1.88 μmol·L-1)光降解的影响 Table 1 Effects of catechin and (-) Epicatechin gallate on the photodegradation of chlorothalonil
| |||||||||||||||||||||||||||||||||||||||||||||||
在同种光源条件下, 随着儿茶素、表儿茶素没食子酸酯与百菌清物质的量的比的增加, 百菌清的光降解速度加快, 降解半衰期缩短.其中儿茶素与百菌清的物质的量浓度比分别为1∶1、1∶5、1∶10时, 汞灯光照下百菌清的半衰期分别为15.1、3.5、2.3 min, 与百菌清自身光降解半衰期相比分别缩短5.7、24.7、37.7倍;紫外光照射下的百菌清光解半衰期分别缩短2.8、6.2、10.8倍;太阳光照射下的百菌清光解半衰期分别缩短1.3、1.7、15倍.
Monadjemi等证明了百菌清光降解过程中百菌清的过渡态为三重激发态, 其最大吸收波长为311 nm和324 nm.太阳光经过大气层到达地面的光波主要分布在可见光区400~760 nm, 而实验所使用高压汞灯辐射波长在250~400 nm以内, 因此百菌清在高压汞灯下更容易达到激发态与活性物质发生光化学反应(Monadjemi et al., 2011).儿茶素、表儿茶素没食子酸酯属于2-苯基苯并二氢吡喃结构的黄酮类化合物(图 3), 具有强的还原能力(Gago et al., 2007), 可以提供H自由基与激发态的百菌清反应, 在自然光照和高压汞灯照射下均能显著提高纯水中百菌清的光降解.在高压汞灯、紫外和太阳光下, 表儿茶素没食子酸酯对百菌清的降解促进作用低于儿茶素, 可能由于C环上的酯基不利于酚氧自由基的形成, 降低了其还原能力.在不同光源条件下, 表现出对百菌清的降解促进作用存在差异, 可能因为黄酮类化合物自身在光照条件下易自身发生氧化, 但是在不同的光源下其氧化反应速率差异导致其浓度的变化不同而影响百菌清的降解(Delorenzo et al., 2009).
图 3(Fig. 3)
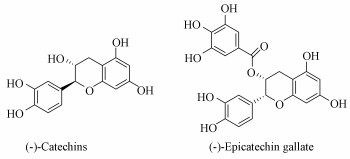 |
| 图 3 儿茶素、表儿茶素没食子酸酯的化学结构 Fig. 3The structures of catechin and (-)-Epicatechin gallate |
3.3 光降解反应体系中百菌清代谢途径分析3.3.1 儿茶素、表儿茶素没食子酸酯作用下百菌清及代谢产物的定性分析百菌清及其4种降解代谢产物经过高效液相色谱检测, 通过向反应体系中加入儿茶素、表儿茶素没食子酸酯后, 百菌清的光降解产物与2, 4, 5-三氯-1, 3-二氰苯、2, 5-二氯-1, 3-二氰苯、5-氯-1, 3-二氰苯标准品中的保留时间一致, 分别在6.8、5.3、4.5 min出峰(图 4a).这说明添加儿茶素、表儿茶素没食子酸酯后, 百菌清的光降解代谢产物为2, 4, 5-三氯-1, 3-二氰苯、2, 5-二氯-1, 3-二氰苯、5-氯-1, 3-二氰苯.
图 4(Fig. 4)
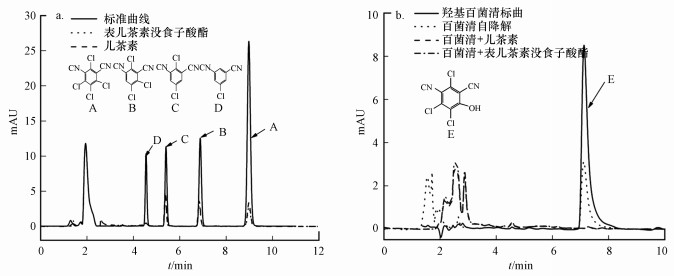 |
| 图 4 高压汞灯条件下百菌清反应液的高效液相色谱图 (A: 百菌清, B:2, 4, 5-三氯-1, 3-二氰苯, C:2, 5-二氯-1, 3-二氰苯, D:5-氯-1, 3-二氰苯, E:4-羟基百菌清) Fig. 4High performance liquid chromatography of chlorothalonil reaction solution under HPML (A: chlorothalonil, B: 2, 4, 5-trichloroisophtalonitrile, C: 2, 5-dichloroisophtalonitrile, D: 5-chloroisophtalonitrile) |
4-羟基百菌清为百菌清在水中自然光降解的主要产物, 具有高毒性和水溶性.当百菌清光降解反应液中添加儿茶素、表儿茶素没食子酸酯时, 反应体系中没有发现4-羟基百菌清产生(图 4b), 而百菌清自身在高压汞灯下降解主要产物为4-羟基百菌清.从表 2可以看出4-羟基百菌清在高压汞灯光照下产生降解, 表明百菌清自身光降解生成的4-羟基百菌清量不是持续累加;当4-羟基百菌清水溶液中加入儿茶素、表儿茶素没食子酸酯时, 4-羟基百菌清光化学降解速率降低, 说明儿茶素、表儿茶素没食子酸酯对4-羟基百菌清的光降解效应低.儿茶素、表儿茶素没食子酸酯对4-羟基百菌清的产生均起到有效的抑制作用.由此得出儿茶素、表儿茶素没食子酸酯改变了百菌清的光降解途径, 避免高毒的邻氯苯酚类化合物4-羟基百菌清的产生, 进而降低了其对环境的潜在危害.
表 2(Table 2)
| 表 2 儿茶素(C)、表儿茶素没食子酸酯(ECG)对四羟基百菌清(CTL-OH)产生的抑制效应 Table 2 Inhibitory effect of catechin and (-)-epicatechin gallate on the formation of CTL-OH | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 2 儿茶素(C)、表儿茶素没食子酸酯(ECG)对四羟基百菌清(CTL-OH)产生的抑制效应 Table 2 Inhibitory effect of catechin and (-)-epicatechin gallate on the formation of CTL-OH
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
3.3.2 儿茶素、表儿茶素没食子酸酯作用下百菌清光降解代谢产物的定量分析选择百菌清浓度为1.88 μmol·L-1、儿茶素和表儿茶素没食子酸酯浓度为18.8 μmol·L-1, 在高压汞灯光照下进行反应, 百菌清在30 min反应过程内降解量以及检测到的代谢物残留量(表 3).百菌清的反应液中添加儿茶素、表儿茶素没食子酸酯后, 百菌清降解的摩尔浓度与其光降解产物的物质的量浓度总和相等, 说明添加儿茶素、表儿茶素没食子酸酯时, 百菌清溶液降解途径为逐步还原脱氯反应.
表 3(Table 3)
| 表 3 百菌清及其代谢物的定量分析 Table 3 Quantitative analysis of chlorothalonil and its metabolites | |||||||||||||||||||||||||||||||||||||||||
表 3 百菌清及其代谢物的定量分析 Table 3 Quantitative analysis of chlorothalonil and its metabolites
| |||||||||||||||||||||||||||||||||||||||||
3.3.3 儿茶素、表儿茶素没食子酸酯对百菌清代谢产物光降解速率的影响为了进一步研究儿茶素、表儿茶素没食子酸酯对于百菌清光降解过程中生成产物的光解途径及反应机理, 分别进行了两种代谢产物(2, 5-二氯-1, 3-二氰苯、5-氯-1, 3-二氰苯)与儿茶素, 及与表儿茶素没食子酸酸酯的光降解实验.由表 3可知, 在高压汞灯光照下, 2, 5-二氯-1, 3-二氰苯自身光降解的半衰期为347 min, 添加儿茶素和表儿茶素没食子酸酯后, 其光降解半衰期分别缩短了16.5倍、13.0倍.由表 3可知, 在上述条件下5-氯-1, 3-二氰苯不发生光降解, 可能是因为儿茶素、表儿茶素没食子酸酯降解百菌清及代谢产物的脱氯反应是依次发生的, 在苯环上的C—Cl键受到邻位和对位氰基的影响很容易断裂被氢原子取代形成还原脱氯产物, 而5-氯-1, 3-二氰苯的C—Cl键没有氰基的邻对位效应, 具有相对较高键能不易断裂形成脱氯产物, 因此5-氯-1, 3-二氰苯为百菌清在儿茶素、表儿茶素没食子酸酯作用下的最终降解产物.文献报道5-氯-1, 3-二氰苯对斑马鱼的毒性比百菌清和4-羟基百菌清对斑马鱼的毒性分别小266倍和6倍(Lv et al., 2017), 儿茶素、表儿茶素没食子酸酯对百菌清的光降解为代谢解毒过程.
表 4(Table 4)
| 表 4 儿茶素、表儿茶素没食子酸酯对2, 5-二氯-1, 3-二氰苯、5-氯-1, 3-二氰苯光降解作用 Table 4 The effect of catechin and (-)-epicatechin gallate on degradation of 2, 5-dichloro-1, 3-dicyanobenzene and 5-chloro-1, 3-dicyanobenzene | ||||||||||||||||||||||||||||||||
表 4 儿茶素、表儿茶素没食子酸酯对2, 5-二氯-1, 3-二氰苯、5-氯-1, 3-二氰苯光降解作用 Table 4 The effect of catechin and (-)-epicatechin gallate on degradation of 2, 5-dichloro-1, 3-dicyanobenzene and 5-chloro-1, 3-dicyanobenzene
| ||||||||||||||||||||||||||||||||
3.4 儿茶素、表儿茶素没食子酸酯对自然水体中百菌清的光敏化降解效应为探究儿茶素、表儿茶素没食子酸酯对百菌清在自然生态水质中的光催化降解效应, 分别研究了百菌清在田沟水、池塘水以及稻田水(水质详见表 6)3种自然水质中的降解.太阳光照射下, 百菌清在稻田水、塘水、田沟水的光降解半衰期分别为86.6、99.0、86.6 min;紫外光照射下, 百菌清在稻田水、塘水、田沟水的光降解半衰期分别为33.0、25.4、14.8 min;高压汞灯光照下, 百菌清在稻田水、塘水、田沟水的光降解半衰期分别为22.4、21.7、22.4 min.当添加10物质的量的儿茶素时, 太阳光照射下, 百菌清在稻田水、塘水、田沟水中的光降解速率增加2.7~3.0倍, 紫外光照射下, 百菌清在稻田水、塘水、田沟水中的光降解速率增加1.5~5.9倍, 高压汞灯照射下, 百菌清在稻田水、塘水、田沟水中的光降解速率增加1.9~4.0倍;当添加10物质的量的表儿茶素没食子酸酯时, 太阳光照射下, 百菌清在稻田水、塘水、田沟水中的光降解速率增加4.3~5.0倍, 紫外光照射下, 百菌清在稻田水、塘水、田沟水中的光降解速率增加1.6~2.0倍, 高压汞灯照射下, 百菌清在稻田水、塘水、田沟水中的光降解速率增加1.4~3.7倍.儿茶素、表儿茶素没食子酸酯均能促进百菌清在在自然水体中的光降解速率.
表 5(Table 5)
| 表 5 儿茶素、表儿茶素没食子酸酯对百菌清在自然水体中光降解效应 Table 5 The effect of catechin and (-)-epicatechin gallate on chlorothalonil in natural water | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 5 儿茶素、表儿茶素没食子酸酯对百菌清在自然水体中光降解效应 Table 5 The effect of catechin and (-)-epicatechin gallate on chlorothalonil in natural water
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 6(Table 6)
| 表 6 3种天然水体成分分析 Table 6 The composition analysis of three natural water | ||||||||||||||||||||||||||||||||||||||||||||||||||||
表 6 3种天然水体成分分析 Table 6 The composition analysis of three natural water
| ||||||||||||||||||||||||||||||||||||||||||||||||||||
添加儿茶素、表儿茶素没食子酸酯时, 百菌清在自然水体中反应速率均明显低于相同条件下纯水反应液中的百菌清光降解速率, 其原因可能与不同水源水中多种离子及有机质含量(DOM)的不同而引起.丁世敏等报道表明水体中离子Fe3+间接影响了体系中活性氧的种类和含量, 并能促进水体中H2O2的产生, 而H2O2作为强氧化物质可影响水体中有机污染物的降解速率(丁世敏等, 2010).根据表 6中自然水体的水体成分分析, 可知稻田水中铁的含量最高, 田沟水次之, 池塘水含量最少, 在太阳光下百菌清的自身光降解速率为稻田水≈田沟水>池塘水, 降解途径主要为光氧化脱氯.在自然水体中添加儿茶素、表儿茶素没食子酸酯, 百菌清在不同水源中的光降解速率发生变化, 可能因为黄酮类物质在水体中影响DOM含量的变化和百菌清的光降解主要解途径为光还原脱氯.根据吕宝玲等研究报道可知, DOM能够抑制多种污染物由其激发三线态引发的光解反应, 这与光解过程中污染物分子的激发被DOM还原到基态有关(吕宝玲等, 2019).百菌清在自然水体中的光降解受水体中离子、DOM的含量、种类等多种因素影响.
4 结论(Conclusions)添加儿茶素和表儿茶素没食子酸酯均能提高百菌清在太阳光、高压汞灯和紫外光条件下的光降解速率, 且随着儿茶素、表儿茶素没食子酸酯与百菌清物质的量比的增加, 百菌清的光降解速度加快;儿茶素和表儿茶素没食子酸酯均能促进百菌清在稻田、池塘水和田沟水3种自然水源中的光降解作用, 儿茶素在3种光源下使百菌清降解速率分别提高3.0~5.9、1.5~3.0、1.8~2.9倍;表儿茶素没食子酸酯百菌清光在3种光源下降解速率分别增加1.4~4.8、1.6~5.0、2.0~4.3倍;百菌清在儿茶素、表儿茶素没食子酸酯作用下的最终降解产物为5-氯-1, 3-二氰苯, 避免了高毒代谢物4-羟基百菌清的产生.
参考文献
| Affam A C, Chaudhuri M. 2013. Degradation of pesticides chlorpyrifos, cypermethrin and chlorothalonil in aqueous solution by TiO2 photocatalysis[J]. Journal of Environmental Management, 130(30): 160-165. |
| Barreca D, Bellocco E, Caristi C, et al. 2010a. Flavonoid composition and antioxidant activity of juices from Chinotto (Citrus x myrtifoliaRaf.) fruits at different ripening stages[J]. Journal of Agricultural & Food Chemistry, 58(5): 3031-3036. |
| Barreca D, Bellocco E, Caristi C, et al. 2010b. Distribution of C-and O-glycosyl flavonoids, (3-hydroxy-3-methylglutaryl) glycosylflavanones and furocoumarins in Citrus aurantium L. juice[J]. Food Chemistry, 124(2): 576-582. |
| Callicott K, Hooper-Bùi L. 2019. An investigation of environmental concentrations of atrazine, chlorothalonil, and fipronil in a Mississippi River-influenced marsh in southern Louisiana[J]. Microchemical Journal, 146: 1241-1248. DOI:10.1016/j.microc.2019.01.060 |
| Chaves A, Shea D, Danehower D. 2008. Analysis of chlorothalonil and degradation products in soil and water by GC/MS and LC/MS[J]. Chemosphere, 71(4): 629-638. DOI:10.1016/j.chemosphere.2007.11.015 |
| Chaves A, Shea D, Cope W G. 2007. Environmental fate of chlorothalonil in a Costa Rican banana plantation[J]. Chemosphere, 69(7): 1166-1174. DOI:10.1016/j.chemosphere.2007.03.048 |
| Choudhry G G, Hutzinger O. 1982. Photochemical formation and degradation of polychlorinated dibenzofurans and dibenzo-p-dioxins[J]. Residue Reviews, 84: 133-160. |
| Delorenzo M E, Wallace S C, Danese L E, et al. 2009. Temperature and salinity effects on the toxicity of common pesticides to the grass shrimp, Palaemonetes pugio[J]. Journal of Environmental Science and Health Part B-Pesticides Food Contaminants and Agricultural Wastes, 44(5): 455-460. |
| 丁世敏, 刘元华, 封享华, 等. 2010. Fe(Ⅲ)/苹果酸/H2O2体系对有机物的光降解特性研究[J]. 环境科学学报, 30(9): 1839-1845. |
| Gago B, Lundberg J O, Barbosa R M, et al. 2007. Red wine-dependent reduction of nitrite to nitric oxide in the stomach[J]. Free Radical Biology and Medicine, 43(9): 1233-1242. DOI:10.1016/j.freeradbiomed.2007.06.007 |
| 李学德, 花日茂, 岳永德, 等. 2004. 百菌清水解的影响因素研究[J]. 安徽农业大学学报, 31(2): 131-134. DOI:10.3969/j.issn.1672-352X.2004.02.003 |
| 吕宝玲, 李威, 于筱莉, 等. 2019. 溶解性有机质对罗红霉素光降解的影响研究[J]. 环境科学学报, 39(3): 747-754. |
| Lv P, Zhang J, Shi T, et al. 2017. Procyanidolic oligomers enhance photodegradation of chlorothalonilin water via reductive dechlorination[J]. Applied Catalysis B, 217: 137-143. DOI:10.1016/j.apcatb.2017.05.065 |
| Lv P, Min S, Wang Y, et al. 2020. Flavonoid-sensitized Photolysis of Chlorothalonil in Water[J]. Pest Management Science, 76(9): 2972-2977. DOI:10.1002/ps.5842 |
| Monadjemi S, El Roz M, Richard C, et al. 2011. Photoreduction of chlorothalonil fungicide on plant leaf models[J]. Environmental Science & Technology, 45(22): 9582-9589. |
| Mozzachio A, Rusiecki J, Hoppin J, et al. 1975. Chlorothalonil exposure and cancer incidence among pesticide applicator participants in the agricultural health study[J]. Environmental Research, 108(3): 400-403. |
| Putnam R A, Nelson J O, Clark J M. 2003. The persistence and degradation of chlorothalonil and chlorpyrifos in a cranberry bog[J]. Journal of Agricultural and Food Chemistry, 51(1): 170-176. DOI:10.1021/jf020744r |
| Porras J, Fernandez J J, Torres-Palma R A, et al. 2014. Humic substances enhance chlorothalonil phototransformation via photoreduction and energy transfer[J]. Environmental Science & Technology, 48(4): 2218-2225. |
| Reyna P B, Albá M L, Rodríguez F A, et al. 2021. What does the freshwater clam, Corbicula largillierti, have to tell us about chlorothalonil effects?[J]. Ecotoxicology and Environmental Safety, 208: 111603. DOI:10.1016/j.ecoenv.2020.111603 |
| Sherrard R M, Bearr J S, Murray-Gulde C L, et al. 2004. Feasibility of constructed wetlands for removing chlorothalonil and chlorpyrifos from aqueous mixtures[J]. Environmental Pollution, 127(3): 385-394. DOI:10.1016/j.envpol.2003.08.017 |
| Sakkas V A, Lambropoulou D A, Albanis T A. 2002. Study of chlorothalonil photodegradation in natural waters and in the presence of humic substances[J]. Chemosphere, 48(9): 939-945. DOI:10.1016/S0045-6535(02)00121-2 |
| Sakkas V A, Albanis T A. 2003. Photocatalyzed degradation of the biocides chlorothalonil and dichlofluanid over aqueous TiO2 suspensions[J]. Applied Catalysis B: Environmental, 46(1): 175-188. DOI:10.1016/S0926-3373(03)00198-X |
| Tan Y Q, Xiong H X, Shi T Z, et al. 2013. Photosensitizing effects of nanometer TiO2 on chlorothalonilphotodegradation in aqueous solution and on the surface of pepper[J]. Journal of Agricultural and Food Chemistry, 61(21): 5003-5008. DOI:10.1021/jf4006005 |
| Tan Y, Huang Q, Shi T, et al. 2014. Promoting photosensitized reductive dechlorination of chlorothalonil using epigallocatechingallate in water[J]. Journal of Agricultural and Food Chemistry, 62(50): 12090-12095. DOI:10.1021/jf504565b |
| 唐丽伟, 卢滇楠, 刘永民. 2016. 百菌清污染土壤生物修复研究进展[J]. 化工环保, 36(2): 131-136. DOI:10.3969/j.issn.1006-1878.2016.02.003 |
| Vollmuth S, Zajc A, Niessner R. 1994. Formation of polychlorinated dibenzo-p-dioxins and polychlorinated dibenzofurans during the photolysis of pentachlorophenol-containing Water[J]. Environmental Science & Technology, 28(6): 1145-1149. |
| 王龙, 徐雄, 朱丹, 等. 2021. 城市再生水厂出水中典型有机污染物的赋存情况及其生态风险评价[J]. 环境科学学报, 41(5): 1910-1919. |
| Wang G L, Liang B, Li F, et al. 2011. Recent advances in the biodegradation of chlorothalonil[J]. Current Microbiology, 63(5): 450-457. DOI:10.1007/s00284-011-0001-7 |
| Wu L, Liu G, Yates M V, et al. 2002. Environmental fate of metalaxyl and chlorothalonil applied to a bentgrass putting green under southern California climatic conditions[J]. Pest Management Science, 58(4): 335-342. DOI:10.1002/ps.461 |
| Yu S Y, Wages M R, Cobb G P, et al. 2013. Effects of chlorothalonil on development and growth of amphibian embryos and larvae[J]. Environmental Pollution, 181: 329-334. DOI:10.1016/j.envpol.2013.06.017 |
