 , 弓晓峰
, 弓晓峰
 , 李远航, 熊捷迁, 孙玉恒, 牛丹妮, 吴莉, 林媛
, 李远航, 熊捷迁, 孙玉恒, 牛丹妮, 吴莉, 林媛南昌大学资源环境与化工学院, 鄱阳湖环境与资源利用教育部重点实验室, 南昌 330031
收稿日期: 2020-10-17; 修回日期: 2021-01-15; 录用日期: 2021-01-15
基金项目: 国家自然科学基金(No.41761095)
作者简介: 舒瑶(1996-), 女, E-mail: 15270989038@163.com
通讯作者(责任作者): 弓晓峰, E-mail: xfgong@ncu.edu.cn
摘要:湿地土壤和沉积物中的Fe(Ⅲ)还原过程是地球化学循环中重要的一部分,目前有关鄱阳湖湿地DOM的化学组成及其与Fe(Ⅲ)还原作用的构效关系尚不明确.为此,以鄱阳湖湿地沉积物中分离筛选出的铁还原菌作为模式菌,Fe(Ⅱ)的生成量作为考察指标进行Logistic方程拟合分析,并采用紫外-可见光谱、三维荧光光谱及XRD光谱,研究了不同浓度和来源的DOM对水铁矿的还原作用,并对"DOM-铁还原菌-水铁矿"体系中电子转移机制进行了探讨.结果表明,DOM对水铁矿的还原具有促进作用,当苔草DOM浓度为30 mg·L-1时,可使Fe(Ⅱ)含量增加39.7%;DOM对Fe(Ⅲ)还原的促进作用与水铁矿含量相关,在水铁矿添加量为0~1000 mg·L-1时,Fe(Ⅱ)含量显著增加,其中1000 mg·L-1下的Fe(Ⅱ)生成量是50 mg·L-1的13.2倍.不同浓度DOM对Fe(Ⅲ)还原的促进作用不同,表现为苔草DOM:150 mg·L-1>100 mg·L-1≈50 mg·L-1≈30 mg·L-1>20 mg·L-1>0 mg·L-1,沉积物和根际土DOM对Fe(Ⅲ)还原的促进作用均随着浓度(20、30、50 mg·L-1)的增加而略有增大.不同来源(苔草、沉积物、根际土)DOM对水铁矿还原的促进作用无显著性差异(p < 0.05).DOM对水铁矿还原的促进作用主要表现为低分子量组分(色氨酸、酪氨酸等)为铁还原菌提供营养物质和大分子量组分(腐殖酸、富里酸)作为电子穿梭物质.这些结果反映了DOM在电子转移反应中的重要性,为DOM的环境属性提出了一个新见解.
关键词:DOM铁还原菌异化Fe(Ⅲ)还原鄱阳湖湿地
Effect of DOM on dissimilatory reduction of ferrihydrite by iron reducing bacteria in Poyang Lake Wetland
SHU Yao
 , GONG Xiaofeng
, GONG Xiaofeng
 , LI Yuanhang, XIONG Jieqian, SUN Yuheng, NIU Danni, WU Li, LIN Yuan
, LI Yuanhang, XIONG Jieqian, SUN Yuheng, NIU Danni, WU Li, LIN YuanSchool of Resources, Enviromental and Chemical Engineering, Key Laboratory of Poyang Lake Environment and Resource Utilization, Ministry of Education, Nanchang University, Nanchang 330031
Received 17 October 2020; received in revised from 15 January 2021; accepted 15 January 2021
Abstract: Fe(Ⅲ) reduction in wetland soils and sediments is an important part of the geochemical cycle. At present, the structure-activity relationship between DOM chemical composition and Fe(Ⅲ) reduction is still unclear. For this reason, the iron-reducing bacteria isolated from the sediments of Poyang Lake wetland were selected as the model bacteria, and the production of Fe(Ⅱ) was used as the investigation index for Logistic equation fitting analysis. The UV-Vis spectrophotometer, three-dimensional fluorescence spectrophotometer and XRD were used to study the reduction of ferrihydrite with different concentrations and sources of DOM, and the electron transfer mechanism in the "DOM-iron reducing bacteria-ferrihydrite" system was discussed. The results showed that DOM could promote the reduction of ferrihydrite. When the concentration of Carex DOM was 30 mg·L-1, the content of Fe (Ⅱ) increased by 39.7%. The promoting effect of DOM on Fe (Ⅲ) reduction was related to the content of ferrihydrite. The content of Fe (Ⅱ) increased significantly in the range of 0~1000 mg·L-1 of ferrihydrite, and the yield of Fe (Ⅱ) at 1000 mg·L-1 of ferrihydrite was 13.2 times higher than that at 50 mg·L-1. The promotion effect of DOM on Fe (Ⅲ) reduction was concentration dependent, and higher concentration of DOM has better performance. The promoting effect of sediment and rhizosphere soil DOM on Fe (Ⅲ) reduction increased slightly with the increase of concentration (20, 30, 50 mg·L-1). There was no significant difference in promoting effect of DOM from different sources (Carex, sediment and rhizosphere soil) on the reduction of ferrihydrite (p < 0.05). Ferrihydrite reduction was mainly manifested that the low molecular weight components (such as tryptophan, tyrosine, etc.) provide nutrients for iron-reducing bacteria and the large molecular weight components (humic acid, fulvic acid) function as electron shuttle substances. These results reflect the importance of DOM in the electron transfer and provide a new insight into the environmental properties of DOM.
Keywords: dissolved organic matteriron reducing bacteria(IRB)dissimilatory iron reductionPoyang Lake wetland
1 引言(Introduction)溶解性有机质(dissolved organic matter, DOM)是广泛分布于土壤、沉积物及水体中的有机组分, 能够以其活跃的生物化学特性积极参与到污染物环境行为过程和全球碳循环中(Battin et al., 2009), 具有重要的生态环境效应.DOM在操作性定义上泛指能通过0.45 μm滤膜的非均质类混合物(Chen et al., 2015), 其已知的主要成分包括碳水化合物、蛋白质、氨基酸、腐殖质、各种亲水性有机酸等(Hosen et al., 2014).长期以来, 有关DOM的研究主要集中在吸附络合属性(Dunnivant et al., 1992), 而最近DOM的氧化还原属性(Tobias et al., 2006; Hye-Bin et al., 2019)逐渐成为一个研究热点.在厌氧环境下, 地表大量存在的DOM能够被铁还原菌、硫还原菌和产甲烷菌等(Lovley et al., 1998)多类菌作为电子受体使用, 加速微生物的异化Fe(Ⅲ)还原过程.
异化Fe(Ⅲ)还原是指微生物以胞外不溶性Fe(Ⅲ)氧化物为终端电子受体, 通过氧化电子供体耦联Fe(Ⅲ)还原, 并从这一过程贮存生命活动所需的能量支持生长的微生物代谢过程(Lovley et al., 2004), 普遍存在于沉积物、土壤和地层中.能通过上述代谢形式进行生命活动的微生物即为铁还原菌, 它们广泛分布于土壤、海洋/淡水沉积物、活性污泥等环境中, 是Fe(Ⅲ)还原过程的主要动力(黎慧娟等, 2012).迄今, 研究人员已从水稻土、河流/海洋沉积物(王伟民等, 2008; 赵佳佳, 2010; 刘洪艳等, 2020)等厌氧环境中分离得到了多种厌氧铁还原菌, 而对湿地土壤和沉积物(如鄱阳湖湿地)中异化Fe(Ⅲ)还原微生物的分离纯化研究较为薄弱.
目前普遍认同且研究较多的Fe(Ⅲ)还原机制为电子穿梭机制(Nevin et al., 2002), 即铁还原菌还原氧化型电子穿梭体(胞内或胞外)产生还原型电子穿梭体, 然后还原型电子穿梭体再把电子传递给不溶性Fe(Ⅲ)氧化物, 重新形成氧化型电子穿梭体继续参与新一轮的电子传递作用(柳广飞等, 2018).自Lovley等(2000)首次揭示DOM中的腐殖质是有效的天然电子穿梭体以来, DOM作用下的微生物异化Fe(Ⅲ)还原所涉及的动力学过程及相关矿物转变的研究备受关注.研究表明(Scott et al., 1998; Nurmi et al., 2002), DOM中的氧化还原活性基团(醌基)不仅能接受来自电子供体如铁还原菌的电子, 还能将电子转移到其它电子受体如Fe(Ⅲ)氧化物上, 从而促进异化Fe(Ⅲ)还原过程.然而目前关于DOM化学组成及其与Fe(Ⅲ)还原作用的构效关系尚不明确, 且在水位落差较大的鄱阳湖湿地研究中鲜有报道.因此, 本论文对鄱阳湖湿地沉积物中的铁还原菌进行分离纯化, 并以其为电子转移驱动力, 在恒温厌氧培养条件下, 以易被微生物利用的葡萄糖为碳源, 人工合成的无定形态水铁矿为末端电子受体, 构建“DOM-铁还原菌-水铁矿”相互作用体系, 探讨鄱阳湖湿地DOM对铁还原菌异化还原水铁矿的影响, 以期为深入认识、强化及调控鄱阳湖湿地土壤中Fe(Ⅲ)异化还原过程提供必要的理论依据.
2 材料与方法(Materials and methods)2.1 供试土壤及植物供试土壤采集于鄱阳湖南矶山湖滩沉积物, 其基本理化性质见表 1.供试湿地植物选择优势物种灰化苔草, 其处理方法参考申钊颖等(2019)的研究.
表 1(Table 1)
| 表 1 鄱阳湖沉积物基本理化性质 Table 1 The basic physico-chemical properties of sediments in Poyang Lake | |||||||||||||||
表 1 鄱阳湖沉积物基本理化性质 Table 1 The basic physico-chemical properties of sediments in Poyang Lake
| |||||||||||||||
2.2 铁还原菌的分离纯化2.2.1 培养基配制LB液体培养基的配制参考林玉满等(2015)的研究, 配方为: 蛋白胨10 g、牛肉膏5 g、NaCl 5 g、蒸馏水1000 mL, 调节培养基pH值为7.0, 121 ℃灭菌20 min.
柠檬酸铁培养基的配制参考王伟民等(2008)的研究, 配方为: 柠檬酸铁3.3 g·L-1、NH4Cl 1 g·L-1、CaCl2·2H2O 0.07 g·L-1、MgSO4·7H2O 0.6 g·L-1、K2HPO4·3H2O 0.722 g·L-1、KH2PO4 0.25 g·L-1、葡萄糖10 g·L-1、琼脂粉10 g·L-1、蒸馏水1000 mL, 调节培养基pH为7.0, 121 ℃灭菌20 min.不添加琼脂粉即为柠檬酸铁液体培养基.
2.2.2 铁还原菌富集及分离纯化鄱阳湖湿地沉积物铁还原菌的分离筛选参考王伟民等(2008)的研究.充N2条件下称取沉积物样品10.00 g于100 mL血清瓶中, 加入1 mL水铁矿悬液(含Fe量约为15.7 g·L-1)及50 mL去离子水, 在30 ℃下暗光静置1周进行恢复培养.将培养后的土壤悬液于700 r·min-1离心10 min, 取上清液作为微生物接种液.吸取稀释100倍的接种液1 mL在柠檬酸铁固体培养基斜面上均匀涂布, 通入N2并用铝盖密封, 于30 ℃暗光培养3~4 d, 待铁还原菌菌落长出(培养基由黄绿色变为白色), 筛选分离纯化目的菌株, 并进行生长曲线测定(权海荣等, 2016).取LB液体培养基中扩繁12 h左右的菌液转入50 mL离心管中, 4000 r·min-1离心10 min, 弃上清液, 于4 ℃保存.使用时将其取出用无菌超纯水逐级稀释配成菌悬液, 控制OD600值为0.8~0.9(LB液体培养基为空白), 以保证一致性(赵昕宇等, 2018).
2.3 供试DOM提取分别提取来自鄱阳湖湿地沉积物、湿地植物苔草以及苔草根际土中的DOM, 具体采用本课题组之前对不同来源DOM的提取方法(申钊颖等, 2019), 提取出的DOM样品于4 ℃避光冷藏备用.其pH由便携式pH计测得, 浓度以水溶性有机碳(DOC)表示, 由总有机碳(Total Organic Carbon, TOC)测定仪(德国耶拿multi N/C 2100)测定, DOM相关性质见表 2.
表 2(Table 2)
| 表 2 不同来源DOM相关性质 Table 2 The properties of different DOM | ||||||||||||||||
表 2 不同来源DOM相关性质 Table 2 The properties of different DOM
| ||||||||||||||||
2.4 水铁矿溶液的配制采用王亚娥等(2014)的方法, 在0.15 mol·L-1的FeCl3溶液中慢速滴加1 mol·L-1 NaOH溶液并搅拌, 控制溶液的pH值为7.0~7.6, 可得到红褐色悬浮状液体即为水铁矿悬液(含铁量为8.281 g·L-1).人工配制的无定型态水铁矿具有比表面积大、活性高的特点, 易被铁还原菌利用(覃海华等, 2018), 同时也是湿地土壤/沉积物中重要的Fe(Ⅲ)氧化物形态.
2.5 实验方法2.5.1 DOM和葡萄糖对Fe(Ⅲ)还原的影响采用恒温厌氧培养方法, 设置如下平行试验: ①无菌条件下的空白组;②菌+水铁矿的对照组;③菌+水铁矿+葡萄糖还原体系;④菌+水铁矿+苔草DOM还原体系;⑤菌+水铁矿+葡萄糖+苔草DOM还原体系.在若干个10 mL血清瓶中加入1 mL水铁矿溶液(含铁量为8.281 g·L-1), 1 mL 5 g·L-1 NH4Cl, 加盖后于121 ℃灭菌30 min, 冷却后开盖, 加入1 mL过0.22 μm滤膜的25 mmol·L-1的磷酸盐缓冲液(王亚娥等, 2013), 根据设置的不同试验体系选择性地加入1 mL菌悬液, 1 mL 50 g·L-1的葡萄糖溶液(过0.22 μm滤膜)和1 mL 30 mg·L-1的苔草DOM(过0.22 μm滤膜), 控制最终反应体系为6 mL(未满的以无菌水补齐), 盖上橡胶塞后通入N2排氧, 然后用铝盖密封, 置于培养箱中30 ℃暗光培养, 定时采样测定Fe(Ⅱ)浓度.
2.5.2 含铁量对DOM存在下Fe(Ⅲ)还原的影响根据2.5.1节试验结果知DOM能促进铁还原菌对水铁矿的还原过程, 为了探究DOM对Fe(Ⅲ)还原的促进作用是否与Fe(Ⅲ)氧化物含量相关, 设置“菌+葡萄糖+苔草DOM+不同浓度水铁矿”反应体系.参照2.5.1节进行恒温厌氧批量试验, 水铁矿溶液的含铁量分别设置为50、100、200、500、1000 mg·L-1(CK用无菌水代替), 苔草DOM浓度为30 mg·L-1, 对培养体系定时采样测定Fe(Ⅱ)浓度.
2.5.3 不同浓度/来源DOM对铁还原菌异化还原水铁矿的影响将提取自沉积物、苔草及根际土的DOM用蒸馏水稀释至不同浓度.参照2.5.1节进行恒温厌氧批量试验, 苔草DOM配制成20、30、50、100、150 mg·L-1, 沉积物和根际土DOM分别配制成20、30、50 mg·L-1, CK用无菌水代替, 对培养体系定时采样测定Fe(Ⅱ)浓度.
2.6 分析方法DOM紫外-可见光谱测定(许伟, 2009): 将提取自沉积物、苔草及根际土的DOM进行一定稀释, 于TU-1901紫外可见分光光度计上进行扫描, 波长范围为200~600 nm.
DOM三维荧光光谱测定(申钊颖等, 2019): 采用F-4500日本日立公司荧光分光光度计进行三维荧光光谱扫描, 激发波长范围为Ex=200~600 nm(采样间隔10 nm), 发射波长范围为Em=200~600 nm(采样间隔10 nm).
Fe(Ⅱ)浓度测定: 每次采样时, 从各处理取出1瓶摇匀, 剔除铝盖, 揭开橡胶塞, 用一次性注射器吸取1 mL悬液置于含4 mL浓度为0.5 mol·L-1盐酸溶液的带盖聚乙烯离心管中浸提, 每瓶取3次做重复, 在摇床上振荡浸提1 h(Stabnikov et al., 2004).测定时用孔径0.22 μm滤膜过滤, 定量吸取滤液, 用邻菲啰啉分光光度法(Lovley et al., 1998)测定滤液中Fe(Ⅱ)浓度.
Logistic方程的表达式为:
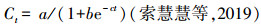 | (1) |
XRD矿物学表征: 反应结束后, 从溶液中收集矿物, 进行真空冷冻干燥, 取适量冻干碾磨过筛的矿物粉末压片, 采用德国布鲁克公司D8 ADVANCE多晶X射线衍射仪进行测试分析(王亚洁等, 2015).
2.7 数据统计处理实验数据用SPSS 26和Excel 2018进行统计分析, 采用Origin 8.5软件作图.用Matlab 2019b分析DOM三维荧光图谱, Jade 6软件分析水铁矿XRD衍射数据, Curve Expert 1.4软件对微生物Fe(Ⅲ)还原过程进行Logistic拟合.
3 结果与讨论(Results and discussion)3.1 铁还原菌株形态及生长曲线3.1.1 铁还原菌株形态通过富集培养及分离纯化, 得到一株厌氧且能利用葡萄糖为碳源的铁还原菌, 在柠檬酸铁固体培养基上呈灰白色圆形不透明菌落, 经革兰氏染色(油镜×100倍)可以看出, 该菌株呈短杆状, 为革兰氏阳性细菌, 见图 1.
图 1(Fig. 1)
 |
| 图 1 铁还原菌的菌体形态 Fig. 1The morphology of iron reducing bacteria |
3.1.2 铁还原菌生长曲线如图 2所示, 菌株在LB液体培养基中停滞期较短, 可能原因是菌体经扩繁后繁殖较快, 培养2 h左右就进入对数生长期, 以最大的速率生长和分裂, 大约12 h后进入稳定生长期, 活菌数目达到最大.由于在对数生长期, 菌体活力最佳, 因此在后续实验中选择培养12 h铁还原菌配制成菌悬液.
图 2(Fig. 2)
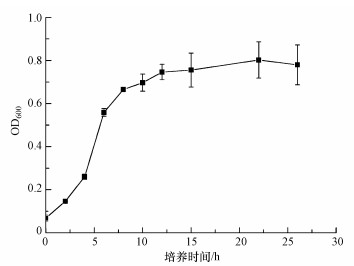 |
| 图 2 铁还原菌生长曲线 Fig. 2The growth curve of iron reducing bacteria |
3.2 DOM紫外-可见光谱特征分析对来自沉积物、根际土和苔草的DOM进行UV-Vis扫描光谱, 结果如图 3所示.从图 3可见, 3种来源DOM的吸光度随着波长的增加总体呈降低趋势, 并且缺少明显的特征峰.苔草和根际土DOM的吸收光谱相似, 含有不饱和共轭双键结构, 在226~250 nm附近有显著吸收峰(Adams et al., 2018), 而沉积物DOM在该处无明显吸收峰, 说明苔草和根际土DOM可能含有更多的芳香基团和不饱和双键.3种DOM都在250~280 nm附近出现π-π*跃迁精细结构吸收平台, 主要由木质素磺酸及其衍生物对光的吸收引起的(He et al., 2014).
图 3(Fig. 3)
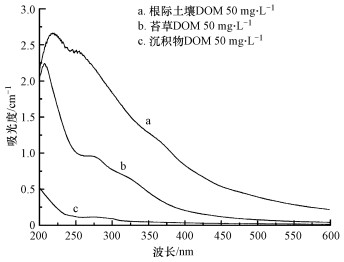 |
| 图 3 不同来源DOM的紫外-可见吸收光谱 Fig. 3The UV-Vis absorption spectra of DOM from different sources |
对于DOM吸收光谱性质的研究, 国内外常用吸光度或吸光度比值表征其性质, 主要指标通常包括254 nm处的特定紫外吸光度(SUVA254)、250 nm处的吸光度与365 nm处的吸光度之比(E2/E3).SUVA254定义为溶液在254 nm下的100倍吸光度值与该溶液的DOM浓度之比, 常用来表征腐殖化程度和芳香程度(Al-Reasi et al., 2013), SUVA254的值越大则腐殖化程度越大.由表 3可知腐殖化程度根际土DOM>苔草DOM>沉积物DOM.E2/E3值用于指示DOM分子质量的大小, 比值越大, DOM分子质量越小.DOM分子质量大小能够反映腐殖酸(humic acids, HA)和富里酸(fulvic acids, FA)所占的比例, 一般HA的分子量较大, FA的分子质量相对较小, DOM分子质量越大, HA的比例就越高(Korshin et al., 1997).研究(张春华等, 2016)表明, 当E2/E3<3.5时, DOM中HA的含量大于FA的含量, 由表 3可知, 3种来源DOM的E2/E3值变化不大且均小于3.5, 主要都以大分子质量、含芳香特性的HA为主.
表 3(Table 3)
| 表 3 紫外-可见光谱特征值 Table 3 The characteristic values of UV-Vis spectra | ||||||||||||
表 3 紫外-可见光谱特征值 Table 3 The characteristic values of UV-Vis spectra
| ||||||||||||
3.3 DOM三维荧光光谱特征分析对于DOM三维荧光图谱的分析, 根据荧光峰所在位置不同, 可大致划出以下几种峰(Hstrobe et al., 2001; 李晓洁等, 2018), 对应的类型如表 4所示.
表 4(Table 4)
| 表 4 DOM主要荧光峰 Table 4 The main fluorescence peaks of DOM | ||||||||||||||||||||||||||||||||
表 4 DOM主要荧光峰 Table 4 The main fluorescence peaks of DOM
| ||||||||||||||||||||||||||||||||
对分别来自苔草、沉积物和根际土的DOM进行三维荧光扫描, 得到三维荧光图谱如图 4所示.可知, 3种DOM的峰值类似, 均可看出有较为明显的A、B、C、T、D、E这6种峰.说明3种来源DOM的组成主要为腐殖酸、富里酸、类蛋白(色氨酸、酪氨酸)物质.
图 4(Fig. 4)
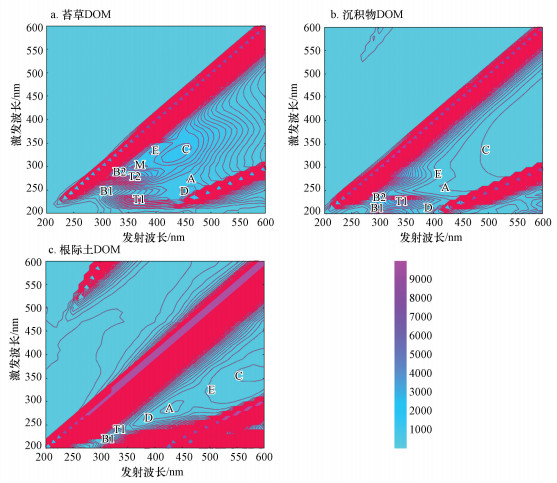 |
| 图 4 不同来源DOM三维荧光光谱图 Fig. 4The three-dimensional fluorescence spectra of DOM from different sources |
三维荧光区域的分区如图 5所示, 从图中可以看出不同物质的分布情况及相对浓度.由图 5可知, 3种DOM所含的微生物代谢产物含量基本一致且均较低, 类腐殖酸物质占比最高, 其次为类富里酸物质, 这与紫外-可见光谱图(图 3)分析结果一致.相比于沉积物样品, 苔草和根际土中类蛋白荧光物质(I、II类物质)占比例较高, 可能是受到人类活动影响.三者的腐殖质(类腐殖酸、类富里酸物质)含量较高且占比相差不大, 说明腐殖化强度较大.其中, 沉积物DOM中类富里酸物质含量较高, 而苔草和根际土DOM中的类腐殖酸物质含量较高.苔草中的腐殖酸可能向土壤中提供从而影响到苔草生长的根际土壤(申钊颖等, 2019), 因此苔草和根际土DOM中各成分所占比例相似.
图 5(Fig. 5)
 |
| 图 5 DOM样品EEM光谱Pi, n百分比分布 Fig. 5The percentage distribution of Pi, n in DOM EEM spectra |
3.4 DOM和葡萄糖对Fe(Ⅲ)还原的影响图 6反映了添加苔草DOM和/或葡萄糖对铁还原菌异化还原水铁矿的影响.从图 6可知, 恒温厌氧培养条件下, 16 d培养期内不加菌的空白处理Fe(Ⅱ)浓度基本保持不变, 这表明培养液中累积的Fe(Ⅱ)浓度是铁还原菌以Fe(Ⅲ)为电子受体异化Fe(Ⅲ)还原过程中产生的.仅加菌和水铁矿的对照处理②以及仅添加菌、水铁矿和DOM的培养体系④, 水铁矿有很少量的还原, 且后者比前者生成的Fe(Ⅱ)含量略高, 可能是体系内含有残留于菌液的培养基成分可为铁还原菌提供少量的营养物质, 而加入DOM后体系内营养成分增加, 故生成Fe(Ⅱ)含量更多.仅添加葡萄糖的处理③及同时添加DOM和葡萄糖的处理⑤, 在培养初期即开始发生Fe(Ⅲ)的还原, 且产生在溶液中的Fe(Ⅱ)含量随时间增加, 最后趋于平衡.对比实验结果可知, 经16 d的反应, 处理⑤体系最终生成的Fe(Ⅱ)浓度比处理③高出39.70%.
图 6(Fig. 6)
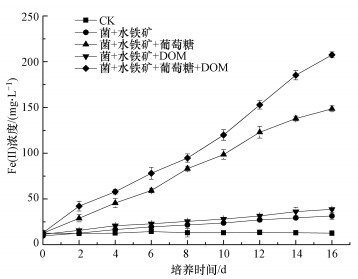 |
| 图 6 DOM和葡萄糖对Fe(Ⅲ)还原的影响 Fig. 6Effect of DOM and glucose on Fe(Ⅲ) reduction |
由以上结果推测: ①Fe(Ⅲ)还原过程主要是微生物介导的生物学过程, 需要铁还原菌和碳源的参与, 不添加外援碳源则铁还原菌无法得到充足的营养物质支持自身的生长, 无法进行Fe(Ⅲ)的还原作用;②仅添加DOM的体系Fe(Ⅲ)的还原相较于对照处理略有增加, 说明DOM中存在一些小分子物质可以作为电子供体被铁还原菌利用以获得能源.当铁还原菌得到电子后, 这些小分子物质的氧化还原结构被破坏丧失作为电子穿梭体促进微生物对水铁矿还原的特性(崔东宇等, 2015);③在铁还原菌和葡萄糖同时存在下, 添加DOM有利于加速水铁矿还原, 且随着反应时间的增加, 促进作用越明显.说明在添加葡萄糖作为碳源的情况下, DOM可从铁还原菌获得电子, 再将电子传递给不溶性的水铁矿, 从而提高了电子的传递效率, 起到电子穿梭体的作用.
研究(许伟等, 2009)表明, DOM具有氧化还原活性, 对Fe(Ⅲ)还原过程起到明显的促进作用, 这与本文所得到的结果一致.DOM对水铁矿还原的促进作用是通过为铁还原菌提供营养物质和作为电子穿梭体实现的, 主要是发挥电子穿梭体的功能.结合三维荧光图谱可知, DOM中的色氨酸、酪氨酸等低分子量组分可作为电子供体为铁还原菌提供能量, 而大分子量腐殖酸、富里酸为电子穿梭物质.DOM中腐殖质(富里酸、腐殖酸)所含的醌基、酚羟基等活性基团能为在Fe(Ⅲ)氧化物表面吸附提供配位点, 使铁还原菌在不直接接触Fe(Ⅲ)氧化物的情况下进行Fe(Ⅲ)还原反应, 从而加快还原反应的限速步骤(Klüpfel et al., 2014).
3.5 DOM存在下含铁量对Fe(Ⅲ)还原的影响在含有DOM及葡萄糖的反应体系中, 加入不同浓度的水铁矿, 探究DOM对Fe(Ⅲ)还原的促进作用是否与Fe(Ⅲ)氧化物含量相关, 结果如图 7所示.
图 7(Fig. 7)
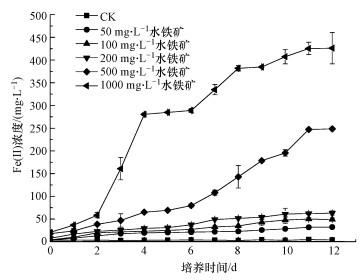 |
| 图 7 DOM存在下含铁量对Fe(Ⅲ)还原的影响 Fig. 7Effect of iron content on Fe(Ⅲ) reduction in the presence of DOM |
从图 7可知, 未添加水铁矿的空白处理(CK)基本无Fe(Ⅱ)生成, 而含不同浓度水铁矿的实验体系中Fe(Ⅱ)浓度均随着培养时间的延长不断增加, 然后趋于平缓.含铁量越高, 12 d培养期内生成的Fe(Ⅱ)量也越多, 表现为: 1000 mg·L-1>500 mg·L-1>200 mg·L-1>100 mg·L-1>50 mg·L-1>0 mg·L-1.其中, 添加1000 mg·L-1水铁矿对Fe(Ⅲ)还原的促进作用最为显著(p < 0.05), 生成的Fe(Ⅱ)浓度是添加50 mg·L-1水铁矿的13.2倍.
表 5采用Logistic方程拟合了Fe(Ⅲ)还原特征参数.由表 5可知, 不同浓度水铁矿处理下的拟合效果良好.比较Fe(Ⅲ)还原潜势(参数a)和最大反应速率(Vmax)差异均较大, 且变化具有一致性, 均随着含铁量的增大而增大.而低浓度处理下的铁还原反应速率常数(参数c)变化不明显, 添加1000 mg·L-1水铁矿的铁还原反应速率常数是其他低浓度处理下的2倍左右.不同含铁量处理下铁还原的Vmax大小顺序为: 1000 mg·L-1>500 mg·L-1>200 mg·L-1>100 mg·L-1>50 mg·L-1>0 mg·L-1.不同处理下的最大反应速率对应时间(TVmax)在第2~5 d, 表明铁还原菌要经过1~2 d生长期后大量增殖, 参与Fe(Ⅲ)还原.由以上结果可知, 含铁量越高, DOM对Fe(Ⅲ)还原的促进作用越明显.
表 5(Table 5)
| 表 5 不同含铁量下水铁矿还原过程的动力学参数 Table 5 The kinetic parameters of reduction process of different concentration of ferrihydrite | ||||||||||||||||||||||||||||||||||||||||||||||
表 5 不同含铁量下水铁矿还原过程的动力学参数 Table 5 The kinetic parameters of reduction process of different concentration of ferrihydrite
| ||||||||||||||||||||||||||||||||||||||||||||||
3.6 不同浓度/来源DOM对铁还原菌异化还原水铁矿的影响在有葡萄糖存在的情况下, 通过添加不同浓度/来源的DOM研究其对Fe(Ⅲ)还原过程的影响, 结果如图 8所示.
图 8(Fig. 8)
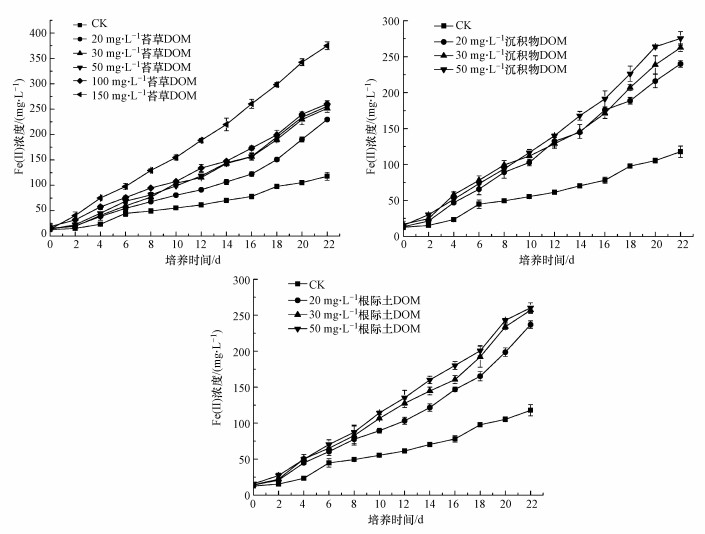 |
| 图 8 不同浓度DOM对铁还原菌异化还原水铁矿的影响 Fig. 8Effect of different concentrations of DOM on dissimilation reduction of ferrihydrite by IRB |
结果表明(图 8、图 9), 相比于仅含菌的对照组(CK), 同时含菌+DOM的实验体系中Fe(Ⅱ)浓度均显著增加, 且不同浓度DOM处理下的Fe(Ⅱ)浓度亦存在差异, 其最终浓度从高至低依次为, 苔草DOM: 150 mg·L-1>100 mg·L-1≈50 mg·L-1≈30 mg·L-1>20 mg·L-1>0 mg·L-1;沉积物和根际土DOM: 50 mg·L-1 >30 mg·L-1>20 mg·L-1.随着反应时间的进行, 产生的Fe(Ⅱ)量逐渐增加.从图 8可知, 在一定浓度范围内, 随着DOM浓度的增大, 产生的Fe(Ⅱ)量也增加.说明在电子供体(葡萄糖)充足的情况下, 电子穿梭体(DOM)的浓度对Fe(Ⅲ)还原起着主要作用.
图 9(Fig. 9)
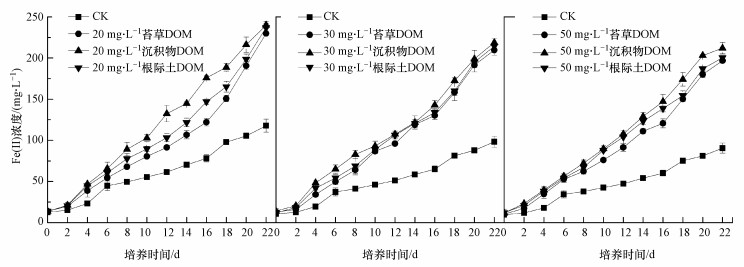 |
| 图 9 不同来源DOM对铁还原菌异化还原水铁矿的影响 Fig. 9Effect of DOM from different sources on dissimilation reduction of ferrihydrite by IRB |
表 6采用Logistic方程拟合了Fe(Ⅲ)还原特征参数.从表 6中可以看出, 几种处理下的Logistic方程拟合结果均达到满意的相关程度.对于苔草DOM, 150 mg·L-1浓度下Fe(Ⅲ)还原潜势(参数a)及最大反应速率(Vmax)均较于低浓度下增大, 而20、30、50、100 mg·L-1浓度之间的Fe(Ⅲ)还原潜势(参数a)及最大反应速率(Vmax)无明显差异, 但均比未添加DOM的对照处理高得多.对于沉积物和根际土DOM, 不同浓度处理下(20、30、50 mg·L-1)的Fe(Ⅲ)还原潜势(参数a)及最大反应速率(Vmax)无明显差异, 可能是由于浓度相差较小因而促进作用差异不太明显.但总体上, 随着DOM浓度的增大, 对Fe(Ⅲ)还原的促进作用也越大.此外, 不同浓度DOM下的铁还原反应速率常数(参数c)变化不明显, 且最大反应速率对应时间(Tvmax)均在5 d之内.
表 6(Table 6)
| 表 6 不同来源/浓度DOM作用下水铁矿还原过程的动力学参数 Table 6 The kinetic parameters of ferrihydrite reduction process under different sources / concentrations of DOM | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 6 不同来源/浓度DOM作用下水铁矿还原过程的动力学参数 Table 6 The kinetic parameters of ferrihydrite reduction process under different sources / concentrations of DOM
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
对比试验结果可知, 在厌氧条件下, 加入苔草、沉积物及根际土来源的DOM均能促进铁还原菌对水铁矿的异化还原作用, 并且可以加快Fe(Ⅲ)生物还原速率.在一定浓度范围内, DOM对Fe(Ⅲ)还原的促进作用随着浓度增加而增大.
由图 9可知, 同一浓度下不同来源的DOM对水铁矿还原的促进作用相似, 22 d培养期内反应生成的Fe(Ⅱ)浓度及反应速率均无显著性差异(p>0.05), 总体表现为沉积物DOM的促进作用略高于根际土和苔草DOM.由三维荧光区域积分图(图 5)可知, 沉积物DOM的富里酸含量比根际土和苔草DOM的略高, 根际土和苔草DOM的腐殖酸含量较多, 而三者腐殖酸和富里酸总的含量相差不大.由此可推断, 腐殖酸和富里酸物质含量与DOM电子转移能力存在直接关系(袁田, 2011), 而高分子量富里酸芳香性物质在DOM的电子循环过程中可能起主导作用.
3.7 水铁矿XRD分析对反应前后的水铁矿进行XRD分析, 见图 10.从图 10可知, 接种铁还原菌和不同来源DOM的体系反应后, 水铁矿的XRD图并无明显差异.相较于未接菌的空白对照, 添加菌的反应产物衍射峰稍微明显一些, 说明结晶度有所提高, 但并无新晶形矿物产生, 可能是因为在近中性及厌氧条件下, 水铁矿不容易转化成针铁矿和赤铁矿等其他次生矿物(吕靖龙, 2019).
图 10(Fig. 10)
 |
| 图 10 添加菌和DOM反应前后水铁矿的XRD图 Fig. 10XRD diagram of ferrihydrite before and after adding IRB and DOM reaction |
3.8 “DOM-铁还原菌-水铁矿”体系机理探讨自然界中Fe(Ⅲ)多以不溶性Fe(Ⅲ)氧化物存在, 使得微生物还原Fe(Ⅲ)氧化物的速率很慢.氧化还原介体(电子穿梭体)的存在, 如腐殖质及其模型物AQDS(Lovley et al., 1996b; Van et al., 2009)、生物炭(Kappler et al., 2014)等, 可以满足在无需微生物与铁矿物直接接触的情况下促进Fe(Ⅲ)还原过程.传统观点认为, DOM主要参与吸附、络合和配位等物理化学过程(任理想, 2008; 夏伟霞等, 2014);而生物地球化学的观点认为, DOM能够担当电子穿梭体的角色, 参与微生物在地表过程中的物质循环与能量代谢(Lovley et al., 1998; De-Yin et al., 2010).通过实验定量分析, 经D14T还原后, DOM的电子供给量(electron donating capacities, EDC)由初始2.2~14 μmol·g-1增加到253~347 μmol·g-1, 经3次还原-氧化循环后电子供给量可稳定维持在150~250 μmol·g-1, 并且加入DOM可提高水铁矿的还原溶解速率, 印证了DOM在菌株D14T还原水铁矿的体系中所发挥的电子穿梭作用(许伟等, 2009).DOM的电子穿梭能力主要与腐殖质(腐殖酸、富里酸)的氧化还原官能团(醌基)数量有关.有研究对比来自土壤、淡水及沉积物等不同来源的腐殖质发现, 醌基含量更高的土壤或沉积物腐殖质具有更高的电子接受能力(Lovley et al., 1996c; Scott et al., 1998).在微生物异化Fe(Ⅲ)还原体系中, DOM中的色氨酸、酪氨酸等低分子量有机质可被铁还原菌当作碳源, 作为电子供体被分解利用, 而大分子腐殖质(腐殖酸、富里酸)无法进入细胞内部, 可充当电子穿梭体(崔东宇等, 2015; 吴云当等, 2016; 吴东明等, 2019).这与本实验得到的结果一致, 说明“DOM-铁还原菌-水铁矿”体系中的电子转移途径可能如图 11所示.
图 11(Fig. 11)
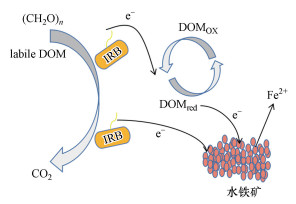 |
| 图 11 DOM对水铁矿异化还原促进作用的电子转移机制 (DOMox表示氧化态的DOM, DOMred表示还原态的DOM, labile DOM表示低分子量有机质) Fig. 11The electron transfer mechanism of DOM promoting dissimilatory reduction of ferrihydrite |
从图 11可以看出, DOM中的色氨酸、酪氨酸等低分子量组分可作为电子供体, 易被铁还原菌分解为能源以支持其生长代谢, 而大分子量的腐殖质(腐殖酸、富里酸)可作为电子穿梭体促进Fe(Ⅲ)还原.首先腐殖质DOM从铁还原菌呼吸链上获得电子变为还原态, 然后还原态腐殖质DOM再将电子传递给难溶性水铁矿, 自身转化为氧化态, Fe(Ⅲ)还原为Fe(Ⅱ).DOM的电子穿梭能力克服了铁还原菌与Fe(Ⅲ)氧化物直接接触的需要, 并且DOM与铁还原菌和Fe(Ⅲ)氧化物直接接触的几率高于Fe(Ⅲ)氧化物与铁还原菌直接接触的几率(Bauer et al., 2009), 从而促进Fe(Ⅲ)还原过程.
4 结论(Conclusions)1) Fe(Ⅲ)还原过程是微生物介导的生物学过程, 需要铁还原菌和碳源的参与.在葡萄糖存在下, 添加30 mg·L-1苔草DOM生成的Fe(Ⅱ)浓度相较于未添加的增加39.7%.
2) 在电子供体及Fe(Ⅲ)氧化物充足的情况下, DOM的浓度不会成为微生物异化Fe(Ⅲ)还原过程的限制条件, 含铁量越高, 促进作用越明显.因而DOM可经历多次还原-氧化, 作为电子穿梭体反复转移电子(如腐殖酸、富里酸), 促进Fe(Ⅲ)还原过程.
3) 不同浓度DOM对Fe(Ⅲ)还原的促进作用存在差异.表现为在一定浓度范围内, 随着DOM浓度的增加, 产生的Fe(Ⅱ)含量也增加.因此, 在电子供体充足的情况下, 电子穿梭体的浓度对Fe(Ⅲ)还原起着主要作用.
4) DOM对Fe(Ⅲ)还原的促进作用主要是通过为微生物提供营养物质和作为电子穿梭体实现.“DOM-铁还原菌-水铁矿”电子穿梭转移途径为: DOM从铁还原菌电子呼吸链上获得电子, 转变为还原态DOM, 然后还原态DOM将电子传递给水铁矿, 自身又变成氧化态.研究DOM对异化Fe(Ⅲ)还原的影响可为鄱阳湖流域土壤和沉积物生物地球化学循环提供理论支撑.
参考文献
| Adams J L, Tipping E, Feuchtmayr H, et al. 2018. The contribution of algae to freshwater dissolved organic matter: implications for UV spectroscopic analysis[J]. Inland Waters, 8(1): 1-12. DOI:10.1080/20442041.2018.1428429 |
| Al-Reasi H A, Wood C M, Smith D S. 2013. Characterization of freshwater natural dissolved organic matter(DOM): mechanistic explanations for protective effects against metal toxicity and direct effects on organisms[J]. Environment International, 59(3): 201-207. |
| Battin T J, Luyssaert S, Kaplan L A, et al. 2009. The boundless carbon cycle[J]. Nature Geoscience, 2(9): 598-600. DOI:10.1038/ngeo618 |
| Bauer I, Kappler A. 2009. Rates and extent of reduction of Fe(Ⅲ) compounds and O2 by humic substances[J]. Environmental Science Technology, 43(13): 4902-4908. DOI:10.1021/es900179s |
| Chen M L, Jin H. 2015. Pre-treatments, characteristics, and biogeochemical dynamics of dissolved organic matter in sediments: A review[J]. Water Research, 79: 10-25. DOI:10.1016/j.watres.2015.04.018 |
| 崔东宇, 何小松, 席北斗, 等. 2015. 堆肥中亲水性有机物还原容量表征及影响因素研究[J]. 分析化学, 43(2): 218-225. |
| Huang D Y, Zhuang L, Cao W D, et al. 2010. Comparison of dissolved organic matter from sewage sludge and sludge compost as electron shuttles for enhancing Fe(Ⅲ) bioreduction[J]. Journal of Soils and Sediments, 10(4): 722-729. DOI:10.1007/s11368-009-0161-2 |
| Dunnivant F M, Schwarzenbach R P, Macalady D L. 1992. Reduction of substituted nitrobenzenes in aqueous solutions containing natural organic matter[J]. Environmental Science Technology, 26: 2133-2142. DOI:10.1021/es00035a010 |
| He X S, Xi B D, Cui D Y, et al. 2014. Influence of chemical and structural evolution of dissolved organic matter on electron transfer capacity during composting[J]. Journal of Hazardous Materials, 268: 256-263. DOI:10.1016/j.jhazmat.2014.01.030 |
| Hosen J D, Mcdonough O T, Febria C M, et al. 2014. Dissolved organic matter quality and bioavailability changes across an urbanization gradient in headwater streams[J]. Environmental Science Technology, 48(14): 7817-7824. DOI:10.1021/es501422z |
| Hstrobe B W, Hansen H C B, Borggaard O K, et al. 2001. Composition and reactivity of DOC in forest floor soil solutions in relation to tree species and soil type[J]. Biogeochemistry, 56(1): 1-26. DOI:10.1023/A:1011934929379 |
| Kim H B, Kim J G, Choi J H, et al. 2019. Photo-induced redox coupling of dissolved organic matter and iron in biochars and soil system: Enhanced mobility of arsenic[J]. Science of the Total Environment, 689: 1037-1043. DOI:10.1016/j.scitotenv.2019.06.478 |
| Kappler A, Wuestner M L, Ruecker A, et al. 2014. Biochar as an electron shuttle between bacteria and Fe(Ⅲ) minerals[J]. Environmental Science Technology, 1(8): 339-344. |
| Klupfel L, Piepenbrock A, Kappler A, et al. 2014. Humic substances as fully regenerable electron acceptors in recurrently anoxic environments[J]. Nature Geoscience, 7(3): 195-200. DOI:10.1038/ngeo2084 |
| Korshin G V, Benianmin M M, Sletten R S. 1997. Adsorption of natural organic matter (NOM) on iron oxide: Effects on nom composition and formation of organo-halide compounds during chlorination[J]. Water Research, 31(7): 1643-1650. DOI:10.1016/S0043-1354(97)00007-9 |
| 黎慧娟, 彭静静. 2012. 异化Fe(Ⅲ)还原微生物研究进展[J]. 生态学报, 32(5): 1633-1642. |
| 李晓洁, 高红杰, 郭冀峰, 等. 2018. 三维荧光与平行因子研究黑臭河流DOM[J]. 中国环境科学, 38(1): 311-319. DOI:10.3969/j.issn.1000-6923.2018.01.035 |
| 林玉满, 陈小岚, 魏招娣, 等. 2015. 一株铁还原菌FeRB-FL1404的分离和鉴定及其去除高岭土中Fe(Ⅲ)研究[J]. 中国非金属矿工业导刊, (1): 11-15. DOI:10.3969/j.issn.1007-9386.2015.01.005 |
| 柳广飞, 朱佳琪, 于华莉, 等. 2018. 电子穿梭体介导微生物还原铁氧化物的研究进展[J]. 地球科学, 43(S1): 157-170. |
| 刘洪艳, 刘淼, 袁媛. 2020. 海洋沉积物中铁还原细菌组成及异化铁还原与产氢性质分析[J]. 微生物学通报, 47(9): 2711-2719. |
| Lovley D R, Fraga J L, Blunt-Harris E L, et al. 1998. Humic substances as a mediator for microbially catalyzed metal reduction[J]. Acta Hydrochimica et Hydrobiologica, 26(3): 152-157. DOI:10.1002/(SICI)1521-401X(199805)26:3<152::AID-AHEH152>3.0.CO;2-D |
| Lovley D R, Holmes D E, Nevin K P. 2004. Dissimilatory Fe(Ⅲ) and Mn(Ⅳ) reduction[J]. Advances in Microbial Physiology, 49: 219-286. |
| Lovley D R, Kashefi K, Vargas M, et al. 2000. Reduction of humic substances and Fe(Ⅲ) by hyperthermophilic microorganisms[J]. Chemical Geology, 169(3/4): 289-298. |
| Lovley D R, Woodward J C, Chapelle F H. 1996b. Rapid anaerobic benzene oxidation with a variety of chelated Fe(Ⅲ) forms[J]. Applied and Environmental Microbiology, 62(1): 288-291. DOI:10.1128/aem.62.1.288-291.1996 |
| Lovley D R, Woodward J C. 1996c. Mechanisms for chelator stimulation of microbial Fe(Ⅲ)-oxide reduction[J]. Chemical Geology, 132(1/4): 19-24. |
| 吕靖龙. 2019. 含Cd水铁矿向晶质氧化铁转化的研究[D]. 武汉: 华中农业大学 |
| Nevin K P, Lovley D R. 2002. Mechanisms for Fe(Ⅲ) oxide reduction in sedimentary environments[J]. Geomicrobiology Journal, 19: 141-159. DOI:10.1080/01490450252864253 |
| Nurmi J T, Tratnyek P G. 2002. Electrochemical properties of natural organic matter (NOM), fractions of NOM, and model biogeo-chemical electron shuttles[J]. Environmental Science Technology, 36: 617-624. DOI:10.1021/es0110731 |
| 覃海华, 忻宏蔚, 刘洪艳. 2018. 不同电子受体下铁还原细菌异化还原Fe(Ⅲ)性质及菌群特征[J]. 生态学杂志, 37(6): 1759-1764. |
| 权海荣, 李杰, 王亚娥, 等. 2016. 两株铁还原菌的分离鉴定及特性研究[J]. 广东化工, 43(18): 18-20. DOI:10.3969/j.issn.1007-1865.2016.18.008 |
| 任理想. 2008. 土壤重金属形态与溶解性有机物的环境行为[J]. 环境科学与技术, 31(7): 69-73. DOI:10.3969/j.issn.1003-6504.2008.07.018 |
| Scott D T, Mcknight D M, Blunt-Harris E L, et al. 1998. Quinone moieties act as electron acceptors in the reduction of humic substances by humics-reducing microorganisms[J]. Environmental Science Technology, 32: 2984-2989. DOI:10.1021/es980272q |
| 申钊颖, 弓晓峰, 江良, 等. 2019. 利用荧光区域积分法解析鄱阳湖DOM组成及来源[J]. 环境科学与技术, 42(5): 196-203. |
| Stabnikov V P, Tay S T L, Tay D K, et al. 2004. Effect of iron hydroxide on phosphate removal during anaerobic digestion of activated sludge[J]. Applied Biochemistry and Microbiology, 40(4): 376-380. DOI:10.1023/B:ABIM.0000033914.52026.e5 |
| 索慧慧, 林颖, 赵苗苗, 等. 2019. 生物炭对淹水土壤中溶解性有机质含量及组成特征的影响[J]. 水土保持学报, 33(2): 155-161+271. |
| Tobias H, Christian B. 2006. Oxidation and incorporation of hydrogen sulfide by dissolved organic matter[J]. Chemical Geology, 235(1). |
| Van der Zee F R, Cervantes F J. 2009. Impact and application of electron shuttles on the redox(bio)transformation of contaminants: A review[J]. Biotechnology Advances, 27(3): 256-277. DOI:10.1016/j.biotechadv.2009.01.004 |
| 王伟民, 曲东, 徐佳. 2008. 水稻土中铁还原菌的分离纯化及铁还原能力分析[J]. 西北农林科技大学学报(自然科学版), (10): 103-109. DOI:10.3321/j.issn:1671-9387.2008.10.018 |
| 王亚娥, 冯娟娟, 李杰, 等. 2014. 不同Fe(Ⅲ)对活性污泥异化铁还原耦合脱氮的影响及机理初探[J]. 环境科学学报, 34(2): 377-384. |
| 王亚娥, 冯娟娟, 李杰. 2013. 不同Fe(Ⅲ)对活性污泥异化铁还原及除磷影响研究[J]. 中国环境科学, 33(6): 993-998. DOI:10.3969/j.issn.1000-6923.2013.06.005 |
| 王亚洁, 朱永官, 孙国新, 等. 2015. 铁还原菌shewanella oneidensis MR-1对根表铁中砷运移的影响[J]. 环境科学学报, 35(7): 2240-2246. |
| 吴东明, 李怡, 邓晓, 等. 2019. 溶解性有机质对铁还原的促进作用研究[A]. 中国土壤学会土壤环境专业委员会、中国土壤学会土壤化学专业委员会. 2019年中国土壤学会 |
| 吴云当, 李芳柏, 刘同旭. 2016. 土壤微生物-腐殖质-矿物间的胞外电子传递机制研究进展[J]. 土壤学报, 53(2): 277-291. |
| 夏伟霞, 谭长银, 万大娟, 等. 2014. 土壤溶解性有机质对重金属环境行为影响的研究进展[J]. 中国资源综合利用, 32(1): 50-54. DOI:10.3969/j.issn.1008-9500.2014.01.036 |
| 许伟. 2009. 水溶性有机物的电子转移能力及其对微生物异化铁还原影响的研究[D]. 成都: 四川师范大学 |
| 许伟, 胡佩, 周顺桂, 等. 2009. 水溶性有机物的电子穿梭功能研究[J]. 环境科学, 30(8): 2297-2301. DOI:10.3321/j.issn:0250-3301.2009.08.020 |
| 袁田. 2011. 水溶性有机物电子转移能力表征及对Fe(Ⅲ)还原的强化效应[D]. 长沙: 湖南农业大学 |
| 张春华, 黄廷林, 方开凯, 等. 2016. 同温混合初期主库区沉积物间隙水DOM的光谱特征: 以周村水库为例[J]. 中国环境科学, 36(10): 3048-3055. DOI:10.3969/j.issn.1000-6923.2016.10.030 |
| 赵佳佳. 2010. 海洋沉积物中异化Fe(Ⅲ)还原特征及铁还原菌的分离鉴定[D]. 杨凌: 西北农林科技大学 |
| 赵昕宇, 范钰莹, 席北斗, 等. 2018. 不同来源堆肥腐殖质还原菌异化铁还原能力评估与调控[J]. 中国环境科学, 38(10): 3815-3822. DOI:10.3969/j.issn.1000-6923.2018.10.028 |
