 , 胡菁1,2, 龙云川1,2, 周少奇1,2,3
, 胡菁1,2, 龙云川1,2, 周少奇1,2,3

1. 贵州大学, 资源与环境工程学院, 贵阳 550003;
2. 贵州科学院, 贵阳 550001;
3. 华南理工大学环境与能源学院, 广州 510006
收稿日期: 2020-08-18; 修回日期: 2020-10-19; 录用日期: 2020-10-19
基金项目: 国家重点研发计划(No.2016YFC0400708);中国博士后科学基金(No.2019M653841XB);贵州省基础研究计划项目(黔科合基础[2020]1Y168);国家自然科学基金(No.U1612441)
作者简介: 朱成斌(1996-), 男, E-mail: 1146629732@qq.com
通讯作者(责任作者): 周少奇(1965—), 男, 教授, 博士生导师, 长期从事生活污水处理相关研究. E-mail: 2975742087@qq.com
摘要:为研究贵州威宁草海重金属污染现状,对该区域内20个采样点表层沉积物中的6种重金属元素(Pb、Cd、Cu、Zn、Fe、Mn)进行检测和分析.结果表明,表层沉积物中Cd、Zn和Pb的含量分别为贵州省土壤背景值的32.44、614.45和185.30倍,主要来源为采矿及矿物加工.此外,县城污水排放对Cu分布有一定的影响.Cd、Zn和Pb主要以可还原态及可氧化态存在,形态分布受Fe元素影响较大;Mn则以弱酸可提取态为主,具有较高的生物有效性.健康风险评价结果表明,表层沉积物对儿童造成的非致癌风险值(1.2×101 a-1)超过限值(1.0×100 a-1),对成人(7.91×10-5 a-1)和儿童(1.11×10-3 a-1)造成的致癌风险超过了可接受水平,其中,Cd是主要的致癌风险元素.综合来看,草海表层沉积物的重金属污染较为严重.
关键词:草海沉积物重金属形态分布健康风险评价
Spatial distribution fractionation and human health risk assessment of heavy metals in surface sediments from Caohai Lake, Guizhou
ZHU Chengbin1
 , HU Jing1,2, LONG Yunchuan1,2, ZHOU Shaoqi1,2,3
, HU Jing1,2, LONG Yunchuan1,2, ZHOU Shaoqi1,2,3

1. College of Resource and Environmental Engineering, Guizhou University, Guiyang 550003;
2. Guizhou Academy of Science, Guiyang 550001;
3. School of Environment and Energy, South China University of Technology, Guangzhou 510006
Received 18 August 2020; received in revised from 19 October 2020; accepted 19 October 2020
Abstract: In order to study the current situation of heavy metal pollution in Caohai (Weining, Guizhou Province), six heavy metals (Pb, Cd, Cu, Zn, Fe, Mn) in surface sediments from 20 sampling sites in this area were examined and analyzed. The results show that the contents of Cd, Zn and Pb are 32.44, 614.45 and 185.30 times as much as the background values of soil in Guizhou province, which are mainly derived from mining and mineral processing. In addition, the county sewage discharge has a certain influence on the distribution of Cu. Cd, Zn and Pb mainly exist in reducible and oxidizable states, and their morphological distribution is greatly affected by Fe. Mn is mainly in the extractable state of weak acid, which has a high bioavailability. The results of health risk assessment show that the non-carcinogenic risk value caused by surface sediments to children (1.2×101 a-1) exceeds the limit (1.0×100 a-1), and the carcinogenic risk values to adults (7.91×10-5 a-1) and children (1.11×10-3 a-1) exceed the acceptable level, among which Cd is the main carcinogenic risk element. In conclusion, heavy metal pollution of surface sediments in Caohai is serious.
Keywords: Caohai Lakesedimentheavy metalsmorphological distributionhealth risk
1 引言(Introduction)过去30年来, 我国大型工业快速发展, 化学用品需求量不断增加, 使得湖泊沉积物及土壤重金属的潜在威胁不断增加, 从而引起了公众的广泛关注(Liu et al., 2014; Lin et al., 2016; Dai et al., 2018).重金属可在环境中持续存在, 可随食物链在生物组织中不断积累, 并具有潜在的毒性, 水生环境的重金属污染可能会扩散到整个自然生态系统(Liu et al., 2012; Birch et al., 2013).环境中的重金属主要受人为因素影响, 如农业活动、工业排放、生活污水和化石燃料燃烧等.沉积物是水生生态系统中不可或缺的组成部分, 被普遍认为是水体重金属的主要汇, 并被广泛用作了解重金属污染现状和人为因素对水生环境的影响(Pekey, 2006).
根据欧洲共同体参考局(BCR)提出的提取程序, 沉积物重金属分为弱酸可提取态、可还原态、可氧化态和残渣态, 不同的形态对环境的危害也有所不同.Al-Mur(2020)对红海表层沉积物重金属形态进行研究发现, Cu与有机质具有很强的亲和力, 主要以可氧化态存在, 生态风险较小, Fe、Mn和Cd多为弱酸可提取态和可氧化态, 风险较大;Liang等(2018)研究发现, 我国胶州湾表层沉积物中Cd的生物可利用性很高, 重金属生态风险相对较大;Hu等(2018)研究表明, 天鹅泻湖中的Cd多为弱酸可提取态, 部分Pb、Zn的形态分布受Fe-Mn氧化物的影响, 湖区整体面临较为严重的重金属污染.目前重金属暴露风险采用美国环境总署(EPA)提出的健康风险评价法进行评估.缪雄谊(2020)对黄河三角洲土壤重金属进行分析发现, As存在中等致癌风险, 是主要的公众健康风险威胁因素.闫晓露等(2020)对辽东湾北部河口区土壤重金属研究发现, 在以手口途径为主要暴露途径的重金属污染风险中, Cd存在可接受致癌风险.Emenike等(2020)对Atuwara河沉积物重金属的研究结果表明, As、Cd、Cr和Ni通过摄入途径对儿童的致癌风险在两个季节均高于安全限值.综上所述, 沉积物重金属污染对生态环境和人类身心健康存在较为严重的影响.
威宁草海是贵州省境内最大的淡水湖泊, 是国家湿地保护计划中的重要湿地.目前对于草海重金属的研究多围绕污染现状及生态风险评价开展(林绍霞等, 2012; 张转玲等, 2018; 王志杰等, 2019; 汤向宸等, 2020; Hu et al., 2020), 而有关草海湖重金属形态分布特征及健康风险评价鲜有报道.因此, 本研究拟对草海表层沉积物的总量、形态分布、空间变化特征及来源进行分析, 同时利用健康风险评价法对重金属暴露风险进行综合评估, 以期为草海湿地重金属污染防治提供基础数据.
2 材料与方法(Materials and methods)2.1 研究区域概况草海湿地位于云贵高原中部乌蒙山腹地, 坐落于威宁彝族回族苗族自治县西南方, 海拔2171.70 m, 湖面面积为25 km2, 年均降水量为1000 mm, 年均日照时数为1805.40 h, 年均温度为10.50 ℃, 属于亚热带高原季风气候(韩会庆等, 2016).草海湖还是贵州省境内最大的天然淡水湖泊, 是以黑颈鹤为代表鸟类的越冬栖息地, 素有“高原明珠”、“鸟的王国”之称(赵斌等, 2019).湖区地势整体表现为由东南角向西北角逐渐降低, 大气降水是草海湿地的主要水源.草海流域是我国著名的土法炼锌集散地, 具有很悠久的历史(Hu et al., 2017).锌矿的开采及冶炼导致锌和镉等重金属元素由原生相向次生相转变, 湿地周围的污染物通过地表径流进入水体.目前, 草海湿地正面临着较为严重的锌、镉污染.
2.2 样品的采集采用网格布点法, 根据草海湿地的地形设置如图 1所示的20个采样点.于2020年4月使用抓斗采样器采集0~10 cm表层沉积物, 装入自封袋内密封保存, 带回实验室后于-20 ℃低温保存.沉积物样品经冷冻干燥后研磨, 过100目筛后置于4 ℃冰箱内备用.
图 1(Fig. 1)
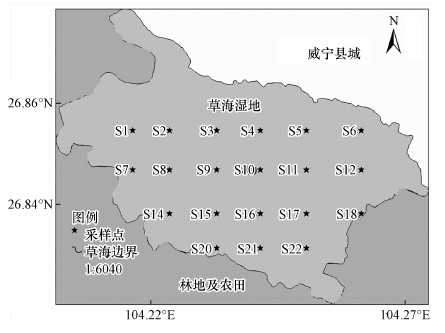 |
| 图 1 草海湖区采样点分布示意图 Fig. 1Distribution of sampling points in Caohai Lake district |
2.3 实验方法各重金属总量参考土壤沉积物金属总量微波消解法(HJ 832—2017)采用HF-HClO4消解法进行提取, 分布形态采用改进的BCR连续提取法(向语兮等, 2020)进行提取, 步骤如表 1所示.最终得到弱酸可提取态、可还原态、可氧化态及残渣态4种形态.总量及各形态含量均用ICP-MS(赛默飞世尔)测定.实验中采用标准物质GBW07428(GSS-14, 中国地质科学院地球物理地球化学勘查研究所)进行质量控制, 回收率为85%~105%.实验用水为超纯水, 试剂均为优级纯, 实验所用器皿均用10%硝酸浸泡24 h以上.
表 1(Table 1)
| 表 1 改进的BCR连续提取法具体步骤 Table 1 Specific steps for improved BCR continuous extraction | ||||||||||
表 1 改进的BCR连续提取法具体步骤 Table 1 Specific steps for improved BCR continuous extraction
| ||||||||||
采用Origin 8进行图鉴绘制, 采样点及等值线图用Surfer 15及ArcGIS 10.5进行绘制, 相关性分析等利用SPSS 24.0完成.
2.4 评价方法2.4.1 沉积物重金属人体健康风险评价方法基于美国环境总署(EPA)提出的健康风险评价模型, 对常见污染物对人体的危害进行评价.根据接触途径的不同, 分为通过呼吸、皮肤接触和口腔摄入3种积累方式(Jafarabadi et al., 2017), 其计算方法见式(1)~(3).
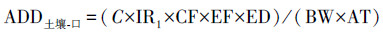 | (1) |
 | (2) |
 | (3) |
表 2(Table 2)
| 表 2 人体健康风险评价模型参数 Table 2 Parameters of human health risk assessment model | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 2 人体健康风险评价模型参数 Table 2 Parameters of human health risk assessment model
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
目前, 国际上健康风险评价模型分为致癌健康风险评价模型和非致癌健康风险评价模型(熊佳等, 2020).根据EPA提供的数据, 对Cd和Pb进行致癌和非致癌健康风险评价, 对Cu、Zn、Fe和Mn只进行非致癌健康风险评价.土壤非致癌健康风险评估模型和致癌健康风险评估模型见公式(4)~(6).
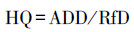 | (4) |
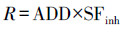 | (6) |
表 3(Table 3)
| 表 3 重金属不同暴露途径参考剂量及致癌斜率因子 Table 3 RfD and SF in different exposure routes of heavy metals | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 3 重金属不同暴露途径参考剂量及致癌斜率因子 Table 3 RfD and SF in different exposure routes of heavy metals
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
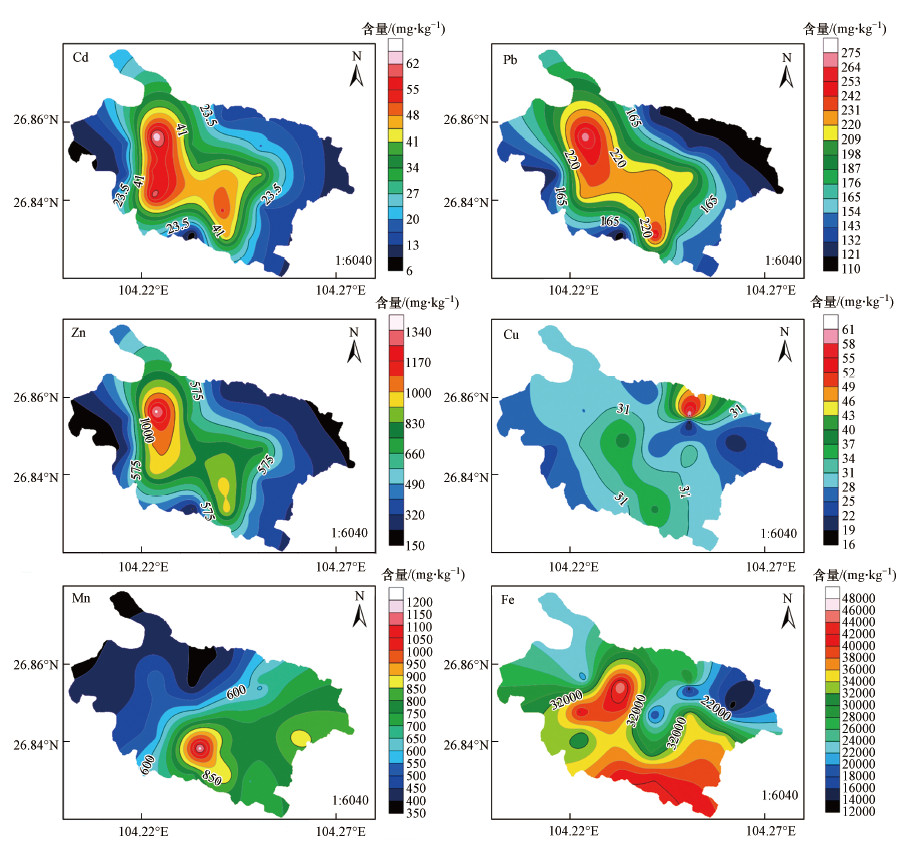
3 结果与讨论(Results and discussion)3.1 表层沉积物重金属含量空间分布特征草海湿地表层沉积物中Cd、Zn、Fe等元素统计信息如表 4所示.沉积物中重金属元素含量分布差异性较大, Cd、Zn、Pb、Fe、Cu和Mn的含量均值分别为32.44、614.45、185.30、32008.49、31.07和664.01 mg·kg-1, 分别为贵州省土壤背景值的154.48、7.07、5.96、0.83、1.16和1.26倍, 其中, Fe、Cu和Mn分别有6个、10个和14个采样点的含量超过背景值.参考土壤环境质量标准(GB 15618—2018)所研究的6种重金属中Cd和Zn超标, 超标率分别为100%和95%.
表 4(Table 4)
| 表 4 草海湿地表层沉积物各重金属元素统计信息 Table 4 Statistics of heavy metal elements in surface sediment of Caohai wetland | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 4 草海湿地表层沉积物各重金属元素统计信息 Table 4 Statistics of heavy metal elements in surface sediment of Caohai wetland
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
图 2所示为草海湿地重金属含量分布等值线图.从空间上来看, Pb、Cd和Zn均表现出湖心含量高于湖周的特征, 且三者具有相似的含量分布特征;Mn表现为从东南角向西北角逐渐降低;Fe元素在整个湖区的分布面积最为广泛, 且以东南角的含量最大, 对照土壤背景值发现, 有30%的采样点超过背景值, 均分布于图中的高含量区域;除靠近县城的采样点Cu元素含量较高外, 草海Cu整体含量分布较为均匀.
图 2(Fig. 2)
 |
| 图 2 草海表层沉积物重金属含量等值线图 Fig. 2Iso-linear diagram of heavy metal concentration in surface sediments of Caohai |
在自然条件下, Cd、Pb和Zn三者多为伴生关系(铅锌矿).草海表层沉积物中Cd、Pb和Zn的分布特征相似, 可能具有相同的来源.湿地内生有大量水生植物, 东部湖区以挺水植物为主, 为还原环境;西部则多为沉水植物, 为氧化环境(曹星星, 2016), 氧化还原条件的不同势必会影响湖区重金属的迁移转化.有研究表明, 沉积物中的Zn在氧化条件下会被释放, 还原条件下则会被重新固定, 同时沉积物中的铁锰氧化物(氢氧化物)会将氧化环境释放的Zn2+重新吸附(张密等, 2016), 故草海表层沉积物中的Zn逐渐向东部湖区扩散.同理, Pb和Cd的分布特征也受到了植物和沉积物铁、锰元素的影响.
在还原条件下微生物会利用MnO2、Fe(OH)3进行无氧呼吸, 将MnO2、Fe(OH)3还原为Mn2+和Fe2+而溶解于间隙水中或吸附于颗粒物上(刘晶, 2019).微生物总是倾向于利用较高电位的电子受体来氧化有机物以获得相对高额的能量和效率(许昆明等, 2010).微生物优先利用MnO2进行无氧呼吸, 使得Mn元素得以扩散并沉积在东部湖区, 故Mn元素的扩散能力大于Fe.
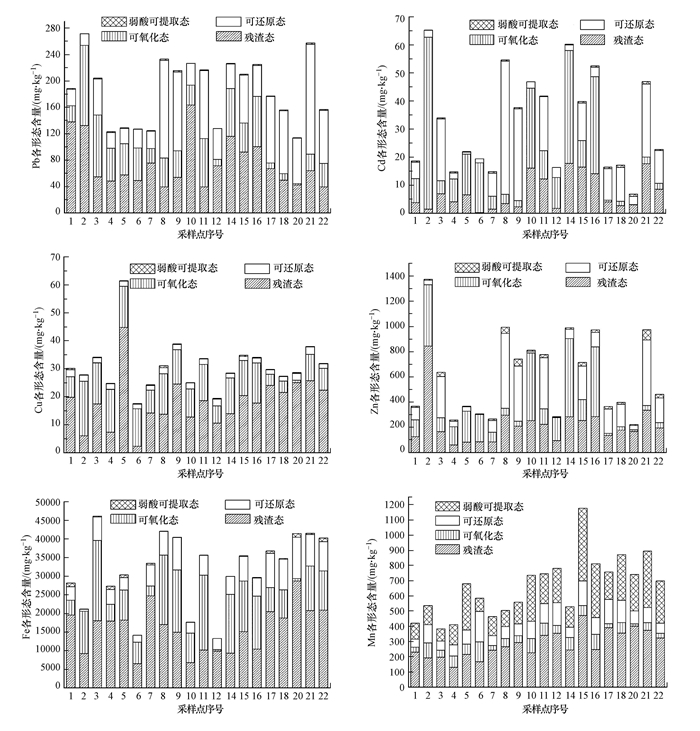
3.2 表层沉积物重金属形态分布特征如图 3所示, 所研究重金属的形态分布特征各有不同.其中, Cu主要以残渣态(58.42%)和可氧化态(34.54%)形式存在;Mn主要以弱酸可提取态和残渣态形式存在, 分别占总量的30.63%和43.24%;可氧化态及残渣态是沉积物中Fe的主要存在形态, 分别为31.53%和50.33%.与上述重金属不同的是, Cd、Pb和Zn三者的形态分布特征按采样点的不同可大体上分为两类:3号、8号、9号、11号、15号、17号、18号、20号、21号和22号采样点的Cd、Pb和Zn主要以可还原态形式存在, 分别占总量的60.76%、52.16%和46.72%;其余10个采样点的Cd和Zn主要为可氧化态, 质量分数分别为64.46%和54.38%, Pb主要以残渣态形式存在, 占总量的52.89%.
图 3(Fig. 3)
 |
| 图 3 草海表层沉积物重金属形态空间分布 Fig. 3Spatial distribution of heavy metals in surface sediments of Caohai Lake |
沉积物中重金属的弱酸可提取态、可还原态和可氧化态之和称为次生相, 是沉积物中重金属污染的主要来源.以弱酸可提取态存在的重金属对外界水环境条件变化极为敏感, 在弱酸和中性条件下就能释放(王书航等, 2013), 具有极高的生物可利用性, 同时对环境的影响最大.故从整体上看, 草海湿地Mn的迁移能力及生物有效性最强.Mn作为植物生长的必要元素, 低浓度可以促进植物的生长, 若长时间暴露在高浓度下, 会对植物产生不可逆的损伤(Santos et al., 2017).猜测草海表层沉积物Mn弱酸可提取态含量较高与水生植物生长有关, 还需要进一步研究.
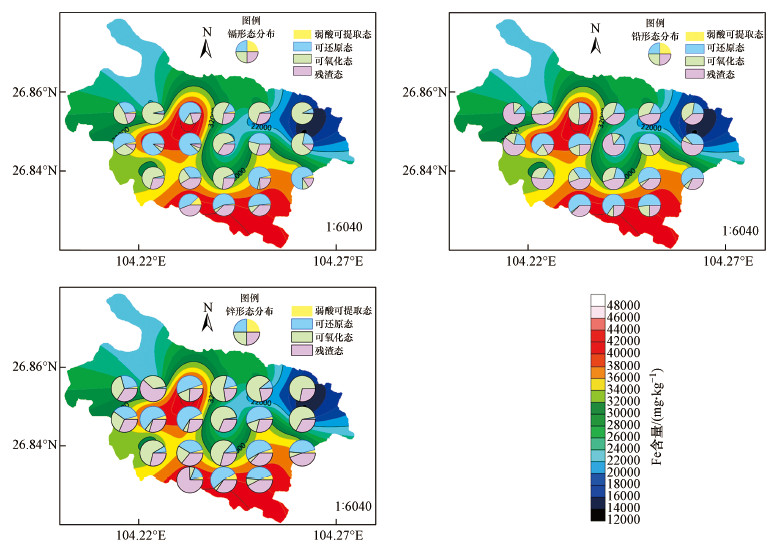
可还原态是指以铁锰结核或凝结物形式或以胶膜形式覆盖在沉积物颗粒表面上的部分重金属(徐圣友等, 2008).铁锰氧化物具有较大的比表面积, 对重金属有很大的离子交换和吸附容量, 可将某些重金属离子吸附固定, 并在环境微生物的作用下改变金属离子的氧化还原特性(Hu et al., 2018), 故Fe的存在会对重金属的可还原态产生较大的影响.如图 4所示, 将Cd、Pb和Zn的形态分布图和Fe含量分布图进行叠加, 发现处于高Fe含量范围内的Cd、Pb和Zn主要以可还原态为主.王勤等(2020)对湘江下游河床沉积物进行研究时发现Zn、Pb趋于赋存于铁矿物中, Laing等(2009)提出在含氧条件下铁锰氧化物是Cd和Zn的主要吸附剂, 这与本文的研究发现一致.当水体氧化还原条件发生改变时, 即水体处于缺氧环境下, 沉积物中的可还原态重金属将会被厌氧微生物还原, 转化为可溶解的离子形式进入水体.特别的, Cd、Zn和Pb的分布形态仅与Fe含量密切相关, 这与王海等(2002)的研究结果存在差异.由表 4可得, 草海表层沉积物中Fe平均含量是Mn的48倍, 以至于Mn对沉积物重金属形态分布的影响可忽略, 故Mn与Cd、Zn和Pb的分布形态之间的关联并不明显.
图 4(Fig. 4)
 |
| 图 4 Fe含量分布和Cd、Pb、Zn形态分布叠加图 Fig. 4Fe overlay of concentration distribution and Cd, Pb, Zn morphology distribution |
以可氧化态存在的重金属能与沉积物中的烷烃和腐殖酸等有机质形成化合物, 还可以与硫化物形成沉淀.只有在强氧化环境下, 有机质被水-沉积物系统中的微生物氧化分解, 硫元素变成S6+, 重金属元素才会转化为离子形式释放出来(周怀东等, 2008).以可氧化态存在的重金属生物有效性最低, 故对水环境质量的威胁最小.湿地内的动植物残体可以提供大量的有机质, 与Cd、Pb、Zn、Fe、Cu形成不溶于水的金属螯合物, 降低扩散风险.有研究表明, Cu更容易与有机质结合(黄丽敏, 2018), 故铁锰氧化物并未对Cu形态分布特征产生影响.
残渣态重金属也被称为原生态重金属, 主要赋存于原生矿物与次生矿物的硅酸盐晶格内, 性质非常稳定, 不参与水-沉积物系统的再平衡分配(徐圣友等, 2008).一般情况下不会随着水体环境的变化而变化, 是所研究形态中危险系数最小的, 对环境几乎不存在影响.
3.3 重金属污染来源分析相关性分析被广泛用于重金属来源识别, 若重金属元素质量分数之间呈显著相关, 可推测它们存在相似污染源或伴生污染现象, 故其对重金属污染源的解析具有重要意义(陈苗等, 2020).本文对所研究的6种重金属进行相关性分析, 结果如表 5所示.由表可知, Cd与Pb、Zn呈显著正相关(p < 0.01), 相关系数分别为0.91和0.98, 说明三者具有相似的来源, 同理Fe与Cu可能也具有相似的来源.
表 5(Table 5)
| 表 5 草海表层沉积物重金属相关性分析 Table 5 Correlation analysis of surface sediment of Caohai Lake | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 5 草海表层沉积物重金属相关性分析 Table 5 Correlation analysis of surface sediment of Caohai Lake
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
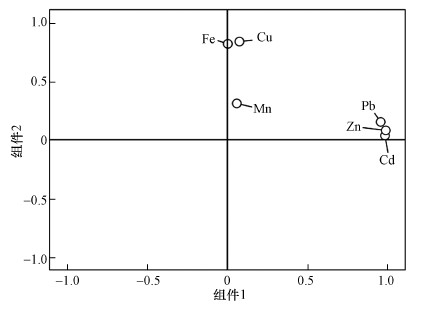
沉积物中重金属的来源按大类可以分成天然源和人为源, 利用主成分分析对Pb、Cd、Cu、Zn、Fe和Mn的来源进行分析.首先对含量数据进行KMO和Bartlett’s球形检验, 所得结果分别为0.66和0, 表明数据之间存在相关性, 这与相关性分析结果一致.以重金属质量分数作方差极大值正交旋转, 得到特征值大于1的2个主成分, 如表 6所示, PC1解释了47.86%的方差变异, Zn、Cd和Pb具有很高的正载荷.草海所处的黔西北地区分布有丰富的矿产资源, 在过去的几十年内一直是我国最大的土法炼锌集散地(Hu et al., 2017).由于设备不完善、技术落后等原因, 加上冶炼废水废渣的随意倾倒和堆放, 严重威胁着流域生态环境.通过大气沉降和地表径流的搬用作用, 残存在矿渣内的Cd、Zn和Pb进入草海湿地, 最终形成了如图 2所示的分布特征.可以认为草海表层沉积物中的Cd、Zn和Pb主要来自铅锌矿、镉锌矿的开采、选矿及其冶炼等生产活动中产生的废水、废渣等, 因此, 第一主成分可以代表矿业和工业活动等人为来源.
表 6(Table 6)
| 表 6 沉积物重金属元素主成分旋转载荷 Table 6 Principal component rotation load of heavy metal elements in sediments | ||||||||||||||||||||||||||||||||
表 6 沉积物重金属元素主成分旋转载荷 Table 6 Principal component rotation load of heavy metal elements in sediments
| ||||||||||||||||||||||||||||||||
PC2解释了24.99%的方差变异, Fe和Cu有很高的正载荷, Mn的载荷较低.草海流域内土壤以黄棕壤为主.黄棕壤由砂页岩、石灰岩、白云岩和第四纪红色黏土发育而成, 其中, 第四纪红色黏土中含有大量的Fe元素(郑杰, 2019).参考贵州省土壤背景值, 所研究的20个采样点Fe元素丰度与背景值基本接近, 可以认为Fe无明显人为输入, 主要来自岩石风化, 图 5的结果也证实了这一观点, 故PC2可以代表岩石母岩风化、土壤侵蚀等自然因素.相比于Mn, Cu更偏向于人为源, 参考郑杰(2019)的研究, Cu还可能来源于县城工业废水的排放和农业生产过程中农药化肥的使用.
图 5(Fig. 5)
 |
| 图 5 草海表层沉积物主成分分析图 Fig. 5Analysis of the principal components of the surface sediments of Caohai Lake |
综上所述, 草海表层沉积物中Zn、Cd和Pb主要来自于原有土法炼锌残存尾矿渣浸出;Fe和Mn主要来自于岩石风化;湖区大范围内的Cu与Fe具有相似的来源, 所不同的是Cu还存在少量人为来源.
3.4 重金属元素健康风险评价3.4.1 重金属元素非致癌健康风险评价根据美国环境总署(EPA)给出的各金属暴露途径参考剂量, 计算得出研究区域重金属非致癌风险评价结果如表 7所示.除Fe、Mn外其余4种重金属成人和儿童的HI值均小于1, 3种暴露途径对成人和儿童造成的非致癌风险由大到小分别为Pb、Cd、Cu、Zn和Pb、Cu、Cd、Zn;Fe和Mn对儿童的HI值已经超过了人体可承受的能力, 其中, 经口摄入和皮肤接触是Mn的主要暴露途径, 分别占HI值的77.83%和21.82%, Fe以经口摄入为主要途径, 占总量的99.10%.
表 7(Table 7)
| 表 7 研究区域沉积物非致癌风险值 Table 7 Non-cancer risk values for soils in the study area | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 7 研究区域沉积物非致癌风险值 Table 7 Non-cancer risk values for soils in the study area
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
根据评价结果, 土壤重金属对成人和儿童的非致癌风险系数大小为HQ手-口>HQ皮肤>HQ呼吸.3种暴露途径对成人的风险总值为2.4×10-1, 处于可接受范围, 儿童的风险总值是成人的50倍, 超过可接受的最大范围, 故研究区域内重金属非致癌风险不容小觑.
3.4.2 重金属元素致癌健康风险评价根据EPA给出的数据, 对研究区域内Cd、Pb的致癌风险进行评估, 结果如表 8所示.所研究区域内成人Cd风险值高于10-6, 处于人体可接受范围内, 儿童Cd致癌风险高于10-4, 超过人体所能承受的最高限值, 可见草海湿地表层沉积物已经存在显著的重金属致癌健康风险.3种暴露途径的R值依次为经口摄入>皮肤吸收>呼吸吸入.其中, 儿童的风险值约为成人的14倍, 说明在接触过程中儿童患癌症的风险更大.Pb的致癌风险值远小于管控值, 故对人体造成的致癌风险可忽略不计.因此, 草海表层沉积物已经严重威胁到周围居民的健康, 具有不可接受的致癌风险.
表 8(Table 8)
| 表 8 研究区域沉积物致癌风险值 Table 8 Risk of carcinogenicity in soils of the study area | |||||||||||||||||||||||||||||||||||||||||||||||||||||
表 8 研究区域沉积物致癌风险值 Table 8 Risk of carcinogenicity in soils of the study area
| |||||||||||||||||||||||||||||||||||||||||||||||||||||
4 结论(Conclusions)1) 草海表层沉积物重金属含量分布差异较大, 除Fe、Cu和Mn的部分采样点外所研究重金属均超过贵州省土壤背景值, Cd和Zn含量超过中国土壤环境质量二级标准, 超标率为100%和95%.
2) 沉积物中的Cu主要以可氧化态和残渣态形式存在;Mn主要以弱酸可提取态和残渣态形式存在;可氧化态及残渣态是Fe的主要存在形态;Pb、Cd和Zn主要是以可还原态和可氧化态形式存在, 其中, 可还原态主要分布在Fe含量较高的区域内.
3) 相关性和主成分分析结果表明, 草海表层沉积物中Fe和Cu的来源相似, 主要来源于岩石风化等自然源;Zn、Pb和Cd也具有同源性, 主要受矿石冶炼等人为源的影响.Mn元素的来源主要为自然源, 但与Fe、Cu之间的相关性不强, 具体原因还需要进一步研究.
4) 沉积物内的重金属对周围居民具有不可忽略的非致癌风险和较大的致癌风险, 且整体上表现为儿童所面临的风险大于成人.
参考文献
| Al-Mur B A. 2020. Geochemical fractionation of heavy metals in sediments of the Red Sea, Saudi Arabia[J]. Oceanologia, 62(1): 31-44. DOI:10.1016/j.oceano.2019.07.001 |
| Birch F G, Apostolatos C. 2013. Use of sedimentary metals to predict metal concentrations in black mussel (Mytilus galloprovincialis) tissue and risk to human health (Sydney estuary, Australia)[J]. Environmental Science and Pollution Research, 20(8): 5481-5491. DOI:10.1007/s11356-013-1538-8 |
| 曹星星. 2016. 基于水化学与稳定同位素的岩溶湿地流域地球化学过程研究[D]. 贵阳: 贵州大学 |
| 陈苗, 匡荟芬, 胡春华, 等. 2020. 结合主成分分析法(PCA)和正定矩阵因子分解法(PMF)的鄱阳湖丰水期表层沉积物重金属源解析[J]. 湖泊科学, 4(32): 964-976. |
| Dai L, Wang L, Li L, et al. 2018. Multivariate geostatistical analysis and source identification of heavy metals in the sediment of Poyang Lake in China[J]. Science of the Total Environment, 621: 1433-1444. DOI:10.1016/j.scitotenv.2017.10.085 |
| Du Laing G, Rinklebe J, Vandecasteele B, et al. 2009. Trace metal behaviour in estuarine and riverine floodplain soils and sediments: A review[J]. Science of the Total Environment, 407(13): 3972-3985. DOI:10.1016/j.scitotenv.2008.07.025 |
| Emenike P C, Tenebe I T, Neris J B, et al. 2020. An integrated assessment of land-use change impact, seasonal variation of pollution indices and human health risk of selected toxic elements in sediments of River Atuwara, Nigeria[J]. Environmental Pollution, 265(114795B). DOI:10.1016/j.envpol.2020.114795 |
| 韩会庆, 苏志华, 罗绪强, 等. 2016. 2000-2010年草海自然保护区生境质量变化[J]. 西南林业大学学报, 36(5): 158-163. |
| Hu C, Yang X, Dong J, et al. 2018. Heavy metal concentrations and chemical fractions in sediment from Swan Lagoon, China: Their relation to the physiochemical properties of sediment[J]. Chemosphere, 209: 848-856. DOI:10.1016/j.chemosphere.2018.06.113 |
| Hu J, Long Y, Zhou W, et al. 2020. Influence of different land use types on hydrochemistry and heavy metals in surface water in the lakeshore zone of the Caohai wetland, China[J]. Environmental Pollution (Barking, Essex: 1987), 267: 115454. DOI:10.1016/j.envpol.2020.115454 |
| Hu J, Zhou S, Wu P, et al. 2017. Assessment of the distribution, bioavailability and ecological risks of heavy metals in the lake water and surface sediments of the Caohai plateau wetland, China[J]. PLoS One, 12(12): e189295. |
| 黄丽敏. 2018. 天然沉积物上重金属竞争吸附的位点能量分布研究[D]. 上海: 上海交通大学. 93 |
| Liang X, Song J, Duan L, et al. 2018. Source identification and risk assessment based on fractionation of heavy metals in surface sediments of Jiaozhou Bay, China[J]. Marine Pollution Bulletin, 128: 548-556. DOI:10.1016/j.marpolbul.2018.02.008 |
| 李嘉蕊. 2019. 基于土壤-作物-人体系统的耕地重金属污染评价和健康风险评估[D]. 杭州: 浙江大学. 119 |
| 缪雄谊. 2020. 重金属污染的扩散迁移及其健康风险评价[D]. 合肥: 中国科学技术大学. 126 |
| 林绍霞, 张清海, 郭媛, 等. 2012. 贵州草海沉积物重金属污染特征及潜在生态风险分析[J]. 农业环境科学学报, 31(11): 2236-2241. |
| Lin Q, Liu E, Zhang E, et al. 2016. Spatial distribution, contamination and ecological risk assessment of heavy metals in surface sediments of Erhai Lake, a large eutrophic plateau lake in southwest China[J]. Catena, 145: 193-203. DOI:10.1016/j.catena.2016.06.003 |
| 刘晶. 2019. 金属离子在典型铁氧化物表面的吸附、氧化/还原及结晶生长研究[D]. 广州: 中国科学院大学(中国科学院广州地球化学研究所). 160 |
| Liu E, Birch G F, Shen J, et al. 2012. Comprehensive evaluation of heavy metal contamination in surface and core sediments of Taihu Lake, the third largest freshwater lake in China[J]. Environmental Earth Sciences, 67(1): 39-51. DOI:10.1007/s12665-011-1478-x |
| Liu E F, Shen J. 2014. A comparative study of metal pollution and potential eco-risk in the sediment of Chaohu Lake (China) based on total concentration and chemical speciation[J]. Environmental Science and Pollution Research, 21(12): 7285-7295. DOI:10.1007/s11356-014-2639-8 |
| Pekey H. 2006. The distribution and sources of heavy metals in Izmit Bay surface sediments affected by a polluted stream[J]. Marine Pollution Bulletin, 52(10): 1197-1208. DOI:10.1016/j.marpolbul.2006.02.012 |
| Qian Y, Cheng C, Feng H, et al. 2020. Assessment of metal mobility in sediment, commercial fish accumulation and impact on human health risk in a large shallow plateau lake in southwest of China[J]. Ecotoxicology and Environmental Safety, 194: 110346. DOI:10.1016/j.ecoenv.2020.110346 |
| Ranjbar Jafarabadi A, Riyahi Bakhtiyari A, Shadmehri Toosi A, et al. 2017. Spatial distribution, ecological and health risk assessment of heavy metals in marine surface sediments and coastal seawaters of fringing coral reefs of the Persian Gulf, Iran[J]. Chemosphere, 185: 1090-1111. DOI:10.1016/j.chemosphere.2017.07.110 |
| Santos E F, Kondo Santini J M, Paix?o A P, et al. 2017. Physiological highlights of manganese toxicity symptoms in soybean plants: Mn toxicity responses[J]. Plant Physiology and Biochemistry, 113: 6-19. DOI:10.1016/j.plaphy.2017.01.022 |
| 汤向宸, 林陶, 夏品华, 等. 2020. 贵州草海湿地不同水位梯度沉积物中汞、砷形态分布及风险评价[J]. 湖泊科学, 32(1): 100-110. |
| 王海, 王春霞, 王子健. 2002. 太湖表层沉积物中重金属的形态分析[J]. 环境化学, 21(5): 430-435. DOI:10.3321/j.issn:0254-6108.2002.05.003 |
| 王勤, 彭渤, 方小红, 等. 2020. 湘江下游河床沉积物重金属污染的矿物学分析[J]. 矿物岩石地球化学通报, 39(3): 558-575. |
| 王书航, 王雯雯, 姜霞, 等. 2013. 蠡湖沉积物重金属形态及稳定性研究[J]. 环境科学, 34(9): 3562-3571. |
| 王志杰, 柳书俊, 郑杰, 等. 2019. 草海流域土壤重金属污染及其生态风险评价[J]. 生态环境学报, 28(12): 2438-2446. |
| 向语兮, 王晓, 单保庆, 等. 2020. 白洋淀表层沉积物重金属形态分布特征及生态风险评价[J]. 环境科学学报, 40(6): 2237-2246. |
| 熊佳, 韩志伟, 吴攀, 等. 2020. 独山锑冶炼厂周边土壤锑砷空间分布特征、污染评价及健康风险评估[J]. 环境科学学报, 40(2): 655-664. |
| 徐圣友, 叶琳琳, 朱燕, 等. 2008. 巢湖沉积物中重金属的BCR形态分析[J]. 环境科学与技术, (9): 20-23. |
| 许昆明, 邹文彬, 司靖宇. 2010. 南海越南上升流区沉积物中溶解氧、锰和铁的垂直分布特征[J]. 热带海洋学报, 29(5): 56-64. |
| 闫晓露, 郑欢, 赵烜杭, 等. 2020. 辽东湾北部河口区土壤重金属污染源识别及健康风险评价[J]. 环境科学学报, 40(8): 3028-3039. |
| 张密, 文波, 黄凌霞, 等. 2016. 氧化还原条件对城市水体沉积物重金属迁移转化的影响[J]. 华东师范大学学报(自然科学版), (2): 160-170. |
| 张转玲, 谭红, 何锦林, 等. 2018. 贵州草海表层沉积物重金属污染特征及来源分析[J]. 生态环境学报, 27(12): 2314-2320. |
| 赵斌, 朱四喜, 杨秀琴, 等. 2019. 草海湖沉积物中重金属污染现状及生态风险评价[J]. 环境科学研究, 32(2): 235-245. |
| 郑杰. 2019. 贵州草海流域不同土地利用方式土壤重金属、氮和磷的空间分布与生态风险评价[D]. 贵阳: 贵州大学. 76 |
| 周怀东, 袁浩, 王雨春, 等. 2008. 长江水系沉积物中重金属的赋存形态[J]. 环境化学, 27(4): 515-519. |
