 , 于涛2, 徐闻欣3, 聂慧1, 李丹1, 王松林1
, 于涛2, 徐闻欣3, 聂慧1, 李丹1, 王松林1

1. 华中科技大学环境科学与工程学院, 武汉 430074;
2. 中国市政工程中南设计研究总院有限公司, 武汉 430010;
3. 中冶南方工程技术有限公司, 武汉 430223
收稿日期: 2020-09-26; 修回日期: 2020-11-18; 录用日期: 2020-11-18
基金项目: 国家重点研发计划(No.2018YFC1901403)
作者简介: 龚庆(1995—), 女, E-mail: m201873657@hust.edu.cn
通讯作者(责任作者): 王松林, E-mail: wangsonglin99@hust.edu.cn
摘要:采用二硫化钼(MoS2)作为助催化剂加入到亚铁离子(Fe2+)/单过硫酸盐(PMS)体系,去除溶液中的磺胺甲恶唑(SMX)和还原六价铬(Cr(Ⅵ)),分别对SMX及SMX与Cr(Ⅵ)共存情况下的去除效果进行研究,并考察了MoS2、Fe2+、PMS、SMX投加量对SMX和Cr(Ⅵ)去除效果的影响.结果表明,在[MoS2]0=0.9 g·L-1,[Fe2+]0 =0.3 mmol·L-1,[PMS]0=1 mmol·L-1,[Cr(Ⅵ)]0=100 μmol·L-1,[SMX]0=25 μmol·L-1,初始pH为3.0的条件下反应30 min时,SMX的去除率和Cr(Ⅵ)的还原率分别达到98.8%和99.2%;实验中MoS2和Fe2+浓度与Cr(Ⅵ)还原率呈正相关,而PMS浓度过高则会抑制Cr(Ⅵ)的还原;MoS2/Fe2+/PMS体系下Cr(Ⅵ)的还原机理不仅与MoS2还原生成的亚铁离子有关,Cr(Ⅵ)也能够被MoS2或PMS直接还原.EPR实验表明,MoS2/Fe2+/PMS体系中主要的自由基是SO4·-和HO·.
关键词:二硫化钼亚铁离子磺胺甲恶唑六价铬硫酸根自由基羟基自由基
Improved removal of sulfamethoxazole and Cr(Ⅵ) by the addition of MoS2 into the Fe2+/PMS process
GONG Qing1
 , YU Tao2, XU Wenxin3, NIE Hui1, LI Dan1, WANG Songlin1
, YU Tao2, XU Wenxin3, NIE Hui1, LI Dan1, WANG Songlin1

1. School of Environmental Science and Engineering, Huazhong University of Science and Technology, Wuhan 430074;
2. Central and Southern China Municipal Engineering Design & Research Institute Co., Ltd, Wuhan 430010;
3. WISDRI Engineering & Research Incorporation Limited, Wuhan 430223
Received 26 September 2020; received in revised from 18 November 2020; accepted 18 November 2020
Abstract: The simultaneous removal of sulfamethoxazole (SMX) and reduction of Cr(Ⅵ) in Molybdenum sulfide/ferrous ion/peroxymonosulfate (MoS2/Fe2+/PMS) process was studied. In the meantime, some influencing factors, such as the dosages of MoS2, Fe2+, PMS and SMX, were also investigated. The results show that the removal of SMX and the reduction of Cr(Ⅵ) were 98.8% and 99.2%, respectively, at the optimal pH (3.0) under the conditions of reaction time of 30 minutes, MoS2 dosage of 0.9 g·L-1, Fe2+ dosage of 0.3 mmol·L-1, PMS dosage of 1 mmol·L-1, and initial SMX and Cr(Ⅵ) concentrations of 25 μmol·L-1 and 100 μmol·L-1. The reduction of Cr(Ⅵ) increased with the elevation of MoS2 or Fe2+ concentration, while excessive PMS inhibited the removal of Cr(Ⅵ). Fe2+ benefit the reduction of Cr(Ⅵ), while the Cr(Ⅵ) could be inhibited by the increased initial SMX concentration and PMS dosage. The analysis of electron paramagnetic resonance (EPR) has proven that both sulfate and hydroxyl radicals are the dominant reactive species in the MoS2/Fe2+/PMS process.
Keywords: molybdenum disulfideferrous ionsulfamethoxazoleCr(Ⅵ)sulfate radicalhydroxyl radical
1 引言(Introduction)单过硫酸盐(PMS)是热力学上非常强的氧化剂, 但与大多数污染物的直接反应速率非常慢, 这意味着与通过活化产生活性自由基来氧化的间接反应相比, PMS的直接氧化反应可忽略不计(Farshid et al., 2013).PMS的活化方法通常包括均相和非均相过渡金属催化剂(Antoine et al., 2013; Ma et al., 2019)、非金属的非均相催化剂(Guo et al., 2017)、紫外、超声和热活化方法.在这些活化方法中, 环境友好且成本较低的亚铁离子(Fe2+)具有较高的催化活性, 从而引起了广泛关注.PMS能够被亚铁离子(Fe2+)活化并有效降解水溶液中的有机污染物, Fe2+与PMS体系的基本反应机理可归纳成如下反应方程式(Farshid et al., 2013):
 | (1) |
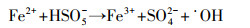 | (2) |
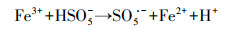 | (3) |
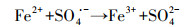 | (4) |
 | (5) |
SMX在地表水及污水处理系统中的检出率非常高, 在我国的珠江、黄浦江、渤海湾、华东地区长江下游等地均有检出(章强等, 2014), 且在磺胺类抗生素中检出率最高, 检出的浓度范围从几ng·L-1到几百ng·L-1.在很多国家的污水处理系统中也均检测到SMX的残留, 且浓度普遍高于地表水中.同时, 重金属已经被人类使用了数千年, 而且更多的重金属暴露仍在继续, 甚至在一些国家持续增加.在有毒重金属离子中, 六价铬(Cr(Ⅵ))是地表水和地下水中常见的污染物, 广泛存在于皮革鞣制加工、电镀、印刷、颜料、抛光等行业的废水中, 会造成多种不良的健康影响并带来严重的环境问题(Yoshida et al., 2017).Cr(Ⅵ)性质活泼, 迁移性强, 毒性为Cr(Ⅲ)的数百倍.去除水中Cr(Ⅵ)最简便的方法就是将其转化为Cr(Ⅲ)后, 再将超出浓度限值的Cr(Ⅲ)用沉淀法从水中去除.当污水厂汇集有机污染废水与Cr金属离子污染废水进行处理时, 应该开发一种有效且经济的技术, 以降低有机污染物及六价铬的浓度.已有研究表明, 当废水中有存在重金属时Fenton或类Fenton体系的氧化效果并不会降低, 甚至可作为催化剂提升体系中氧化剂的利用率(黄翔峰等, 2016).一些高级氧化技术能够有效地将六价铬还原为三价铬, 同时降解水中的有机污染物(Dong et al., 2018; 衣晓虹等, 2019).
本研究针对Fe2+/PMS体系中Fe2+/Fe3+循环慢的问题, 将MoS2作为助催化剂加入Fe2+/PMS体系中, 对MoS2/Fe2+/PMS体系同时处理难降解有机物和还原重金属的能力进行研究, 分别探究体系对单独磺胺甲恶唑(SMX)及SMX与Cr(Ⅵ)共存情况下的去除效果, 考察MoS2、Fe2+、PMS投加量对SMX去除率与Cr(Ⅵ)还原率的影响, 并进行自由基鉴定.
2 材料与方法(Materials and methods)2.1 实验材料实验所用二硫化钼、过硫酸盐、硝酸、磺胺甲恶唑、5, 5-二甲基-1-氧化吡咯啉均为分析纯, 购于Aladdin公司; 硫酸亚铁、氢氧化钠、碳酸氢钠、氯化钠、硝酸钾、重铬酸钾、碘化钾均为分析纯, 购于国药集团化学试剂有限公司; 甲醇为色谱纯, 购于Tedia公司; 所有试剂的溶解和配制均用超纯水.
实验中用到的主要仪器有高效液相色谱仪(LC-16型, 岛津仪器有限公司)、液相色谱柱(ZORBAX SB-C18型, 安捷伦科技有限公司)、紫外可见分光光度计(UV-3100PC型, 上海美谱达仪器有限公司)、电感耦合等离子体发射光(ICP-OES型, 美国利曼公司)、超纯水仪(Micropure UV型, 赛默飞世尔科技有限公司).
2.2 实验方法本实验在250 mL烧杯中进行, 并用恒温槽控制反应温度为(25±1) ℃, 反应液体积为100 mL.反应过程中使用磁力搅拌器对反应溶液进行充分搅拌, 转速固定为400 r·min-1; 所需浓度的MoS2、亚铁离子及SMX或SMX+Cr(Ⅵ)加入反应容器中后, 使用0.1 mmol·L-1 HNO3和0.1 mmol·L-1 NaOH调节溶液的初始pH; 加入所需浓度的PMS开始反应, 在设定的时间点取出1 mL样品加入0.5 mL甲醇迅速猝灭, 取出的样品在分析之前均通过0.22 μm有机滤膜过滤.所有实验至少重复2次.
2.3 分析方法SMX浓度采用高效液相色谱仪(Shimadzu LC-16)测定.色谱仪的主要配置为一台紫外-可见检测器(SPD-16)和一根反相XDB-C18柱(5 μm particle size, 4.6 mm×150 mm, Waters), 流动相采用流速为1 mL·min-1的比例为35∶65的甲醇和0.1%甲酸溶液, 柱温、进样量和检测波长分别为30 ℃、20 μL和270 nm.
Cr(Ⅵ)浓度测定采用二苯基甲酰肼分光光度法(张翠粉等, 2007).其原理为Cr(Ⅵ)与二苯基甲酰肼作用生成紫红色络合物, 在540 nm处测吸光值.具体操作为:在设定的时间点取样后快速经0.22 μm有机滤膜过滤, 加入0.5 mL甲醇猝灭, 然后加入一定体积的硫酸溶液、磷酸溶液和二苯基甲酰肼溶液, 在540 nm处测吸光值.
PMS浓度测定采用碘量法(Guan et al., 2011).碘量法的原理是PMS将I-氧化成I2, 进而络合形成I3-, 在352 nm处测定I3-的吸光值.具体操作为:在设定的时间点取样后快速经0.22 μm有机滤膜过滤, 加入0.5 mL甲醇猝灭, 然后加入一定体积的KI溶液, 在352 nm处测吸光值.测定PMS有效含量时, 根据朗伯-比尔定律计算PMS浓度, 摩尔吸光系数为26400 L·mol-1·cm-1.
亚铁离子及总铁浓度的测定均采用邻菲罗啉分光光度法(Harvey et al., 1955).亚铁离子浓度测定的原理为:在pH为3~9的溶液中, 亚铁离子可以与邻菲罗啉形成橙红色络合物, 以此进行比色测定.总铁浓度测定的原理则为:利用盐酸羟胺将溶液中的三价铁离子还原为亚铁离子后, 再测定溶液中的亚铁离子浓度.具体操作为:在设定的时间点取样后快速经0.22 μm有机滤膜过滤, 加入0.5 mL甲醇猝灭, 然后加入一定体积的pH=4.5的缓冲溶液和邻菲罗啉溶液, 在510 nm处测吸光值.
利用电子顺磁共振(EPR)来检测自由基的生成和类型.利用EPR检测自由基的原理为:自由基与自由基捕获剂结合会形成稳定的产物, 在EPR检测下会呈现特征峰型.具体操作为:在设定的时间点取样后快速经0.22 μm有机滤膜过滤, 再加入一定量的DMPO(自由基捕获剂), 用毛细石英管快速吸取液体, 放入EPR谐振腔中完成检测.
3 结果与讨论(Results and discussion)3.1 不同反应体系对SMX降解的影响图 1所示为MoS2/Fe2+/PMS、Fe2+/PMS、MoS2/PMS、MoS2/Fe2+体系及单一MoS2、Fe2+、PMS体系对SMX的降解效果.由图 1可知, 反应时间为6 min时, MoS2/Fe2+、PMS、MoS2及Fe2+体系对SMX的降解率均小于4%, 表明SMX在这4种体系下几乎没有被降解.在Fe2+/PMS体系下, SMX在初始的0.5 min内迅速降解35.0%, 在之后的0.5~6 min内仅降解了1.7%, 这可能是由于Fe2+/PMS体系下三价铁离子转化为亚铁离子的速率较慢所致(Zou et al., 2013).而在MoS2/Fe2+/PMS体系下, SMX能在反应6 min时达到88.5%的降解率, 远远高于Fe2+/PMS或MoS2/PMS体系在6 min时对SMX的降解率, 这表明MoS2可作为出色的助催化剂提升传统Fe2+/PMS体系的降解效率.之前的研究也得到了类似的结论, 展现出MoS2提升芬顿或类芬顿体系降解效果的能力(Xing et al., 2018).从图 1中还可以看到, SMX在MoS2/PMS体系下也会被逐渐降解, 6 min时降解率达到22.8%, 这表明PMS也能被MoS2活化产生活性自由基进而对SMX产生降解效果(Sheng et al., 2019).
图 1(Fig. 1)
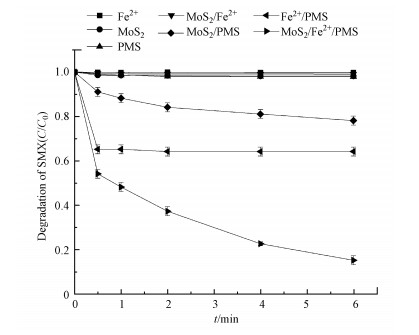 |
| 图 1 不同体系对SMX的降解效果([MoS2]0=0.3 g·L-1, [Fe2+]0=70 μmol·L-1, [PMS]0=75 μmol·L-1, [SMX]0=25 μmol·L-1, 初始pH=3.0) Fig. 1Degradation of SMX in different reaction systems |
3.2 不同反应体系对SMX降解和Cr(Ⅵ)还原的影响图 2和图 3分别显示了Fe2+、PMS、MoS2、MoS2/PMS、MoS2/Fe2+、Fe2+/PMS、MoS2/Fe2+/PMS和MoS2/Fe2+/PMS体系在SMX和Cr(Ⅵ)共存情况下对这两种底物各自的去除和还原效果.从图 2中可以看到, 单独PMS和Fe2+/PMS体系对SMX和Cr(Ⅵ)共存情况下Cr(Ⅵ)的去除和还原效果均在9%以下.单独PMS体系在SMX和Cr(Ⅵ)共存情况下反应30 min时, Cr(Ⅵ)浓度降低了8.7%(图 2), SMX浓度降低了32.4%(图 3), 这与图 1中单独PMS对单一底物SMX几乎无降解不同.这是由于PMS能与Cr(Ⅵ)发生类芬顿反应产生活性自由基从而降解SMX(单良, 2016).但维持强氧化能力需要较高浓度的Cr(Ⅵ), 单独加入PMS很难达到同时去除SMX和还原Cr(Ⅵ)的效果.
图 2(Fig. 2)
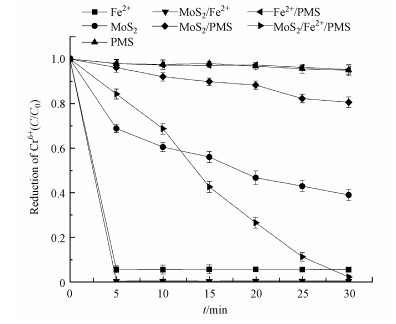 |
| 图 2 不同体系对六价铬还原效果的影响([MoS2]0=0.9 g·L-1, [Fe2+]0=0.3 mmol·L-1, [PMS]0=1 mmol·L-1, [Cr(Ⅵ)]0=100 μmol·L-1, [SMX]0=25 μmol·L-1, 初始pH=3.0) Fig. 2Reduction of Cr(Ⅵ) in different reaction systems |
图 3(Fig. 3)
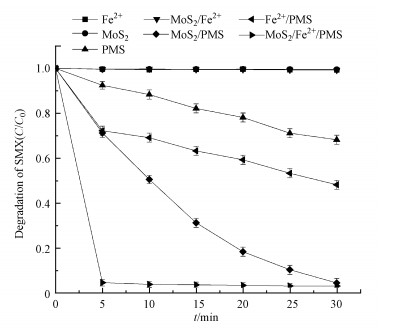 |
| 图 3 六价铬存在条件下不同体系对SMX降解效果的影响([MoS2]0=0.9 g·L-1, [Fe2+]0=0.3 mmol·L-1, [PMS]0=1 mmol·L-1, [Cr(Ⅵ)]0=100 μmol·L-1, [SMX]0=25 μmol·L-1, 初始pH=3.0) Fig. 3Reduction of SMX in different reaction systems when Cr(Ⅵ) exsists |
由图 2可知, MoS2、MoS2/PMS和MoS2/Fe2+/PMS体系对SMX和Cr(Ⅵ)共存情况下的Cr(Ⅵ)均有持续的还原作用.在MoS2和MoS2/PMS体系中均无亚铁离子存在, 且单独PMS对Cr(Ⅵ)的还原效率较低, 推测在这两个反应体系中是MoS2表面具有还原性的Mo4+活性点位与Cr(Ⅵ)反应将其还原为三价铬.因此, 在SMX和Cr(Ⅵ)共存体系中, MoS2不仅作为助催化剂参与反应, 其对Cr(Ⅵ)的直接还原作用也较为关键.其中, MoS2体系对Cr(Ⅵ)的还原效率要高于MoS2/PMS体系, 在反应30 min时MoS2体系对Cr(Ⅵ)的还原率达到62.7%, 而30 min时MoS2/PMS体系对Cr(Ⅵ)的还原率为22.5%.主要是反应时间为0~5 min时去除速率的不同造成了这两个体系对Cr(Ⅵ)还原效率的差别, 在5~30 min时两者的浓度曲线几乎平行.反应时间为0~5 min时MoS2/PMS体系对Cr(Ⅵ)的还原速率低于MoS2体系, 可能是由于此段时间PMS也与MoS2发生反应, 占据了MoS2表面的部分Mo4+位点.而在反应5 min之后, 溶液中的PMS浓度降低, MoS2和MoS2/PMS两个体系对Cr(Ⅵ)的还原速率趋于一致.
单独Fe2+体系在5 min内对Cr(Ⅵ)的还原率为94.1%, 表明亚铁离子可以与Cr(Ⅵ)直接反应将其还原为三价铬.而MoS2/Fe2+体系在5 min内对Cr(Ⅵ)的还原率为99.8%.MoS2/Fe2+/PMS体系在反应30 min时对Cr(Ⅵ)的还原率达到99.2%, 且同时对SMX的降解率达到98.8%(图 3), 是这7个体系中唯一能在30 min内同时将SMX去除率与Cr(Ⅵ)还原率达到90%以上的反应体系.
3.3 MoS2浓度对SMX降解和Cr(Ⅵ)还原的影响如图 4a所示, 当MoS2浓度为0.3~1.5 g·L-1时, MoS2/Fe2+/PMS体系在SMX与Cr(Ⅵ)共存时对Cr(Ⅵ)的还原效率随着MoS2浓度的提升而升高.MoS2浓度为0.9 g·L-1时, 反应30 min时Cr(Ⅵ)的还原率达到99.2%, 继续提升MoS2浓度Cr(Ⅵ)还原速率也随之提升, 将MoS2浓度提升至1.5 g·L-1也未见抑制效果.在此MoS2浓度范围内, 该体系对SMX的降解效率均大于97%, MoS2浓度在此范围内的改变并未对SMX去除效率造成明显改变(图 4b).
MoS2是一种无机化合物, 具有非常稳定的物理化学性质.MoS2的加入可以有效地催化Fe2+/PMS体系, 提高SMX的降解率, 因为MoS2能使活性Mo4+暴露出来, 实现有效的Fe3+/Fe2+循环, 防止铁泥沉淀.更重要的是, 使用MoS2催化可以同时实现SMX分子的降解和Cr(Ⅵ)的还原, 降低多组分废水对环境的危害.据研究(Xu et al., 2020), 通过沉淀、过滤可将二硫化钼分离, 并对回收的二硫化钼进行重复利用, 降解效率不会有明显的改变.使用ICP-OES也未检测出反应溶液中存在Mo离子, 表明该体系下MoS2较稳定并不会释放Mo离子到溶液中.
图 4(Fig. 4)
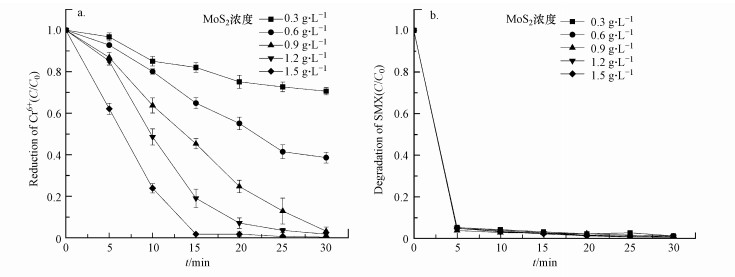 |
| 图 4 MoS2投加浓度对六价铬还原效果(a)和SMX(b)降解效果的影响([Fe2+]0=0.3 mmol·L-1, [PMS]0=1 mmol·L-1, [Cr(Ⅵ)]0=100 μmol·L-1, [SMX]0=25 μmol·L-1, 初始pH=3.0) Fig. 4Effect of MoS2 dosage of the MoS2/Fe2+/PMS process for the reduction of Cr(Ⅵ) (a) and degradation of SMX(b) |
3.4 亚铁离子浓度对SMX降解和Cr(Ⅵ)还原的影响图 5所示为SMX与Cr(Ⅵ)两种底物共存时, 亚铁离子浓度对MoS2/Fe2+/PMS体系还原Cr(Ⅵ)的影响.由图可知, 亚铁离子浓度为0.1~1.5 mmol·L-1时, 随着亚铁离子浓度的提升, Cr(Ⅵ)的还原速率也随之加快, 但在此亚铁离子浓度范围内SMX的降解效率改变不大, 均在97%以上.
图 5(Fig. 5)
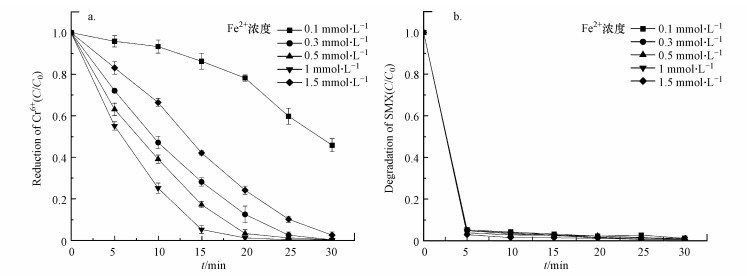 |
| 图 5 亚铁离子投加浓度对六价铬还原效果(a)及SMX(b)降解效果的影响([MoS2]0=0.9 g·L-1, [PMS]0=1 mmol·L-1, [Cr(Ⅵ)]0=100 μmol·L-1, [SMX]0=25 μmol·L-1, 初始pH=3.0) Fig. 5Effect of MoS2 dosage of the MoS2/Fe2+/PMS process for the reduction of Cr(Ⅵ)(a) and degradation of SMX(b) |
MoS2/Fe2+/PMS体系在SMX与Cr(Ⅵ)两种底物共存时对Cr(Ⅵ)的还原并无明显的快反应与慢反应阶段区分, 随着亚铁离子浓度的提升, 30 min内Cr(Ⅵ)的还原速率整体提升, 因此, 可以推断亚铁离子在该体系Cr(Ⅵ)的还原中处于关键地位.
3.5 PMS浓度对SMX降解和Cr(Ⅵ)还原的影响PMS作为氧化剂提供降解SMX所必须的活性自由基, 且从图 1可以看出PMS可能会抑制MoS2对Cr(Ⅵ)的还原, 因此, 在研究MoS2/Fe2+/PMS体系同时去除SMX和Cr(Ⅵ)这两种底物时, PMS浓度也是重要的影响因素之一.
如图 6a所示, 当PMS浓度为0.2~1 mmol·L-1时, 在反应前5 min内PMS浓度越高Cr(Ⅵ)还原速率越慢, 但在反应5~30 min时, PMS浓度越高Cr(Ⅵ)还原速率越快.反应前5 min内PMS浓度越高反而抑制Cr(Ⅵ)的还原可能是因为反应初期PMS浓度越高溶液中消耗的亚铁离子也越多, 能被亚铁离子还原的Cr(Ⅵ)数量也随之降低.而在反应5 min之后适量浓度的PMS对亚铁离子消耗减缓, 同时促进一定量的Cr(Ⅵ)还原为三价铬, 因而此时PMS浓度越高Cr(Ⅵ)还原速率越快.当PMS浓度为1~4 mmol·L-1时, PMS浓度越高反应30 min内Cr(Ⅵ)还原速率被抑制得越严重, 这可能是由于PMS浓度过高会占据MoS2表面大量的Mo4+点位或浓度较高的PMS对亚铁离子的消耗速度加快.由图 6b可知, PMS浓度为0.2~4 mmol·L-1时, SMX的降解效率改变也不大, 降解效率均在96%以上.
图 6(Fig. 6)
 |
| 图 6 PMS投加浓度对六价铬还原效果(a)及SMX降解效果(b)的影响([MoS2]0=0.9 g·L-1, [Fe2+]0=0.3 mmol·L-1, [Cr(Ⅵ)]0=100 μmol·L-1, [SMX]0=25 μmol·L-1, 初始pH=3.0) Fig. 6Effect of PMS dosage of the MoS2/Fe2+/PMS process for the reduction of Cr(Ⅵ)(a) and degradation of SMX(b) |
3.6 初始SMX浓度对SMX降解和Cr(Ⅵ)还原的影响从图 7a中可以看出, 当SMX浓度为0~25 μmol·L-1时, SMX浓度对Cr(Ⅵ)的还原几乎没有影响, 但当SMX浓度高于25 μmol·L-1时, SMX浓度对Cr(Ⅵ)的还原呈现逐步抑制的趋势.因此, SMX与Cr(Ⅵ)这两种底物在MoS2/Fe2+/PMS体系中的去除存在竞争关系.如图 7b所示, 当底物之一的SMX浓度升至100 μmol·L-1时, 该体系在反应至30 min时也能将其几乎完全降解.
图 7(Fig. 7)
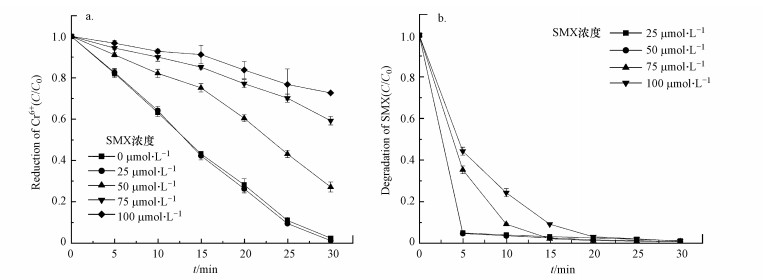 |
| 图 7 SMX浓度对六价铬还原效果(a)及SMX降解效果(b)的影响([MoS2]0=0.9 g·L-1, [Fe2+]0=0.3 mmol·L-1, [PMS]0=1 mmol·L-1, [Cr(Ⅵ)]0=100 μmol·L-1, 初始pH=3.0) Fig. 7Effect of SMX dosage of the MoS2/Fe2+/PMS process for the reduction of Cr(Ⅵ)(a) and degradation of SMX(b) |
3.7 反应中六价铬和铁的浓度变化为了进一步探究MoS2/Fe2+/PMS体系对Cr(Ⅵ)的还原机理, 分别检测了MoS2/Cr6+、Fe2+/Cr6+、Fe3+/Cr6+、MoS2/Fe2+/Cr6+、MoS2/Fe3+/Cr6+体系中Cr(Ⅵ)浓度的变化(图 8a).可以看到, 三价铁离子对Cr(Ⅵ)并无还原作用, 但MoS2/Fe3+/Cr6+体系能够较快速地还原Cr(Ⅵ), 在反应20 min时可还原98.9%的Cr(Ⅵ).单独MoS2对Cr(Ⅵ)也有还原作用, 但在反应30 min时对Cr(Ⅵ)的还原率仅为46.1%, 因此直接证明了MoS2能将铁离子还原为亚铁离子从而还原Cr(Ⅵ).同时图 8b也能看到, MoS2/Fe2+/PMS体系中亚铁离子浓度在20 min后有明显回升, 这种亚铁离子浓度的回升在Fe2+/PMS体系中并未出现.综上所述, Cr(Ⅵ)能够被MoS2直接还原, 也能被MoS2还原生成的亚铁离子还原为三价铬, 少量Cr(Ⅵ)可能通过与PMS反应被去除.
图 8(Fig. 8)
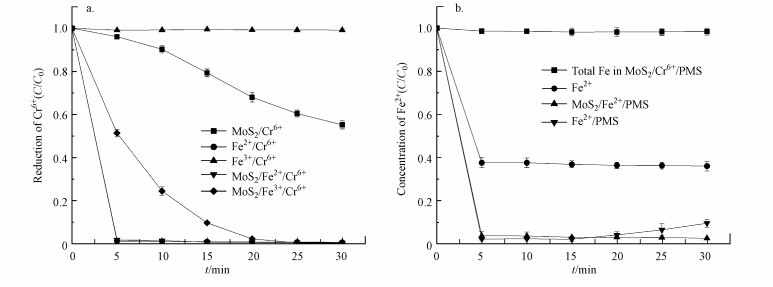 |
| 图 8 不同体系反应中六价铬浓度变化(a)([MoS2]0=0.9 g·L-1, [Fe2+]0=0.3 mmol·L-1, [Fe3+]0=0.3 mmol·L-1, [Cr(Ⅵ)]0=100 μmol·L-1, 初始pH=3.0)及亚铁离子及总铁浓度变化(b)([MoS2]0=0.9 g·L-1, [Fe2+]0=0.3 mmol·L-1, [PMS]0=1 mmol·L-1, [Cr(Ⅵ)]0=100 μmol·L-1, [SMX]0=25 μmol·L-1, 初始pH=3.0) Fig. 8Variation of Cr(Ⅵ) (a) and Fe2+ and total iron ions(b) in different reaction systems |
3.8 自由基鉴定为了进一步探究反应过程中自由基的生成, 本研究使用DMPO作为自由基捕获剂进行EPR实验.如图 9所示, 对应于DMPO-OH特定位置的超精细偶合常数(α(N)=1.49 mT和α(H)=1.49 mT)和对应于DMPO-SO4特定位置的超精细偶合常数(α(N)=1.38 mT, α(H)=1.02 mT, α(H)=0.14 mT和α(H)=0.08 mT)(Zhu et al., 2016)在Fe2+/PMS和MoS2/Fe2+/PMS体系中都可以发现, 其中, DMPO-OH的特征峰高度比DMPO-SO4要高很多, 这可能是因为DMPO-SO4在水溶液中容易发生水解反应生成DMPO-OH(Timmins et al., 1999).同时, MoS2/Fe2+/PMS体系中的信号强度显著超过Fe2+/PMS体系中的信号强度.该结果表明, 加入MoS2可以促进·OH和SO4·-形成, 这与在Fe2+/PMS体系中添加MoS2可显著提升SMX降解这一现象一致.
图 9(Fig. 9)
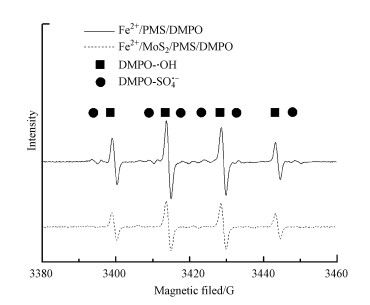 |
| 图 9 不同体系自由基的EPR谱图([MoS2]0=1.67 g·L-1, [Fe2+]0=1.4 mmol·L-1, [PMS]0=8 mmol·L-1, [SMX]0=25 μmol·L-1, [DMPO]0=8.3 mmol·L-1, 初始pH=3.0) Fig. 9EPR spectra of MoS2/Fe2+/PMS process |
许多研究表明, Fe2+/PMS体系中的反应主要包含如式(1)~(3)所示的3个方程式.Fe2+催化PMS分解, 可分别通过式(1)或式(2)直接生成SO4·-或·OH, 同时伴随着Fe2+到Fe3+的快速转化.生成的Fe3+随着式(3)所示反应再缓慢转化为Fe2+, 此反应限制了Fe2+/PMS体系的整体反应效率.因此, 促进Fe3+/Fe2+循环是提高Fe2+/PMS体系效率的好方法, 该方法可以促进PMS分解生成SO4·-和·OH.
4 结论(Conclusions)1) MoS2/Fe2+/PMS体系能同时去除SMX和还原Cr(Ⅵ), 当[MoS2]0=0.9 g·L-1, [Fe2+]0=0.3 mmol·L-1, [PMS]0=1 mmol·L-1, [Cr(Ⅵ)]0=100 μmol·L-1, [SMX]0=25 μmol·L-1, 初始pH为3.0, 反应30 min时Cr(Ⅵ)的还原率达到99.2%, 且同时对SMX的降解率达到98.8%.
2) 随着MoS2或Fe2+浓度分别从0.3 g·L-1和0.1 mmol·L-1升至1.5 g·L-1和1.5 mmol·L-1, Cr(Ⅵ) 还原速率不断提升; 然而PMS浓度过高时会抑制Cr(Ⅵ)的还原效率, SMX浓度提升可抑制对Cr(Ⅵ)的还原效率.
3) 在MoS2/Fe2+/PMS体系内Cr(Ⅵ)能够被MoS2直接还原去除, 也能被MoS2还原生成的亚铁离子还原为三价铬, 此外, 少量Cr(Ⅵ)可能通过与PMS反应被还原.
参考文献
| Dong C, Ji J, Shen B, et al. 2018. Enhancement of H2O2 decomposition by the co-catalytic effect of WS2 on the Fenton reaction for the synchronous reduction of Cr(Ⅵ) and remediation of phenol[J]. Environmental Science & Technology, 52(19): 11297-11308. |
| Farshid G, Mahsa M. 2017. Application of peroxymonosulfate and its activation methods for degradation of environmental organic pollutants: Review[J]. Chemical Engineering Journal, 310: 41-62. DOI:10.1016/j.cej.2016.10.064 |
| Guan Y, Ma J, Li X, et al. 2011. Influence of pH on the formation of sulfate and hydroxyl radicals in the UV/peroxymonosulfate system[J]. Environmental Science & Technology, 45(21): 9308-9314. |
| Guo Y, Zeng Z, Li Y, et al. 2017. Catalytic oxidation of 4-chlorophenol on in-situ sulfur-doped activated carbon with sulfate radicals[J]. Separation and Purification Technology, 179: 257-264. DOI:10.1016/j.seppur.2017.02.006 |
| Harvey Jr A E, Smart J A, Amis E S. 1955. Simultaneous spectrophotometric determination of iron (Ⅱ) and total iron with 1, 10-phenanthroline[J]. Analytical Chemistry, 27(1): 26-29. DOI:10.1021/ac60097a009 |
| 黄翔峰, 熊永娇, 彭开铭, 等. 2016. 金属离子络合对抗生素去除特性的影响研究进展[J]. 环境化学, 35(1): 133-140. |
| Liu J, Dong C, Deng Y, et al. 2018. Molybdenum sulfide Co-catalytic Fenton reaction for rapid and efficient inactivation of Escherichia coli[J]. Water Research, 145: 312-320. DOI:10.1016/j.watres.2018.08.039 |
| Ma Q, Zhang X, Guo R, et al. 2019. Persulfate activation by magnetic γ-Fe2O3/Mn3O4 nanocomposites for degradation of organic pollutants[J]. Separation and Purification Technology, 210: 335-342. DOI:10.1016/j.seppur.2018.06.060 |
| Qin Y, Song F, Ai Z, et al. 2015. Protocatechuic acid promoted alachlor degradation in Fe(Ⅲ)/H2O2 Fenton system[J]. Environmental Science & Technology, 49(13): 7948-7956. |
| 单良. 2011. 过硫酸盐对含Cl-或含Cr(Ⅵ)水中染料的降解实验研究[D]. 青岛: 中国海洋大学 |
| Sheng B, Yang F, Wang Y, et al. 2019. Pivotal roles of MoS2 in boosting catalytic degradation of aqueous organic pollutants by Fe(Ⅱ)/PMS[J]. Chemical Engineering Journal, 375: 121989. DOI:10.1016/j.cej.2019.121989 |
| Timmins G S, Liu K J, Bechara E J, et al. 1999. Trapping of free radicals with direct in vivo EPR detection: a comparison of 5, 5-dimethyl-1-pyrroline-N-oxide and 5-diethoxyphosphoryl-5-methyl-1-pyrroline-N-oxide as spin traps for HO and SO4·-[J]. Free Radical Biology and Medicine, 27(3/4): 329-333. |
| Xing M, Xu W, Dong C, et al. 2018. Metal sulfides as excellent co-catalysts for H2O2 decomposition in advanced oxidation processes[J]. Chemosphere, 4(6): 1359-1372. |
| 衣晓虹. 2019. MOFs及其复合物光催化还原Cr(Ⅵ)及降解有机污染物性能研究[D]. 北京: 北京建筑大学 |
| Yoshida N, Tsaturyan A, Akitsu T, et al. 2017. Photo-induced reduction of Cr6+ by the hybrid systems "CuII complex with Schiff base and TiO2": dependence on irradiation wavelength[J]. Russian Chemical Bulletin, 66(11): 2057-2065. DOI:10.1007/s11172-017-1981-7 |
| 张翠粉, 徐苏娟, 刘清明, 等. 2007. 二苯卡巴肼分光光度法测定水中Cr6+方法的改进[J]. 污染防治技术, (4): 91-92. |
| 章强, 辛琦, 朱静敏, 等. 2014. 中国主要水域抗生素污染现状及其生态环境效应研究进展[J]. 环境化学, 33(7): 1075-1083. |
| Zhu C, Fang G, Dionysiou D D, et al. 2016. Efficient transformation of DDTs with persulfate activation by zero-valent iron nanoparticles: a mechanistic study[J]. Journal of Hazardous Materials, 316: 232-241. DOI:10.1016/j.jhazmat.2016.05.040 |
| Zou J, Ma J, Chen L, et al. 2013. Rapid acceleration of ferrous iron/peroxymonosulfate oxidation of organic pollutants by promoting Fe(Ⅲ)/Fe(Ⅱ) cycle with hydroxylamine[J]. Environmental Science & Technology, 47(20): 11685-11691. |
