 , 韩璐1
, 韩璐1
 , 文威2, 段晓虎1
, 文威2, 段晓虎11. 中国环境科学研究院环境基准与风险评估国家重点实验室, 北京 100012;
2. 中南安全环境技术研究院股份有限公司, 武汉 430079
收稿日期: 2020-11-08; 修回日期: 2021-02-04; 录用日期: 2021-02-07
基金项目: 国家水体污染控制与治理科技重大专项(No.2018ZX07601-003)
作者简介: 闫晓寒(1996—), 女, E-mail: 15735170998@163.com
通讯作者(责任作者): 韩璐(1981—), 女, 研究员, 硕士生导师.长期从事水环境管理、环境风险评估、水污染控制等方面的研究和管理支撑工作.在国内外核心学术期刊上发表论文30余篇. E-mail: hanlu@craes.org.cn
摘要:以辽河保护区水体为研究对象,使用三维荧光光谱技术(EEMs)结合平行因子模型(PARAFAC)探究辽河保护区水体溶解性有机质(DOM)的组成成分、主要来源及DOM的空间分布特征.同时,结合水体理化性质指标,运用统计学分析方法研究影响DOM的主要因素.结果表明,辽河保护区表层水中DOM含有3种荧光组分,分别为陆源及海洋源类腐殖C1(λEx/λEm=245,315 nm/415 nm)、类富里酸C2(λEx/λEm=260,355 nm/470 nm)及类色氨酸C3(λEx/λEm=225,280 nm/340 nm).辽河保护区DOM以类腐殖质物质C1与C2为主要成分(占总组分荧光强度的78%),以类蛋白质组分C3为次要组分(占总组分荧光强度的22%).从组分及空间分布上看,DOM类腐殖质组分总荧光强度表现为上游>下游>中游,类蛋白质组分的荧光强度则表现为中游>下游>上游,与周边环境因素及人为扰动因素具有密切关系.DOM来源受内源释放和外源输入共同影响,具有自生源特征和腐殖化特征.通过相关性分析可知,C1、C2与DOC呈显著正相关关系;C3与TP呈正相关关系,与TN呈负相关关系.
关键词:三维荧光平行因子溶解性有机质空间分布来源解析辽河保护区
Spectral characteristics and spatial distribution of DOM in surface water of Liaohe reservation zone
YAN Xiaohan1
 , HAN Lu1
, HAN Lu1
 , WEN Wei2, DUAN Xiaohu1
, WEN Wei2, DUAN Xiaohu11. State Key Laboratory of Environmental Criteria and Risk Assessment, Chinese Research Academy of Environmental Sciences, Beijing 100012;
2. Central-Southern Safety & Environment Technology Institute Co., Ltd, Wuhan 430079
Received 8 November 2020; received in revised from 4 February 2021; accepted 7 February 2021
Abstract: Taking Liaohe reservation zone water as the research object, Excitation-emission matrix spectroscopy (EEMS) combined with parallel factor analysis (PARAFAC) was applied to investigate the fluorescence characteristics, spatial distribution and its source of dissolved organic matter (DOM) in the water of Liaohe reservation zone. Combined with the physical and chemical properties of the water, the main factors affecting DOM were studied by using statistical analysis method. The results indicated that three fluorescence components were identified by PARAFAC, including Terrestrial and Marine humic acids, fulminate and tryptophan-like component namely C1 (λEx/λEm=245, 315 nm/415 nm), C2 (λEx/λEm=260, 355 nm/470 nm) and C3 (λEx/λEm=225, 280 nm/340 nm). The contribution rates to the total fluorescence intensity of C1 and C2 were 78% and C3 were 22%, respectively. The spatial distribution characteristics of DOM humus components are upstream > midstream> downstream, the fluorescence intensity of protein-like components was as follows: midstream> downstream >upstream, which are closely related to the surrounding environmental factors and human disturbance factors. DOM source is influenced by both endogenous release and exogenous input, and has autogenesis and humification characteristics. Water pollution in the Liaohe River Basin is mainly affected by N and P inputs. Certain correlation was observed between the fluorescence intensity of DOM and the water quality parameters of the water of Liaohe reservation zone. C1, C2 and DOC are significantly positively correlated.C3 was positively correlated with TP and negatively correlated with TN. C1, C2 and DOC were significantly positively correlated.C3 was positively correlated with TP and negatively correlated with TN.
Keywords: three-dimensional fluorescenceparallel factordissolved organic matterspatial distributionsource analysisLiaohe reservation zone
1 引言(Introduction)溶解性有机质(Dissolved Organic Matter, 简称DOM)广泛存在于天然水体和土壤中, 是一类粒径小于0.45 μm且具有复杂结构的溶解性有机混合物(Burdige et al., 2015).DOM作为水环境中的碳储存库, 影响着全球碳循环;并且作为水环境中有机污染物、重金属离子等污染物的重要载体, 影响着污染物的生物可利用性、毒性和迁移转化(范诗雨等, 2018).由于DOM在水环境中长期存在, 对水生生态系统可产生重要影响, 因而受到****们的广泛关注.
天然水体中DOM的来源主要分两种, 一种是内源排放, 主要为水生生物新陈代谢排放物及生物残骸转化所形成的DOM;另一种为外源输入, 主要是陆地动植物残骸及人工合成有机物等向河流输入后所形成的DOM(Pernet-Coudrier et al., 2008).不同来源的DOM具有不同的组成成分及光学性质(Tang et al., 2014).研究表明, DOM的组成成分和光学性质可反映出水体的性质组成, 对水环境保护研究具有重要意义(胡霞等, 2018).三维荧光光谱技术(Three Dimensional Excitation-Emission Matrix Spectra, 3DEEMs)是获取DOM结构信息的有效技术手段, 具有分析速度快、样品需求量少、灵敏度高等优点(Carstea et al., 2014).三维荧光光谱技术与平行因子分析方法相结合, 可快速分离出重叠峰, 准确解析DOM的组成组分及来源, 目前已被广泛应用于河流、湖泊、水库等水体DOM的组分、来源、分布等研究中, 并可用于对水体的水质情况进行初步判断(郝子峰等, 2019;高凤等, 2019).
辽河流域作为我国大型寒冷地区流域, 随着区域工业化程度上升, 流域水生态系统受损严重.辽河流域主体分布在辽宁省中部城市群, 是生态恢复实践的重点对象.为更加有效地治理和保护辽河, 2010年5月, 由辽宁省委、省政府批准沿辽河干流设立辽河保护区(123°55′30″E~121°41′E, 43°02′N~40°47′N).保护区全长538 km, 占地总面积为1869.2 km2.自2010年划定保护区范围后, 经过多年自然封育管理与水污染治理, 保护区内植被恢复, 辽河干流水质也达到了规定的摘掉重污染帽子的标准.辽河保护区的划定对于健康河流保护具有代表性, 本文按照区域特征对采样断面进行划分, 揭示溶解性有机质(DOM)的空间分布规律, 探究辽河保护区DOM与水质参数之间的相关性, 明确保护区水体环境的潜在影响因素, 判断水质污染情况.有助于日后实现水质的快速、实时监测, 可以对辽河保护区各区域的水质污染防治及水环境管理提供有针对性的管理措施.
2 材料与方法(Materials and methods)2.1 研究区域概况及采样点布设辽河保护区位于我国东北地区西南部, 起于东、西辽河交汇处福德店, 途经铁岭市、沈阳市、鞍山市、盘锦市, 终于盘锦市大洼县入海口.保护区内海拔由东北向西南逐渐降低, 其中, 山区、丘陵主要分布在铁岭市和沈阳市北部, 平原主要分布在沈阳市南部、鞍山市、盘锦市.保护区内主要支流有左岸汇入的东辽河、招苏台河、汎河、左小河等, 以及右岸汇入的西辽河、柳河、小柳河、一统河等.
本文以辽河保护区表层水体为研究对象, 根据周边支流汇入情况, 于2019年10月末在不同河段(保护区上游至下游)及各个支流汇入口共布设21个采样点, 所有采样点均以GPS定位.具体采样点分布如图 1所示, 辽河保护区水体各个城市段采样点位及名称见表 1.
图 1(Fig. 1)
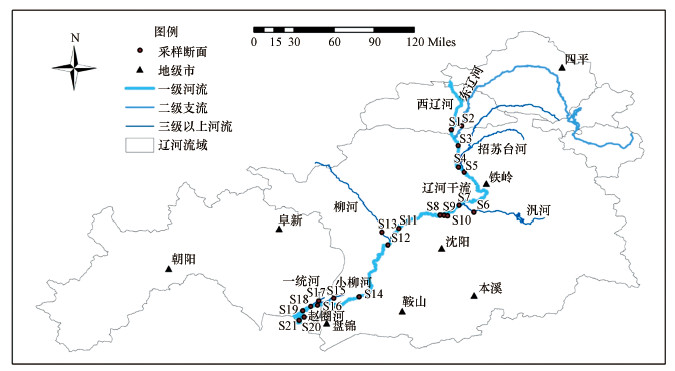 |
| 图 1 辽河保护区水体采样点位布设图 Fig. 1Layout of sampling points in Liaohe reservation zone |
表 1(Table 1)
| 表 1 辽河保护区水体采样点分布 Table 1 Distribution information of sampling points in Liaohe reservation zone | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 1 辽河保护区水体采样点分布 Table 1 Distribution information of sampling points in Liaohe reservation zone
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
2.2 样品采集在各采样点使用有机玻璃采样器采集表层水样1 L, 现场测试水样溶解氧(DO)、pH、温度等理化性质指标.取500 mL水样过0.45 μm的醋酸纤维素滤膜后装入聚丙烯材料的采样瓶中, 滤液中的有机物即为DOM, 用于光谱分析.另取100 mL水样装入采样瓶中用于氨氮(NH4+-N)、总磷(TP)、总氮(TN)、化学需氧量(COD)、溶解性有机碳(DOC)的测定.将采集完的样品置于黑暗、4 ℃低温条件下保存, 尽快送回实验室完成测定.
2.3 样品测定2.3.1 三维荧光光谱分析DOM荧光特性采用日立F-7000荧光分光光度计测定, 配用1 cm的四通石英比色皿和150 W氙弧灯的光源.基本参数设定如下:电压为700 V, 夹缝为5 nm, 扫描速度为2400 nm·min-1, 激发波长200~450 nm, 发射波长260~550 nm.测定前采用Milli-Q超纯水作为空白, 去除瑞利散射和拉曼散射的影响.
2.3.2 特征参数荧光指数(Fluorescence Intensity, FI)可表征溶解性有机质的来源, 是指在370 nm激发波长下, 发射波长为470 nm与520 nm处荧光强度的比值(Mcknight et al., 2001).自生源指数(Biological Index, BIX)是反映溶解性有机质自生源贡献的指标, 是指激发波长为310 nm时, 发射波长在380 nm和430 nm处荧光强度的比值(Birdwell et al., 2010).腐殖化指数(Humification Index, HIX)是用于衡量水中溶解性有机物腐殖化程度的参数, 指激发波长为255 nm时, 发射波长在435~480 nm与300~345 nm区间内取荧光强度平均值的比值(孟永霞等, 2020).
2.4 数据处理2.4.1 平行因子模型运用MATLAB 9.1软件中PARAFAC工具箱对辽河保护区水体21个三维荧光光谱数据矩阵进行处理得到3个荧光组分.
2.4.2 统计分析实验数据主要采用Origin9.1、Excel 2016及SPSS 25软件进行统计检验、绘图和分析;数据空间分布图及采样点布点图利用ArcGIS 10.2绘制.
3 结果与讨论(results and discussion)3.1 DOM荧光组分识别对21个采样点DOM的三维荧光光谱数据进行平行因子分析, 共识别出3种荧光组分.3个荧光组分的最大激发/发射波长分布曲线及三维荧光光谱如图 2所示, 其中, C1和C2为类腐殖质组分, C3为类蛋白质组分.组分C1(λEx/λEm=245, 315 nm/415 nm)、组分C2(λEx/λEm=260, 355 nm/470 nm)、组分C3(λEx/λEm=225, 280 nm/340 nm)均具有2个激发峰和1个发射峰.各组分的最大激发波长、最大发射波长、荧光类型及与相关文献对比见表 2.
图 2(Fig. 2)
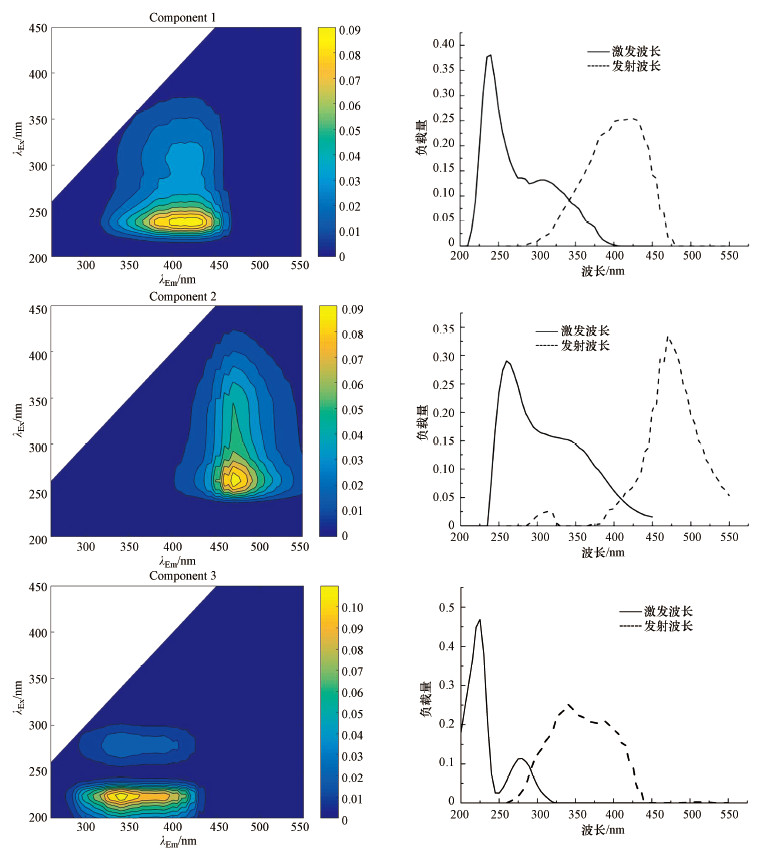 |
| 图 2 辽河保护区水体DOM荧光光谱特征 Fig. 2Fluorescence spectral characteristics of DOM in Liaohe reservation zone |
表 2(Table 2)
| 表 2 辽河保护区3种荧光组分光谱特征 Table 2 Spectral characteristics of three fluorescence components in Liaohe reservation zone | ||||||||||||||||||||
表 2 辽河保护区3种荧光组分光谱特征 Table 2 Spectral characteristics of three fluorescence components in Liaohe reservation zone
| ||||||||||||||||||||
组分C1的短波激发峰(λEx/λEm=245 nm/415 nm)对应传统A峰, 为陆生源类腐殖质物质, 长波激发峰(λEx/λEm=315 nm/415 nm)对应传统M峰, 为海洋源类腐殖质物质, 故组分C1为传统A峰及M峰的混合体, 称为陆源及海洋源类腐殖质.峰A与DOM中高芳香度、高分子量的基团有关, 不易被生物降解利用, 用于指示外源输入(李帅东等, 2017).峰M主要与异养生物代谢产生的可溶性有机物有关, 相对分子质量大, 结构复杂且稳定, 不易被生物降解或利用, 指示海洋类腐殖质物质(Battin, 1998;蔡文良等, 2012).由此可见, 海洋类腐殖质荧光峰也存在于陆地水体中(陈永娟等, 2016), 可能与辽河入海口处有机质的地球化学循环有关.
组分C2的短波激发峰(λEx/λEm=260 nm/470 nm)对应传统A峰, 为紫外区类腐殖质;长波激发峰(λEx/λEm=355 nm/470 nm)对应传统C峰, 为可见光区类腐殖质.峰C一般与小分子量、高荧光效率的基团有关, 在水环境中易被氧化降解(李帅东等, 2017).峰A及峰C主要来自于陆源输入.
组分C3的短波激发峰(λEx/λEm=225 nm/340 nm)对应传统T2峰, 长波激发峰(λEx/λEm=280 nm/340 nm)对应传统T1峰, 属于色氨酸类荧光峰.峰T1与峰T2一般来源于水体内浮游植物和微生物的降解, 可间接反映水体中微生物活动情况(韩宇超等, 2009).
3.2 DOM空间分布特征DOM含量可由总荧光强度表征, 荧光强度分布差异可揭示DOM的空间分布.辽河保护区表层水21个采样点的总荧光强度及3个荧光组分含量如图 3所示.
图 3(Fig. 3)
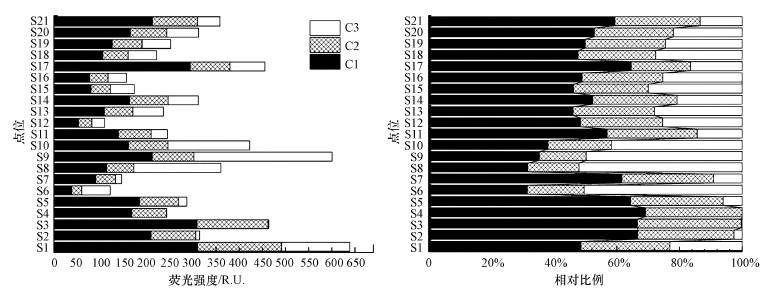 |
| 图 3 荧光强度空间分布与各荧光组分的相对比例 Fig. 3Spatial distribution of fluorescence intensity and relative ratio of each fluorescence component |
从各组分占总组分的比例来看, 辽河保护区DOM以类腐殖质物质为主要成分, 占总组分荧光强度的78%, 其中, 陆源及海洋源类腐殖质组分C1占比较大, 约为52.3%;以类蛋白质组分C3为次要组分, 占总组分荧光强度的22%.由于天然水体中类腐殖质物质的含量相对较多, 受人为干扰严重的污染水体中则类蛋白质物质的含量相对较多(刘堰杨等, 2018).通过与辽河保护区划定初期阶段研究(赵芸等, 2013;邵田田等, 2015)对比可知, 辽河保护区DOM的主要成分由以类蛋白组分为主变为以类腐殖质组分为主, 说明辽河保护区经多年治理后, 人为扰动影响水平显著降低, 人为营养素输入降低, 微生物活动驱动力减少, 类蛋白质组分相应下降, DOM主要源于水生生物与沉积物有机质溶出、保护区周边土壤有机质输入等.
从荧光强度的空间变化趋势来看, 辽河保护区DOM各组分荧光强度受周边环境及人为扰动影响严重.类腐殖质组分总荧光强度表现为上游>下游>中游, 类蛋白质组分总荧光强度则表现为中游>下游>上游.上游区域, 类腐殖质物质大多占90%以上, 水体受人为活动影响少, DOM主要来源于土壤径流、枯叶腐烂释放等过程.中游区域, 类蛋白组分含量显著升高(约占50%), 类腐殖质组分含量下降, DOM总荧光强度在S8、S9、S10点位出现高值, 这可能是由于七星湿地区域内水生动植物丰富, 并接收来自周围工业、农业、居民生活等人为活动所产生的污水, 使水体内微生物活动加剧, 故而色氨酸组分含量明显升高(隋志男等, 2015;Baker, 2002).下游区域, 类蛋白组分含量约占20%, 可能是由于色氨酸组分不稳定易分解, 且辽河下游流经盘锦市, 受周围城市污水及石油开采等工业企业废水排放的影响, 使下游水体表现出类蛋白质荧光峰.其中, S1、S8、S9、S10、S17点位处DOM总荧光强度高于400 R.U., 说明西辽河支流汇入口、七星湿地、谷家排水站采样点处DOM浓度较高, 辽河流域污染治理应注重支流汇入影响.
对3个荧光组分进行相关性分析(表 3), 结果显示, C1与C2显著相关(p < 0.01), C3与C1、C2互不相关, 说明辽河保护区水体内DOM中两个类腐殖质组分来源相同, 但与类蛋白组分来源不同.结合采样点位分布情况可以看出, 这与周边环境因素及人为扰动因素具有密切关系.
表 3(Table 3)
| 表 3 3个荧光组分荧光强度相关性 Table 3 Correlation of fluorescence intensity of three fluorescence components | ||||||||||||||||||||
表 3 3个荧光组分荧光强度相关性 Table 3 Correlation of fluorescence intensity of three fluorescence components
| ||||||||||||||||||||
根据平行因子分析的结果, 通过聚类分析得到各采样点DOM荧光组分聚类结果(图 4).整体来看, 辽河保护区各采样点之间的距离均在5之内, 说明荧光组分类别、来源等特征差别不大.因为在21个采样点中有19个采样点的DOM荧光光谱均含有以上3个组分, 其余2个采样点含有2个组分.表明辽河保护区水体中DOM荧光组分组成没有明显的区域差异性, 这种差异性只是小范围的.辽河保护区水体自上游至下游, 水质参数差异不显著, 水体环境相似.少量采样点(如七星湿地内)受环境因素及人为干扰因素使得水体内有机质成分不稳定.
图 4(Fig. 4)
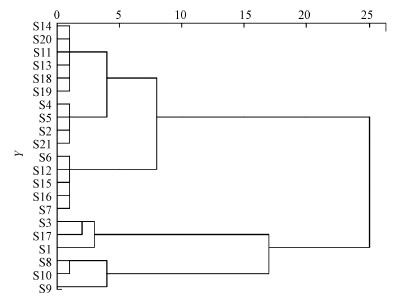 |
| 图 4 辽河保护区不同采样点DOM荧光数据的聚类分析 Fig. 4Cluster analysis of DOM fluorescence data at different sampling points in Liaohe reservation zone |
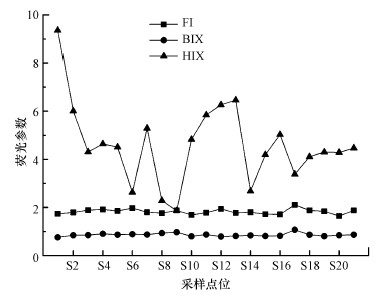
3.3 DOM来源解析荧光指数(FI)一般用来判断水体DOM中腐殖质组分的来源, 当FI值小于1.4时, DOM来源主要为外源水体、土壤等陆源输入;当FI值大于1.9时, 水体DOM来源主要为水生微生物活动引起的内源释放(Mcknight et al., 2001).自生源指数(BIX)是衡量水体DOM的自生来源贡献的重要指标, BIX值越高表示DOM以生物源为主, BIX值越低表示DOM以陆源输入为主.有研究指出, BIX>1时, 水体DOM主要由微生物活动产生;BIX < 0.8时, 水体DOM主要来源为陆源输入;BIX值在0.8~1时, 水体DOM来源受陆源与内源共同影响(Jaffé et al., 2004).腐殖化指数(HIX)一般用来反映DOM的腐殖化程度, 当HIX值大于6时, 水体DOM腐殖化程度较高, 主要以陆源为主;当HIX值在3~6时, 水体DOM腐殖化程度较高, 具有微弱的新近自生源特征;当HIX在1.5~3时, 水体DOM腐殖化程度较低, 具有重要的新近自生源特征;当HIX < 1.5时, 水体DOM以自生源为主(Zang et al., 2010).
图 5(Fig. 5)
 |
| 图 5 FI、BIX、HIX沿程变化图 Fig. 5Changes of FI, BIX and HIX along the course |
辽河保护区不同采样点DOM的3个荧光指数的沿程变化情况如图 4所示.由图可知, FI指数变化范围为1.6~2.1, 平均值为1.82, 表明保护区内水体DOM的来源受内源与外源共同影响.其中, S18采样点(谷家排水站)FI值最大(2.1), 可能是由于生活污水的排放使得此处DOM具有明显的自生源特征.BIX值范围为0.76~1.07, 平均值为0.86, 表明水体中DOM的来源介于陆源输入与外源释放之间.同时, BIX高值(1.07)仍出现在S18采样点处, 说明此处DOM主要来源于水体中生物或细菌释放, 这与FI指数的结论一致.HIX值范围为1.9~9.4, 各个采样点差异较大.辽河保护区水体内HIX值均大于1.5, 表明水体DOM组分腐殖化特征明显, DOM的来源受一定陆源输入的影响.其中, S1、S2、S12、S13、S14采样点HIX值大于6, 说明东辽河、西辽河、汎河、柳河支流汇入口处DOM主要受陆源影响, 腐殖化程度较高, 由于柳河的径流量较大, 所以S13柳河汇入后采样点处DOM的HIX值也较高.总体来看, 辽河保护区干流HIX值平均为4.1, 说明保护区内DOM腐殖化程度较高, 这主要与河流周围植被覆盖率较高、土壤有机质含量较高、通过径流等方式流入河流腐殖酸类DOM较多有关.
辽河保护区水体与珠江、长江水体相似, DOM具有外源与内源双重特性, 但辽河保护区水体蛋白质组分含量较低, 受人为因素影响较低(袁博等, 2019;蔡文良等, 2012).与太白山自然保护区(2.0 < FI < 2.1, BIX=0.6, HIX>4)(张文浩等, 2020)相比, 辽河保护区周围环境因素与太白山自然保护区相似, 河流主要流经林草地, 表现出腐殖化程度较高的特征.通常地, 受人类活动影响较少的水体, DOM的类腐殖质组分含量较高, FI值较低;周围林地草地居多的水体, 腐殖化程度(HIX指数)较高;而受人类影响较重的城市水体, DOM的类蛋白组分含量较高, BIX值则较低(陈毅忠等, 2017;Ghervase et al., 2010).辽河保护区沿岸分布着城市、农村、林草地、湿地等不同土地利用区域, 水体中DOM同时具有陆源特征和自生源特征且腐殖化程度较高.
综上所述, 辽河保护区水体DOM的来源受内源与外源共同作用, 上游水体周围土地利用类型是DOM来源的主要影响因素, 中、下游水体中人为扰动因素的影响水平有所升高, 这与DOM荧光组分特征分析结果一致.
3.4 DOM组分与环境因子的相关性分析从表 4可以看出, 辽河保护区水体污染主要受N、P输入的影响, 其中, 磷污染最为突出, 干流及支流上大多数采样点TP浓度超过Ⅳ类水标准;其次为氮污染, 支流汇入处TN浓度均值为1.66 mg·L-1, 高于Ⅳ类水标准.由于辽河保护区区域内土地利用类型主要为林草地及农业用地(冯娜娜等, 2020), 农业生产中大量使用的化肥农药通过地表径流和下渗至地下径流进入河流(Shrestha et al., 2006), 使水体TN、TP浓度升高.总体上看, 辽河保护区水体支流污染较干流污染严重.
表 4(Table 4)
| 表 4 辽河保护区水体理化指标 Table 4 Physical and chemical indexes of Liaohe reservation zone | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 4 辽河保护区水体理化指标 Table 4 Physical and chemical indexes of Liaohe reservation zone
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
辽河保护区DOM组分与水环境理化指标的相关性如表 5所示.由表可知, 类腐殖质组分C1及C2与DOC呈显著正相关关系(r=0.774、0.773), 说明作为DOM主要成分的类腐殖质组分是造成水体DOC浓度上升的主要原因(张文浩等, 2020).类蛋白质组分C3与TP呈正相关关系, 表明磷营养盐浓度随着色氨酸组分浓度的升高而增加, 这可能是由于微生物的降解活动会向水体中释放磷营养素所致.C3组分与TN呈负相关关系, 表明氮营养盐浓度随着色氨酸组分浓度的升高而降低, 这可能与氮营养素是蛋白质类有机物的重要组成分有关, 这与赵海超等(2019)的研究结果一致.
表 5(Table 5)
| 表 5 辽河保护区DOM组分与水环境理化指标相关性分析 Table 5 Correlation analysis between DOM components and physical and chemical indexes of water environment in Liaohe reservation zone | ||||||||||||||||||||||||||||||
表 5 辽河保护区DOM组分与水环境理化指标相关性分析 Table 5 Correlation analysis between DOM components and physical and chemical indexes of water environment in Liaohe reservation zone
| ||||||||||||||||||||||||||||||
4 结论(Conclusion)1) 辽河保护区表层水中DOM主要包括3种荧光组分, 由类腐殖质和类蛋白物质组成, 分别为陆源及海洋源类腐殖质、类富里酸和类色氨酸.
2) 辽河保护区DOM以类腐殖质物质为主要成分, 占总组分荧光强度的78%, 其中, 陆源及海洋源类腐殖质组分C1占有较大比例, 约为52.3%;以类蛋白质组分C3为次要组分, 占总组分荧光强度的22%.类腐殖质组分总荧光强度表现为上游>下游>中游, 类蛋白质组分的荧光强度则表现为中游>下游>上游, 受周边环境及人为扰动影响严重.
3) 辽河保护区FI指数变化范围为1.6~2.1, 平均值为1.82;BIX值范围为0.76~1.07, 平均值为0.86;HIX值范围为1.9~9.4, 说明水体中DOM的来源受内源和外源共同作用.辽河保护区水体DOM的来源受内源与外源共同作用, 上游水体周围土地利用类型是DOM来源的主要影响因素, 中、下游水体中人为扰动因素的影响水平有所升高.
4) 辽河流域水体污染主要受N、P输入的影响, 根据DOM荧光参数对水质指标进行相关性分析结果可知, C类腐殖质组分C1及C2与DOC呈显著正相关关系(r=0.774、0.773), 说明作为DOM主要成分的类腐殖质组分是造成水体DOC浓度上升的主要原因.类蛋白质组分C3与TP呈正相关关系, 表明磷营养盐浓度随着色氨酸组分浓度的升高而增加, 这可能是由于微生物的降解活动会向水体中释放磷营养素.C3组分与TN呈负相关关系, 表明氮营养盐浓度随着色氨酸组分浓度的升高而降低, 这可能与氮营养素是蛋白质类有机物的重要组成分有关.
5 展望(Prospect)溶解性有机质的三维荧光分析技术可快速表征DOM的组成、性质、来源及迁移转化, 可以用于水环境中污染物示踪, 表征有机污染程度, 实现水质的在线监测.通过对水环境溶解性有机质的测定与表征, 辨析水质指标对DOM荧光特性的影响, 可为水体质量的管理提供必要的技术支撑.下一步工作应对辽河保护区水体中的藻类、微生物等参数进行测定与分析, 深入研究引起DOM特征变化的原因, 为保护区的治理提供更为全面的理论依据.
参考文献
| Baker A. 2002. Fluorescence excitation-emission matrix characterization of river waters impacted by a tissue mill effluent[J]. Environmental Science and Technology, 36(7): 1377-1382. DOI:10.1021/es0101328 |
| Battin T J. 1998. Dissiolved organic matter and its optical properties in a blackwater tributary of the upper Orinoco River, Venezuela[J]. Organic Geochemistry, 28(9/10): 561-569. |
| Birdwell J E, Engel A S. 2010. Characterization of dissolved organic matter in cave and spring waters using UV-Vis absorbance and fluorescence spectroscopy[J]. Organic Geochemistry, 41(3): 270-280. DOI:10.1016/j.orggeochem.2009.11.002 |
| Burdige D J, Komada T. 2015. Sediment Pore Waters//Hansell D A, Carlson C A, eds. Biogeochemistry of Marine Dissolved Organic Matter[M]. London: Academic Press. 535-577 |
| 蔡文良, 许晓毅, 杜娴, 等. 2012. 嘉陵江重庆段DOM三维荧光光谱的平行因子分析[J]. 环境科学研究, 25(3): 276-281. |
| Carstea E M, Baker A, Savastru R. 2014. Comparison of river and canal water dissolved organic matter fluorescence within an urbanised catchment[J]. Water and Environment Journal, 28(1): 11-22. DOI:10.1111/wej.12062 |
| 陈毅忠, 杜尔登, 王聿琳, 等. 2017. 三维荧光组合PARAFAC分析评估城市水体DOM特征分布与来源[J]. 常州大学学报(自然科学版), 29(6): 55-62. DOI:10.3969/j.issn.2095-0411.2017.06.008 |
| 陈永娟, 胡玮璇, 庞树江, 等. 2016. 北运河水体中荧光溶解性有机物空间分布特征及来源分析[J]. 环境科学, 37(8): 3017-3025. |
| Coble P G. 1996. Characterization of marine and terrestrial DOM in seawater using excitation-emission matrix spectroscopy[J]. Marine Chemistry, 51(4): 325-346. DOI:10.1016/0304-4203(95)00062-3 |
| Coble P G, Del Castillo C E, Avril B. 1998. Distribution and optical properties of CDOM in the Arabian Sea during the 1995 Southwest Monsoon[J]. Deep Sea Research Part Ⅱ: Topical Studies in Oceanography, 45(10/11): 2195-2223. |
| 范诗雨, 秦纪洪, 刘堰杨, 等. 2018. 岷江上游水体中DOM光谱特征的季节变化[J]. 环境科学, 39(10): 4530-4538. |
| 冯娜娜, 董春来, 徐笠, 等. 2020. 辽河保护区土地利用方式对河流水质的影响[J]. 环境工程技术学报, 10(4): 579-584. |
| 高凤, 邵美玲, 唐剑锋, 等. 2019. 城镇流域水体-沉积物中溶解性有机质的荧光特性及影响因素: 以宁波市小浃江为例[J]. 环境科学, 40(9): 4009-4017. |
| Ghervase L, IojI C, Carstea E, et al. 2010. Spectroscopic and physico-chemical evaluation of lentic ecosystems from Bucharest City[J]. Environmental Problems and Development, 9: 272-277. |
| 韩宇超, 郭卫东. 2009. 九龙江河口有色溶解有机物的三维荧光光谱特征[J]. 环境科学学报, 29(3): 641-647. DOI:10.3321/j.issn:0253-2468.2009.03.027 |
| 郝子峰, 高宗军, 焦立新, 等. 2019. 白洋淀水体溶解性有机质荧光光谱特征研究[J]. 环境科学与技术, 42(8): 150-156. |
| He W, Hur J. 2015. Conservative behavior of fluorescence EEM-PARAFAC components in resin fractionation processes and its applicability for characterizing dissolved organic matter[J]. Water Research, 83: 217-226. DOI:10.1016/j.watres.2015.06.044 |
| 胡霞, 程艳, 贾尔恒·阿哈提, 等. 2018. 西北内陆城市河段水体CDOM三维荧光指纹特征研究[J]. 环境科学与技术, 41(S1): 226-231. |
| Jaffé R, Boyer J N, Lu X, et al. 2004. Source characterization of dissolved organic matter in a subtropical mangrove-dominated estuary by fluorescence analysis[J]. Marine Chemistry, 84(3/4): 195-210. |
| 李帅东, 张明礼, 杨浩, 等. 2017. 昆明松华坝库区表层土壤溶解性有机质(DOM)的光谱特性[J]. 光谱学与光谱分析, 37(4): 1183-1188. |
| 刘堰杨, 秦纪洪, 刘琛, 等. 2018. 基于三维荧光及平行因子分析的川西高原河流水体CDOM特征[J]. 环境科学, 39(2): 720-728. |
| Mcknight D M, Boyer E W, Westerhoff P K, et al. 2001. Spectrofluorometric characterization of dissolved organic matter for indication of precursor organic material and aromaticity[J]. Limnology and Oceanography, 46(1): 38-48. DOI:10.4319/lo.2001.46.1.0038 |
| 孟永霞, 程艳, 李琳, 等. 2020. 新疆匹里青河小流域DOM荧光特征及与汞的相互作用[J]. 生态与农村环境学报, 36(6): 770-777. |
| Nebbioso A, Piccolo A. 2003. Molecular characterization of dissolved organic matter (DOM): a critical review[J]. Analytical Bioanalytical Chemistry, 405(1): 109-124. |
| Pernet-Coudrier B, Clouzot L, Varrault G, et al. 2008. Dissolved organic matter from treated effluent of a major wastewater treatment plant: characterization and influence on copper toxicity[J]. Chemosphere, 73(4): 593-599. DOI:10.1016/j.chemosphere.2008.05.064 |
| 邵田田, 宋开山, 丁智, 等. 2015. 辽河东西支流与干流水体光学特性和组分对比研究[J]. 中国环境科学, 35(9): 2794-2804. DOI:10.3969/j.issn.1000-6923.2015.09.035 |
| Shrestha S, Kazama F. 2006. Assessment of surface water quality using multivariate statistical techniques: a case study of the Fuji River Basin, Japan[J]. Environmental Modelling and Software, 22(4): 464-475. |
| 隋志男, 郅二铨, 姚杰, 等. 2015. 三维荧光光谱区域积分法解析辽河七星湿地水体DOM组成及来源[J]. 环境工程技术学报, 5(2): 114-120. |
| Tang J M, Liang S X, Sun H W, et al. 2014. Analysis of dissolved organic matters in Fu River of Baoding using three-dimensional fluorescence excitation-emission matrix[J]. Spectroscopy and Spectral Analysis, 34(2): 450. |
| Van Heusden M C, Thompson F, Dennis J, et al. 1998. Distribution and optical properties of CDOM in the Arabian Sea during the 1995 Southwest Monsoon[J]. Deep Sea Research Part Ⅱ Topical Studies in Oceanography, 45(10/11): 2195-2223. |
| Yao X, Zhang Y L, Zhu G W, et al. 2011. Resolving the variability of CDOM fluorescence to differentiate the sources and fate of DOM in Lake Taihu and its tributaries[J]. Chemosphere, 82(2): 145-155. |
| 袁博, 吴巍, 郭梦京, 等. 2019. 灞河流域DOM荧光光谱特征及其对细菌组成的影响[J]. 中国环境科学, 39(8): 3383-3395. |
| Zang Y L, Zang E L, Yin Y, et al. 2010. Characteristics and sources of chromophoric dissolved organic matter in lakes of the Yungui Plateau, China, differing in trophic state and altitude[J]. Limnology and Oceanography, 55(6): 2645-2659. |
| 张文浩, 赵铎霖, 王晓毓, 等. 2020. 太白山自然保护区水体CDOM吸收与三维荧光特征[J]. 环境科学, 41(11): 4958-4969. |
| 赵海超, 李艳平, 王圣瑞, 等. 2019. 洱海上覆水DOM荧光特征及对富营养化的指示意义[J]. 光谱学与光谱分析, 39(12): 3888-3896. |
| 赵芸, 林进, 陈浩, 等. 2013. 辽河水体中溶解有机质的光谱初步研究[J]. 环境科学与技术, 36(4): 103-108. |
