 , 夏星辉
, 夏星辉
 , 张真瑞, 席楠楠
, 张真瑞, 席楠楠北京师范大学环境学院, 水环境模拟国家重点实验室, 北京 100875
收稿日期: 2020-04-24; 修回日期: 2020-06-11; 录用日期: 2020-06-11
基金项目: 国家重点研发计划(No.2017YFA0605001);国家创新研究群体科学基金(No.51721093)
作者简介: 陈建(1994-), 男, E-mail:chenj@mail.bnu.edu.cn
通讯作者(责任作者): 夏星辉, E-mail:xiaxh@bnu.edu.cn
摘要:目前有关增温和重金属复合作用对植物富集疏水性有机物的影响研究还鲜有报道.本文通过构建土壤-大气-植物密闭微宇宙,分析土壤、大气和植物中多环芳烃(Polycyclic aromatic hydrocarbons,PAHs)的浓度及土壤中PAHs降解菌基因的拷贝数,进而探究增温(+6℃)和锌胁迫(100~600 mg·kg-1)及两者复合作用对菠菜富集4种氘代PAHs及其致癌风险的影响.结果表明,增温使菠菜根部中PAHs的浓度降低了1.5%~20.4%,这是由于增温促进了土壤中PAHs的生物降解,进而导致PAHs自由溶解态浓度降低;另外,增温也降低了根部脂肪的含量,从而降低PAHs在根部的富集作用.然而,菠菜根部中PAHs的浓度随土壤中锌浓度的增加而增加,且增加比例为1.2%~91.7%,这主要是因为锌抑制了土壤中PAHs的降解,进而增加了PAHs的自由溶解态浓度;另外,锌胁迫还增加了菠菜根部细胞膜的通透性,进而促进根部吸收PAHs.增温和锌胁迫条件下,菠菜茎叶中PAHs的浓度分别降低了7.3%~51.1%和增加了3.0%~76.9%,与对根部富集PAHs的影响一致,这归因于茎叶中的PAHs主要来源于根部的向顶运输而非大气的茎叶吸收.增温和锌复合作用对菠菜富集PAHs具有拮抗作用,这是因为两者对土壤中PAHs的生物降解具有相反的影响.在无外源PAHs输入下,增温和锌胁迫分别会降低和增加PAHs的总致癌风险.
关键词:增温锌复合污染多环芳烃植物富集风险评价
The effects of elevated temperature and zinc combination on the accumulation of polycyclic aromatic hydrocarbons in spinach
CHEN Jian
 , XIA Xinghui
, XIA Xinghui
 , ZHANG Zhenrui, XI Nannan
, ZHANG Zhenrui, XI NannanState Key Laboratory of Water Environment Simulation, School of Environment, Beijing Normal University, Beijing 100875
Received 24 April 2020; received in revised from 11 June 2020; accepted 11 June 2020
Abstract: To date, few information is available on effects of elevated temperature and heavy metals on accumulation of hydrophobic organic compounds in plants. In this study, effects of elevated temperature (+6 ℃), zinc (100~600 mg·kg-1) and their combination on the accumulation of four deuterated polycyclic aromatic hydrocarbons (PAHs) in spinach (Spinacia oleracea L.) and PAH-associated cancer risk were explored by measuring the PAH concentrations in soil, air and plant, and copy numbers of PAH-degrading gene in soil in an enclosed soil-air-plant microcosm. Results showed that PAH concentration in root decreased by 1.5%~20.4% under the elevated temperature. This was because elevated temperature promoted biodegradation of PAHs in soil and consequently decreased the concentration of freely dissolved PAHs. Additionally, elevated temperature decreased lipid concentration in roots, contributing to the root uptake of PAHs. In comparison, zinc addition increased the PAH concentrations in roots by 1.2%~91.7%, which is attributed to increases in concentration of freely dissolved PAHs and root electrolyte leakages. Additionally, PAH concentration in shoot was lower by 7.3%~51.1% under high temperature, while higher by 3.0%~76.9% under increased zinc concentrations. These results are in consistence with variations of PAH concentration in root under elevated temperature and zinc. This is because PAH accumulated in shoot originated mainly from acropetal translocation in root rather than foliage uptake from air. Elevated temperature and zinc combination had an antagonistic effect on the uptake of PAHs by spinach, attributing to their opposite influence on PAH biodegradation in soil. As a result, elevated temperature decreased total cancer risk of PAHs, whereas zinc increased the risk in the systems without PAH inputs.
Keywords: elevated temperaturezincco-contaminationpolycyclic aromatic hydrocarbonsplant accumulationrisk assessment
1 引言(Introduction)疏水性有机物(Hydrophobic organic compounds, HOCs)是目前环境中一类主要的污染物, 广泛存在于各种环境介质中(González et al., 2019).由于具有较大的辛醇/水分配系数(Octanol/water partition coefficient, Kow)和亲脂性及毒性效应, HOCs易蓄积在可食用植物(如蔬菜和作物)体内并通过食物链传递危害人体健康(武彤等, 2020).因此, 植物对HOCs的富集作用及其影响因素也成为国内外环境科学领域的研究热点.
在自然环境中, 土壤HOCs-重金属复合污染普遍存在(Thavamani et al., 2012), 如工业电子垃圾回收站(Zhang et al., 2011)和用废水灌溉的农业地(Huang et al., 2016), 甚至自然沉积物中都存在二者的复合污染(Viana et al., 2012).近年来, 陆续有****开展了重金属对植物富集HOCs影响的相关研究, 并发现重金属会显著影响HOCs在植物体内的富集过程(Wang et al., 2017b; Lu et al., 2013; Deng et al., 2018).一方面, 重金属会诱导破坏植物根部细胞膜, 导致根部细胞膜通透性增加, 进而促进HOCs在根部的富集及向顶运输(Wang et al., 2016).另一方面, 重金属会造成细胞膜的脂质过氧化, 导致植物脂肪含量降低, 进而降低HOCs在植物体内的富集量(Lu et al., 2013; Pan et al., 2018).此外, 一些重金属和芳环HOCs之间会形成阳离子-π作用(Tao et al., 2015), 导致土壤中HOCs生物有效性降低, 进而抑制植物富集HOCs.因此, 重金属可通过多种作用机制影响植物对HOCs的富集作用.
另外, 温度会进一步影响植物的生理特性(如细胞膜的通透性和脂肪含量)及重金属和芳环HOCs之间的阳离子-π作用(Wang et al., 2016; Chen et al., 2020), 进而影响HOCs在植物体内的富集作用.目前全球气候变暖已成为不争的事实, 据政府间气候变化专门委员会第五次评估报告预测, 21世纪末全球平均气温将增加1.5~4.8 ℃(IPCC, 2013).综上, 可以推测气候变暖会进一步改变重金属对植物富集HOCs的影响模式.然而, 目前有关气候变暖背景下重金属对植物富集和转运HOCs以及HOCs的人体健康风险影响的研究还鲜有报道.另外, 有研究表明增温会促进土壤中HOCs的生物降解作用(Chen et al., 2019), 导致土壤中HOCs浓度降低.而重金属又可能对土壤微生物具有毒性效应, 从而抑制HOCs的生物降解(Song et al., 2017), 导致土壤中HOCs浓度的增加.因此, 可以推测增温和重金属对植物富集HOCs具有交互影响作用.
为验证上述科学推测, 本文尝试探究增温、锌胁迫和两者复合作用对菠菜(Spinacia oleracea L)富集多环芳烃(Polycyclic aromatic hydrocarbons, PAHs)及PAHs致癌风险的影响.选取PAHs和锌(Zn)分别为HOCs和重金属的代表, 这是因为PAHs和锌常以高污染水平共存于土壤环境中(Tang et al., 2010; González et al., 2019).另外, 本文采用氘代PAHs以避免环境背景PAHs的干扰.PAHs可通过根部吸收(Soil-root pathway)和茎叶吸收(Soil-air-shoot pathway)途径进入植物组织中.然而, 常规的土壤-植物盆栽实验体系(Sun et al., 2019; Zhao et al., 2020)难以探究有机物是如何通过茎叶吸收途径进入植物组织中.为此, 本文拟构建土壤-大气-植物密闭微宇宙, 通过分析PAHs在土壤、大气和植物三相中的浓度及PAHs在各相间的分配作用, 探究PAHs是如何通过根部吸收和茎叶吸收途径进入菠菜组织, 以及增温和锌胁迫对菠菜富集PAHs及其致癌健康风险的影响机理.本研究有助于理解在气候变暖和重金属共存条件下植物对HOCs的富集过程, 以及为评估HOCs的人体健康风险提供科学依据.
2 材料与方法(Materials and methods)2.1 试验材料4种氘代PAHs(菲、蒽、荧蒽、芘, 纯度>98%)、正己烷和二氯甲烷(色谱级)均购于北京百灵威科技有限公司;ZnSO4·7H2O(分析纯)购于国药集团公司;聚氨酯泡沫(Tisch Environmental TE-1012, Cleves, OH, USA)购于北京赛福莱博科技公司;聚二甲基硅氧烷的固相微萃取(SPME)纤维购于Polymicro技术公司;菠菜种子购于中国农业科学院.
2.2 污染土壤制备褐土土壤样品采自河北省保定市(39°25′54″N, 115°41′56″E)的农用地表层土壤(0~20 cm), 经风干、磨碎和过筛后备用.土壤pH为8.17, 有机质含量为1.61%.向土壤加载一系列浓度梯度(0、100、200、400和600 mg·kg-1)的ZnSO4·7H2O水溶液, 并搅拌均匀.每个浓度组设置3个重复.在室温条件下, 密封避光老化3周, 期间适量加水以维持最大田间持水率的50%.然后, 将4种PAHs以丙酮溶液的形式加入土壤, 待丙酮完全挥发后, 不断加入未被污染的土壤并充分搅拌均匀.在上述条件下, 再次老化4周.老化结束后, 立即测定土壤中氘代菲、蒽、荧蒽和芘的浓度.
2.3 土培实验和采样本文通过构建土壤-大气-植物密闭微宇宙以探究PAHs是如何通过根部吸收和茎叶吸收进入菠菜组织及增温和锌的影响.微宇宙的主体由有机玻璃圆筒组成(图 1), 分为茎叶室(高×直径=15 cm×25 cm)和根部室(高×直径=15 cm×15 cm).在圆筒内添加适量的NaHCO3和NaOH溶液, 以缓冲筒内CO2的浓度.圆筒内置集成传感器, 以实时监测圆筒内的气温和CO2浓度.
图 1(Fig. 1)
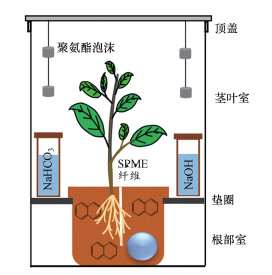 |
| 图 1 土壤-大气-植物密闭微宇宙示意图(Chen et al., 2019) Fig. 1Scheme of enclosed soil-air-plant microcosms |
实验处理组如下:PAHs(对照组)、PAHs+Zn、PAHs+增温(+6 ℃)、PAHs+Zn+增温.每个处理组设置3个重复.土壤中ZnSO4的浓度分别设置为100、200、400、600 mg·kg-1, 分别表示为Zn100、Zn200、Zn400、Zn600.根据研究区域的气候条件和增温潜势, 本文白天/夜间基温设置为15/10 ℃(黄淮海流域菠菜收割时期的温度), 增温幅度为+6 ℃ (21世纪末黄淮海流域平均气温将增加~6 ℃(Sun et al., 2015)), 即21/16 ℃.菠菜种子杀菌和催芽后(具体参照本课题组先前研究的方法(Chen et al., 2019)), 播种于新鲜土壤中培养2周, 待用.用锡纸包裹育苗盆后, 加入2 kg上述污染土壤, 然后在每盆中移栽4株长势一致的菠菜.将固相微萃取纤维插入根际土中以萃取土壤孔隙水中自由溶解态的PAHs (Ter-Laak et al., 2006).为了采集气相中的PAHs, 将聚氨酯泡沫悬挂在育苗盆的上方作为大气被动采样装置(Francisco et al., 2017)(图 1).所有圆筒分别放入两个人工气候箱中, 白天/夜间温度设置为15/10 ℃或21/16 ℃, 每天光照/黑暗时间为16 h/8 h, 光照强度为12000 lx, 湿度为75%.
在45 d土培实验期间, 每隔3 d调整圆筒在人工气候箱中的位置.暴露实验结束后, 收集聚氨酯泡沫, 置于-20 ℃冰箱保存, 待测.从土壤中取出固相微萃取纤维后, 浸泡在1 mmol·L-1 EDTA溶液中5 min (Lu et al., 2017), 以去除吸附在其表面上的锌, 最后浸泡在甲醇中, 萃取2 d(具体可参考本课题组先前的研究(Chen et al., 2019)).植物样品用超纯水冲洗后浸泡在1 mmol·L-1 EDTA溶液中5 min (Lu et al., 2017), 然后再次冲洗干净, 并分成茎叶和根部.一部分新鲜植物样品用于测定脂肪含量和电解质渗透率, 另一部分置于-20 ℃冰箱保存.取适量顶层土壤(~5 cm)和根际土壤(离根系~3 cm (Su et al., 2008))样品置于-20 ℃冰箱保存.
2.4 样品中PAHs的测定样品前处理方法参照本课题组先前的研究(Chen et al., 2019).具体为:72 h冷冻干燥后, 土样经磨碎, 植物样品和聚氨酯泡沫样品经剪碎后, 取适量于玻璃管中;加入体积比为1 : 1的正己烷和二氯甲烷混合液(萃取剂)及二氟联苯(回收率指示剂), 超声萃取30 min, 重复3次;将萃取液氮吹至1 mL, 然后过2 g硅胶柱, 并用正己烷和二氯甲烷混合液(V : V=1 : 1)洗脱;将洗脱液氮吹至 < 1 mL, 加入间三联苯(内标), 并用正己烷定容至1 mL.利用气相色谱-质谱联用仪(Shimadzu, TQ8040, Japan)进行PAHs的定性和定量分析, 具体上机条件可参照本课题组先前的研究(Zhai et al., 2018).
2.5 植物生理特性和土壤中nidA基因拷贝数的测定菠菜脂肪含量的测定参照先前研究的方法(Yang et al., 2017).具体为:菠菜在105 ℃条件下烘干24 h后, 剪碎放入玻璃管中;然后加入正己烷和乙醇混合液(V : V=1 : 1), 超声萃取2 h;将萃取液过0.22 μm滤膜后, 倒入新的玻璃管中;通过缓慢氮吹, 将滤膜和新玻璃管中的有机溶剂吹干;残留在滤膜和新玻璃管中的物质分别为碳水化合物和脂肪.参照Fu等(2018)的研究方法测定根部的电解质渗透率.具体为:取0.1 g根尖鲜样, 加入10 mL去离子水, 经32 ℃水浴2 h后用电导率测定仪(Mettler, SG23, Switzerland)测定溶液的电导率(EC1);之后将样品于121 ℃高温灭菌20 min, 取出待冷却至室温后再次测定溶液的电导率(EC2).根部电解质渗透率=(EC1/EC2)×100%.
利用土壤基因组DNA快速抽提试剂盒(B518233)提取土壤总基因组DNA.利用荧光定量PCR仪(Roche, Rotkreuz, Switzerland)荧光定量PCR测定nidA基因(芘的功能降解基因(Peng et al., 2010))片段的拷贝数.正向和反向引物序列分别为5′-TTCCCGAGTACGAGGGATAC和5′-TCA CGTTGATGAACGACAAA (DeBruyn et al., 2007).
2.6 质量保证与数据处理每种PAHs的检出限和定量限分别按仪器分析的3倍和10倍信噪比(S/N)计算, 4种氘代PAHs在GC-MS/MS上的检测限为0.05~0.1 μg·L-1.采用内标法测定的4种PAHs标准曲线的相关系数均大于0.99.植物、土壤和聚氨酯泡沫样品中PAHs的方法回收率分别为72.6%~81.4%、78.4%~90.4%和71.8%~82.5%.在样品检测过程中, 每20个样品加入一个正己烷溶液(溶剂空白), 且正己烷溶液中未检测到PAHs.在整个土培实验期间, 两个气候箱的白天/夜间温度分别为(15/10±1)和(21/16±1) ℃.土壤-大气-植物密闭微宇宙的质量控制和质量保证可参阅课题组先前的研究(Chen et al., 2019).
所有数据用SPSS 20.0进行统计分析.分析方法采用独立样本t-检验或One-Way ANOVA进行显著性差异分析, 显著性水平设为p < 0.05.
2.7 PAHs的终生致癌风险评估在土壤-大气-植物体系中, 成人可通过蔬菜摄取(葛蔚等, 2017)、空气呼吸(张艺璇等, 2020)和土壤暴露(包括误食土壤、皮肤接触和呼吸(陈凤等, 2017))3种途径暴露于PAHs.因此, 本文采用终生癌症风险增量模型(Incremental lifetime cancer risk, ILCR) (Wang et al., 2017a)来评估成人通过蔬菜摄取(ILCRplant)、空气呼吸(ILCRair)、土壤暴露(ILCRsoil)3种方式暴露于PAHs产生的致癌风险.具体计算方法可参照课题组先前的研究(Chen et al., 2020).
3 结果和讨论(Results and discussion)3.1 增温和锌对菠菜生长的影响由图 2可知, 与对照组(PAHs处理组)相比, 增温(+6 ℃)显著增加了菠菜茎叶和根部的生物量, 这是因为增温会促进菠菜叶片的光合作用.然而锌的存在显著降低了根部和茎叶的生物量, 且降低程度随锌浓度(100~600 mg·kg-1)的增加而增加.已有研究也发现, 由于毒性效应, 铜、铬和镉等重金属会抑制小白菜和玉米等植物的生长(Wang et al., 2016; Deng et al., 2018).与对照组相比, 增温和锌复合作用降低了菠菜的生物量, 表明增温和锌胁迫对菠菜生长具有拮抗作用.由表 1可知, 增温和锌均轻微地降低了根部的脂肪含量, 这可归因于增温诱导的生长稀释作用和锌诱导的细胞膜脂质过氧化(Pan et al., 2018).另外, 增温和高浓度锌增加了根部的电解质渗透率, 表明增温和锌胁迫均能提高菠菜根部细胞膜的通透性.
图 2(Fig. 2)
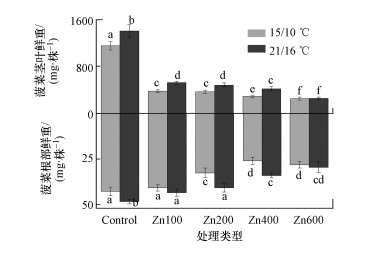 |
| 图 2 不同温度和锌浓度条件下菠菜茎叶和根部的生物量(鲜重) (不同小写字母表示存在显著性差异(p < 0.05)) Fig. 2Shoot and root biomass of spinach (fresh weight) treated with temperatures and Zn at varied levels (Values displaying different lowercase letters are significantly different (p < 0.05)) |
表 1(Table 1)
| 表 1 菠菜根部的脂肪含量和电解质渗透率 Table 1 The lipid content and electrolyte leakages of roots | |||||||||||||||||||||||||||||||||||||
表 1 菠菜根部的脂肪含量和电解质渗透率 Table 1 The lipid content and electrolyte leakages of roots
| |||||||||||||||||||||||||||||||||||||
3.2 增温和锌对菠菜根部富集多环芳烃的影响由图 3可知, 增温(+6 ℃)显著降低了4种PAHs在菠菜根部中的浓度(p < 0.05).与对照组相比, 增温条件下, 菠菜根部中菲、蒽、荧蒽和芘的浓度分别降低了6.7%、16.9%、5.6%和18.5%.然而, 与对照组相比, 根部中PAHs的浓度均随土壤中锌浓度(100~600 mg·kg-1)的增加而增加.这些结果表明增温和锌对根部富集PAHs具有拮抗作用.另外, 增温和锌复合作用表观上促进了根部中PAHs的浓度, 这表明锌对根部富集PAHs的促进作用大于增温的抑制作用.
图 3(Fig. 3)
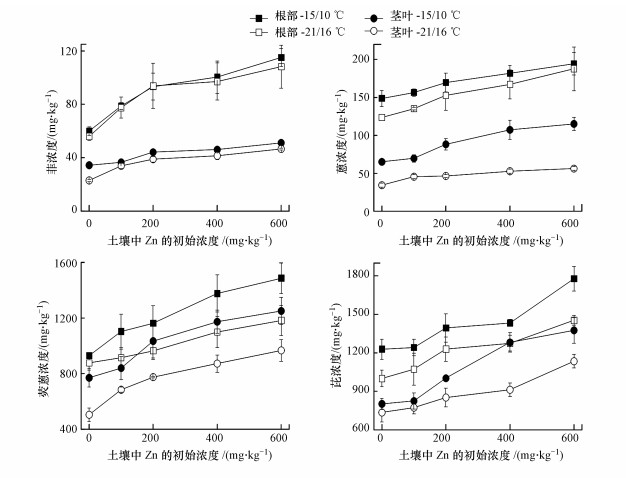 |
| 图 3 菠菜根部和茎叶中4种PAHs的浓度 Fig. 3The four PAHs concentrations in root and shoot of spinach |
土壤中PAHs的赋存形态主要包括吸附结合态和自由溶解态.目前普遍认为, 土壤固相吸附结合态的PAHs不能直接被生物吸收利用, 而土壤孔隙水中自由溶解态的PAHs可以直接被植物吸收和富集(Ni et al., 2017).如图 4所示, 根部中PAHs的浓度与PAHs自由溶解态浓度之间呈显著正相关(p < 0.01), 表明PAHs自由溶解态的浓度可以很好地反映其生物有效性, 而且PAHs的植物有效性是控制其在植物体内富集的关键因素.已有研究表明, 植物根部吸收HOCs可视为自由溶解态的HOCs在土壤孔隙水和根部有机组分(如脂肪)之间的分配过程(Fu et al., 2016; Zhu et al., 2016).在本研究中, 影响土壤孔隙水中PAHs自由溶解态浓度的因素可能主要包括:①PAHs在土壤固相与孔隙水之间的分配作用;②PAHs与重金属之间的阳离子-π作用.例如, 本课题组先前研究发现铜和PAHs之间会形成阳离子-π作用, 进而降低土壤中PAHs的自由溶解态浓度(Chen et al., 2020).因此, 本文利用密度泛函数理论(DFT)对PAHs-Zn络合物进行结构优化和能量计算(具体可参阅本课题组先前的研究(Chen et al., 2020)).如图 5所示, Zn2+和PAHs(以蒽和荧蒽为例)之间作用的结合能(ΔG)均大于0, 这说明Zn2+和PAHs之间不能形成阳离子-π作用.因此, 土壤孔隙水中PAHs的自由溶解态浓度主要与土壤固相PAHs的浓度有关.
图 4(Fig. 4)
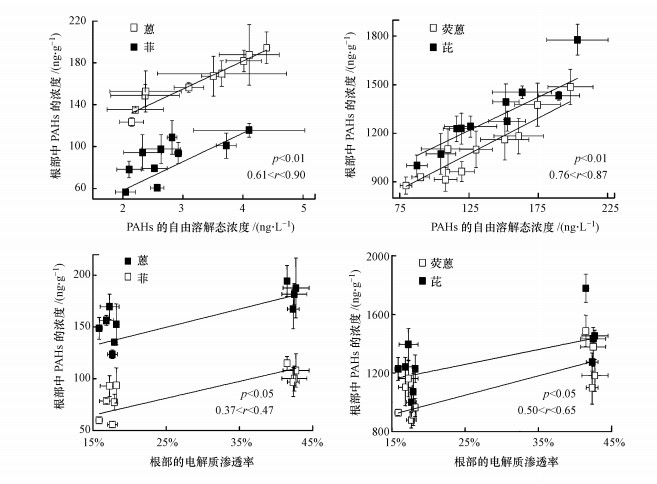 |
| 图 4 根部中PAHs的浓度与PAHs自由溶解态的浓度和根部电解质渗透率之间的相关性 Fig. 4The correlations between PAH concentrations in roots and the concentrations of freely dissolved PAHs or electrolyte leakages of roots |
图 5(Fig. 5)
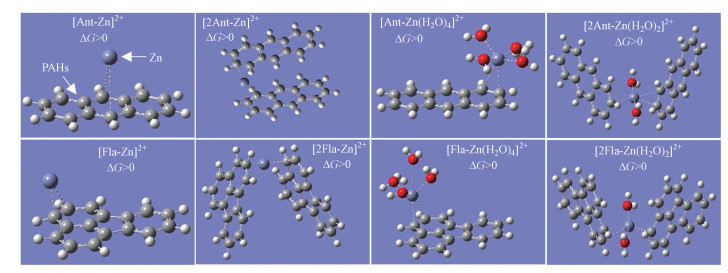 |
| 图 5 溶液中蒽和荧蒽与Zn2+之间的作用构象 Fig. 5Optimized geometry structure between anthracene or fluoranthene and Zn2+ in solution |
由图 6可知, 增温显著降低了土壤中PAHs的浓度.这是因为一方面增温促进了土壤中PAHs向大气中的挥发, 这可从气相中PAHs浓度的升高得到验证(图 6);另一方面, 增温显著增加了土壤中芘的功能降解基因nidA的拷贝数(图 7), 表明增温会增强PAHs降解菌的活性, 进而促进土壤中PAHs的生物降解.已有研究也发现增温会促进土壤中有机物的生物降解(Noyes et al., 2009; Chen et al., 2019).与增温的影响相反, 土壤中PAHs的浓度随锌浓度的增加而增加(图 6).这可归因于锌对PAHs功能降解菌具有毒性效应, 导致降解菌的活性降低(即nidA拷贝数的降低, 图 7), 从而抑制了土壤中PAHs的生物降解.近来, Chen等(2018)也发现Cd会抑制土壤中苯并芘的生物降解, 进而导致土壤中苯并芘的浓度随Cd浓度的增加而增加.另外, 在锌胁迫条件下, 根部中PAHs的浓度与根部电解质渗透率之间存在正相关关系(图 4, p < 0.05), 这表明锌会诱导破坏根部细胞膜, 导致根部细胞膜通透性的增加, 进而促进根部吸收PAHs.
图 6(Fig. 6)
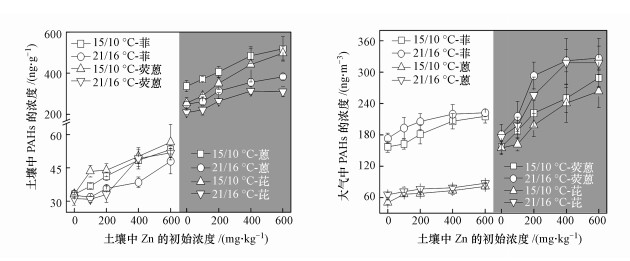 |
| 图 6 土壤和大气中PAHs的浓度 Fig. 6PAH concentrations in soil and air |
图 7(Fig. 7)
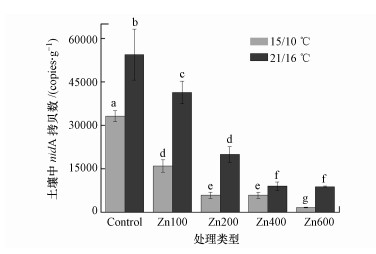 |
| 图 7 根际土壤中芘的功能降解基因nidA的拷贝数 Fig. 7The copy numbers of nidA gene (a functional gene for Pyr-degradating) in rhizosphere soil |
3.3 增温和锌对菠菜茎叶富集多环芳烃的影响如图 3所示, 菠菜茎叶中4种PAHs的浓度随温度的升高而降低, 而随土壤中锌浓度的增加而增加(p < 0.05).例如, 与对照组相比, Zn100、Zn200、Zn400和Zn600处理组茎叶中芘的浓度分别增加了2.9%~5.2%、15.8%~25.1%、23.9%~59.8%和54.3%~71.6%(图 3).综上, 增温和锌胁迫对茎叶富集PAHs具有拮抗作用, 且两者复合作用表观上促进了茎叶富集PAHs.
植物茎叶中PAHs一般来源于:①根部吸收(Soil-root pathway)后的向顶运输;②气相的茎叶吸收(Soil-air-shoot pathway).在本研究中, 增温和锌胁迫对茎叶和根部中PAHs浓度的影响一致(图 3), 说明菠菜茎叶中的PAHs主要来源于根部的向顶运输, 这是由于大气中PAHs浓度较低(图 6, 50.6~ 326.8 ng·m-3), 导致气相的茎叶吸收贡献相对较低.Tao等(2009)也发现小麦茎叶中10种PAHs主要来源于根部的向顶运输, 且向顶运输的贡献占51.7%~72.6%.然而也有研究报道小麦茎叶中的六溴环十二烷主要来源于通过气相的茎叶吸收, 而向顶运输的贡献仅占14.4%~29.8%(Zhu et al., 2016).本研究与Zhu等(2016)研究中六溴环十二烷不一致的结果主要是因为本研究中4种PAHs的亲脂性相对较弱(4.54 < logKow < 5.22), 根部中的PAHs可随蒸腾流向顶运输迁移到菠菜茎叶组织, 而六溴环十二烷的亲脂性较强(logKow>5.38)(Zhu et al., 2016), 其会吸附固定在根部脂肪中, 难以随蒸腾流向顶运输迁移到小麦茎叶组织.
3.4 PAHs的致癌风险评估由表 2可知, 对于本研究模拟的土壤-大气-植物系统, 通过土壤暴露、空气吸入和菠菜摄取暴露于PAHs的ILCR值分别为2.6×10-5~5.3×10-5、0.7×10-5~1.2×10-5和0.7×10-6~1.6×10-6, 即暴露途径的风险水平为土壤暴露>空气吸入>菠菜摄取, 这是因为在本研究中, 整个系统中的PAHs来源于土壤.
表 2(Table 2)
| 表 2 通过菠菜摄取、空气呼吸和土壤暴露途径产生的PAHs终生致癌风险 Table 2 The lifetime cancer risks of PAHs though ingestion exposure from spinach, inhalation exposure from air and ingestion, dermal contact and inhalation exposure from soil | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 2 通过菠菜摄取、空气呼吸和土壤暴露途径产生的PAHs终生致癌风险 Table 2 The lifetime cancer risks of PAHs though ingestion exposure from spinach, inhalation exposure from air and ingestion, dermal contact and inhalation exposure from soil
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
由表 2可知, 增温条件下, 土壤暴露和菠菜摄取暴露于PAHs的致癌风险分别降低了19.7%~27.3%和18.8%~34.2%, 而空气吸入PAHs产生的致癌风险增加了7.4%~23.8%.另外, 增温降低了PAHs的总致癌风险(ILCRtotal), 表明在无外源PAHs输入条件下, 气候变暖会有利于降低土壤-大气-植物体系中PAHs的污染水平.Dalla-Valle等(2007)基于多介质逸度模型预测, 在未来50年, 气候变暖会显著降低多氯联苯的环境水平, 从而降低多氯联苯对人体的健康风险(Nadal et al., 2015).然而, 锌会增加土壤暴露、空气吸入和菠菜摄取暴露于PAHs的致癌风险, 且增加比例随锌浓度的增加而增加.例如, 与对照组相比, Zn100、Zn200、Zn400和Zn600处理组的ILCRtotal值分别增加了5.0%~15.2%、18.4%~25.2%、43.5%~47.4%和52.0%~62.7%.这些结果表明增温和锌胁迫对PAHs的总致癌风险具有拮抗作用, 且当锌为低浓度(100 mg·kg-1)时, 增温和锌胁迫复合作用降低了PAHs的总致癌风险;而当锌为高浓度(200~600 mg·kg-1)时, 两者复合作用增加了PAHs的总致癌风险(表 2).
值得注意的是, 本文的实验体系是基于土壤-大气-植物密闭微宇宙, 土壤是PAHs的源, 且无大气外源PAHs的输入.然而在一些地区, 人为活动和工业排放产生的PAHs会大量释放至大气中, 导致气相中PAHs浓度显著升高, 此时土壤是PAHs的汇.在此条件下, 增温和重金属对植物富集PAHs及其致癌风险的影响可能与本研究存在不一致的结果.因此, 后续在探究不同增温幅度和重金属对植物富集PAHs及其健康风险的影响时, 还需考虑大气PAHs输入的影响.
4 结论(Conclusions)1) 增温(+6 ℃)降低了菠菜根部和茎叶中PAHs的浓度, 且降低比例分别为1.5%~20.4%和7.3%~51.1%.增温抑制根部富集PAHs可归因于:一方面增温促进了土壤中PAHs的生物降解和挥发, 进而降低了土壤中PAHs的浓度, 导致土壤中PAHs自由溶解态浓度降低;另一方面, 增温促进了菠菜的生长及诱导细胞膜的脂质过氧化, 导致根部脂肪含量降低.
2) 菠菜根部和茎叶中PAHs的浓度随土壤中锌浓度(100~600 mg·kg-1)的增加而增加, 且增加比例分别为1.2%~93.2%和7.3%~93.2%.这是因为一方面锌抑制了土壤中PAHs的生物降解, 进而增加了土壤中PAHs的浓度, 导致土壤中PAHs自由溶解态浓度增加;另一方面, 锌会破坏根部细胞膜, 导致根部细胞膜通透性增加, 进而有利于根部富集PAHs.
3) 增温和锌胁迫对茎叶和根部富集PAHs的影响一致, 这是因为菠菜茎叶中的PAHs主要来源于根部的向顶运输.增温和锌胁迫对菠菜富集PAHs具有拮抗作用.
4) 在无外源PAHs输入条件下, 增温和锌胁迫分别降低和增加了PAHs的致癌风险, 这也表明增温和锌胁迫之间存在拮抗作用.当土壤中存在低浓度锌(100 mg·kg-1)时, 增温和锌胁迫的复合作用降低了PAHs的总致癌风险;而当存在高浓度锌(200~600 mg·kg-1)时, 两者复合作用增加了PAHs的总致癌风险.
参考文献
| Chen F, Luo Z, Ma J, et al. 2018. Interaction of cadmium and polycyclic aromatic hydrocarbons in co-contaminated soil[J]. Water, Air, & Soil Pollution, 229(4): 114-124. |
| 陈凤, 王程程, 张丽娟, 等. 2017. 铅锌冶炼区农田土壤中多环芳烃污染特征、源解析和风险评价[J]. 环境科学学报, 37(4): 1515-1523. |
| Chen J, Xia X H, Wang H T, et al. 2019. Uptake pathway and accumulation of polycyclic aromatic hydrocarbons in spinach affected by warming in enclosed soil/water-air-plant microcosms[J]. Journal of Hazardous Materials, 379: 120831. DOI:10.1016/j.jhazmat.2019.120831 |
| Chen J, Xia X H, Zhang Z R, et al. 2020. The combination of warming and copper decreased the uptake of polycyclic aromatic hydrocarbons by spinach and their associated cancer risk[J]. Science of the Total Environment, 727: 138732. DOI:10.1016/j.scitotenv.2020.138732 |
| Dalla-Valle M, Codato E, Marcomini A. 2007. Climate change influence on POPs distribution and fate:A case study[J]. Chemosphere, 67(7): 1287-1295. DOI:10.1016/j.chemosphere.2006.12.028 |
| DeBruyn J M, Chewning C S, Sayler G S. 2007. Comparative quantitative prevalence of mycobacteria and functionally abundant nidA, nahAc, and nagAc dioxygenase genes in coal Tar contaminated sediments[J]. Environmental Science & Technology, 41(15): 5426-543. |
| Deng S, Ke T, Wu Y, et al. 2018. Heavy metal exposure alters the uptake behavior of 16 priority polycyclic aromatic hydrocarbons (PAHs) by pak choi (Brassica chinensis L.)[J]. Environmental Science & Technology, 52(22): 13457-13468. |
| Francisco A P, Harner T, Eng A. 2017. Measurement of polyurethane foam-air partition coefficients for semivolatile organic compounds as a function of temperature:Application to passive air sampler monitoring[J]. Chemosphere, 174: 638-642. DOI:10.1016/j.chemosphere.2017.01.135 |
| Fu H, Yu H, Li T, et al. 2018. Influence of cadmium stress on root exudates of high cadmium accumulating rice line (Oryza sativa L.)[J]. Ecotoxicology and Environmental Safety, 150: 168-175. DOI:10.1016/j.ecoenv.2017.12.014 |
| Fu Q, Wu X, Ye Q, et al. 2016. Biosolids inhibit bioavailability and plant uptake of triclosan and triclocarban[J]. Water Research, 102: 117-124. DOI:10.1016/j.watres.2016.06.026 |
| 葛蔚, 程琪琪, 柴超, 等. 2017. 青岛市城郊蔬菜中多环芳烃污染特征和健康风险评估[J]. 环境科学学报, 37(12): 4772-4778. |
| González G B, Martínez V A, Vila C M, et al. 2019. Biodegradation as an important sink of aromatic hydrocarbons in the oceans[J]. Nature Geoscience, 12(2): 119-125. DOI:10.1038/s41561-018-0285-3 |
| Huang Y, Fulton A N, Keller A A. 2016. Simultaneous removal of PAHs and metal contaminants from water using magnetic nanoparticle adsorbents[J]. Science of the Total Environment, 571: 1029-1036. DOI:10.1016/j.scitotenv.2016.07.093 |
| IPCC.2013.Climate Change 2013: the Physical Science Basis.Contribution of Working Group I to the Fifth Assessment Report of the Intergovernmental Panel on Climate Change[M].Cambridge, United Kingdom and New York, NY, USA: Cambridge University Press |
| Lu L, Xie R, Liu T, et al. 2017. Spatial imaging and speciation of Cu in rice (Oryza sativa L.) roots using synchrotron-based X-ray microfluorescence and X-ray absorption spectroscopy[J]. Chemosphere, 175: 356-364. DOI:10.1016/j.chemosphere.2017.02.082 |
| Lu M, Zhang Z Z, Su X L, et al. 2013. Effect of copper on in vivo fate of BDE-209 in pumpkin[J]. Journal of Hazardous Materials, 262: 311-317. DOI:10.1016/j.jhazmat.2013.08.067 |
| Nadal M, Marquès M, Mari M, et al. 2015. Climate change and environmental concentrations of POPs:A review[J]. Environmental Research, 143: 177-185. DOI:10.1016/j.envres.2015.10.012 |
| Ni N, Song Y, Shi R Y, et al. 2017. Biochar reduces the bioaccumulation of PAHs from soil to carrot (Daucus carota L.) in the rhizosphere:A mechanism study[J]. Science of the Total Environment, 601-602: 1015-1023. DOI:10.1016/j.scitotenv.2017.05.256 |
| Noyes P D, McElwee M K, Miller H D, et al. 2009. The toxicology of climate change:Environmental contaminants in a warming world[J]. Environment International, 35(6): 971-986. DOI:10.1016/j.envint.2009.02.006 |
| Pan L, Sun J, Le X C, et al. 2018. Effect of copper on the translocation and transformation of polychlorinated biphenyls in rice[J]. Chemosphere, 193: 514-520. DOI:10.1016/j.chemosphere.2017.11.054 |
| Peng J J, Cai C, Qiao M, et al. 2010. Dynamic changes in functional gene copy numbers and microbial communities during degradation of pyrene in soils[J]. Environmental Pollution, 158(9): 2872-2879. DOI:10.1016/j.envpol.2010.06.020 |
| Song M, Yang Y, Jiang L, et al. 2017. Characterisation of the phenanthrene degradation-related genes and degrading ability of a newly isolated copper-tolerant bacterium[J]. Environmental Pollution, 220: 1059-1067. DOI:10.1016/j.envpol.2016.11.037 |
| Su Y H, Zhu Y G. 2008. Uptake of selected PAHs from contaminated soils by rice seedlings (Oryza sativa) and influence of rhizosphere on PAH distribution[J]. Environmental Pollution, 155(2): 359-365. DOI:10.1016/j.envpol.2007.11.008 |
| Sun J, Wu Y, Jiang P, et al. 2019. Concentration, uptake and human dietary intake of novel brominated flame retardants in greenhouse and conventional vegetables[J]. Environment International, 123: 436-443. DOI:10.1016/j.envint.2018.12.008 |
| Sun Q, Miao C, Duan Q. 2015. Projected changes in temperature and precipitation in ten river basins over China in 21st century[J]. International Journal of Climatology, 35(6): 1125-1141. DOI:10.1002/joc.4043 |
| Tang X, Shen C, Shi D, et al. 2010. Heavy metal and persistent organic compound contamination in soil from Wenling:An emerging e-waste recycling city in Taizhou area, China[J]. Journal of Hazardous Materials, 173(1): 653-660. |
| Tao Y, Xue B, Yang Z, et al. 2015. Effects of metals on the uptake of polycyclic aromatic hydrocarbons by the cyanobacterium Microcystis aeruginosa[J]. Chemosphere, 119: 719-726. DOI:10.1016/j.chemosphere.2014.08.013 |
| Tao Y, Zhang S, Zhu Y, et al. 2009. Uptake and acropetal translocation of polycyclic aromatic hydrocarbons by wheat (Triticum aestivum L.) grown in field-contaminated soil[J]. Environmental Science & Technology, 43(10): 3556-3560. |
| Ter-Laak T L, Agbo S O, Barendregt A, et al. 2006. Freely dissolved concentrations of PAHs in soil pore water:measurements via solid-phase extraction and consequences for soil tests[J]. Environmental Science & Technology, 40(4): 1307-1313. |
| Thavamani P, Megharaj M, Naidu R. 2012. Multivariate analysis of mixed contaminants (PAHs and heavy metals) at manufactured gas plant site soils[J]. Environmental Monitoring and Assessment, 184(6): 3875-3885. DOI:10.1007/s10661-011-2230-4 |
| Viana P Z, Yin K, Rockne K J. 2012. Field measurements and modeling of ebullition-facilitated flux of heavy metals and polycyclic aromatic hydrocarbons from sediments to the water column[J]. Environmental Science & Technology, 46(21): 12046-12054. |
| Wang J, Zhang X F, Ling W T, et al. 2017a. Contamination and health risk assessment of PAHs in soils and crops in industrial areas of the Yangtze River Delta region, China[J]. Chemosphere, 168: 976-987. DOI:10.1016/j.chemosphere.2016.10.113 |
| Wang S, Luo C, Zhang D, et al. 2017b. Reflection of stereoselectivity during the uptake and acropetal translocation of chiral PCBs in plants in the presence of copper[J]. Environmental Science & Technology, 51(23): 13834-13841. |
| Wang S, Wang Y, Luo C, et al. 2016. Could uptake and acropetal translocation of PBDEs by corn be enhanced following Cu exposure? Evidence from a root damage experiment[J]. Environmental Science & Technology, 50(2): 856-863. |
| 武彤, 尹姗姗, 刘子鑫, 等. 2020. 六溴环十二烷(HBCDs)异构体和对映体在白洋淀土壤和植物中的选择性富集与传输[J]. 环境科学学报, 40(3): 1051-1062. |
| Yang C Y, Chang M L, Wu S C, et al. 2017. Partition uptake of a brominated diphenyl ether by the edible plant root of white radish (Raphanus sativus L.)[J]. Environmental Pollution, 223: 178-184. DOI:10.1016/j.envpol.2017.01.009 |
| Zhai Y W, Xia X H, Xiong X, et al. 2018. Role of fluoranthene and pyrene associated with suspended particles in their bioaccumulation by zebrafish (Danio rerio)[J]. Ecotoxicology and Environmental Safety, 157: 89-94. DOI:10.1016/j.ecoenv.2018.03.065 |
| Zhang D, An T, Qiao M, et al. 2011. Source identification and health risk of polycyclic aromatic hydrocarbons associated with electronic dismantling in Guiyu town, South China[J]. Journal of Hazardous Materials, 192(1): 1-7. |
| 张艺璇, 曹芳, 郑涵, 等. 2020. 2017年秋季长春市PM2.5中多环芳烃的污染来源及健康风险评价[J]. 环境科学, 41(2): 564-573. |
| Zhao P, Ye Q, Yu K, et al. 2020. Uptake and transformation of decabromodiphenyl ether in different rice cultivars:Evidence from a carbon-14 study[J]. Science of the Total Environment, 704: 135398. DOI:10.1016/j.scitotenv.2019.135398 |
| Zhu H, Sun H, Zhang Y, et al. 2016. Uptake pathway, translocation, and isomerization of hexabromocyclododecane diastereoisomers by wheat in closed chambers[J]. Environmental Science & Technology, 50(5): 2652-2659. |
