 , 杨海洋1, 梁恒1
, 杨海洋1, 梁恒1
 , 李圭白1
, 李圭白11. 哈尔滨工业大学环境学院, 哈尔滨 150001;
2. 中国市政工程华北设计研究总院有限公司, 天津 300070
收稿日期: 2020-08-25; 修回日期: 2020-09-14; 录用日期: 2020-09-14
基金项目: 国家重点研发计划资助(No.2018YFC0408000)
作者简介: 孙成超(1994-), 男, 硕士研究生, E-mail:scc170906@163.com
通讯作者(责任作者): 梁恒(1979—), 男, 教授, 博士生导师, 主要研究方向为:膜法水处理技术与原理, E-mail:hitliangheng@163.com
摘要:针对日益严重的地表水锰污染,本实验采用高锰酸钾与接触氧化的方法协同除锰;通过调配进水中Ca2+、Mg2+含量模拟我国不同地区硬度差异显著的地表水,探究水体硬度对锰的去除效果的影响.结果表明:Mn2+被高锰酸钾氧化并形成"锰质活性滤膜",可在停药后实现稳定有效除锰.成熟滤池的除锰效果会显著受到硬度的影响,进水硬度在40、200、400 mg·L-1及700 mg·L-1(CaCO3计)时,接触氧化滤池分别在48、56、64 d及72 d实现稳定除锰,而4根滤柱对Mn2+去除的极限浓度分别为1.8、1.7、1.2 mg·L-1及0.7 mg·L-1.
关键词:高锰酸钾接触氧化地表水除锰硬度
Potassium permanganate combined contact oxidation filter: Effect of hardness on start-up and manganese removal
SUN Chengchao1,2
 , YANG Haiyang1, LIANG Heng1
, YANG Haiyang1, LIANG Heng1
 , LI Guibai1
, LI Guibai11. School of Environment, Harbin Institute of Technology, Harbin 150001;
2. North China Municipal Engineering Design & Research Institute Co., Ltd., Tianjin 300070
Received 25 August 2020; received in revised from 14 September 2020; accepted 14 September 2020
Abstract: As manganese pollution gradually aggravated in surface water,a process in which potassium permanganate assisted/combined contact oxidation filter was developed. In addition,the effect of hardness on manganese removal was investigated by artificial controlling concentrations of calcium and magnesium in the water due to the phenomenon of hardness background varied highly in different regions. The results showed that potassium permanganate oxidized Mn2+ in the water to generate active manganese-based film which can still realize the stable manganese concentration of effluent once the addition of potassium permanganate stopped. The hardness had a significant effect on manganese removal of the contact oxidation filter. When adjusting the concentration of hardness to 40,200,400 mg·L-1 and 700 mg·L-1 (as CaCO3) in the influent,the maturity period of contact oxidation filter occurred after 48,56,64 days and 72 days,respectively. In the maturity period,the highest removal capability of Mn2+ was 1.8,1.7,1.2 mg·L-1 and 0.7 mg·L-1.
Keywords: potassium permanganatecontact oxidationmanganese removal from surface waterhardness
1 引言(Introduction)近年来地表水源水污染逐渐加剧, 其中内源污染和外源污染更能引发地表水中锰(Mn2+)含量不断增长, 甚至远超于生活饮用水标准数十倍(孙中兴, 2010;刘树元等, 2014;孙滨, 2013).传统的砂滤体系是目前水厂中最为常规的除锰工艺, 然而却无法时刻保障有效除锰, 出水锰含量超标现象经常发生(Aschner, 2017).高效稳定的除锰是目前饮用水除锰所面临的一项重要挑战, 同时引起了众多研究者的关注.投加高锰酸钾(KMnO4)及其复合盐, 通过其氧化作用实现地表水中锰的去除, 仍是目前应用最广的方法.许多研究发现, 以地下水为原水的实验表明, 投加KMnO4可快速氧化原水中的Mn2+, 并发现对Mn2+具有持续催化氧化能力的“锰质活性滤膜”逐渐在滤料表面生成(Guo et al., 2017;李圭白等, 2019).更重要的是, 地表水给水处理厂中也发现了这种高催化氧化“锰质活性滤膜”的存在.可见以高锰酸钾协同锰质活性滤膜在砂滤器内通过接触氧化作用有望实现锰的高效稳定去除.
另一方面, 我国不同地区地表水硬度差异显著, 低至几十mg · L-1(以CaCO3计)而高至近千mg · L-1 (李晓涛等, 2008;李爱民, 2004;史栾生等, 2005).水的硬度对除锰效果具有怎样影响, 却鲜有报道, 本文针对以上问题进行试验.
2 试验装置和方法(Experimental apparatus and methods)2.1 试验装置试验采用内径为1.8 cm, 总高度2.4 m的硅胶软管, 并在内部填充石英砂作为砂滤过滤器.过滤器由底部的承托层、中部的有效过滤层以上部的水头变化区组成.承托层总厚0.1 m, 分别由粒径为4~8 mm和2~4 mm各0.05 m组成.单级过滤材料采用石英砂, 填装有效过滤层厚度为1.5 m, d80=1.42 mm, d10=0.78 mm, 不均匀系数K80=1.82;变化水头700 mm.试验装置示意见图 1.
图 1(Fig. 1)
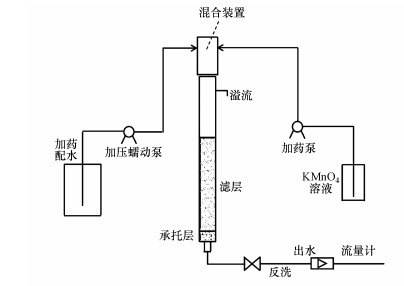 |
| 图 1 试验装置示意图 Fig. 1Schematic diagram of experimental device |
2.2 试验方法MnCl2、FeCl2被投加至自来水中用以配制试验原水, 表 1所示为水质指标.活性炭滤罐置于自来水后部、配水桶前部, 用以将自来水中带有的余氯进行去除.滤柱进水的不同硬度以投加CaCl2、MgCl2实现, 各滤柱对应原水硬度分别为40、200、400 mg · L-1及700 mg · L-1(以CaCO3计).根据KMnO4与Fe2+、Mn2+反应化学方程式计算所需KMnO4理论投药量为2.20 mg · L-1.KMnO4首先在混合装置中与原水经过5~6 min的充分混合, 而后通过下向流的方式以5 m · h-1的过滤速度流入砂滤柱内.为避免沉积堵塞影响砂滤效果, 同时避免新形成的活性氧化膜被破坏, 每24 h对滤柱进行低强度的水力反洗.反洗强度为6~8 L · s-1 · m-2, 反洗时间3~4 min.
表 1(Table 1)
| 表 1 试验水质 Table 1 Characteristics of experimental synthetic water | ||||||||||||||||
表 1 试验水质 Table 1 Characteristics of experimental synthetic water
| ||||||||||||||||
2.3 分析项目与仪器对样品进行了金属离子测定和UV254测定0.45 μm微滤膜用以在检测前过滤待测样品.其他检测项目及方法如表 2所示.
表 2(Table 2)
| 表 2 分析项目与方法 Table 2 Analytical items and methods | ||||||||||||
表 2 分析项目与方法 Table 2 Analytical items and methods
| ||||||||||||
3 结果与讨论(Results and discussion)3.1 自然养成石英砂对照滤柱图 2所示1#滤柱为进水硬度40 mg · L-1 KMnO4投量为0 mg · L-1时自然养成过程中进出水中锰含量.从图 2中看出, Mn2+进水浓度控制于1.0 mg · L-1附近, 在不投加KMnO4自然养成情况下, 石英砂滤柱运行后期Mn2+的去除效能有缓慢的提升, 且出水Mn2+含量有较大波动, 而在前期并没有明显的锰去除作用.经过60 d的过滤后, 原水的锰仅去除了0.2~0.3 mg · L-1左右, 出水中Mn2+含量仍高达0.8 mg · L-1.笔者发现, 具有显著除锰作用的“锰质活性滤膜”没有在石英砂滤柱短期自然过滤条件下形成.
图 2(Fig. 2)
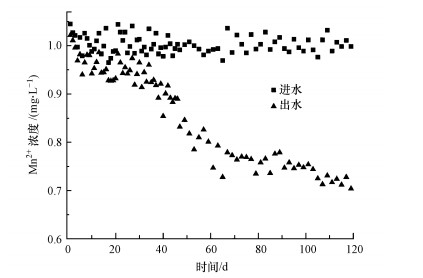 |
| 图 2 进、出水锰浓度在硬度为40 mg · L-1的砂滤柱内的变化 Fig. 2The change of manganese concentration in the influent and effluent of sand filter column at the hardness of 40 mg · L-1 |
3.2 不同硬度条件下滤池除锰效果本试验中, 笔者试图研究在高锰酸钾协同“锰质活性滤膜”作用下对锰去除效能的影响.如图 3所示, 2#~5#滤柱进水硬度分别为40、200、400 mg · L-1及700 mg · L-1(CaCO3计).为了考察锰在滤柱内的去除量, 以8 ~10 d为一个KMnO4投加周期, 随后停药.实验结果表明在进水Mn2+含量约为0.1 mg · L-1左右时, 于各进水硬度条件, 投加KMnO4后出水Mn2+含量均达标, 这是由于投加KMnO4将水中Fe2+、Mn2+全部氧化.在药剂停止投加时, 生成的“锰质活性滤膜”协同KMnO4作用于Mn2+, 通过被滤料截留和氧化作用共同实现锰的除去.第一次停药时, 生成的活性滤膜很少, 所以出水锰浓度很快增高, 但随着投加KMnO4时间变长, 生成的活性滤膜愈来愈多, 使停药期间出水锰达标的时间增长, 最后, 例如对硬度为40 mg · L-1的原水, 生成的“锰质活性滤膜”发挥其接触氧化作用, 成功实现了滤柱第5次停药无KMnO4投加下的持续达标除锰.这表明砂滤柱已具有高效的除锰效果, 即认为砂滤柱内的滤料已经成熟, 而滤柱从开始投药至滤料完全成熟所需的是时间即为滤柱的成熟期.由图可见, 硬度为40 mg · L-1的原水, 总运行时间为60 d, 扣除停药时间12 d, 总投药时间为48 d, 即滤柱的成熟期为48 d.由图可见, 滤柱的成熟期受原水硬度的影响是比较大的, 随原水硬度增长成熟期不断增长.当原水硬度为200、400 mg · L-1及700 mg · L-1时, 滤柱成熟期分别增长至56、64 d及72 d.另外, 尽管在第6次停药后继续对进水硬度为700 mg · L-1的滤柱加药, 但并没有显著的观察到Mn2+被去除, 说明在此条件下, 成熟石英砂滤柱展现出较差的的锰去除能力.
图 3(Fig. 3)
 |
| 图 3 不同硬度下(a) 40 mg · L-1;(b) 200 mg · L-1;(c) 400 mg · L-1和(d) 700mg · L-1, 各砂滤柱进出水中锰浓度变化 Fig. 3The change of manganese concentration in sand filter columns under different hardness (a) 40 mg · L-1, (b) 200 mg · L-1, (c) 400 mg · L-1 and (d) 700 mg · L-1 |
“锰质活性滤膜”通过KMnO4氧化Mn2+生成的锰氧化物被截留吸附在滤料表面而形成, 其中MnO2 · mH2O为具有较强催化氧化作用的“活性滤膜”(Aschner, 2017).首先, “活性滤膜”表面会快速吸附原水中的Mn2+(方程(1)), 随后通过接触催化作用, 使水中的溶解氧氧化Mn2+, 进而新的MnO2 · mH2O被生成(方程(2))(White et al., 1997).
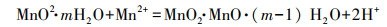 | (1) |
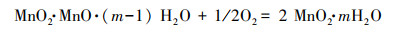 | (2) |
3.3 不同硬度条件下成熟滤料对锰去除界限浓度为了探究已经成熟的滤柱除锰的极限浓度, 在2#~5#滤柱实现稳定除锰30 d后, 进水中Mn2+浓度被持续增高, 各滤柱出水Mn2+浓度被测定用以分析滤柱对锰的去除效能.由图 4可见, 当进水Mn2+浓度逐渐升高时, 对应进水硬度为40、200、400 mg · L-1和700 mg · L-1的滤柱出现出水锰高于0.1 mg · L-1时的对应天数分别为第6、20、35 d和37 d, 相应的Mn2+去除界限浓度分别为1.8、1.7、1.2 mg · L-1及0.7 mg · L-1.对去除锰起着至关重要的作用的是位于“锰质活性滤膜”上表面吸附点位数量, 吸附位点竞争会存在于进水中的Ca2+、Mg2+和Mn2+, 当硬度增大会导致能够被Mn2+作用的有效位点减少, Mn2+的氧化过程也将进一步被影响, 从而无法时间较低浓度的锰的去除.因此, 本试验中进水中硬度过高直接导致了成熟滤料除锰极限浓度下降, 引发出水锰超标现象, 此时通过辅助投加KMnO4可以实现对锰的有效去除, 从而缓解出水锰超标现象.
图 4(Fig. 4)
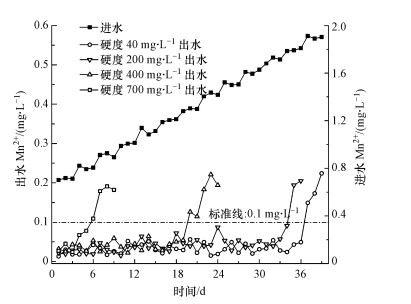 |
| 图 4 硬度为40、200、400 mg · L-1和700 mg · L-1时各成熟滤柱除锰效能 Fig. 4Manganese removal performance in the ripened sand filter with hardness of 40, 200, 400 mg · L-1 and 700 mg · L-1 |
3.4 滤料形貌表征及分析3.4.1 SEM表征由图 5的SEM图像可见, 形态不规则且表面较为光滑是原始石英砂滤料颗粒的特征.相比之下, 在进水硬度为40 mg · L-1的条件下, 经过长期过滤后的滤料表面呈现疏松多孔且蓬松的结构.此外可以在滤料表面观察到由于锰氧化物的积累而形成的球型褶状叠加滤层, 同时由于高锰酸钾的投加, 滤料表面也有少量的片状以及线状结构沉积物(图 6).“锰质活性滤膜”具有多孔结构, 是随着过滤进行逐渐负载在滤料表面上的锰氧化物.其形成不仅可以提高Mn2+的传质氧化速率, 同时滤膜空间褶皱度的增加包含有较多的有效位点, 促进与Mn2+的反应.在进水硬度为200 mg · L-1的滤柱中提取的滤料表面上, 发现同样具有不规则孔洞和明显的球体褶状叠加现象, 但与进水硬度为40 mg · L-1的滤柱内的滤料相比, 其整体结构更为紧凑、球体之间的叠加度更小.随着进水硬度不断加大, 700 mg · L-1的滤柱中滤料表面颗粒感尤为明显, 然而空间结构并不显著, 滤膜呈现紧凑严密状, 且无可观的孔洞结构和球状褶皱.对比图 6图片可见, 随进水硬度升高, 负载于滤料表面的“锰质活性滤膜”逐渐不再呈现多褶皱状、多孔洞结构, 其整体结构发生了从疏松向紧凑的转变, 空间感也随之降低, 这直接导致了与Mn2+发生有效接触的面积减少, 除锰能力降低也是因氧化传质速率降低而引起的.
图 5(Fig. 5)
 |
| 图 5 石英砂生料扫描电镜图((a)×100和(b)×2000) Fig. 5Scanning electron microscope of pristine quartz sand ((a) ×100 and (b) ×2000) |
图 6(Fig. 6)
 |
| 图 6 硬度为40、200、400 mg · L-1和700 mg · L-1滤柱内滤料表观形貌(× 5000) Fig. 6Surface morphologies of sand grains in sand filter with hardness of 40, 200, 400 mg · L-1 and 700 mg · L-1 (×5000) |
3.4.2 EDS能谱分析对原始的石英砂滤料和各个硬度条件下成功挂膜的滤料进行了EDS能谱分析, 考察其表面元素种类, 结果如图 7所示.Si、Au和O 3种元素主要在原始的石英砂滤料中被检测到, Fe、Mn的元素则在成熟的滤料表面被发现, 其中Fe元素检测峰强度相对Mn元素稍弱;另外, 发现元素含量降低的是Si的而元素含量增加的是O.结果表明, 投加KMnO4后其迅速氧化生成的大量的锰的氧化物被截留在滤料表面, 然而当进水中硬度含量不断增加时, 虽然滤料表面的Ca、Mg元素的峰强没有显著增加, 但测定的Mn元素峰显著降低, 这也表明了, 硬度的增大显著影响了滤料表面沉积或吸附的锰含量.
图 7(Fig. 7)
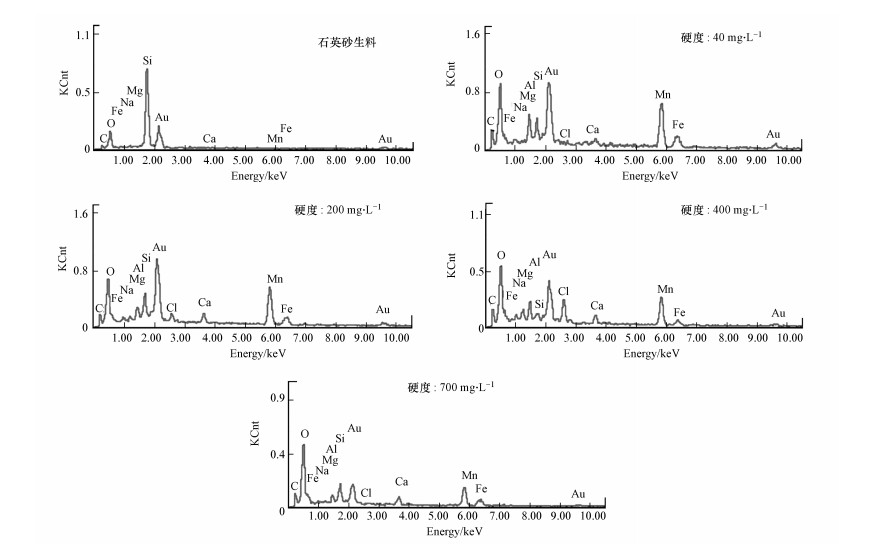 |
| 图 7 硬度为40、200、400 mg · L-1和700 mg · L-1滤柱内滤料表面元素分析 Fig. 7Elements composition of manganese oxides films in sand filter with hardness of 40, 200, 400 mg · L-1 and 700 mg · L-1 (× 5000) |
表 3所示为成熟石英砂滤料表面沉积的“锰质活性滤膜”中所含元素及其质量百分比.可知, Mn、O元素是“活性滤膜”中的主要元素, 而随着进水硬度的逐渐升高, Ca、Mg元素质量分数在“活性滤膜”中不断增加, 而元素质量分数不断降低的是Mn.Ca2+、Mg2+含量在进出水的检测中没有发现显著的差异, 这表明动态作用是Mn2+与二价钙镁阳离子竞争的主要方式, 是一个不停的替换被吸附锰, 再脱附、再吸附的过程, 而整个过程中仅有极少量的Ca2+、Mg2+离子形成固体氧化物被滤料截留, 所以挂膜后的滤料表面Mn、O仍为主要元素.水体中钙镁离子的存在不仅与锰发生竞争吸附, 更导致生成的钙镁氧化物堵塞沉积在“锰质活性滤膜”形成的层叠多孔褶皱结构的孔洞和裂隙中, 致使“活性滤膜”的结构由疏松多孔转向致密紧凑, 减小“活性滤膜”的吸附位点和与Mn2+的有效接触面积, 直接导致除锰速率降低.这一结论也与扫描电镜观察的结果相吻合.另外, 与进水硬度较高的滤柱(400 mg · L-1和700 mg · L-1)相比, Mn、Ca、Mg的元素含量在低硬度滤柱中(40 mg · L-1与200 mg · L-1)差异不显著, 其中Mn元素占比最高, 质量百分比达到45%;而十分接近的1.8 mg · L-1和1.7 mg · L-1的除锰界限浓度也在两根滤柱中被检测到.这说明当水中硬度小于200 mg · L-1时, 成熟滤池中接触氧化除锰能力受到钙镁离子影响较小.
表 3(Table 3)
| 表 3 活性滤膜表面主要元素及质量百分比 Table 3 Major elements in the manganese oxides films | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 3 活性滤膜表面主要元素及质量百分比 Table 3 Major elements in the manganese oxides films
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
4 结论(Conclusions)1) 接触氧化滤池的高效除锰可以通过投加KMnO4, 使水中Mn2+被快速氧化, 在短期内快速促进“锰质活性滤膜”生成实现.“活性滤膜”生成后, 无需继续投加药剂, 接触氧化滤池也可实现高效稳定除锰, 可节约投药成本.因此, 高锰酸钾协同接触氧化滤池实现深度稳定除锰是一种具有应用价值的先进技术.
2) 锰的去除效能在成熟滤池中受到原水中存在的Ca2+、Mg2+含量的显著影响.进水硬度在40、200、400 mg · L-1及700 mg · L-1(CaCO3计)时, 成熟后对Mn2+去除界限浓度分别为1.8、1.7、1.2 mg · L-1及0.7 mg · L-1.为了达成高效深度除锰, 在高锰高硬度水体中, 可通过KMnO4药剂投加辅助接触氧化滤池.
3) 滤料表观形貌和元素分析结果表明, 原水中钙镁离子含量过高不利于生成疏松多孔、多吸附位点的空间褶状结构, 并会降低Mn2+的传质氧化速率, 不利于Mn2+的去除.
参考文献
| Aschner J L C. 2017. Manganese neurotoxicity:cellular effects and bloodbrain barriertransport[J]. Neurose Biobeha V Rev, 15: 333-340. |
| Guo Y M, Huang T L, Wen G. 2017. The Simultaneous removal of ammonium and manganese from groundwater by iron-manganese co-oxide filter film:The role of chemical catalytic oxidation for ammonium removal[J]. Chemical Engineering Journal, 308: 322-329. DOI:10.1016/j.cej.2016.09.073 |
| 李圭白, 梁恒, 杜星, 等. 2019. 锰质活性滤膜化学催化氧化除锰机理研究[J]. 给水排水, 75(5): 1-5, 75. |
| 刘树元, 郑晨, 袁琪. 2014. 台州长潭水库铁锰质量浓度变化特征及其成因分析[J]. 环境科学, 35(10): 3702-3708. |
| 李晓涛, 刘彦军, 徐鸿勋. 2008. 黑龙江省地表水水化学特征[J]. 黑龙江水利科技, (1): 1-4. |
| 李爱民. 2004. 山西省地表水天然水化学分析与评价[J]. 山西水利科技, (3): 74-76. |
| 孙中兴.2010.松江区饮用水中锰污染状况及影响因素分析[D].厦门: 复旦大学 |
| 孙滨. 2013. 曲靖市独木水库铁、锰元素现状调查分析[J]. 环境科学导刊, 32: 59-60. |
| White D A, Asfar-Siddique A. 1997. Removal of manganese and iron from drinking water using hydrous manganese dioxide[J]. Solvent Extraction and Ion Exchange, 15(6): 1133-1145. DOI:10.1080/07366299708934526 |
| 史栾生, 黄小兰. 2005. 广东省地表水水化学特征分析[J]. 广东水利水电, (2): 78-80. |
