 , 俞辉2,3, 林晓晓2, 盖艳波2
, 俞辉2,3, 林晓晓2, 盖艳波2
 , 张为俊1,2
, 张为俊1,21. 中国科学技术大学环境科学与光电技术学院, 合肥 230026;
2. 中国科学院安徽光学精密机械研究所, 合肥 230031;
3. 中国科学技术大学, 合肥 230026
收稿日期: 2019-03-22; 修回日期: 2019-04-29; 录用日期: 2019-04-29
基金项目: 国家自然科学基金(No.91544228,21876177,41575125,41605102);国家重点研发计划(No.2016YFC0202205);上海市大气颗粒物污染防治重点实验室开放课题(No.FDLAP18001)
作者简介: 张永灏(1994-), 男, E-mail:m18655101896@163.com
通讯作者(责任作者): 盖艳波, E-mail:gaiyanbo@aiofm.ac.cn
摘要: 在(298±2)K和一个大气压条件下,采用相对速率法研究了一系列酮类物质与氯原子的反应动力学.使用丙醛和乙苯作为参比物,光解三氯乙酰氯作为氯原子产生源,测得2-己酮与氯原子的反应速率常数为(1.80±0.42)×10-10 cm3·molecule-1·s-1,与已有文献报道值非常符合,验证了实验方法和所选参比物的可靠性.首次测得了(298±2)K和一个大气压条件下2-庚酮和2-辛酮与氯原子反应的速率常数,分别为(2.54±0.62)×10-10和(2.12±0.63)×10-10 cm3·molecule-1·s-1.与其母体烷烃的反应速率对比发现,酮类物质中羰基的存在使得其反应速率都比其母体烷烃变慢.利用所测的速率常数和氯原子的浓度信息估算这些酮类物质在大气中的平均寿命,结果显示,在海洋边界层或沿海地区等氯原子浓度较高的地区,这些物质与氯原子反应的大气化学寿命都在小时量级,完全可以与OH自由基的反应相竞争,是这些物质在大气中的重要降解途径.另外,在内陆污染地区或工业聚集区,氯原子的反应及其对二次污染物生成的贡献同样不能忽视.
关键词:相对速率法烟雾箱酮氯原子
Rate constants for gas-phase reactions of Cl atoms with a series of ketones by relative rate method
ZHANG Yonghao1,2
 , YU Hui2,3, LIN Xiaoxiao2, GAI Yanbo2
, YU Hui2,3, LIN Xiaoxiao2, GAI Yanbo2
 , ZHANG Weijun1,2
, ZHANG Weijun1,2 1. School of Environmental Science and Optoelectronic Technology, University of Science and Technology of China, Hefei 230026;
2. Laboratory of Atmospheric Physico-Chemistry, Anhui Institute of Optics and Fine Mechanics, Chinese Academy of Sciences, Hefei 230031;
3. University of Science and Technology of China, Hefei 230026
Received 22 March 2019; received in revised from 29 April 2019; accepted 29 April 2019
Abstract: Reaction kinetics of several ketones with chlorine atoms was studied using the relative rate method at (298±2) K and atmospheric pressure. The reaction rate constant of 2-hexanone with chlorine atoms was measured to be (1.80±0.42)×10-10 cm3·molecule-1·s-1 using propionaldehyde and ethylbenzene as reference compounds, which is in good agreement with the reported values in the literature. And the rate constants for reactions of 2-heptanone and 2-octanone with chlorine atoms were measured for the first time, which were (2.54±0.62)×10-10 and (2.12±0.63)×10-10 cm3·molecule-1·s-1, respectively. Compared with reaction rate constants of their parent alkanes with chlorine atoms, it was found that the presence of carbonyl group in these ketones makes their rate constants smaller than those of their parent alkanes. The average lifetimes of these ketones in the atmosphere have also been estimated using the measured rate constants. The results showed that the reaction with chlorine atoms could be an important degradation pathway for these ketones, which can compete with their reactions with OH radicals, especially in areas with high concentration of chlorine atoms such as marine boundary layer and coastal areas. In addition, in some inland polluted areas or industrial agglomeration areas where the concentration of chlorine atom is also relatively high, the reaction of chlorine atoms and their contribution to the formation of secondary pollutants could also not be ignored.
Keywords: rate constantssmog chamberketonechlorine atom
1 引言(Introduction)对流层中的大气组成十分复杂, 大量挥发性有机物(VOCs)通过人为源和生物源排放到大气中.这些挥发性有机物也可以作为其它VOC转换的产物存在, 并在二次有机气溶胶(SOA)的形成和全球气候的变化过程中起着关键作用(Lamb et al., 1993; Jenkin et al., 2002).在城市等人类活动频繁的区域, 人为排放的挥发性有机物是大气中主要的VOC来源.然而, 从全球尺度上, 植物挥发性有机物(BVOCs)的排放在总VOC排放中占据主导地位, 以碳元素来衡量的每年排放量约为1150×1012 g(1150 TgC·a-1), 而人为源排放的挥发性有机物的年均排放量仅为110 TgC(Griffin et al., 1999; Guenther et al., 2000).相较于人为排放的VOC, 植物挥发性有机物往往具备更高的反应活性(Penuelas et al., 2010).因此, 对流层中挥发性有机物尤其是BVOC在大气中的降解过程的研究十分重要.
在大气VOC循环中, 酮是一类具有代表性的物质.一方面, 酮类物质既是一种重要的工业原料, 也能由植物代谢产生(Grosjean et al., 2002), 另一方面, 酮类也是很多初级挥发性有机物在大气中氧化的中间产物(吴海等, 2004; 伦小秀等, 2005; Kroll et al., 2008).大量酮类物质可以通过人为或生物源排放到大气中, 如2-己酮可作为溶剂和油漆的洗涤剂;2-庚酮既是一种重要的溶剂和涂料, 也可作为香料使用;2-辛酮在水果中广泛存在, 同时也在工业中用作表面活性剂和合成纤维油剂.它们在对流层中可以与大气中的氧化剂发生一系列光化学反应, 进一步对大气环境产生影响(Llusia et al., 1998).
对流层中的主要氧化剂有OH自由基、NO3自由基、臭氧和氯原子等(Atkinson et al., 1997; Wang et al., 2018a), 其中与OH自由基的反应被认为是大气中酮类物质主要的降解途径, 与之的反应速率测定的报道远远多于其它氧化剂(Atkinson et al., 2000; Jiménez et al., 2005; Wang et al., 2015).近年来, 越来越多的研究表明, 氯原子在大气VOC降解中的作用不可忽视.最早观测到大气中的Cl原子是在沿海地区和海洋空气的环境中, 由于大气中Cl2分子的光解, 可以观测到Cl原子浓度在沿海城市地区保持较高水平, 约为1×105 atom·cm-3或更高(Spicer et al., 1998).海盐气溶胶和氮氧化物通过非均相反应产生的NOCl和ClNO2进一步光解也可以产生氯原子(Fantechi et al., 1998).沿海地区氯原子的另一个来源是OH自由基与HCl分子的反应, 其中HCl通过酸化的氯化钠气溶胶与硝酸或硫酸生成(Tham et al., 2016).大多数NOx和强酸通过人为源排放到对流层.因此, 在一些沿海城市地区, 人类活动产生的强酸会使得氯原子的浓度更高(Knipping et al., 2003).随着研究的广泛开展, Cl原子的光解前驱物ClNO2在近年来也被越来越多地在远离海洋边界层的内陆地区观测到, 例如在欧洲中部和我国河北望都地区等人类活动频繁的内陆地区观测到了与沿海地区同等浓度的ClNO2(Faxon et al., 2013; Tham et al., 2016).各种研究表明, Cl原子在大气挥发性有机物作为氧化剂的降解过程中起着重要作用(葛茂发等, 2009).
相比于其它氧化剂, 氯原子具有更高的反应活性, 根据已有的文献报道, 氯原子所引发的氧化反应速率比OH自由基高出约两个数量级(Atkinson et al., 1997; Spicer et al., 1998).然而Cl原子相关反应参数和机理相对缺乏, 直接影响了对大气化学反应机理的认识和模式模拟结果的准确性.
本文选择了具有广泛人为源和生物源的几种酮类物质(2-己酮、2-庚酮、2-辛酮), 利用相对速率法测量了它们与Cl原子的反应速率常数, 并与其它反应途径对比分析了反应在大气中的重要性.研究结果为大气化学反应动力学数据库和模式模拟提供了基本数据, 同时也为评估这些化合物对环境的影响提供了重要的参考依据.
2 实验部分(Experimental section)2.1 实验原理和方法所有动力学实验均在室温(298±2) K和一个大气压下(1.01×105 Pa)在特氟龙烟雾箱气袋中进行.采用相对速率法测量2-己酮、2-庚酮、2-辛酮与氯原子的反应速率常数(吴海等, 2001; Wang et al., 2018b; Gai et al., 2011; 2015).氯原子通过紫外灯(中心波长在254 nm处)光照三氯乙酰氯(CCl3COCl)得到.选择与氯原子反应速率常数已知的乙苯、丙醛作为参比物质与待测酮类充入烟雾箱中, 生成的氯原子将同时与参比物、被测定酮类物质进行反应, 反应过程相对独立, 通过测量同一时刻参比物与待测物质的浓度变化计算待测酮类与氯原子的反应速率常数.整个反应过程的原理可用式(1)~式(5)进行:
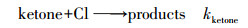 | (1) |
 | (2) |
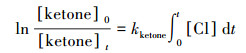 | (3) |
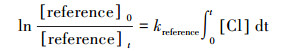 | (4) |
 | (5) |
为了尽可能模拟酮类物质在实际大气中的反应, 实验中使用一套零空气发生装置(737-15, AADCO)产生干净的零空气作为载气.室内空气经粒子过滤器、干燥器以及零空气发生器后, 所含的甲烷等碳氢化合物、NOx、H2S、SO2、O3和NH3等杂质气体浓度均低于1 ppb, 颗粒相浓度低于10个·cm-3, 满足实验的需要.在实验开始前, 将一定量的待测酮类与参比物质通过微量进样器加入到底部装有加热炉的三口烧瓶内汽化, 零空气通过质量流量计(D07-19B/ZM, 北京七星华创电子有限公司)将样品气通入100 L特氟龙气袋中.烟雾箱内装有两根紫外灯(TUV 36W/G36 T8, Philips)用于光解三氯乙酰氯得到氯原子, 为保证光解效率, 烟雾箱内部装有反射涂层.每次配气完成后将气体静置, 使其混合均匀并同时进行暗反应与壁损失的测量, 进而启动反应进行反应速率常数的测量.
参比物与待测酮类的浓度变化通过装有氢火焰离子化检测器的气相色谱仪(GC-FID, 7820A, Agilent Technologies)进行测定, 控制各组实验中待测酮类物质和参比物浓度范围均在(2~4)×1014 molecule·cm-3, 三氯乙酰氯浓度约为所测酮类物质和参比物浓度的2倍以上以保证实验过程中有足够的氯原子.由于色谱中各物质浓度与其峰面积成正比, 公式(5)中各物质浓度的比值可以用相应的峰面积比值代替, 所以无需对各待测物质浓度进行准确标定.烟雾箱内的样品通过采样泵进入色谱六通阀内, 按照分流比4:1进入毛细色谱柱中(HP-5, 30 m, 0.25 μm, 0.320 mm i.d, Agilent Technologies), 色谱运行方法如下:先以40 ℃保持2 min, 随后以75 ℃·min-1的升温速率升温至100 ℃, 并保留1 min, 最后以50 ℃·min-1的速率升至200 ℃, 整个过程中检测器温度为300 ℃.平均每12 min完成一组实验数据的采集.由于所选酮类物质与氯原子的反应速率较快, 如果持续光照反应一直进行, 反应物将很快彻底消耗, 色谱测量无法获得足够的实验数据点, 因此实验中使用一套定时控制系统, 控制电源使每次光照反应时间均为2 min, 色谱采集获得此时的反应物浓度信息以后, 再开灯反应进行下一个数据点的采集.一组实验累积光照反应时间大约在30 min.
2.2 实验试剂2-己酮:东京化成工业株式会社, 纯度>98.0%;2-庚酮:Adamas, 纯度99%;2-辛酮:Adamas, 纯度99%;丙醛:东京化成工业株式会社, 纯度>98.0%, 乙苯:国药集团化学试剂有限公司, 化学纯;三氯乙酰氯:阿拉丁试剂, 纯度99%.
3 结果与讨论(Results and discussion)3.1 可靠性测试实验开始前, 先将待测酮类、参比物与三氯乙酰氯按照一定比例通入烟雾箱内, 用GC-FID测量各VOCs组分浓度的变化, 通过5 h的测量发现各组分浓度均未有明显的变化(相对偏差在±1%之内), 说明壁损失和暗反应对实验没有影响;另外, 在未加入三氯乙酰氯的情况下, 用与实验相同的光照条件对待测酮类和参比物光照30 min, 发现光解反应对各VOCs浓度的影响也可以忽略(浓度变化小于2%).
实验过程中, 所选酮类和参比物与氯原子反应的产物也可能对反应物的测量产生干扰.为此本课题组利用预实验对色谱方法进行了测试.配制一定浓度的反应物和参比物气体, 通入三氯乙酰氯, 开灯连续光照30 min使反应进行彻底, 利用之前设定的色谱方法对反应后的体系进行检测, 发现所有产物峰均能与反应物峰完全分开.因此, 在当前色谱运行条件下, 反应产物不会对反应物的测量产生影响.另外, 对每一个参比物的实验, 反应物和参比物初始浓度均按1:1、1:2和2:1的比例重复至少3次, 以保证实验结果的准确性.
3.2 实验结果分析实验在室温(298±2) K下进行, 首先利用丙醛和乙苯当参比物, 测量了2-己酮与氯原子的反应速率常数.将不同时刻测得的2-己酮和参比物浓度按照公式(5)作图, 用最小二乘法进行线性回归拟合, 获得2-己酮与氯原子的反应速率拟合图如图 1a所示.图中直线拟合的线性可决系数R2均大于0.99, 一定程度上证明了实验方法的可靠性.参比物丙醛和乙苯与氯原子的反应速率常数分别为(1.40±0.3) ×10-10 cm3·molecule-1·s-1和(1.15±0.04) ×10-10 cm3·molecule-1·s-1(Thévenet et al., 2000; Anderson et al., 2007a).结合图 1a拟合曲线的斜率, 可计算得到2-己酮与氯原子的反应速率常数分别为(1.85±0.03) ×10-10 cm3·molecule-1·s-1和(1.78±0.02) ×10-10 cm3·molecule-1·s-1, 相应结果列于表 1中.将多组数据求平均带来的标准偏差和参比物本身数据自带的误差之和作为最终的总误差.所选参比物中, 丙醛反应速率常数的误差明显更大一些(21%), 因此将其误差作为本文中来自参比物结果的误差.最终可得到2-己酮与氯原子的反应速率常数为(1.80±0.42) ×10-10 cm3·molecule-1·s-1.
图 1(Fig. 1)
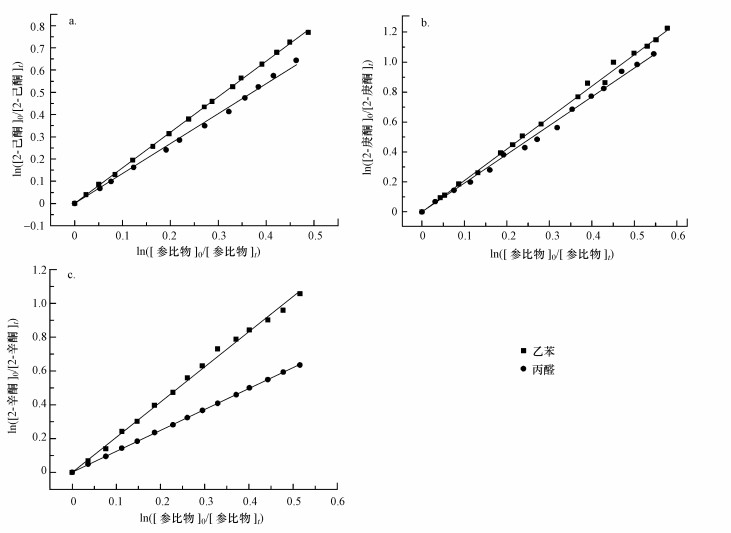 |
| 图 1 2-己酮与氯原子(a)、2-庚酮与氯原子(b)和2-辛酮与氯原子(c)反应的相对速率曲线(参比物分别为乙苯(■)和丙醛(●)) Fig. 1Relative rate plots for Cl atoms with 2-hexanone(a), 2-heptanone(b) and 2-octanone(c) using ethylbenzene (■) and propionaldehyde (●) as reference compounds |
表 1(Table 1)
| 表 1 利用不同参比物得到的3种酮类与氯原子的反应速率常数 Table 1 Rate constants for reactions of Cl atoms with a series of ketones using different reference compounds | ||||||||||||||||||||||||||||||||||||||||
表 1 利用不同参比物得到的3种酮类与氯原子的反应速率常数 Table 1 Rate constants for reactions of Cl atoms with a series of ketones using different reference compounds
| ||||||||||||||||||||||||||||||||||||||||
2-己酮与氯原子的反应速率常数已有文献报道.Taketani等(2006)利用相对速率法测得2-己酮与氯原子的反应速率常数为(1.88±0.16)×10-10 cm3·molecule-1·s-1, 与本研究结果在误差范围内非常一致, 证明了本研究方法和结果的可靠性.此外, Albaladejo等(2003)和Cuevas等(2004)利用绝对速率法测得的反应速率常数分别为(6.54±0.58) ×10-11 cm3·molecule-1·s-1和(6.56±0.98) ×10-11 cm3·molecule-1·s-1, 低于本文和Taketani等(2006)的结果.他们利用绝对速率法通过测量氯原子的浓度衰减来获得反应的速率常数, 然而实验中高浓度的Cl2 (氯原子前体物)会与反应中生成的烷基自由基反应重新生成氯原子, 从而使测量到的氯原子衰减速率变慢, 使得氯原子与2-己酮的反应速率常数被低估(Taketani et al., 2006).
进一步, 在室温和一个大气压条件下, 分别使用丙醛和乙苯作为参比物测量了2-庚酮和2-辛酮与氯原子反应的速率常数.根据公式(5)拟合得到的曲线如图 1b和1c所示, 直线斜率值kketone/kreference和对应的速率常数值也列于表 1中, 其中使用丙醛和乙苯得到2-庚酮的反应速率分别为(2.60±0.06) ×10-10 cm3·molecule-1·s-1和(2.48±0.08) ×10-10 cm3·molecule-1·s-1, 使用丙醛和乙苯得到2-辛酮的反应速率分别为(2.17±0.12) ×10-10 cm3·molecule-1·s-1和(2.07±0.20) ×10-10 cm3·molecule-1·s-1.取平均值并考虑参比物本身的偏差, 最终获得2-庚酮和2-辛酮与氯原子的反应速率常数分别为(2.54±0.62) ×10-10 cm3·molecule-1·s-1和(2.12±0.63) ×10-10 cm3·molecule-1·s-1.
关于2-庚酮和2-辛酮与氯原子的反应速率常数, 文献中并未见报道.氯原子与这些饱和VOCs的反应主要是通过夺氢反应进行的, 因此VOCs中C—H键的数量以及影响C—H键强弱的基团都可以影响到总体的反应速率.表 2列出了一系列结构类似的酮类物质与氯原子的反应速率常数.可以看出, 除了2-辛酮以外, 随着这些酮类VOC链长的增加, 反应速率逐渐变大.另外, 与母体烷烃的速率常数对比可见, 这些酮类物质与氯原子的反应速率都低于它们的母体烷烃与氯原子的反应速率.一方面, 这些VOCs中的C—H键直接被C=O键取代, 使得C—H键减少, 反应速率变慢;另一方面, 羰基C=O取代后, 会钝化相邻的α位的C—H键, 导致VOCs反应活性降低, 这与大多数文献报道结果相一致(Cuevas et al., 2004; Taketani et al., 2006).
表 2(Table 2)
| 表 2 一系列酮类物质及其对应母体烷烃与氯原子反应的速率常数对比 Table 2 Comparison of rate constants for reactions of a series of ketones and their alkane structural homologues with chlorine atoms | ||||||||||||||||||||||||||||||||
表 2 一系列酮类物质及其对应母体烷烃与氯原子反应的速率常数对比 Table 2 Comparison of rate constants for reactions of a series of ketones and their alkane structural homologues with chlorine atoms
| ||||||||||||||||||||||||||||||||
3.3 大气意义已知这些酮类与大气氧化剂的反应速率常数, 结合公式τ =1/(k[X])可以估算它们在大气对流层中的平均寿命, 其中[X]为大气中氧化剂的浓度.大气中的氧化剂主要有OH自由基、NO3自由基、臭氧以及氯原子.饱和酮类物质与臭氧的反应速率非常慢, 很难与其它氧化剂竞争.NO3自由基作为夜间的主要氧化剂, 与这些酮类物质的反应速率还未见文献报道.唯一有数据可查的饱和酮类物质是丙酮, 其与NO3的反应速率小于3×10-17 cm3·molecule-1·s-1(Atkinson et al., 2003), 对应的大气化学寿命大于2年, 因此与NO3的反应不是这些酮类在大气中的主要反应途径.
表 3列出了这几个酮类物质与OH和Cl原子的反应速率常数以及对应的大气化学寿命.可以看出, 对流层OH浓度和Cl原子浓度分别为1×106 molecule·cm-3 (Bloss et al., 2005)和1×105 atoms·cm-3(Spicer et al., 1998)时, 估算得到的这些酮类物质的大气化学寿命都在小时量级.此时, 对流层中的氯原子在挥发性有机化合物(VOC)的氧化和臭氧生成过程中的作用可能比以前想象的更重要.尽管计算用的氯原子浓度是在海洋区域特定情况下观测到的一个峰值, 但预计它将在海洋边界层的对流层化学和在黎明时氯原子浓度远早于OH达到峰值的沿海区域发挥重要作用.在这些区域, VOCs与氯原子的反应完全可以与白天OH的反应和夜间NO3自由基的反应相竞争.此外, 在一些工业聚集区或污染严重的城市地区也观测到高浓度的氯原子浓度, 这些地区氯原子在大气二次污染物(包括臭氧)形成中的重要性也不可忽视.而在海拔1 km以上的自由对流层和其它洁净地区(氯原子浓度低于104 molecule·cm-3), 这些VOCs与氯原子的反应将无法与其它途径竞争.在实际大气中, 这些酮类物质还可能进入气溶胶或者云滴中, 因此, 非均相反应过程在这些酮类物质降解过程中的作用需要进一步开展研究.
表 3(Table 3)
| 表 3 计算得到的几种酮类物质与大气中OH自由基和氯原子反应的平均寿命 Table 3 Calculated lifetimes of the studied ketones with respect to reactions with OH radicals and Cl atoms | |||||||||||||||||||||||||
表 3 计算得到的几种酮类物质与大气中OH自由基和氯原子反应的平均寿命 Table 3 Calculated lifetimes of the studied ketones with respect to reactions with OH radicals and Cl atoms
| |||||||||||||||||||||||||
4 结论(Conclusions)1) 利用丙醛和乙苯作为参比物, 在298 K和一个大气压条件下, 测得了氯原子和2-己酮、2-庚酮、2-辛酮的反应速率常数分别为(1.80±0.42)×10-10、(2.54±0.62)×10-10、(2.12±0.63)×10-10 cm3·molecule-1·s-1.其中2-己酮的速率常数与之前文献中报道的数值非常一致, 证明了实验装置和方法的可靠性.2-庚酮和2-辛酮的速率常数为首次报道.研究结果丰富了大气反应动力学数据库, 也为大气化学模式提供了基础数据.
2) 将所测酮类物质与它们的母体烷烃对比发现, 羰基的存在使得酮类物质与Cl原子的反应活性都比它们的母体烷烃偏慢, 可能是由于羰基对其α位的C—H键有钝化作用导致.具体的影响机制还需要进一步开展实验和理论计算来研究.
3) 通过大气寿命估算发现, 与氯原子反应也可以是这些酮类物质在大气中的重要反应途径, 尤其是在沿海地区或城市工业聚集区.这种情况下, 这类反应的后续产物信息以及反应在二次污染物形成中的贡献也需要进一步研究.
参考文献
| Albaladejo J, Notario A, Cuevas C A, et al. 2003. Gas-phase chemistry of atmospheric Cl atoms: a PLP-RF kinetic study with a series of ketone[J]. Atmospheric Environment, 37(4): 455–463.DOI:10.1016/S1352-2310(02)00921-4 |
| Anderson R S, Huang L, Iannone R, et al. 2007a. Laboratory measurements of the 12C/13C kinetic isotope effects in the gas-phase reactions of unsaturated hydrocarbons with Cl atoms at (298±3) K[J]. Journal of Atmospheric Chemistry, 56(3): 275–291.DOI:10.1007/s10874-006-9056-4 |
| Anderson R S, Huang L, Iannone R, et al. 2007b. Measurements of the 12C/13C kinetic isotope effects in the gas-phase reactions of light alkanes with chlorine atoms[J]. Journal of Physical Chemistry A, 111(3): 495–504.DOI:10.1021/jp064634p |
| Atkinson R. 1997. Gas-Phase tropospheric chemistry of volatile organic compounds: 1. Alkanes and Alkenes[J]. Journal of Physical and Chemical Reference Data, 26(2): 215–290.DOI:10.1063/1.556012 |
| Atkinson R, Arey J. 2003. Atmospheric degradation of volatile organic compounds[J]. Chemical Reviews, 103(12): 4605–4638.DOI:10.1021/cr0206420 |
| Atkinson R, Tuazon E C, Aschmann S M. 2000. Atmospheric chemistry of 2-pentanone and 2-heptanone[J]. Environmental Science & Technology, 34(4): 623–631. |
| Bloss W J, Evans M J, Lee J D, et al. 2005. The oxidative capacity of the troposphere: coupling of field measurements of OH and a global chemistry transport model[J]. Faraday Discussions, 130: 425–436.DOI:10.1039/b419090d |
| Cuevas C A, Notario A, Matinez E, et al. 2004. A kinetic study of the reaction of Cl with a series of linear and ramified ketones as a function of temperature[J]. Physical Chemistry Chemical Physics, 6(9): 2230–2236.DOI:10.1039/B313587J |
| Fantechi G, Jensen N R, Saastad O, et al. 1998. Reactions of Cl atoms with selected VOCs: kinetics, products and mechanisms[J]. Journal of Atmospheric Chemistry, 31(3): 247–267.DOI:10.1023/A:1006033910014 |
| Faxon C B, Allen D T. 2013. Chlorine chemistry in urban atmospheres: A review[J]. Environmental Chemistry, 10(3): 221–233.DOI:10.1071/EN13026 |
| Gai Y B, Ge M F, Wang W G. 2011. Kinetics of the gas-phase reactions of some unsaturated alcohols with Cl atoms and O3[J]. Atmospheric Environment, 45(1): 53–59.DOI:10.1016/j.atmosenv.2010.09.047 |
| Gai Y B, Lin X X, Ma Q, et al. 2015. Experimental and theoretical study of reactions of OH radical with hexenols: an evaluation of the relative importance of H-abstraction reaction channel[J]. Environmental Science & Technology, 49(17): 10380–10388. |
| 葛茂发, 马春平. 2009. 活性卤素化学[J]. 化学进展, 2009, 21(2): 307–334. |
| Griffin R J, Cocker D R, Flagan R C, et al. 1999. Organic aerosol formation from the oxidation of biogenic hydrocarbons[J]. Journal of Geophysical Research, 104(D3): 3555–3567.DOI:10.1029/1998JD100049 |
| Grosjean D, Grosjean E, Moreira L F R. 2002. Speciated ambient carbonyls in Rio de Janeiro, Brazil[J]. Environmental Science & Technology, 36(7): 1389–1395. |
| Guenther A, Geron C, Pierce T, et al. 2000. Natural emissions of non-methane volatile organic compounds, carbon monoxide, and oxides of nitrogen from North America[J]. Atmospheric Environment, 34(12/14): 2205–2230. |
| Herath T N, Orozco I, Clinch E C, et al. 2018. Relative rate studies of the reactions of atomic chlorine with acetone and cyclic ketones[J]. International Journal of Chemical Kinetics, 50(1): 41–46.DOI:10.1002/kin.21138 |
| Jenkin M E, Saunders S M, Derwent R G, et al. 2002. Development of a reduced speciated VOC degradation mechanism for use in ozone models[J]. Atmospheric Environment, 36(30): 4725–4734.DOI:10.1016/S1352-2310(02)00563-0 |
| Jiménez E, Ballesteros B, Martínez E, et al. 2005. Tropospheric reaction of OH with selected linear ketones: kinetic studies between 228 and 405 K[J]. Environmental Science & Technology, 39(3): 814–820. |
| Knipping E M, Dabdub D. 2003. Impact of chlorine emissions from sea-salt aerosol on coastal urban ozone[J]. Environmental Science & Technology, 37(2): 275–284. |
| Kroll J H, Seinfeld J H. 2008. Chemistry of secondary organic aerosol: Formation and evolution of low-volatility organics in the atmosphere[J]. Atmospheric Environment, 42(16): 3593–3624.DOI:10.1016/j.atmosenv.2008.01.003 |
| Lamb B, Gay D, Westberg H, et al. 1993. A biogenic hydrocarbon emission inventory for the U.S.A. using a simple forest canopy model[J]. Atmospheric Environment Part A-General Topics, 27(11): 1673–1690.DOI:10.1016/0960-1686(93)90230-V |
| Llusia J, Penuelas J. 1998. Changes in terpene content and emission in potted Mediterranean woody plants under severe drought[J]. Canadian Journal of Botany, 76(8): 1366–1373.DOI:10.1139/b98-141 |
| 伦小秀, 张晓山, 牟玉静. 2005. 3-甲基丁酮与OH自由基反应的速率常数及其机理研究[J]. 环境化学, 2005, 24(5): 510–515. |
| Penuelas J, Staudt M. 2010. BVOCs and global change. Special Issue: Induced biogenic volatile organic compounds from plants[J]. Trends in Plant Science, 15(3): 133–144.DOI:10.1016/j.tplants.2009.12.005 |
| Spicer C W, Chapman E G, Finlayson-Pitts B J, et al. 1998. Unexpectedly high concentrations of molecular chlorine in coastal air[J]. Nature, 394(6691): 353–356.DOI:10.1038/28584 |
| Taketani F, Matsumi Y, Wallington T J, et al. 2006. Kinetics of the gas phase reactions of chlorine atoms with a series of ketones[J]. Chemical Physics Letters, 431(4/6): 257–260. |
| Tham Y J, Wang Z, Li Q Y, et al. 2016. Significant concentrations of nitryl chloride sustained in the morning: Investigations of the causes and impacts on ozone production in a polluted region of northern China[J]. Atmospheric Chemistry and Physics, 16(23): 14959–14977.DOI:10.5194/acp-16-14959-2016 |
| Thévenet R, Mellouki A, Bras G L. 2000. Kinetics of OH and Cl reactions with a series of aldehydes[J]. International Journal of Chemical Kinetics, 32(11): 676–685.DOI:10.1002/1097-4601(2000)32:11<676::AID-KIN3>3.0.CO;2-V |
| Wallington T J, Kuryo M J. 1987. Flash photolysis resonance fluorescence investigation of the gas-phase reactions of OH radicals with a series of aliphatic ketones over the temperature range 240~440 K[J]. Journal of Physical Chemistry, 91(19): 5050–5054.DOI:10.1021/j100303a033 |
| Wang J, Zhou L, Wang W G, et al. 2015. Gas-phase reaction of two unsaturated ketones with atomic Cl and O3: kinetics and products[J]. Physical Chemistry Chemical Physics, 17(18): 12000–12012.DOI:10.1039/C4CP05461J |
| Wang S Y, Du L, Zhu J Q, et al. 2018a. Gas-phase oxidation of allyl acetate by O3, OH, Cl and NO3: reaction kinetics and mechanism[J]. The Journal of Physical Chemistry A, 122(6): 1600–1611.DOI:10.1021/acs.jpca.7b10599 |
| Wang S Y, Du L, Tsona N T, et al. 2018b. Gas-phase kinetic and mechanism study of the reactions of O3, OH, Cl and NO3 with unsaturated acetates[J]. Environmental Chemistry, 15(7): 411–423.DOI:10.1071/EN18111 |
| 吴海, 牟玉静, 张晓山, 等. 2001. 相对速率法测氯原子与一系列低碳醇的反应速率常数[J]. 环境科学学报, 2001, 21(6): 649–653. |
| 吴海, 张逸, 牟玉静. 2004. 异丙醇与OH自由基和Cl反应产物的研究[J]. 环境化学, 2004, 23(1): 1–6. |
