 , 陈志远1, 李锋民2, 种云霄1
, 陈志远1, 李锋民2, 种云霄1
 , 李慧珊1, 李梅1, 林月锦1, 胡洪营3
, 李慧珊1, 李梅1, 林月锦1, 胡洪营31. 华南农业大学资源环境学院, 广州 510642;
2. 中国海洋大学环境科学与工程学院, 青岛 266100;
3. 清华大学环境学院, 北京 100084
收稿日期: 2018-12-17; 修回日期: 2019-03-20; 录用日期: 2019-03-20
基金项目: 科技基础性工作专项(No.2013FY112300);天河区科技计划项目(No.201705YH00)
作者简介: 高帅强(1996-), 男, E-mail:1092567421@qq.com
通讯作者(责任作者): 种云霄, E-mail:cyx04@scau.edu.cn
摘要: 矮慈姑(Sagittaria pygmaea Miq)是常见的稻田杂草类沉水植物,但在水污染防治中较少被研究应用.本研究利用典型黑臭河道中厌氧还原态的底泥模拟构建污染水体,考察矮慈姑在其中的生长情况和主要污染物的变化.结果表明,矮慈姑及其根系对底泥具有非常强的耐受性,经过180 d的生长,其植株数量扩增了20倍以上,生物量(干重)达到(411.09±136.19)g·m-2,不但地上部分形成了对底泥密集覆盖的沉水植被层,而且地下部分在底泥中也形成了发达的根系.对矮慈姑根与茎叶生物量进行对比分析发现,矮慈姑的根冠比高达0.66±0.36,远高于其它沉水植物,表明矮慈姑的根可以抵御底泥中还原态物质的胁迫作用,从而发育出较庞大的根系.矮慈姑生长使得底泥中还原性物质浓度大幅下降,相较初始底泥,矮慈姑根系到达的底泥区域中典型还原物质亚铁(Fe(Ⅱ))和酸挥发性硫化物(AVS)分别下降了92.6%和96.3%.此外,矮慈姑生长也较好地阻控了底泥中氮、磷向上覆水释放,使得上覆水氮、磷维持在较低的浓度范围.上述研究结果首次发现,矮慈姑能够很好地耐受重污染水体中厌氧还原态的底泥并可对其中的主要污染物进行去除,在黑臭河道等重污染水体的生态修复中具有很大的应用潜力,可以作为沉水植被修复的先锋种,是值得进一步开发的野生水生植物资源.
关键词:矮慈姑重污染底泥亚铁AVS生态修复
Tolerance of Sagittaria pygmaea Miq to heavily polluted sediments and its removal of major pollutants
GAO Shuaiqiang1
 , CHEN Zhiyuan1, LI Fengmin2, CHONG Yunxiao1
, CHEN Zhiyuan1, LI Fengmin2, CHONG Yunxiao1
 , LI Huishan1, LI Mei1, LIN Yuejin1, HU Hongying3
, LI Huishan1, LI Mei1, LIN Yuejin1, HU Hongying3 1. College of Resources and Environment, South China Agricultural University, Guangzhou 510642;
2. College of Environmental Science and Engineering, Ocean University of China, Qingdao 266100;
3. School of Environment, Tsinghua University, Beijing 100084
Received 17 December 2018; received in revised from 20 March 2019; accepted 20 March 2019
Abstract: Sagittaria pygmaea Miq is a common macrophyte submerged in paddy fields, yet it has been seldomly studied or applied in water pollution control. This study investigated the growth of Sagittaria pygmaea Miq along with the change of major pollutants in a simulative polluted water body, which was constructed using the anaerobic sediments obtained from atypical black and odorous river. Results showed that Sagittaria pygmaea Miq, especially its root system, has strong tolerance to contaminated sediments. After 180 days of growth, the plant number has increased over 20 times and the biomass (dry weight) has reached (411.09 ±136.19) g·m-2.A dense submerged vegetation layer has formed above-ground covering the sediments, and a developed root system was found in the sediments below ground. A comparative analysis on the biomass of root and leave for Sagittaria pygmaea Miq revealed that the root to shoot ratio has reached 0.66±0.36, which was far greater than that of other submerged plants. It indicated the capability of Sagittaria pygmaea Miq to resist the stress from reducing substances in sediments and to develop huge root systems under such circumstances. The growth of Sagittaria pygmaea Miq could significantly reduce the concentrations of reducing substances in sediments. For instance, compared with the initial state, typical reducing substances such as Fe(Ⅱ) and acidic volatile sulfide (AVS) were lowered by 92.6% and 96.3%, respectively, in sediments reachable by the root system. Meanwhile, the growth of Sagittaria pygmaea Miq also controlled the emission of nitrogen and phosphorus from sediments to overlaying water, maintaining their concentrations in relatively low range. Our study demonstrated, for the first time, that Sagittaria pygmaea Miq could well tolerate the anaerobic sediments in heavily polluted water bodies and remove the major pollutants, possessing great potentials for applications in remediation of ecological systems in black and odorous rivers. Sagittaria pygmaea Miq may be applied as a pioneer species for restoration of submerged vegetation and is a wild aquatic resource worthy of further development.
Keywords: Sagittaria pygmaea Miqheavy polluted sedimentFe(Ⅱ)AVSecological restoration
1 引言(Introduction)利用沉水植物构建沉水植被是进行污染水体生态修复及水质提升的重要措施(卢晓明等, 2008;张萌等, 2010).但在底泥污染较严重的水体, 如黑臭水体中, 沉水植被的构建仍比较困难, 主要原因在于底泥中微生物厌氧代谢产生了大量对根系具有毒害作用的还原态物质, 如硫化氢、亚铁、有机胺等(Koch et al., 1990;Armstrong et al., 1996;Le-yi, 2001).沉水植被修复中常用的苦草、黑藻等种类的根系对这种底泥耐受性比较差(张俊等, 2006;谢贻发等, 2007;许宽等, 2013), 移栽后, 虽然茎叶生物量可以快速增长, 但根系生长易受到抑制, 不能充分发育.而发达的根系是沉水植被稳定发育及发挥水质净化功能的关键因素.首先, 沉水植物主要依靠根固定在底质上, 发达的根系有利于植株抵抗波浪、水流等机械力的拖曳破坏(祝国荣等, 2017);根系发育不充分的沉水植物即使初期能够快速生长, 但由于在底质上锚定作用较弱, 形成的植被稳定性较差, 在暴雨、洪水等干扰下易被整株拔起, 受到毁灭性破坏(卢晓明等, 2008;祝国荣等, 2017).其次, 沉水植物根系可以通过吸收利用、泌氧、刺激根际微生物活性等功能去除积累在底泥中的污染物(Jones et al., 1994;夏劲等, 2012;张雨等, 2018), 进而改善底泥特性, 降低内源污染负荷.因此, 在这些水体中构建稳定的沉水植被, 除了探索底泥改善措施外, 筛选耐受性强的沉水植物、特别是根系发达的种类也非常有必要.
本课题组前期在野外调研中发现, 一些施肥的稻田土壤中有机质、氮、磷含量都比较高, 在水稻耕作的淹水期(土壤淹没于水下), 环境条件与黑臭水体底泥类似, 即厌氧反应也会形成大量的还原物质, 而生长于其中的矮慈姑(Sagittaria pygmaea Miq)能够很好地耐受这种淹水条件, 且植株根系都较发达, 推测其可能具有耐受厌氧还原态底泥的潜力, 因此, 采集矮慈姑并带回实验室进行进一步研究.
矮慈姑隶属泽泻科(Alismataceae)慈姑属(Sagittaria), 为叶片基生的莲座型沉水植物, 植株较矮小, 高度通常在30 cm以下, 利用匍匐根茎或种子进行繁殖, 在我国分布广泛, 是常见的“稻田杂草”(陈家宽, 1989;夏步云等, 1995), 但有关其在水污染防治方面的应用还较少被研究报道.
基于此, 本文以采自重污染水体的底泥为生长基质构建小规模实验系统, 重点分析矮慈姑在其中的生长特性及对其中主要污染物的去除情况, 以期为矮慈姑在污染水体治理与生态修复中的应用提供参考.
2 材料与方法(Materials and methods)2.1 底泥和矮慈姑底泥采自典型黑臭河道广州车陂涌和深圳坪山河老河道段, 其中, AVS、Fe(Ⅱ)等还原性物质和可交换性氨氮、TP等内源污染物含量都比较高(表 1), 属于污染较严重的厌氧还原态底泥(许宽等, 2013;谢瑞桃, 2017).
表 1(Table 1)
| 表 1 实验底泥的特征 Table 1 Characteristics of sediment used in the experiment | ||||||||||||
表 1 实验底泥的特征 Table 1 Characteristics of sediment used in the experiment
| ||||||||||||
矮慈姑采自广东河源东江流域稻田, 带回实验室后利用水稻土(采自华南农业大学校内实验基地水稻田)培养扩增, 然后逐渐加入上述底泥进行3个月的驯化, 直至完全可以在其中生长存活.
2.2 实验系统实验装置采用9个容量为60 L的塑料圆桶, 上口径45 cm, 下口径37 cm, 高52 cm.将采回的新鲜底泥充分搅匀后铺入每个桶底部, 厚度控制在15 cm左右, 铺入前从中随机取6个样作为初始底泥样并于-20 ℃冷冻保存.选取6个桶分别移栽较均匀一致的矮慈姑20株, 移栽的个体为处于旺盛生长期的成株, 每株有4~6直立叶片、4~10条根、1~2条匍匐茎(带有处于萌发状态的新芽), 叶片、根长均为10 cm左右.移栽植株用纯水清洗干净, 然后小心植入实验系统底泥中, 剩余3个桶作为对照.移栽矮慈姑后, 9个桶中先加入10 L自来水(水位10 cm左右), 使得新植入的矮慈姑适应环境条件, 1周后矮慈姑生长较稳定, 再沿筒壁缓慢(避免搅动底泥)加入40 L自来水将水位提升到40 cm, 开始实验.整个装置放于露天环境(华南农业大学校园实验基地), 为模拟华南地区气候条件下污染水体的生态修复情况, 实验期间不再人为补给上覆水, 完全依赖降雨补给.
实验自2017年6月初开始, 于2018年1月初结束, 每个系统每隔7 d取表层10 cm上覆水水样500 mL, 分析测定TP、NH4+-N、叶绿素a.
试验结束后, 用虹吸法缓慢排出9个装置的上覆水(尽量不扰动底泥), 最终至5 cm左右水位.首先对矮慈姑系统中的植物株数进行人工计数; 然后对每个桶底泥进行取样, 取样时在底泥中垂直插入直径10 cm、高15 cm的中空管, 将管内底泥从高到低分为高、中、低3层(每层约5 cm高度)并依次取出, 对其中Fe(Ⅱ)、AVS、可交换性氨氮和TP含量进行测定; 最后随机选取部分矮慈姑植株测量其茎叶和根的长度、数量、鲜重、干重等.
2.3 分析测定方法上覆水中, TP采用钼酸铵分光光度法(GB/T11893—1989)测定, NH4+-N采用纳氏试剂比色法(GB/T7479—1987)测定, 叶绿素a采用乙醇免研法(杨玉珍等, 2011)测定.
底泥中, Fe(Ⅱ)采用邻菲罗啉分光光度法(HJ/T345—2007)测定, AVS采用对氨基二甲基苯胺光度法(GB/T 16489—1996)测定, 可交换性氨氮采用氯化钾溶液提取-分光光度法(HJ 634—2012)测定, TP采用碱熔-钼锑抗分光光度法(HJ632—2011)测定.
2.4 数据处理和统计分析采用WPS Excel 2017和Origin9.0进行数据统计及作图, 采用SPSS 19.0软件中的单因素方差分析(ANOVA)对底泥Fe(Ⅱ)、AVS含量等数据进行差异显著性分析, 并采用Duncan多重比较法对显著性差异进行多重比较, 差异显著水平α=0.05.所有数据以平均值±标准差表示.
3 结果与分析(Results and analysis)3.1 矮慈姑生长特性从茎叶与根系的发育来看, 矮慈姑可以耐受本研究采用的重污染底泥, 并能够利用其中的营养物质大量扩增.经过6个月的生长, 每个矮慈姑系统成株数量都扩增了20倍以上, 达到(400±24)株; 此外, 还有处于生长期的幼苗(高5 cm左右)100~300株.植株(高5 cm以上)密度达到(4327.23±1433.57)株·m-2, 生物量(干重)达到(411.09 ±136.19) g·m-2, 矮慈姑生长使得底泥几乎完全被覆盖, 目测覆盖度达到90%~100%(图 1).
图 1(Fig. 1)
 |
| 图 1 矮慈姑实验系统照片 Fig. 1Pictures of Sagittaria pygmaea Miq |
矮慈姑根在底泥中也得到了充分发育, 并形成了发达的根系层.实验期间新生植株根的数量、长度与初始移栽的植株没有显著差别(p < 0.05), 每株仍有4~10条根, 根长在(10.84±1.70) cm左右(图 1);根都集中分布在底泥表层7 cm范围内, 少部分可达10 cm深度, 因此, 大量扩增的矮慈姑植株在底泥中形成了密集的根系层, 其生物量(干重)达到(161.99±53.66) g·m-2.植株根冠比(根和茎叶干重比)和长度比分别为0.66±0.36、1.16±0.26, 在沉水植物中属于比较高的范围(表 2), 特别是根长, 甚至超过茎叶长.常见沉水植物种类通常为茎叶较高大的植株, 即使不受胁迫, 根生物量所占比重也较低.矮慈姑显然与这些种类不同, 既能使底泥中含有较高浓度的AVS、Fe(Ⅱ)等物质(表 1), 还能把更多的生物量分配到与底泥接触的根系中, 这表明矮慈姑根系能够抵御这些还原态物质的胁迫作用, 从而耐受与适应重污染的底泥.
表 2(Table 2)
| 表 2 不同沉水植物的根冠比和长度比 Table 2 The root cap ratio and length ratio of submerged plants | ||||||||||||||||||||||||
表 2 不同沉水植物的根冠比和长度比 Table 2 The root cap ratio and length ratio of submerged plants
| ||||||||||||||||||||||||
3.2 底泥典型还原物质Fe(Ⅱ)和AVS变化矮慈姑的生长使得底泥中Fe(Ⅱ)和AVS含量与分布发生了较大变化(图 2).与初始底泥相比, 矮慈姑系统上部底泥(0~5 cm)和中部底泥(5~10 cm)的Fe(Ⅱ)和AVS含量都显著降低, 上部底泥的Fe(Ⅱ)和AVS含量分别降低92.6%和96.3%, 中部底泥的Fe(Ⅱ)和AVS含量分别降低79.9%和56.6%;下部底泥(5~10 cm)的Fe(Ⅱ)含量变化不显著, 但AVS含量出现显著增加.而对照系统中, 底泥各部分Fe(Ⅱ)和AVS含量都未出现下降, 上部和中部底泥与初始接近, 底部底泥中出现显著增加.
图 2(Fig. 2)
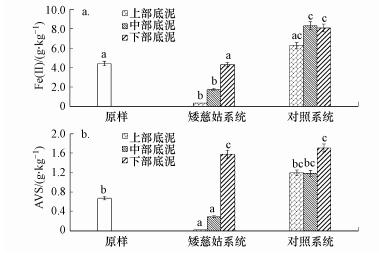 |
| 图 2 矮慈姑系统和对照系统底泥中Fe(Ⅱ)(a)和AVS(b)的变化 (图中数值为平均值±标准误, 图柱上方相同字母表示差异不显著(p>0.05), 不同字母表示显著差异(p < 0.05), 下同) Fig. 2The changes in concentrations of ferrous iron (a) and AVS (b) in sediment of Sagittaria pygmaea Miq system and control system |
Fe(Ⅱ)和AVS是重污染水体底泥中主要的还原态物质, 主要以固态形式存在, 可以被氧或硝酸盐氮等氧化去除(黄海彬等, 2018).实验期间对照系统有单细胞蓝绿藻生长, 由于大气复氧和藻类、矮慈姑的光合作用, 两类系统上覆水的溶解氧都达到6 mg·L-1左右, 但上覆水中的溶解氧较难以通过单纯的扩散向底泥间隙水转移, 而固态Fe(Ⅱ)和AVS也不可能向上覆水扩散, 因此, 对照系统底泥中两种物质都没有出现下降, 而它们在矮慈姑系统中下降则可能是其根系分泌的氧氧化所致.水生植物通常可以将地上部分光合作用产生的氧转移到根部, 并释放到根表, 维持根际微环境处于氧含量较高的氧化状态(夏劲等, 2012).上部和中部底泥是矮慈姑根系集中分布区域, 根据矮慈姑根直径和长度, 可以估算每株根面积为(5.4±3.5) cm2, 因此, 在根系的密集分布层, 大量底泥颗粒可以直接处于根表氧化环境内, 其中的Fe(Ⅱ)和AVS被根释放出的氧逐渐氧化.但水生植物根系分泌氧扩散距离非常短, 形成的稳定氧化层仅限于根表 0.1 cm内(欧媛, 2015), 因此, 根系未能到达的下部底泥中Fe(Ⅱ)和AVS无法被氧化去除.而且由于部分根系衰亡, 释放的有机物向下沉降引起的微生物厌氧代谢, 从而导致更多的Fe(Ⅱ)和AVS产生, 这可能是下部底泥中两种物质出现含量升高的原因.
3.4 上覆水主要水质指标变化矮慈姑在水底泥界面的大量扩增也会延缓和阻控底泥中磷和氨氮的释放, 使得上覆水氮、磷维持在较低的浓度范围.本实验各系统中上覆水除了初始加入的自来水外, 以自然降雨为主, 其中的氮、磷含量都比较低, 但所采用底泥中含有丰富的磷和可交换性氨氮, 它们与Fe(Ⅱ)和AVS不同, 更多以离子形式吸附在底泥颗粒上, 具有迁移性, 可向上覆水释放, 通常被看作污染水体内源污染物(张丽萍等, 2003;杨艳等, 2018);而实验期间出现多次暴雨导致底泥颗粒上浮, 也加速了其中磷和氨氮的释放(Reddy et al., 1996;秦伯强等, 2005).本研究中, 氨氮和磷的释放使得实验初期所有系统上覆水的TP、NH4+-N浓度升高, 进而导致单细胞蓝绿藻类生长, 表现为叶绿素a浓度也逐渐升高(图 3).但100 d之后, 对照系统上覆水TP、NH4+-N和叶绿素a浓度继续升高, 矮慈姑系统则缓慢下降, 两者浓度水平出现显著差别(p < 0.05).整个实验期间, 对照系统TP、NH4+-N、叶绿素a浓度平均值分别为1.29 mg·L-1、2.14 mg·L-1、301.56 mg·m-3, 矮慈姑系统则分别为0.2 mg·L-1、0.46 mg·L-1、120.46 mg·m-3.可见, 植入矮慈姑系统, 随着株数扩增, 其对底泥表面的覆盖越来越高, 也使得更多的氮、磷吸收到矮慈姑体内, 从而延缓了底泥中磷和氨氮的释放, 较好地控制了上覆水水质的变化.
图 3(Fig. 3)
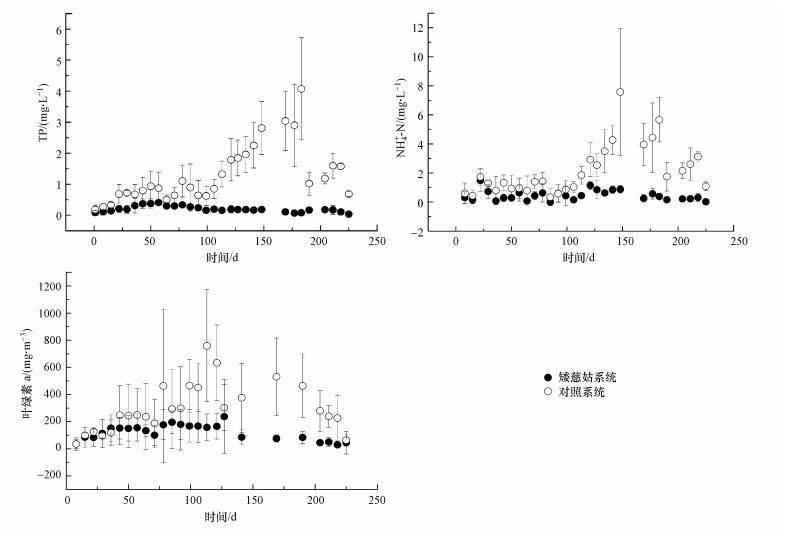 |
| 图 3 矮慈姑系统和对照系统上覆水总磷(a)、氨氮(b)和叶绿素a(c)的变化 Fig. 3The changes of total phosphorus(a), ammonia nitrogen(b) and chlorophyll a(c) in overlying water of Sagittaria pygmaea Miq system and control system |
3.5 底泥氮、磷含量的变化矮慈姑生长也使得底泥中NH4+-N和磷被去除, 其中, 氨氮的去除率更高.与初始底泥相比, 矮慈姑系统上、中、下部底泥中NH4+-N含量分别下降了84.4%、72.5%和34.6%, 对照系统只有上部底泥NH4+-N含量出现大幅下降, 中部和下部底泥中NH4+-N含量反而有所上升(图 4).由于对照系统实验期间上覆水中NH4+-N浓度出现大幅升高, 且有大量单细胞蓝绿藻类生长, 因此, 上部底泥中NH4+-N降低应该是向上覆水释放的结果.矮慈姑系统上覆水中NH4+-N浓度一直较低, 表明释放较少, 因此, 底泥中NH4+-N降低更多是矮慈姑生长吸收和硝化反硝化所致.矮慈姑生物体氮含量约为3.37%时, 结合矮慈姑的密度可以计算出矮慈姑生长需要的氮量约为13.85 g·m-2, 因此, 植株扩增需要吸收大量氮来满足生长.而NH4+-N是沉水植物可以直接吸收利用的氮形式, 因此, 底泥部分NH4+-N被转移到矮慈姑体内;此外, 由于根系氧的释放, 部分NH4+-N有可能会被氨氧化菌氧化形成硝酸盐氮, 在微生物作用下硝酸盐氮可以将硫根离子和Fe(Ⅱ)氧化, 自身被反硝化为氮气, 因此, 部分NH4+-N及AVS、Fe(Ⅱ)则可能是通过这种硝化反硝化作用去除(吴晓磊, 1995).
图 4(Fig. 4)
 |
| 图 4 矮慈姑系统和对照系统底泥中可交换性氨氮(a)和磷(b)的去除 Fig. 4The changes of ammonia nitrogen(a) and phosphorus (b)in sediment of Sagittaria pygmaea Miq system and control system |
各系统底泥中磷的去除也在30%以上, 其中, 矮慈姑系统的去除率平均值高于对照系统, 但差异性不显著(p < 0.05).对照系统磷的降低应该也是向上覆水释放并被藻类吸收利用的结果, 矮慈姑系统中释放较少, 磷的降低更多是被矮慈姑生长利用的结果.本研究采用的底泥属于富磷底泥, 含量高于氨氮, 磷在实验系统中的去除途径主要是向矮慈姑或藻类转移, 但植物等对磷的需求远小于氮, 因而其去除率也比较低.
4 讨论(Discussion)4.1 矮慈姑对厌氧还原态底泥的耐受及适应性机制已有研究表明, 除了厌氧还原产物以外, 底泥中丰富的营养物质也不利于沉水植物根系的发育(Le-yi, 2001; Zhu et al., 2014).但在本研究中, 矮慈姑在富含这两类物质的重污染底泥中发育出了密集的根系, 并有着较高的根冠比, 这是它区别于其它沉水植物的重要特性.为什么矮慈姑的根未受到影响?这可能与矮慈姑生长环境有关, 与苦草等常见沉水植物不同, 矮慈姑是沼生的矮小型沉水植物, 随着沼泽被逐渐开发为稻田, 它也逐渐适应了稻田生境条件, 成为稻田杂草.尽管稻田淹水期产生的厌氧还原态物质的胁迫作用并不利于根系发育, 但作为稻田中杂草, 首先面临较强的除草压力, 其次是与水稻营养的竞争.因为传统耕作中除草主要依靠机械力, 而发达的根系可以使得矮慈姑植株锚定能力增强, 不会被轻易拨出; 水稻是较高大的农作物, 根系发达且具有较强的营养吸收能力, 矮慈姑根向下伸展可以避开与水稻根系对表层土壤中营养的竞争.因此, 在这两种生存压力作用下, 矮慈姑可能进化出某种适应机制抵抗厌氧还原态物质的胁迫, 使其根生长不受影响.较强的泌氧能力有助于还原性物质氧化, 林剑华等(2014)研究发现, 不同湿地植物根系泌氧能力不同, 这与根系结构有关, 据此推测, 矮慈姑有可能是通过发育出特殊根系结构使其泌氧能力更强.此外, 硝酸盐氮也可以氧化AVS等还原态物质(陈磊等, 2013), 其扩散性要好于溶解氧, 而底泥中往往有丰富的氨氮, 在有氧条件下硝化细菌可以将氨氧化为硝酸盐氮, 矮慈姑根际微环境是否更适宜氨氧化菌生长, 进而促进硝酸盐氮生成?抑或是其它的机制, 值得进一步探讨.
4.2 矮慈姑在重污染水体生态修复中应用重污染底泥中大量的还原态物质Fe(Ⅱ)和AVS不仅对植物根系生长具有胁迫性, 其耗氧特性也影响底栖水生动物的生存(Le-yi, 2001, 黄海彬等, 2018), 同时也是水体中令人不悦的臭味和颜色的产生源(陈磊等, 2013).采用物理或化学方法进行原位消除往往需要持续的机械曝气或投加氧化性物质, 投入较大.两类物质在矮慈姑植被发达根系作用下被大量削减为此类污染底泥治理提供了一条潜在生态修复途径.此外, 矮慈姑形成植被与其它沉水植物一样, 对底泥形成密集覆盖, 这样使得其不易被扰动上浮, 从而有力地改善了水底泥界面环境, 有助于上覆水水质的提升, 因此, 矮慈姑在重污染水体生态修复中具有很大的应用潜力.
目前许多城市河道属于污染严重的黑臭水体, 但这些河道同时具有泄洪功能, 汛期会接受上游和周边区域大量排水, 水位和水流速度变化较剧烈频繁, 对这种变化具有较强的适应能力才能使沉水植被稳定发育.矮慈姑较低矮的株高及发达根系使其锚定作用较强(祝国荣等, 2017), 相对苦草等较高大的沉水植物, 不易受到水力条件剧烈变化的冲击, 更适合这类水体的生态修复.
苦草等常用沉水植物种类通常具有较强的化感抑藻特性, 形成的沉水植被能有效地抑制单细胞蓝绿藻生长, 进而保持上覆水清澈透明, 提升水体景观观赏价值(卢晓明等, 2008).但笔者以前的研究曾经发现(汤仲恩等, 2007), 与苦草等高大型沉水植物相比, 矮慈姑的化感抑藻特性较差.本研究实验过程中也发现, 尽管矮慈姑植被形成使得底泥中氮、磷释放减少, 但仍有少量氮、磷释放, 致使单细胞蓝绿藻类生长, 实验期间晴天光照较强时藻类生长曾经使得上覆水较混浊.因此, 对于水体生态修复和水质的进一步提升, 矮慈姑可以作为先锋种类改善底泥的环境条件, 其后再抚育高大型沉水植被对藻类生长进行竞争性抑制, 提升水质至清澈透明状态.但由于矮慈姑的自然生长环境条件是稻田等浅水沼泽, 较少有高大型沉水植物生长, 在污染水体修复中两者是否能够进行植被演替仍需要进一步研究探讨.
5 结论(Conclusions)1) 矮慈姑在以重污染底泥构建的模拟系统中能够大量繁殖扩增, 在华南地区夏、秋、冬6个月生长期, 植株数量扩增20倍以上, 生物量(干重)达到(411.09 ±136.19)g·m-2, 形成对底泥密集覆盖的沉水植被层, 对重污染底泥有很强的适应性.
2) 矮慈姑可以在底泥中形成发达的根系, 植株根长平均值达到10.84 cm, 根冠比为0.66±0.36, 根系与茎叶长度比为1.16±0.26, 远高于其他沉水植物, 表明其根系能够抵御底泥中较高浓度还原态物质的胁迫作用.
3) 慈姑生长可使底泥中典型还原态物质被有效削减, 根系集中分布区域的Fe(Ⅱ)和AVS含量分别下降了92.6%和96.3%, 从而有力地改善了污染底泥特性.
4) 矮慈姑生长使得模拟系统上覆水维持了较好的水质, 实验期间对照系统上覆水TP、NH4+-N、叶绿素a平均浓度分别达到1.29 mg·L-1、2.14 mg·L-1、301.56 mg·m-3, 而矮慈姑系统分别控制在0.2 mg·L-1、0.46 mg·L-1、120.46 mg·m-3, 远低于对照系统, 通过对底泥覆盖和植株吸收利用, 矮慈姑系统有效地阻控了污染底泥中内源污染物氮、磷的释放.
5) 矮慈姑在黑臭水体等重污染水体生态修复中具有很大的应用潜力, 可以作为沉水植被修复的先锋种, 是值得进一步开发的野生水生植物资源.
参考文献
| Armstrong J, Areen Z F, Armstrong W. 1996. Phragmites die-back:Sulphide-and acetic acidinduced bud and root death, lignifications, and blockages within aeration and vascular systems[J]. New Phytologist, 134: 601–614.DOI:10.1111/nph.1996.134.issue-4 |
| 陈家宽. 1989. 中国慈姑属的系统与进化植物学研究[M]. 武汉: 武汉大学出版社: 27–31. |
| 陈磊, 王凌云, 刘树娟, 等. 2013. 硝酸钙对深圳河底泥臭味及生物化学特性的影响[J]. 哈尔滨工业大学学报, 2013, 45(6): 107–113. |
| 陈德元, 谢贻发, 刘正文. 2016. 生长不同根冠比沉水植物的实验水体对磷输入的响应比较研究[J]. 应用与环境生物学报, 2016, 22(5): 747–751. |
| 符辉, 钟家有, 袁桂香, 等. 2015. 沉水植物功能性状变异的来源与结构以微齿眼子菜(Potamogeton maackianus)为例[J]. 湖泊科学, 2015, 27(3): 429–435. |
| 高汾, 张毅敏, 杨飞, 等. 2017. 水位抬升对4种沉水植物生长及光合特性的影响[J]. 生态与农村环境学报, 2017, 33(4): 341–348. |
| 黄海彬, 闫荣, 金昌谷, 等. 2018. 黑臭水体沉积物中耗氧指标的垂向分布特征及其耗氧能力研究[J]. 环境污染与防治, 2018, 40(8): 927–930. |
| 焦立新, 王圣瑞, 金相灿. 2009. 穗花狐尾藻对铵态氮的生理响应[J]. 应用生态学报, 2009, 20(9): 2283–2288. |
| Koch M S, MendelssohnI A, McKee K L. 1990. Mechanism for the hydrogen sulfide induced growth limitation in wetland macrophytes[J]. Limnology & Oceanography, 35: 399–408. |
| Reddy K R, Fisher M M, Ivanoff D. 1996. Resuspension and diffusive flux of nitrogen and phosphorus in a hypereutrophic lake[J]. Journal of Environment Quality, 25(2): 363–371. |
| 林剑华, 杨扬, 李丽, 等. 2014. 8种湿地植物的生长状况及泌氧能力[J]. 湖泊科学, 2014, 27(6): 1042–1048. |
| 李裕元, 李希, 吴金水, 等. 2018. 绿狐尾藻区域适应性与生态竞争力研究[J]. 农业环境科学学报, 2018, 37(10): 2252–2261.DOI:10.11654/jaes.2018-1036 |
| 刘晓培, 张饮江, 李岩, 等. 2012. 矮壮素对苦草矮化特征及生理指标的影响[J]. 生态学杂志, 2012, 31(10): 2561–2567. |
| 刘伟龙, 胡维平, 谷孝鸿. 2007a. 太湖马来眼子菜(Potamogeton malaianus)生物量变化及影响因素[J]. 生态学报, 2007a, 27(8): 3324–3333. |
| 刘伟龙, 胡维平, 陈桥. 2007b. 不同底质和透明度下马来眼子菜的表型可塑性研究[J]. 生态环境, 2007b, 16(2): 363–368. |
| 卢晓明, 宋英伟, 黄民生, 等. 2008. 上海城区中小河道沉水植被恢复的瓶颈问题及可行性分析[J]. 水资源保护, 2008, 4(4): 26–30.DOI:10.3969/j.issn.1004-6933.2008.04.007 |
| Meizer A. 1999. Aquatic macrophytes as tools for lake management[J]. Hydrobiologia, 395(396): 181–190. |
| Le-yi N I. 2001. Stress of fertile sediment on the growth of submersed macrophytes in eutrophic waters[J]. Actahydrobiologica sinica, 25(4): 399–405. |
| 欧媛.2015.典型湿地植物根系泌氧对根际氧化还原环境的影响[D].南京: 南京师范大学http://cdmd.cnki.com.cn/Article/CDMD-10319-1015430365.htm |
| 秦伯强, 朱广伟, 张路, 等. 2005. 大型浅水湖泊沉积物内源营养盐释放模式及其估算方法——以太湖为例[J]. 中国科学D辑:地球科学, 2005, 35(增刊Ⅱ): 33–44. |
| Reddy K R, Patrick J R W H, Lindau C W. 1989. Nitrification-denitrification at the plant root-sediment interface in wetlands[J]. Limnology and Oceanography, 34(6): 1004–1013.DOI:10.4319/lo.1989.34.6.1004 |
| Sanderson P L, Armstrong W. 1980. Phytotoxins in periodically waterlogged forest soil[J]. Soil Science Journal, 31: 643–653.DOI:10.1111/ejs.1980.31.issue-4 |
| Schutten J, Dainty J, Davy A J. 2005. Root anchorage and its significance for submersed plants in shallow lakes[J]. Journal of Ecology, 93: 556–571.DOI:10.1111/jec.2005.93.issue-3 |
| 汤仲恩, 种云霄, 朱文玲, 等. 2007. 几种观赏型沉水植物对富营养化蓝绿藻类的抑制作用[J]. 生态环境, 2007, 16(6): 1637–1642.DOI:10.3969/j.issn.1674-5906.2007.06.011 |
| 吴晓磊. 1995. 人工湿地废水处理机理[J]. 环境科学, 1995, 16(3): 83–86.DOI:10.3321/j.issn:0250-3301.1995.03.024 |
| 夏步云, 杨志海, 李建华, 等. 1995. 矮慈姑的田间消长规律和防除途径[J]. 杂草科学, 1995, 2: 1–3. |
| 夏劲, 王国祥, 王文林, 等. 2012. 慈姑(Sagittaria trifolia)根系泌氧特征[J]. 生态与农村环境学报, 2012, 28(4): 422–426.DOI:10.3969/j.issn.1673-4831.2012.04.016 |
| Xiao J B, Wang H M, Chu S Y, et al. 2013. Dynamic remediation test of polluted river water by Eco-tank system[J]. Environmental Technology, 34(4): 553–558.DOI:10.1080/09593330.2012.704405 |
| 谢贻发, 李传红, 刘正文, 等. 2007. 基质条件对苦草(Vallisneria natans)生长和形态特征的影响[J]. 农业环境科学学报, 2007, 26(4): 1269–1272.DOI:10.3321/j.issn:1672-2043.2007.04.013 |
| 谢瑞桃.2017.黑臭河流底泥在绿化种植中的资源化利用研究[D].安徽: 安徽工业大学.1-102 |
| 许宽, 刘波, 王国祥, 等. 2013. 苦草(Vallisneria spiralis)对城市缓流河道黑臭底泥理化性质的影响[J]. 环境科学, 2013, 34(7): 2642–2649. |
| 徐恩兵, 余平, 朱志强. 2016. 吲哚乙酸和矮壮素对苦草种子萌发和矮化特征的影响[J]. 安徽农业科学, 2016, 44(36): 41–43, 51.DOI:10.3969/j.issn.0517-6611.2016.36.015 |
| 杨玉珍, 夏未铭, 杨瑾, 等. 2011. 水体中叶绿素a测定方法的研究[J]. 中国环境监测, 2011, 27(5): 24–27.DOI:10.3969/j.issn.1002-6002.2011.05.006 |
| 杨娇, 王智, 厉恩华, 等. 2015. 滇池不同底泥条件下黑藻和金鱼藻的生长生理特征[J]. 湿地科学, 2015, 13(4): 430–436. |
| 杨艳, 邓伟明, 何佳, 等. 2018. 溶解氧对滇池沉积物氮磷释放特征影响研究[J]. 环境保护科学, 2018, 44(5): 36–41. |
| 袁龙义, 李守淳, 李伟, 等. 2007. 水深对刺苦草生长和繁殖策略的影响研究[J]. 江西师范大学学报(自然科学版), 2007, 31(2): 156–160.DOI:10.3969/j.issn.1000-5862.2007.02.013 |
| 张丽萍, 袁文权, 张锡辉. 2003. 底泥污染物释放动力学研究[J]. 环境污染治理技术与设备, 2003, 4(2): 22–26. |
| 左进城, 赵晓雨, 康铭杨, 等. 2014a. 底质掩埋对苦草种子成苗和幼苗存活的影响[J]. 广东农业科学, 2014a, 22(11): 39–43. |
| 左进城, 李秀玲, 张鹏, 等. 2014b. 吲哚乙酸和激动素对苦草种子萌发和幼苗生长的影响[J]. 北方园艺, 2014b(23): 53–56. |
| 张萌, 曹特, 过龙根, 等. 2010. 武汉东湖水生植被重建及水质改善试验研究[J]. 环境科学与技术, 2010, 33(6): 154–159. |
| 张俊, 朱伟, 操家顺, 等. 2006. 水体底质异质性对沉水植物生长的影响[J]. 水资源保护, 2006, 22(4): 44–46.DOI:10.3969/j.issn.1004-6933.2006.04.012 |
| 张雨, 晏再生, 吴慧芳, 等. 2018. 沉水植物苦草(Vallisneria natans)对多环芳烃污染沉积物的修复作用[J]. 湖泊科学, 2018, 30(4): 1012–1018. |
| 祝国荣, 张萌, 王芳侠, 等. 2017. 从生物力学角度诠释富营养化引发的水生植物衰退机理[J]. 湖泊科学, 2017, 29(5): 1029–1042. |
| Zhu G R, Cao T, Zhang M, et al. 2014. Fertile sediment and ammonium enrichment decrease the growth and biomechanical strength of submersed macrophyte Myriophyllum spicatum in an experiment[J]. Hydrobiologia, 727: 109–120.DOI:10.1007/s10750-013-1792-2 |
