 , 马华
, 马华
 , 刘艳, 潘雨, 黄丽萍
, 刘艳, 潘雨, 黄丽萍重庆大学城市建设与环境工程学院, 三峡库区生态环境教育部重点实验室, 重庆 400045
收稿日期: 2018-10-12; 修回日期: 2018-12-28; 录用日期: 2018-12-28
基金项目: 国家自然科学基金(No.2140715);中央高校基本科研业务费专项(No.106112016CDJXY210001,106112017CDHQJ218845)
作者简介: 黄娟(1994-), 女, E-mail:h285451750@qq.com
通讯作者(责任作者): 马华, E-mail:water_mh@126.com
摘要: 碳质纳米材料(Carbon Nanomaterials,CNMs)因具有独特的电学及光学等性质而引起了人们的广泛关注,从而被大量使用并释放到环境中,进而影响生态系统环境及生物化学过程,但目前有关CNMs与环境微生物相互作用的研究鲜见报道.因此,本文研究了枝孢菌KR14(Cladosporium sp.)与3种CNMs(单壁碳纳米管(SWCNTs)、石墨烯(Graphene)和氧化石墨烯(GO))的相互作用.结果表明,CNMs的加入促进了3种非特异性酶(漆酶、锰过氧化物酶和木质素过氧化物酶)活性增加,其中,对锰过氧化物酶(MnP)活性的促进作用最为显著,18 d最高增加26.1%.在3种类型的CNMs中,SWCNTs对MnP活性刺激最佳,GO最弱.木质素降解实验和电化学分析表明,CNMs可作为电子导体提高真菌胞外电子传递效率,进而提高KR14对木质素的降解.X射线光电子能谱(XPS)结果表明,除GO外,SWCNTs和石墨烯的氧碳比(O/C)均上升,二者表面发生变化.拉曼光谱(Raman)和傅立叶变换红外光谱(FTIR)结果表明,SWCNTs的ID/IG显著提高,无序性增加;石墨烯出现2D峰,即与KR14相互作用后有一定程度堆叠;KR14可引起CNMs结构转变.本研究结果有助于深入理解和评价环境中CNMs与真菌之间的相互作用关系及CNMs对真菌降解木质素和环境碳循环的影响.
关键词:碳质纳米材料枝孢菌酶活降解
The interaction between carbonaceous nanomaterials(CNMs) and the fungi Cladosporium sp.
HUANG Juan
 , MA Hua
, MA Hua
 , LIU Yan, PAN Yu, HUANG Liping
, LIU Yan, PAN Yu, HUANG Liping Key Laboratory of Three Gorges Reservoir Region's Eco-Environment, Ministry of Education, Urban Construction and Environmental Engineering, Chongqing University, Chongqing 400045
Received 12 October 2018; received in revised from 28 December 2018; accepted 28 December 2018
Abstract: Carbon nanomaterials(CNMs) have attracted extensive attention due to their unique electrical and optical properties, while they may affect ecosystem environment and biochemical processes when released into the environment. Little research has been done on the interactions between CNMs and environmental microbes. Here we investigated the interaction between the fungi Cladosporium sp.(KR14) and three CNMs(single-walled carbon nanotubes, graphene and graphene oxide). Results showed that the presence of CNMs promoted the activities of three non-specific enzymes(laccase, manganese peroxidase and lignin peroxidase), and the enzyme activity of manganese peroxidase increased significantly by 26.1% in 18 days. SWCNTs stimulated MnP activity most greatly among the three types of CNMs. Lignin degradation experiments and electrochemical analysis indicated that CNMs acted as an electron conductor to enhance the extracellular electron transfer of fungi and improve the degradation of lignin by KR14. Results of X-ray photoelectron spectroscopy(XPS) show that for SWCNTs and graphene the O/C increased while for GO the O/C decreased. Raman and Fourier transform infrared spectroscopy results show that ID/IG of SWCNTs increased, meaning that their disorder increased. The appearance of 2D peaks of graphene probably resulted from a certain degree of stacking after interaction, indicating that KR14 caused the changes of CNMs surface structure. Our results contribute to the understanding of the interaction between CNMs and fungi in the environment and the effects of CNMs on fungal degradation of lignin and environmental carbon cycle.
Keywords: carbon nanomaterialsCladosporium sp.enzyme activitiesdegradation
1 引言(Introduction)碳质纳米材料(CNMs)出现短短30年便在各个领域及工程中得到快速发展.由于其独特的机械、电子和生物性质使得CNMs大量运用于生物传感器(Mauter et al., 2008;Seo et al., 2015;Zhu, 2017)、生物医(Malarkey et al., 2007)和药物传输(Stancu et al., 2014)等领域.CNMs的输出会给环境和人类带来潜在的影响, 但有关其进入环境后对生态环境和人类的毒性研究相对较少.碳纳米结构(Carbon Nanostructures, CNSs)包括富勒烯(Fullerene)、碳纳米管(Carbon nanotubes, CNT)、石墨烯(Graphene)和类金刚石碳(diamond-like carbon, DLC)等(Ahmed et al., 2017), 其中, 碳纳米管和石墨烯被大量研究和使用.研究表明, 石墨烯是由碳原子通过sp2杂化轨道紧密排列组成的六边形蜂窝状二维晶体平面结构(赵克利等, 2018), 碳纳米管是通过压制石墨烯片形成圆柱形(Zhang et al., 2013).对于通过工业途径大量排放到环境中的碳纳米管和石墨烯, 其降解途径主要依赖于生物降解及垃圾填埋(Klaine et al., 2008).
微生物对CNMs的生物降解主要是通过微生物及其释放酶系进行.研究表明, 辣根过氧化物酶(HRP)(Allen et al., 2008;2009;Flores et al., 2014)和中性粒细胞髓过氧化物酶(Kagan et al., 2010;Kurapati et al., 2015)在有H2O2存在时, 可通过产生不稳定自由基降解碳纳米管.此外, 作为环境中重要的酶, 漆酶(laccase, Lac)、木质素过氧化物酶(Lignin peroxidase, LiP)和锰过氧化物酶(Manganese peroxidases, MnP)同样能转化和降解CNMs.除此之外, 还可利用细菌进行CNMs降解.例如, You等(2017)使用Mycobacterium. vanbaalenii进行了多壁碳纳米管的微生物转化研究;Zhang等(2013)利用细菌群落降解多壁碳纳米管, 并通过测量14CO2释放量确定其降解能力;Gloria等(2016)通过纯化来自Sparassis latifolia mushroom的木质素过氧化物酶进行单壁碳纳米管的氧化生物降解, 并确定其降解能力;Raghuraj等(2016)通过从土壤中分离纳米材料抗性细菌, 研究微生物介导的多壁碳纳米管的生物降解, 并提出多壁碳纳米管的生物转化是由抗性细菌介导的氧化过程, CNMs能通过改变酶的二级结构以增加或降低酶活性(Chen et al., 2017).相比于细菌, 对环境中广泛存在的真菌与CNMs之间作用关系的研究却较少, 真菌转化SWCNT的程度和在CNMs存在下释放酶活的能力尚不明确.
此外, 木质素作为自然界中丰富的可再生资源, 具有极高的潜在价值, 考虑到真菌对环境木质素的高效转化降解特性及对环境碳循环的重要性, 有必要研究CNMs存在时对真菌降解木质素特性的影响.研究表明, 被排放到环境中的木质素降解缓慢, 成为自然界碳循环的重要限速步骤(Longe et al., 2016).由于资源紧缺, 木质素降解目前成为研究热点之一.Fnu等(2016)采用真菌、细菌和纯化漆酶对木质素进行生物降解, 结果表明, 相较细菌而言, 真菌能更有效地矿化木质素.环境中木质素的完全降解被认为是真菌和细菌共同作用的结果, 其中, 真菌起主要作用(李海涛等, 2010), 特别是真菌可释放可降解木质素酶系, 对木质素降解起到了关键作用.而目前有关环境中CNMs的存在对真菌及CNMs自身降解的影响机理却不清楚, 对于CNMs如何影响木质素的降解也还未明确, 而开展这方面的研究对于理解CNMs潜在影响环境碳循环过程具有重要的意义.
因此, 本研究在CNMs存在的情况下, 通过测定总蛋白含量及胞外酶活性分析CNMs对环境中广泛存在的真菌枝孢菌Cladosporium sp.本身释放酶能力及已释放胞外酶活性的影响, 并以木质素作为底物评估CNMs对真菌降解有机物的影响, 并通过电化学检测分析CNMs影响降解的电化学机理.同时, 利用XPS、Raman和FTIR对CNMs进行结构表征, 分析真菌对CNMs的作用, 从而进一步分析二者的相互影响, 以深入理解CNMs与真菌之间的相互作用及对真菌降解木质素的影响.
2 材料与方法(Materials and methods)2.1 菌种选择与培养2.1.1 菌种本研究所使用的菌种为从德国淡水湖Stechlin湖中分离纯化后得到的真菌, 经18S rDNA基因测序及在NCBI上进行blast比对, 鉴定为枝孢菌Cladosporium sp., 并将其命名为KR14.
2.1.2 培养基及培养方法种子培养基:蛋白胨10 g·L-1, 氯化钠10 g·L-1, 酵母提取物5 g ·L-1, 天然pH.
混合发酵培养基:葡萄糖2.0 g·L-1, 七水硫酸铁0.1 g·L-1, 氯化钙0.02 mg·L-1, 硫酸锌0.5 mg·L-1, 维生素B12 0.5 mg ·L-1, 酒石酸钠0.05 g·L-1, 磷酸二氢钾0.2 g·L-1, 七水硫酸镁0.1 g·L-1, 加入酒石酸钠缓冲液(pH = 4.5)调节pH至4.7.
将生长在PDA培养基上的5日龄的KR14接种于种子培养基中, 用于产生孢子, 形成孢子液.接种后的培养基置于摇床中, 在转速150 r·min-1、温度25 ℃下培养72 h.将产生的孢子液以1/10(V/V)的接种量接种于混合发酵培养基中, 用于产酶.为研究不同类型CNMs对KR14产酶的影响, 在产酶培养基中接入不同类型CNMs:单壁碳纳米管(SWCNT, 30 mg·L-1)、石墨烯(Graphene, 30 mg·L-1)、氧化石墨烯(GO, 30 mg·L-1), 未加入CNMs为空白.在25 ℃、150 r·min-1下振荡培养, 每48 h取上清液测定.另取均存在30 mg·L-1 3种CNMs的培养基, 加入2 g·L-1木质素作为降解底物测定其去除率.上述实验均设置3个平行.
2.2 酶活、总蛋白及木质素去除率测定将取出的上清液于室温下以离心力10000×g离心10 min, 上清液用于酶活、总蛋白含量及木质素去除率测定.
漆酶(Lac)测定:以ABTS为底物测定漆酶酶活.3 mL反应体系中, ABTS终浓度为1 mmol·L-1, 醋酸-醋酸钠缓冲液(pH = 4.5)终浓度为20 mmol·L-1, 上清液100 μL.使用光谱仪(Maya 2000, Ocean Optics, U.S.)在室温下测定前3 min反应体系在420 nm(ε = 36000 L·mol-1·cm-1)处紫外吸光度值的变化.
锰过氧化物酶(MnP)测定:3 mL反应体系中, 包含终浓度为0.5 mmol·L-1的硫酸锰、50 mmol·L-1的酒石酸钠缓冲(pH = 4.5), 上清液100 μL, 混合后加入0.4 mmol·L-1过氧化氢启动反应.室温下使用Maya 2000光谱仪测定前2 min反应体系在240 nm处吸光度值的变化.
木质素过氧化物酶(LiP)测定:以藜芦醇(VA)作为底物, 3 mL反应体系中, 包含终浓度为2 mmol·L-1的藜芦醇、50 mmol·L-1的酒石酸钠缓冲(pH = 3), 上清液100 μL, 混合后加入0.4 mmol·L-1过氧化氢启动反应.室温下使用Maya 2000测定前2 min反应体系在310 nm处吸光度的变化.
定义每分钟催化1 μmol底物所需酶量为一个酶活单位(U·L-1), 酶活力计算公式如下所示:
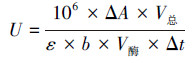 | (1) |
蛋白含量测定:采用BSA法测定总蛋白含量, 使用Thermo公司生产的PierceTM BCA蛋白定量分析试剂盒.
木质素去除率测定:取部分上清液稀释20倍后测定280 nm处吸光度值, 通过木质素浓度及吸光度的标准曲线计算木质素浓度, 并按照公式(2)计算降解率.
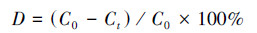 | (2) |
2.3 碳纳米材料的XPS、Raman及FTIR表征将经过KR14作用18 d后的CNMs离心并倾去上清液, 再用超纯水洗涤4~5次, 以洗去表面培养基组分及部分真菌, 对CNMs进行冷冻干燥以便进行表征.相同培养基中未加入KR14的CNMs作为空白.
使用X射线衍射仪(ESCALAB250Xi, Thermo Fisher Scientific, France)进行X射线衍射分析.通过显微共聚焦拉曼光谱仪(LabRAM HR Evolution, HORIBA Jobin Yvon S.A.S, France)在532 nm激光下以20 s积分时间收集可见激发光测量拉曼光谱的结果.通过傅里叶变换红外光谱仪(Nicolet iS50, Thermo Fisher Scientific, America)从1000~3000 cm-1范围扫描所有样品以监测FTIR光谱.
2.4 电化学检测电化学检测利用电化学工作站(CHI-620E, 上海辰华)进行, 以玻璃碳电极(GCE)作为工作电极, 铂丝作为对电极, 银/氯化银(Ag/AgCl)作为参比电极.差分脉冲伏安法(Differential Pulse Voltammetry, DPV)扫描范围为-1.2~0.4 V, 幅度为50 mV, 温度为25 ℃.
3 结果与讨论(Results and discussion)3.1 酶活及总蛋白含量结果分析在Cladosporium sp. KR14发酵培养基中加入不同结构的CNMs以确定其对真菌的影响.由于大量文献提出CNMs具有生物活性(Dizai et al., 2015)及毒性(Liu et al., 2013;Ji et al., 2016;Prasa et al., 2017), 会直接影响酶量分泌, 并且能通过改变酶的二级结构使得酶活增加或降低, 故本文通过测定酶活及蛋白含量来反映其对KR14的影响.通过18 d连续测量Lac、MnP和LiP活性以分析3种CNMs的影响, 结果发现(图 1), 经过培养, 酶活性表现出明显的变化:SWCNT对产酶, 尤其对MnP活性的影响最为显著(图 1a~1c);对于Lac, SWCNTs影响下的酶活性(43.6 U·L-1)高于对照(34.5 U·L-1), 石墨烯影响下的酶活性为37.4 U ·L-1, GO影响下的酶活性为32.9 U·L-1.CNMs略微增加了LiP活性, SWCNT、石墨烯和GO分别可将LiP活性提升至129.5、123.6和95.5 U·L-1.3种CNMs对MnP活性的影响最为明显, 均高于对照组(824.4 U·L-1), 其中, SWCNTs影响下的酶活性最高值为1039.8 U·L-1.
图 1(Fig. 1)
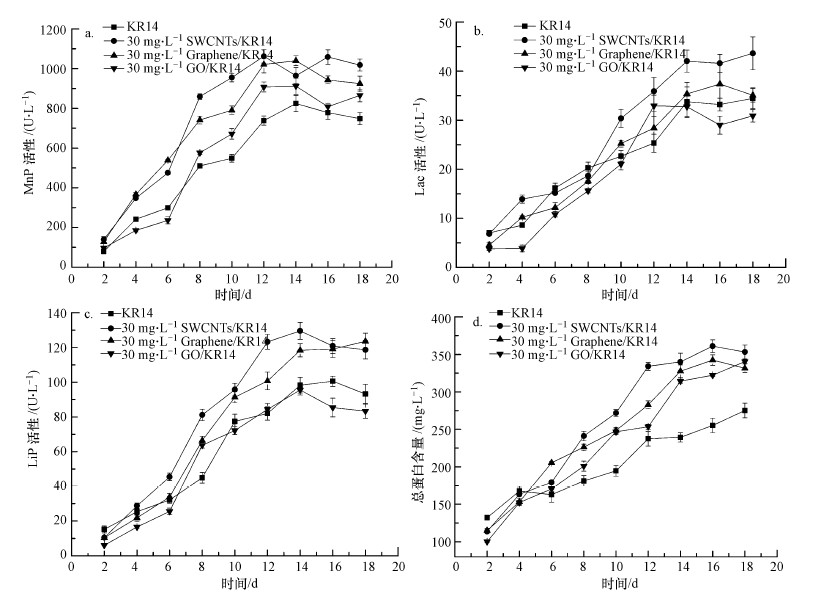 |
| 图 1 CMNs对KR14产酶及总蛋白含量的影响 (a.锰过氧化物酶活性, b.漆酶酶活性, c.木质素过氧化物活性, d.总蛋白含量) Fig. 1Effect of CMNs to KR14 on enzyme activities and total protein (a.MnP activity, b.Lac activity, c.LiP activity, d.total protein concentration) |
CNMs对真菌产酶的影响较为复杂, 并且由真菌物种、培养基组成和底物功能化的相互作用介导(Berry et al., 2014).真菌产生3种酶来转化及降解CNMs, 以降低其生物毒性.对于纯化的单壁碳纳米管, 由于相对缺乏化学官能团及金属含量低(Berry et al., 2014), 因此, 对于漆酶活性的诱导并不如通过直接添加金属离子(Zhuo et al., 2017)和酚类化合物(Francisco et al., 2014)效果明显.然而, 对于MnP, 3种CNMs均在诱导中表现出明显效果, 这可能是由于CNMs促进了MnP的催化循环, 使得Mn2+氧化和Mn3+离解从而增加酶活性.对于3种CNMs的刺激, GO对MnP的刺激最小, 可能是由于Mn2+在酶结合位点与其表面羧基结合, 限制了MnP催化循环中的关键步骤(Zhang et al., 2014).
同时, 通过总蛋白含量测定来分析CNMs对KR14产胞外酶的影响.如图 1d所示, 在CNMs存在下, 前4 d总蛋白质产量低于对照(167.9 mg·L-1), 可能是因为CNMs对胞外酶具有一定的吸附作用, 而固定化酶由于结构变化可造成酶活性的增加, 这与酶活检测结果一致.随着时间的延长, CNMs对酶活性和总蛋白产量有显著的促进作用, 均高于对照, 并在16 d后出现最大蛋白产量(361.0 mg·L-1).说明加入3种CNMs对KR14均有一定的刺激作用, 可产生更多的胞外酶并增加其酶活性.
3.2 木质素降解分析已有研究表明, 白腐真菌培养基中酶的产生与芳香族化合物的存在之间具有着复杂的相互作用(Rogalski et al., 1991).木质素广泛存在于植物体内, 在其分子结构中含有羟苯基丙醇或其衍生物的结构单元, 且木质素作为底物能被细胞外酶降解.因此, 本文利用木质素降解率来分析3种CNMs对KR14降解有机物的间接影响.图 2结果表明, 加入SWCNTs后出现了木质素最高降解率, 其次为石墨烯和GO.14 d时, 木质素降解率达到最大值45.9%, 较对照增加12.7%.14 d后, 木质素降解率降低, 该现象可解释为已降解的木质素发生了一定程度的聚合.
图 2(Fig. 2)
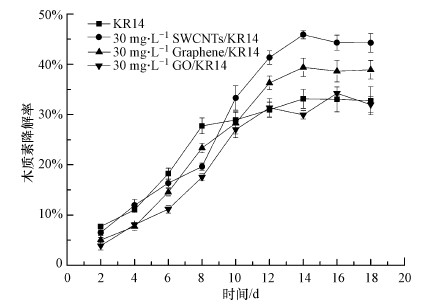 |
| 图 2 CNMs对KR14降解木质素的影响 Fig. 2Effect of 30 mg·L-1 CMNs to KR14 on lignin degradation |
3.3 电化学检测分析电化学分析测试有助于理解真菌及其胞外酶的电子传递效率, 进而理解真菌胞外酶是如何高效率降解木质素及碳质纳米材料CNMs在此过程中的影响.差分脉冲伏安法(DPV)通过施加线性变化的直流电压并叠加矩形脉冲电压, 并记录脉冲前后差值, 以降低背景电流, 使得其灵敏度高于循环伏安法.DPV结果如图 3所示, 单独存在KR14时, 出现了3个较为明显的还原峰, 其峰电位分别为-0.156、-0.576、-0.852 V.加入CNMs后, 峰电位及还原电流均发生改变.加入SWCNTs的变化最为显著, 其中, 第一个峰电位变化较小(由-0.156 V变化至-0.144 V), 还原电流变化明显(由-1.300 μA变化至-1.813 μA).石墨烯和GO均在第3个还原峰处出现还原电流增加(由-8.189 μA分别变化至-1.133、-1.165 μA).对于-0.15 V附近的主要还原峰来说, SWCNTs显著增大了其还原电流但未发生明显峰电位变化, 说明未改变其电子转移途径而增加了其电子转移率(Shungui et al., 2018).考虑到碳质纳米材料良好的导电性, 可推断CNMs在此过程中起到了电子导体作用, 会增强枝孢菌胞外酶与木质素之间的电子传递效率, 也可部分解释CNMs存在时枝孢菌对木质素降解率的提高.
图 3(Fig. 3)
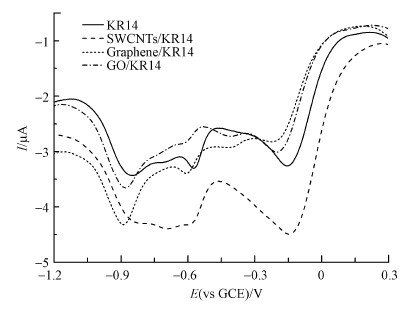 |
| 图 3 KR14、CMNs+KR14差分脉冲伏安图 Fig. 3Differential pulse voltammetry of KR14 and CNMs/KR14 |
上述结果表明, 在枝孢菌KR14降解木质素的过程中, 3种碳纳米材料的存在均在一定程度上影响了真菌和胞外酶的电子转移效率.已有研究发现, 碳质纳米材料可加快氧化还原反应及微生物活性, 如Pan等(2017)研究指出, 石墨烯可加快亚甲基蓝氧化反应和硝基苯还原反应中的电子传递速率;薛丽仙等(2016)通过向生物膜中掺杂石墨烯可有效缩短微生物燃料电池启动时间, 降低阳极内阻, 提高阳极生物膜内的电子传递效率.本研究结果表明, 碳质纳米材料的存在也能够加速真菌胞外电子传递过程, 说明环境中CNMs对微生物胞外电子传递的影响可能具有一定的普遍性.本研究中的电化学DPV结果也说明了CNMs对枝孢菌KR14降解机理影响的复杂性:一方面CNMs刺激了枝孢菌KR14胞外酶的释放, 胞外酶活的增加会促进木质素的降解;另一方面, CNMs凭借自身良好的导电性, 可加速胞外酶的电子传递效率, 也能够有效促进胞外酶对木质素的降解.
3.4 碳纳米材料表征分析为研究枝孢菌KR14对CNMs存在的降解, 对反应前后的CNMs进行了XPS、FTIR与Raman分析.XPS结果(图 4a、4b)显示, 经KR14降解后, SWCNTs和石墨烯的氧碳比(O/C)均明显增加, 分别从原来的0.0472和0.0547变为0.3987和0.3344, 分别上升了35.15%和27.97%;而GO的氧碳比从0.5082降低至0.4171, 降低了9.11%.说明经过KR14处理后, CNMs发生氧化或含氧官能团增加.
图 4(Fig. 4)
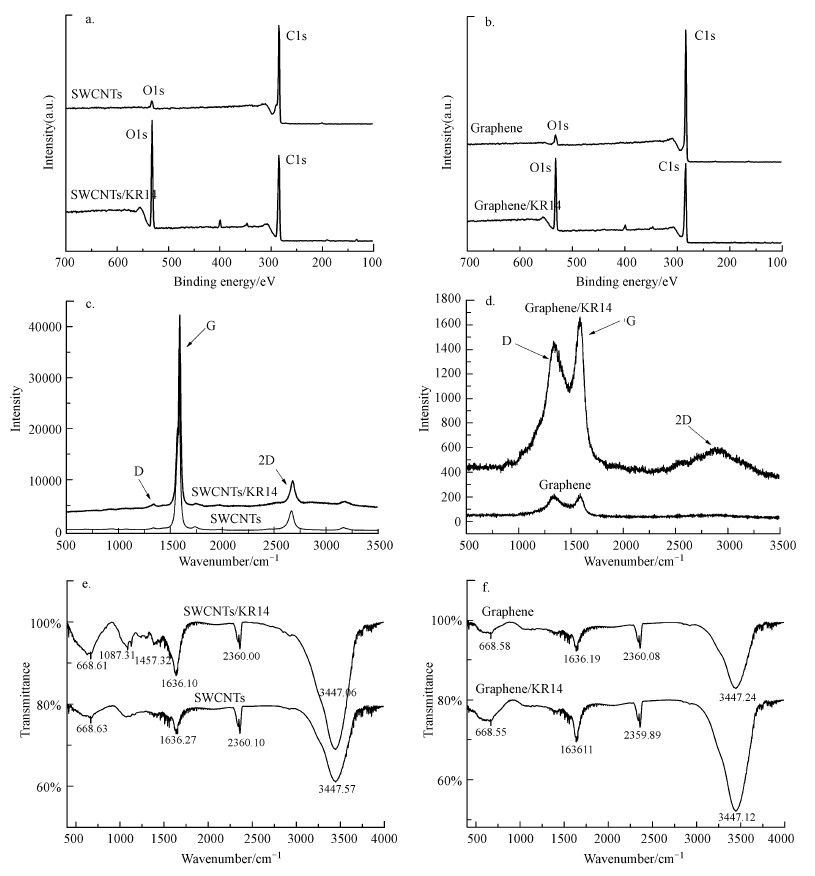 |
| 图 4 KR14对CNMs结构的影响(SWCNTs的XPS光谱(a)、拉曼光谱(c)、红外光谱(e)及石墨烯的XPS光谱(b)、拉曼光谱(d)、红外光谱(f)) Fig. 4Structural change of SWCNTs XPS spectra(a), Raman spectra(c), FTIR spectra(e) and graphene XPS spectra(b), Raman spectra(d), FTIR spectra(f) by KR14 |
拉曼光谱图(图 4c、4d)显示, CNMs均出现3个特征峰, 即D峰、G峰和2D峰.切向D带及无序性G带是碳质材料的特征(Allen et al., 2008), ID/IG比值可用于表示其结构的无序性(Bissett et al., 2010), 2D带可用于表示碳质材料的堆叠程度.CNMs的ID/IG比值增加, 说明其被氧化、侧壁官能化及sp2杂化转化为sp3杂化(Lee et al., 2008;Khanra et al., 2012).通过KR14作用后的SWCNTs的ID/IG比值明显增加, 从0.24增加至0.33, 说明KR14使SWCNTs产生由催化引起的大量缺陷、空穴及不对称结构, SWCNTs的无序性增加.从石墨烯的拉曼光谱图可见, 石墨烯在KR14作用前后D峰与G峰均明显增加, 并且产生明显的2D峰, 但ID/IG变化甚微(由0.15变化至0.16), 说明石墨烯片在KR14作用后无序性增加, 且单层石墨烯发生一定程度的堆叠.氧化石墨烯表征前后数据均未发生明显变化(由于氧化石墨烯表征前后没有明显变化, 故未将其数据列出).
FTIR结果如图 4e、4f所示, 与KR14作用后的SWCNT和石墨烯在1640 cm-1(芳环C=C)、2360 cm-1(CO2反对称伸缩振动)和3447 cm-1(C—H不饱和碳的拉伸振动)处均有明显峰出现.在1087 cm-1和1457 cm-1处, SWCNTs谱图出现两个峰, 其分别对应于C—O的伸展和CH2的不对称角度变化.C—O伸展峰强度改变, 表明KR14作用于SWCNTs的表面或可能产生开环反应(Liu et al., 2018), 这与拉曼光谱结果一致.石墨烯和氧化石墨烯在KR14相互作用后没有检测到官能团的明显变化, 这可能归因于表面氧功能可能影响CNMs对酶促转化的易感性(Mocan et al., 2017).
4 结论(Conclusions)1) 碳纳米材料对KR14存在两方面作用:①影响真菌KR14的胞外酶分泌;②影响已分泌胞外酶活性.加入3种不同CNMs后, 真菌KR14分泌蛋白质含量均有增加, 对胞外酶MnP活性有明显刺激作用, 其中, SWCNTs的效果最为显著, 酶活增加26.1%.
2) CNMs的存在提高了真菌胞外酶的电子传递效率, 进而提高了木质素降解效率, 这是由于CNMs刺激增加了胞外酶产率和CNMs作为电子导体提高了真菌胞外酶与木质素之间的电子传递效率两个原因导致的.
3) KR14可使CNMs发生氧化, 改变其表面官能团, 增加氧碳比(O/C)、表面缺陷及结构无序性, 从而使碳纳米材料结构被破坏, 进而使降解更易进行.
参考文献
| Ahmed A, Surjith A, Kateryna B, et al. 2017. Review on the antimicrobial properties of carbon nanostructures[J]. Materials, 10(9): 1–26. |
| Allen B L, Kichambare P D, Gou P, et al. 2008. Biodegradation of single-walled carbon nanotubes through enzymatic catalysis[J]. Nano Lett, 8(11): 3899–3903.DOI:10.1021/nl802315h |
| Allen B L, Kotche G P, Chen Y, et al. 2009. Mechanistic investigations of horseradish peroxidase-catalyzed degradation of single-walled carbon nanotubes[J]. Journal of the American Chemical Society, 131(47): 17194–17205.DOI:10.1021/ja9083623 |
| Berry T D, Filley T R, Blanchette R A. 2014. Oxidative enzymatic response of white-rot fungi to single-walled carbon nanotubes[J]. Environmental Pollution, 193: 197–204.DOI:10.1016/j.envpol.2014.06.013 |
| Chen M, Zeng G M, Xu P, et al. 2017. How do enzymes 'meet' nanoparticles and nanomaterials?[J]. Trends in Biochemical Sciences, 42(11): 914–930.DOI:10.1016/j.tibs.2017.08.008 |
| Dizaj S M, Mennati A, Jafari S, et al. 2015. Antimicrobial activity of carbon-based nanoparticles[J]. Advanced Pharmaceutical Bulletin, 5: 19–23. |
| Flores-Cervantes D X, Maes H M, Scha A, et al. 2014. Slow biotransformation of carbon nanotubes by horseradish peroxidase[J]. Environmental Science and Technology, 48(9): 4826–4834.DOI:10.1021/es4053279 |
| Fnu A, Ivana B, Keith V, et al. 2016. Biodegradation of lignin by fungi, bacteria and laccases[J]. Bioresource Technology, 220: 414–424.DOI:10.1016/j.biortech.2016.08.016 |
| Gloria M, Faycal K, Alessia B. 2016. A comparative study on the enzymatic biodegradability of covalently functionalized double- and multi-walled carbon nanotubes[J]. Carbon, 100: 367–374.DOI:10.1016/j.carbon.2016.01.023 |
| Goncalves G, Marques P, Vila M. 2017. Graphene-Based Materials in Health and Environment[M]. Berlin: Springer. |
| Kagan V E, Konduru N V, Feng W, et al. 2010. Carbon nanotubes degraded by neutrophil myeloperoxidase induce less pulmonary inflammation[J]. Nature Nanotechnology, 5: 354–359.DOI:10.1038/nnano.2010.44 |
| Khanra P, Kuila T, Kim N H, et al. 2012. Simultaneous biofunctionalization and reduction of graphene oxide by baker's yeast[J]. Chemical Engineering Journal, 183: 526–533.DOI:10.1016/j.cej.2011.12.075 |
| Kurapati R, Russier J, Squillaci M A, et al. 2015. Dispersibility-dependent biodegradation of graphene oxide by myeloperoxidase[J]. Small, 11(32): 3985–3994.DOI:10.1002/smll.201500038 |
| Liu C, Qiu S, Du P, Zhao H, et al. 2018. An ionic liquid-graphene oxide hybrid nanomaterial:synthesis and anticorrosive applications[J]. Nanoscale, 10(17): 8115–8124.DOI:10.1039/C8NR01890A |
| Liu Y, Zhao Y, Sun B, et al. 2013. Understanding the toxicity of carbon nanotubes[J]. Accounts of Chemical Research, 46(3): 702–713.DOI:10.1021/ar300028m |
| Longe L, Garnier G, Saito K.2016.Lignin Biodegradation with Fungi, Bacteria and Enzymes for Producing Chemicals and Increasing Process Efficiency//Production of Biofuels and Chemicals from Lignin[M]. Singapore: Springer.147-179 |
| 李海涛, 姚开, 贺强, 等. 2010. 木质素的生物降解及其应用[J]. 皮革科学与工程, 2010, 20(6): 27–31.DOI:10.3969/j.issn.1004-7964.2010.06.007 |
| Malarkey E B, Parpura V. 2007. Applications of carbon nanotubes in neurobiology[J]. Neurodegener Disease, 4(4): 292–299.DOI:10.1159/000101885 |
| Mauter M S, Elimelech M. 2008. Environmental applications of carbon-based nanomaterials[J]. Environmental Science and Technology, 42(16): 5843–5859.DOI:10.1021/es8006904 |
| Mocan T, Matea C T, Pop T, et al. 2017. Carbon nanotubes as anti-bacterial agents[J]. Cellular and Molecular Life Sciences, 74(19): 3467–3479.DOI:10.1007/s00018-017-2532-y |
| Pan M, Zhang Y, Shan C, et al. 2017. Flat graphene-enhanced electron transfer involved in redox reactions[J]. Environmental Science & Technology, 51(15): 8597–8605. |
| Raghuraj S C, Anjum Q, Baris Y. 2016. Biotransformation of multi-walled carbon nanotubes mediated by nanomaterial resistant soil bacteria[J]. Chemical Engineering Journal, 298: 1–9.DOI:10.1016/j.cej.2016.04.019 |
| Rogalski J, Lundell T, Leonowicz A, et al. 1991. Production of laccase, lignin peroxidase and manganese-dependent peroxidase by various strains of trametes-versicolor depending on culture conditions[J]. Acta Microbiol Pol, 40(3/4): 221–234. |
| Lee S, Peng J W, Liu C H. 2008. Raman study of carbon nanotube purification using atmospheric pressure plasma[J]. Carbon, 46: 2124–2132.DOI:10.1016/j.carbon.2008.09.029 |
| Seo D H, Pineda S, Yick S, et al. 2015. Plasma-enabled sustainable elemental lifecycles:Honeycomb-derived graphenes for next-generation biosensors and supercapacitors[J]. Green Chemistry, 17(4): 2164–2171.DOI:10.1039/C4GC02135E |
| Shungui Z, Jiahuan T, Yong Y, et al. 2018. TiO2 nanoparticle-induced nanowire formation facilitates extracellular electron transfer[J]. Environmental Science and Technology Letters, 5(9): 564–570.DOI:10.1021/acs.estlett.8b00275 |
| 薛丽仙, 杨娜, 任月萍, 等. 2016. 石墨烯掺杂生物阳极微生物燃料电池的产电性能[J]. 环境化学, 2016, 35(5): 1014–1019. |
| You Y, Das K K, Guo H. 2017. Microbial transformation of multiwalled carbon nanotubes by Mycobacterium vanbaalenii PYR 1[J]. Environmental Science and Technology, 51: 2068–2076.DOI:10.1021/acs.est.6b04523 |
| Zhang L, Elijah J P, Mussie Y H, et al. 2013. Degradation of multiwall carbon nanotubes by bacteria[J]. Environmental Pollution, 181: 335–339.DOI:10.1016/j.envpol.2013.05.058 |
| 赵克利, 郝莹, 朱墨, 等. 2018. 石墨烯材料生物降解的策略研究[J]. 化学学报, 2018, 76(3): 168–176. |
| Zhu Z. 2017. An overview of carbon nanotubes and graphene for biosensing applications[J]. Nano-Micro Lett, 9(3): 1–25. |
| Zhuo R, Yuan P, Yang Y. 2017. Induction of laccase by metal ions and aromatic compounds in Pleurotus ostreatus HAUCC 162 and decolorization of different synthetic dyes by the extracellular laccase[J]. Biochemical Engineering Journal, 117: 62–72.DOI:10.1016/j.bej.2016.09.016 |
