 , 王鹏1,2
, 王鹏1,2
 , 刘君政1,2, 赵君1,2
, 刘君政1,2, 赵君1,21. 江西师范大学地理与环境学院, 南昌 330022;
2. 江西师范大学鄱阳湖湿地与流域研究教育部重点实验室, 南昌 330022
收稿日期: 2018-11-07; 修回日期: 2018-12-01; 录用日期: 2018-12-01
基金项目: 国家自然科学基金项目(No.41661017);江西省自然科学基金(No.20151BAB213035);江西省重大生态安全问题监控协同创新中心资助项目(No.JXS-EW-00)
作者简介: 肖汉玉(1994-), 男, xiaohyjxnu@163.com
通讯作者(责任作者): 王鹏(1982-), 男, 副教授, 博士, 主要从事流域水环境和湖泊生态环境的研究. E-mail:wangpengjlu@jxnu.edu.cn
摘要: 为了解乐安江水体浮游细菌群落特征,探讨水化学指标和空间距离对浮游细菌群落的影响,本研究分别于枯水期(2016年12月)和丰水期(2017年7月)对乐安江15个采样点表层水样进行采集.检测了水体NO3--N、NH4+-N、TP、DOC、SO42-、Cl-、Cu、Zn等水化学指标,运用高通量测序技术确定水体浮游细菌群落特征,Mantel Test分析了水化学指标、空间距离(采样点干流长度、平均河网长度、累计河网长度和流域子面积)与细菌群落之间的关系.结果表明:①乐安江水体浮游细菌群落丰富度和多样性丰水期均高于枯水期,丰富度随流向逐渐升高,多样性下游最高,中游最低.②枯水期丰度最高的细菌门类是Proteobacteria,其次是Bacteroidetes和Actinobacteria,枯水期Proteobacteria中下游显著高于上游,Bacteroidetes中下游显著低于上游,Actinobacteria上游显著高于中下游.丰水期丰度最高的细菌门类是Actinobacteria,其次是Proteobacteria和Cyanobacteria,丰水期Actinobacteria丰度先降低后升高,中游丰度显著低于下游,其他河段无显著差异,Proteobacteria丰度随流向逐渐降低,Cyanobacteria丰度中游最高,并且显著高于下游地区.③非淡水细菌占所有细菌丰度的比例沿流向逐渐增加,丰水期均值(62.94%)显著高于枯水期(49.33%).④NO3--N是与浮游细菌群落相关性最高的水化学指标,干流长度是与浮游细菌群落相关性最高的空间距离指标.⑤水化学指标和空间距离与乐安江浮游细菌群落都有显著相关性,并且水化学指标对浮游细菌群落的影响要高于空间距离.本研究为鄱阳湖和乐安江流域水生态环境保护提供了科学依据.
关键词:乐安江浮游细菌水环境因子空间距离高通量测序
Effects of hydrochemical parameter and spatial distance on bacterioplankton community in the Le'an River
XIAO Hanyu1,2
 , WANG Peng1,2
, WANG Peng1,2
 , LIU Junzheng1,2, ZHAO Jun1,2
, LIU Junzheng1,2, ZHAO Jun1,2 1. School of Geography and Environment, Jiangxi Normal University, Nanchang 330022;
2. Key Laboratory of Poyang Lake Wetland and Watershed Research, Ministry of Education, Jiangxi Normal University, Nanchang 330022
Received 7 November 2018; received in revised from 1 December 2018; accepted 1 December 2018
Abstract: To explore the characteristics of the bacterioplankton and effects of hydrochemistry and space distance on the bacterioplankton community, we collected surface water samples from 15 sampling sites in the Le'an River in the dry season (December 2016) and the wet season (July 2017). We tested the concentrations of NO3--N, NH4+-N, TP, DOC, SO42-, Cl-, Cu, Zn and other hydrochemical parameters, and determined the characteristics of the bacterioplankton community using high-throughput sequencing technology. We analyzed the relationships between hydrochemical parameter, spatial distance (mainstream length, average river network length, cumulative river network length and basin area of sampling sites) and bacterioplankton community by Mantel Test. The results showed that:①The bacterioplankton community's richness and diversity in the Le'an River were higher in the wet season than in the dry season. The richness increased along the flow direction, and the diversity was the highest in the lower reaches and the lowest in the middle reaches. ②The highest abundance of bacterioplankton phylum in the dry season was Proteobacteria, followed by Bacteroidetes and Actinobacteria. The abundance of Proteobacteria in the middle and lower reaches was significantly higher than in the upper reaches; the abundance of Bacteroidetes in the middle and lower reaches was significantly lower than in the upper reaches; and the abundance of Actinobacteria in the upper reaches was no significantly higher than in the middle and lower reaches. The highest abundance of bacterioplankton community in the wet season was Actinobacteria, followed by Proteobacteria and Cyanobacteria. The abundance of Actinobacteria first decreased and then increased along the flow direction and was significantly lower in the middle reaches than in the lower reaches. The abundance of Proteobacteria gradually decreased along the flow direction. The abundance of Cyanobacteria in the middle reaches was the highest, and was significantly higher than in the lower reaches. ③The proportion of the non-freshwater bacteria increased gradually along the flow direction, and the proportion in the wet season (62.94%) was significantly higher than in the dry season (49.33%). ④NO3--N was the best parameter in the hydrochemical parameters explaining the dynamics of bacterioplankton community, and the mainstream length was the best parameter in the spatial distance variables. ⑤Both the hydrochemical parameter and the spatial distance significantly affected the distribution of bacterioplankton community in the Le'an River, and the influence of water chemistry was higher than that of the spatial distance. This study provides a scientific basis for the water ecological environment protection in the Le'an River Basin and Poyang Lake.
Keywords: the Le'an Riverbacterioplankton communityhydrochemical parameterspatial distancehigh-throughput sequencing
1 引言(Introduction)河流是人类生活用水和工农业用水的主要来源, 同时也是水循环和碳、氮、磷等元素循环的重要环节(Cole et al., 2007).浮游细菌群落是河流生态系统的重要组成部分, 在河流污染物降解和转化中起着关键作用, 浮游细菌群落结构一定程度上可以反映出该河流生态环境状况(Findlay, 2010).有关淡水流域浮游细菌群落及其影响因素已有不少研究报道(Fortunato et al., 2012; Staley et al., 2015; Ibekwe et al., 2016; Ma et al., 2016; Wang et al., 2016).在解释群落的格局变化方面, “物种筛选”(species sorting)和“质量效应”(mass effects)的观点(Leibold et al., 2004)在解释浮游细菌群落在淡水河流生态系统中的分布方面得到了广泛应用.物种筛选(即物种的选择)认为浮游细菌群落在河流上游分散到下游的过程中, 由于细菌的环境偏好和流经地环境条件的不同, 导致群落组成和结构发生改变;质量效应则认为河流浮游细菌群落的组成和结构通过来自其他生态系统大量细菌的输入来改变.目前已有的研究表明“物种筛选”和“质量效应”都能影响河流细菌群落的分布, 但谁才是影响河流细菌群落分布的主要因素尚未有定论(Read et al., 2015; Savio et al., 2015; Ni?o-García et al., 2016).
乐安江发源于江西省婺源县鄣公山南麓, 全长279 km, 流域面积9616 km2, 是影响鄱阳湖水质的重要河流(张杰等, 2014; 陈波等, 2016).研究水化学指标和空间距离对乐安江浮游细菌群落的影响可以为乐安江乃至鄱阳湖的水生态环境保护提供科学依据.本文根据集合群落理论, 假设不同空间位置的采样点外来细菌输入的差异是导致“质量效应”的主要原因, 而水化学指标的差异是影响“物种筛选”的主要原因, 水化学指标的差异也同时受到不同空间位置外来输入差异的影响.本研究的主要目的:①阐明乐安江水体浮游细菌群落时空分布特征;②探讨水化学指标和空间距离对浮游细菌群落的影响机理.
2 材料与方法(Materials and methods)2.1 样品采集与分析从乐安江上游至下游设置15个采样点(L01~L15), 河流上游地区(L01~L04)从源头婺源县至德兴铜矿, 中游(L05~L10)从德兴铜矿矿区至乐平市, 乐平市以下为下游(L11~L15)河段.分别于枯水期(2016年12月)和丰水期(2017年7月)对采样点表层(50 cm)水体进行采集, 利用便携式水质分析仪(HI9828, HANNA, Italy)现场测定水温(T)、电导率(EC)和pH值.用于水化学指标分析的水样采集250 mL, 用于高通量测序的3 L水样置于预先灭菌的采样瓶, 存于0~4 ℃冷藏箱内, 并且在4 h之内运回实验室进行处理.采用纳氏比色法测定水体氨态氮(NH4+-N)、酚二磺酸光度法测定水体硝态氮(NO3--N)、过硫酸钾消解-钼锑抗分光光度法测定水体总磷(TP), 用于测定NH4+-N和NO3--N的水样通过0.45 μm孔径滤膜过滤.利用电感耦合等离子体质谱仪(ICP-MS)分析测定水体中可溶性重金属元素含量, 样品检测之前, 仪器采样标准物质(SRM, AccuStandard, Inc., USA)进行3次重复检测并且进行极限检测, 6种重金属的极限检测值分别为Cu:0.091 μg · L-1、Zn:0.025 μg · L-1、As:0.1 μg · L-1、Pb:0.026 μg · L-1、Cr:0.031 μg · L-1、Cd:0.001 μg · L-1.用于高通量测序的水样先通过5 μm孔径无菌滤膜过滤去除颗粒杂质, 然后通过0.22 μm孔径无菌滤膜过滤.将过滤后的0.22 μm孔径滤膜置于-80 ℃冰箱保存, 进行后续的DNA提取.
2.2 DNA提取与高通量测序采用E.Z.N.A.? Soil DNA Kit (Omega Bio-tek, Norcross, GA, U.S.)提取基因组DNA, 完成基因组DNA抽提后, 利用1%琼脂糖凝胶电泳检测抽提基因组DNA.对16S rRNA基因的V3~V4高变区片段进行PCR扩增.引物序列(Dennis et al., 2013)为338F(5′-ACTCCTACGGGAGGCAGCA-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′).反应条件:95 ℃预变性2 min, 然后进行95 ℃变性30 s, 55 ℃退火30 s, 72 ℃延伸30 s的15个循环.循环结束后72 ℃最终延伸5 min.每个样本3个重复并进行混合来降低在DNA提取过程中实验操作产生的误差, 然后用2%琼脂糖凝胶电泳检测, 使用AxyPrepDNA凝胶回收试剂盒(AXYGEN公司)切胶回收PCR产物, 混合后用Tris_HCl洗脱;2%琼脂糖电泳检测参照电泳初步定量结果, 将PCR产物用QuantiFluorTM-ST蓝色荧光定量系统(Promega公司)进行检测定量, 按照每个样本的测序量要求, 进行相应比例的混合.高通量测序在上海美吉生物医药科技有限公司Illumina Miseq PE300平台进行.原始数据上传至NCBI数据库中(序列号: SRP142494).
2.3 空间数据的获取与处理本研究共选取了4个关于采样点的空间距离参数, 包括①干流长度(km):采样点之间干流河道长度.表示河水在干流流经的距离.②累计河网长度(km):采样点上游所有河道长度的总和, 表示采样点上游河网的密度.③平均河网长度(km):每一条支流从源头到采样点的河道长度的平均值, 以此来表示河水停留时间的长短(Savio et al., 2015).④子流域面积(km2):每个采样点所控制的流域面积, 表示采样点汇水面积的大小.空间距离的确定利用Arcgis10.3软件中的水文分析(Hydrology)模块对基于流域内30 m分辨率的DEM(Digital Elevation Model)(数据来自中国科学院地理空间数据云, 网址:http://www.gscloud.cn/)进行处理和分析.
2.4 统计方法利用Mothur(V.1.36.1)对原始DNA序列进行过滤处理, 去除嵌合体, 得到优化序列;按照97%相似性将优化序列划分可操作分类单元(OTU, Operational Taxonomic Units);采用RDP classifier贝叶斯算法对照Silva数据库以70%置信度对OTU代表序列进行物种分类.为避免各样品生物量的差异, 按最小样本序列数进行样本序列抽平处理, 得到标准化数据进行后续统计分析.基于OTU进行稀释性曲线分析, 计算覆盖率(Coverage)、Chao丰富度指数和Shannon多样性指数.对照Newton淡水细菌(Newton et al., 2011)数据库, 对OTU进行分类, 确定淡水细菌和非淡水细菌的丰度和比例.
采用独立样本T检验对比枯水期和丰水期样品理化指标和多样性指标的差异性.水化学指标之间的相关关系采用Pearson相关性分析, 非正态分布的水化学指标先进行对数转换(lgX).利用R语言“Vegan”(Oksanen et al., 2010)软件包中的“metaMDS”函数做基于Bray-Curtis距离的采样点非度量多维尺度(NMDS)分析, 用“bioenv”函数分别对空间距离参数和水化学指标做最佳环境因子组合分析, 分别得到最佳空间距离参数组合和最佳水化学指标组合, 并以此来代表空间距离和水化学指标.随后采用“vegdist”函数计算出浮游细菌OTU的bray-curtis距离的差异性矩阵, 以及水化学指标和空间距离的euclidean距离差异性矩阵.通过“mantel”函数中的Mantel Test来确定浮游细菌群落与水化学指标和空间距离之间的相关性和显著性水平, 同时用Partial Mantel Test来控制水化学指标和空间距离之间的相互影响, 分别检验浮游细菌群落与水化学指标和空间距离之间的相关性和显著性水平.
3 结果(Results)3.1 乐安江水化学指标特征乐安江多项理化指标浓度在枯水期高于丰水期(表 1), NH4+-N和NO3--N浓度在枯水期显著高于丰水期, 枯水期NH4+-N和NO3--N浓度在中下游高于上游, 但未达到显著性.丰水期NH4+-N和NO3--N浓度随流向逐渐增加.而TP浓度丰水期高于枯水期(未达到显著性水平), 随流向逐渐升高.DOC枯水期显著高于丰水期, 枯水期DOC浓度中游>下游>上游, 丰水期下游>中游>上游.Cl-浓度枯水期显著高于丰水期, 并且两水期下游浓度显著高于上游和中游.SO42-浓度枯水期显著高于丰水期, 中游显著高于上游.重金属Cu, Zn浓度枯水期显著高于丰水期, 中游浓度最高.
表 1(Table 1)
| 表 1 乐安江水化学指标 Table 1 Hydrochemical parameter of Le′an River | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 1 乐安江水化学指标 Table 1 Hydrochemical parameter of Le′an River
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
乐安江水化学指标之间的相关性分析表明(表 2), pH值与大部分指标之间呈负相关, EC与全部指标呈正相关, NH4+-N与NO3--N、Cl-、Zn、Cr显著正相关.NO3--N除了与pH值呈显著负相关之外, 与其他指标都呈正相关, 并且与EC、DOC、Cl-、SO42-、Cr、Cu、Zn、As、Cd、Pb呈显著正相关.金属元素Cr、Cu、Zn、As、Cd、Pb之间呈正相关.
表 2(Table 2)
| 表 2 乐安江水化学指标的相关性分析 Table 2 Correlation of hydrochemical parameter in the Le′an River | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 2 乐安江水化学指标的相关性分析 Table 2 Correlation of hydrochemical parameter in the Le′an River
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
3.2 细菌群落特征3.2.1 细菌群落结构两个水期总计30个水样通过高通量测序后, 按照97%的相似度划分基因序列, 得到770条OTUs, 各样本文库的覆盖率(Coverage)范围均在99.6%以上, 能够代表乐安江水体细菌群落的真实情况.两个水期chao指数都是随流向逐渐升高(图 2), 枯水期下游显著高于上游, 丰水期中下游显著高于上游河段, 其它河段间无显著差异.两个水期的Shannon指数在下游最高, 枯水期下游显著高于中游, 丰水期下游显著高于上游和中游, 其他河段间无显著差异.
图 2(Fig. 2)
 |
| 图 2 乐安江浮游细菌群落多样性指数变化图 Fig. 2Diversity of planktonic bacterial communities in the Le′an River |
基于Bray-Curtis距离的NMDS分析也表明, 不同水期之间细菌群落结构存在显著的差异, 不同河段采样点之间差异的也比较明显, 枯水期被分成了3个组, 而丰水期采样点之间的差异没有枯水期明显, 但是从上游到下游变化有明显的变化规律(图 3).
图 3(Fig. 3)
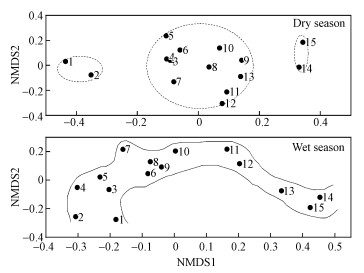 |
| 图 3 基于Bray-Curtis距离的采样点非度量多维尺度(NMDS)分析 Fig. 3Non-metric multidimensional scaling (NMDS) analysis of sampling sites based on Bray-Curtis distance |
3.2.2 细菌群落组成本研究的770条OTUs, 在门水平分类上可以分成30个不同种类的菌群, 其中丰水期被分成26个门, 枯水期被分成28个门.图 4为门水平细菌分类, Others表示平均丰度小于1%的门水平细菌.优势菌群为变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)和蓝藻菌门(Cyanobacteria).枯水期丰度最高的是Proteobacteria(59.87%), 其次是Actinobacteria(21.43%)和Bacteroidetes(15.52%), 而丰水期最高的为Actinobacteria(37.13%), 其次是Proteobacteria (26.57%), Cyanobacteria(19.03%)和Bacteroidetes(13.17%), Others表示平均丰度小于1%的门水平细菌分类的总和.
图 4(Fig. 4)
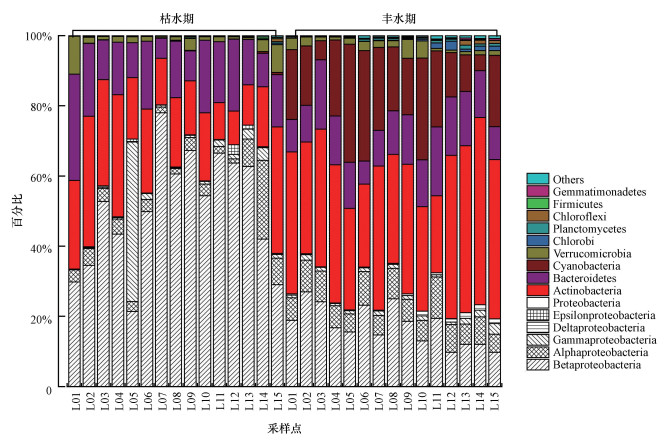 |
| 图 4 乐安江水体门水平浮游细菌分类 Fig. 4Planktonic bacterial phyla in the Le′an River |
主要门水平细菌群落在不同河段间也存在显著差异(表 3).枯水期Proteobacteria丰度上游显著低于中下游, Actinobacteria丰度上游显著高于中下游, Bacteroidetes丰度和Verrucomicrobia丰度随流向先降低后升高, Cyanobacteria丰度随流向逐渐升高.丰水期Proteobacteria丰度随流向逐渐降低, Actinobacteria丰度先降低后升高, 中游丰度显著低于下游, 其他河段无显著差异, Bacteroidetes丰度在中游也是最低的, 但在不同河段间无显著性差异, Cyanobacteria丰度和Verrucomicrobia丰度先升高后降低, 中游丰度显著高于下游.
表 3(Table 3)
| 表 3 乐安江主要门水平浮游细菌群落不同河段的相对丰度 Table 3 The average relative abundance of the main phyla level planktonic bacterial community of different sections in the Le′an River | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 3 乐安江主要门水平浮游细菌群落不同河段的相对丰度 Table 3 The average relative abundance of the main phyla level planktonic bacterial community of different sections in the Le′an River
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
对比Newton淡水细菌数据库对乐安江浮游细菌进行分类(图 5).丰水期非淡水细菌所占的比例62.94%要显著高于枯水期49.33%(p=0.001), 枯水期非淡水细菌丰度大致随流向逐渐升高, 最大值出现在德兴铜矿下游的L05采样点, 丰度高达73.61%.丰水期非淡水细菌没有明显的变化规律, 中游所占的比例最大, 其次是上游, 下游最低.与枯水期相似, 德兴铜矿下游的L05采样点在丰水期也出现了极大值69.83%, 但是最大值出现在乐平市下游的L11采样点, 丰度为75.71%.说明德兴铜矿和乐平市河段外源细菌比例较大.
图 5(Fig. 5)
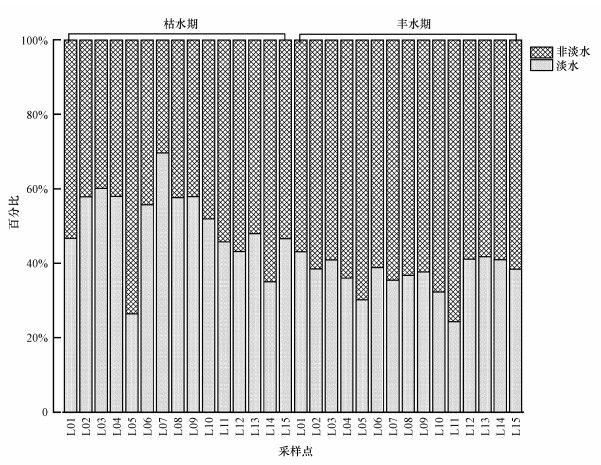 |
| 图 5 乐安江淡水细菌和非淡水细菌丰度 Fig. 5Abundance of freshwater bacteria and non-freshwater bacteria in the Le′an River |
3.3 细菌群落与水化学指标和空间距离之间的关系比较不同水期细菌群落与水化学指标和空间距离指标之间的关系(表 4)发现, 枯水期水化学指标中与细菌群落相关性最高的组合为NO3--N和Cl-, NO3--N与细菌群落的相关性为0.6312, 空间距离相关性最高的是干流长度.丰水期水化学指标中与细菌群落相关性最高的组合为NO3--N, 空间距离相关性最高的组合是干流长度和平均河网长度, 干流长度与浮游细菌群落相关性为0.6027.
表 4(Table 4)
| 表 4 乐安江浮游细菌群落与水化学指标和空间距离组合的相关关系 Table 4 The Correlations between planktonic bacterial community with hydrochemical parameter and spatial distance combinations in the Le′an River | ||||||||||||||||||||||||||||||||||||||||||||||||||
表 4 乐安江浮游细菌群落与水化学指标和空间距离组合的相关关系 Table 4 The Correlations between planktonic bacterial community with hydrochemical parameter and spatial distance combinations in the Le′an River
| ||||||||||||||||||||||||||||||||||||||||||||||||||
根据“bioenv”分析结果(表 4), 分别采用NO3--N和干流长度代表水化学指标和空间距离.Mantel Test结果表明(表 5), 水化学指标、空间距离指标与细菌群落之间具有显著的相关性, 水化学指标与细菌群落的相关性在丰水期和枯水期都要高于空间距离指标.通过Partial Mantel Test来控制水化学指标和空间距离指标之间的相互影响之后, 结果表明, 水化学指标和空间距离与细菌群落之间的相关性均有所降低, 但水化学指标与细菌群落结构之间的相关性依然高于空间距离指标, 并且都达到了显著性水平.空间距离指标与细菌群落之间的相关性在丰水期降至0.1529, 并且未达到显著性水平.
表 5(Table 5)
| 表 5 乐安江浮游细菌群落与水化学指标和空间距离的Mantel Test和Partial Mantel Test Table 5 The Mantel Test and Partial Mantel Test results of planktonic bacterial community with hydrochemical parameter and spatial distance in the Le′an River | ||||||||||||||||||||||||||||||||||||
表 5 乐安江浮游细菌群落与水化学指标和空间距离的Mantel Test和Partial Mantel Test Table 5 The Mantel Test and Partial Mantel Test results of planktonic bacterial community with hydrochemical parameter and spatial distance in the Le′an River
| ||||||||||||||||||||||||||||||||||||
4 讨论(Discussion)本研究发现, 乐安江水体优势浮游细菌群落为Proteobacteria、Actinobacteria、Bacteroidetes和Cyanobacteria, 这一结果与其他****在国内外淡水河流生态系统的研究结果相似(丁珵等, 2012; 于洋等, 2012; Liu et al., 2013; 徐慧敏等, 2016; 陈兆进等, 2017; Hu et al., 2018; Tian et al., 2018; 刘睿等, 2017).然而乐安江不同水期优势菌群丰度也有所差异, 枯水期丰度最高的是Proteobacteria, 而丰水期最高的是Actinobacteria.研究发现Proteobacteria中的Beta-proteobacteria可以快速利用水体N、P等营养物质, 随营养物质浓度的升高迅速增加(Burkert et al., 2003).乐安江枯水期水体NH4+-N和NO3--N浓度显著高于丰水期可能是导致Proteobacteria成为第一大菌门的主要原因.而Actinobacteria正好相反, 习惯在低浓度营养物质水体中生长(Haukka et al., 2006), 乐安江丰水期由于降水增加稀释了河流水体营养物质的浓度, 从而导致Actinobacteria的增加.丰水期Cyanobacteria丰度显著高于枯水期, 并且在丰水期成为水体第三丰富的菌群, 研究发现Cyanobacteria可以依靠水体叶绿素a和藻胆素进行有氧光合作用, 并且在温度为25~35 ℃之间Cyanobacteria的生长速度明显高于其他菌群(Okogwu et al., 2009), 研究发现Cyanobacteria的生长还受磷的限制, 磷酸盐的增加将有利于增加Cyanobacteria的丰度(Bridgeman et al., 2012).乐安江丰水期各样点平均温度为32.6 ℃, 水体TP平均浓度较枯水升高, 所以导致Cyanobacteria在丰水期超过了Bacteroidetes成为水体第三丰富的菌群.
本研究发现, NO3--N是与浮游细菌群落相关性最高的水化学指标.NO3--N作为细菌生长发育的营养物质, 能够影响浮游细菌群落的组成和结构(Isobe et al., 2014), NO3--N与浮游细菌群落相关性可能体现了物种筛选在乐安江细菌群落分布中的影响.Read等(2015)和Savio等(2015)对河流浮游细菌群落的研究表明, 物种筛选会使河流淡水细菌比例从上游至下游逐渐增加, 细菌群落丰度减小;但本次研究中乐安江淡水细菌比例从上游到下游呈逐渐下降的趋势(图 5), 并且细菌群落丰富度随流向逐渐升高(图 2), 说明物种筛选对细菌群落的影响较小, NO3--N与细菌群落之间的显著相关性并不是主要因为物种筛选引起的.研究表明水体DOC和pH值是影响细菌生长的主要水化学指标(Jones et al., 2009; Ni?o-García et al., 2016), 而本文中DOC和pH值与细菌群落之间无显著相关性, 也表明物种筛选作用不是影响细菌群落的主要因素.乐安江水体NO3--N来源广泛, 包括矿山、农业和生活废水的排放(夏雨等, 2015);本次研究中NO3--N与大多数水化学指标显著正相关(表 4)也说明了NO3--N来源的多样性.NO3--N与大量的外源细菌一同进入水体, 即NO3--N与浮游细菌群落相关性体现了质量效应对浮游细菌群落的影响.
干流长度是与乐安江浮游细菌群落相关性最高的空间距离指标.与本研究不同, Savio等(2015)在多瑙河研究发现代表河水停留时间长短的平均河网长度与浮游细菌群落相关性最高, 水体滞留时间在不同河段之间的差异, 导致了物种间相互作用(捕食与竞争等)的强弱, 并且认为在这个过程中“物种筛选”是影响多瑙河浮游细菌群落分布的主要因素.与泰晤士河(Read et al., 2015)和多瑙河(Savio et al., 2015)相比, 乐安江河长279 km, 流域面积9616 km2, 不足以引起较长的水体停留时间.而且乐安江流域内较大的矿山(德兴铜矿和银山铅锌矿), 城市(乐平市和德兴市)和农田(主要分布在中下游)主要分布在干流附近(图 1), 水体细菌在这些人类活动的影响下表现出空间差异性, 并且在这个过程中“质量效应”是主要影响因素.
图 1(Fig. 1)
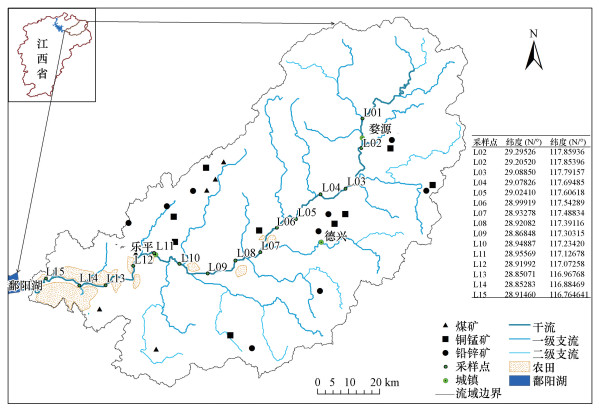 |
| 图 1 乐安江采样点位置示意图 Fig. 1Sampling sites in the Le′an River |
本次研究发现, 水化学指标和空间距离都显著影响乐安江浮游细菌群落分布, 但水化学的影响更大.Read等(2015)、Savio等(2015)和Crump等(2012)的研究发现空间距离对浮游细菌的影响大于水化学指标, 但Read等(2015)认为空间距离引起的河水滞留时间差异(物种筛选)是影响细菌群落分布的主要原因, Savio等(2015)和Crump等(2012)则认为不同空间位置的土壤和地下水细菌的输入差异(质量效应)是主要因素.本文研究表明乐安江水化学指标与浮游细菌群落之间的关系并不能用“物种筛选”的观点来解释, 而应该用“质量效应”的观点来解释.乐安江沿岸不同河段人类活动引起的废水输入在带来外来物种的同时, 也引起河流水化学指标的改变, 从而体现出水化学指标与乐安江浮游细菌群落的相关性.但这种相关性不是由于水化学指标对浮游细菌的“物种筛选”引起, 而是外来物种“质量效应”引起.这一结果否定了本文提出的假设“水化学的差异是影响物种筛选的主要原因”.
5 结论(Conclusions)1) 乐安江浮游细菌群落丰富度和多样性丰水期均高于枯水期, 丰富度随流向逐渐升高, 多样性下游最高, 中游最低.枯水期丰度最高的细菌门类是Proteobacteria, 其次是Bacteroidetes和Actinobacteria.丰水期丰度最高的细菌门类是Actinobacteria, 其次是Proteobacteria和Cyanobacteria.各菌群在不同河段存在明显的差异.
2) 乐安江非淡水细菌占所有细菌丰度的比例丰水期均值(62.94%)显著高于枯水期(49.33%), 并且沿流向逐渐增加.说明乐安江浮游细菌群落受外来细菌输入的影响较大, 并且这种影响随流向逐渐增加.
3) 乐安江浮游细菌群落与水化学指标、空间距离都有显著相关性, 并且水化学对浮游细菌群落的影响要高于空间距离.由于人类活动的影响, 乐安江水化学指标对浮游细菌群落的影响应该用“质量效应”的观点来解释, 而不是“物种筛选”.
参考文献
| Bridgeman T B, Chaffin J D, Kane D D, et al. 2012. From river to lake:Phosphorus partitioning and algal community compositional changes in Western Lake Erie[J]. Journal of Great Lakes Research, 38(1): 90–97.DOI:10.1016/j.jglr.2011.09.010 |
| Burkert U, Warnecke F, Babenzien D, et al. 2003. Members of a readily enriched β-proteobacterial clade are common in surface waters of a Humic Lake[J]. Applied and Environmental Microbiology, 69(11): 6550–6559.DOI:10.1128/AEM.69.11.6550-6559.2003 |
| 陈波, 王鹏, 张华. 2016. 鄱阳湖水体氮磷污染研究进展[J]. 江西师范大学学报(自然科学版), 2016, 40(4): 437–441. |
| 陈兆进, 陈海燕, 李玉英, 等. 2017. 南水北调中线干渠(河南段)浮游细菌群落组成及影响因素[J]. 中国环境科学, 2017, 37(4): 1505–1513.DOI:10.3969/j.issn.1000-6923.2017.04.038 |
| Cole J J, Prairie Y T, Caraco N F, et al. 2007. Plumbing the global carbon cycle:integrating inland waters into the terrestrial carbon budget[J]. Ecosystems, 10(1): 172–185.DOI:10.1007/s10021-006-9013-8 |
| Crump B C, Amaral-Zettler L A, Kling G W. 2012. Microbial diversity in arctic freshwaters is structured by inoculation of microbes from soils[J]. The ISME Journal, 6(9): 1629–1639.DOI:10.1038/ismej.2012.9 |
| Dennis K L, Wang Y, Blatner N R, et al. 2013. Adenomatous polyps are driven by microbe-instigated focal inflammation and are controlled by IL-10 producing T-cells[J]. Cancer Research, 73(19): 5905–5913.DOI:10.1158/0008-5472.CAN-13-1511 |
| 丁珵, 常玉梅, 杨琦, 等. 2012. 我国东北典型河流冰封期细菌多样性的研究——以松花江为例[J]. 环境科学学报, 2012, 32(6): 1415–1423. |
| Findlay S. 2010. Stream microbial ecology[J]. Journal of the North American Benthological Society, 29(1): 170–181.DOI:10.1899/09-023.1 |
| Fortunato C S, Herfort L, Zuber P, et al. 2012. Spatial variability overwhelms seasonal patterns in bacterioplankton communities across a river to ocean gradient[J]. The ISME Journal, 6(3): 554–563.DOI:10.1038/ismej.2011.135 |
| Haukka K, Kolmonen E, Hyder R, et al. 2006. Effect of nutrient loading on bacterioplankton community composition in lake mesocosms[J]. Microbial Ecology, 51(2): 137–146.DOI:10.1007/s00248-005-0049-7 |
| Hu Y, Cai J, Bai C, et al. 2018. Contrasting patterns of the bacterial and archaeal communities in a high-elevation river in northwestern China[J]. Journal of Microbiology, 56(2): 104–112. |
| Ibekwe A M, Ma J, Murinda S E. 2016. Bacterial community composition and structure in an Urban River impacted by different pollutant sources[J]. Science of the Total Environment, 566-567(2016): 1176–1185. |
| Isobe K, Ohte N. 2014. Ecological perspectives on microbes involved in N-cycling[J]. Microbes and Environments, 29(1): 4–16.DOI:10.1264/jsme2.ME13159 |
| Jones S E, Newton R J, Mcmahon K D. 2009. Evidence for structuring of bacterial community composition by organic carbon source in temperate lakes[J]. Environmental Microbiology, 11(9): 2463–2472.DOI:10.1111/emi.2009.11.issue-9 |
| Leibold M A, Holyoak M, Mouquet N, et al. 2004. The metacommunity concept:a framework for multi-scale community ecology[J]. Ecology Letters, 7(7): 601–613.DOI:10.1111/ele.2004.7.issue-7 |
| Liu L, Yang J, Yu X, et al. 2013. Patterns in the composition of microbial communities from a subtropical river:effects of environmental, spatial and temporal factors[J]. PLoS ONE, 8(11): e81232.DOI:10.1371/journal.pone.0081232 |
| 刘睿, 吴巍, 周孝德, 等. 2017. 渭河浮游细菌群落结构特征及其关键驱动因子[J]. 环境科学学报, 2017, 37(3): 934–944. |
| Ma L, Mao G, Liu J, et al. 2016. Spatial-temporal changes of bacterioplankton community along an exhorheic river[J]. Frontiers in Microbiology, 7: 1–12. |
| Newton R J, Jones S E, Eiler A, et al. 2011. A guide to the natural history of freshwater lake bacteria[J]. Microbiology and Molecular Biology Reviews, 75(1): 14–49.DOI:10.1128/MMBR.00028-10 |
| Ni?o-García J P, Ruiz-González C, Del Giorgio P A. 2016. Interactions between hydrology and water chemistry shape bacterioplankton biogeography across boreal freshwater networks[J]. The ISME Journal, 10(7): 1755–1766.DOI:10.1038/ismej.2015.226 |
| Okogwu O I, Ugwumba A O. 2009. Cyanobacteria abundance and its relationship to water quality in the Mid-Cross River floodplain, Nigeria[J]. Revista De Biología Tropical, 57(1/2): 33–43. |
| Oksanen J, Kindt R, Legendre P, et al. 2010. The Vegan Package: Community Ecology Package[EB/OL]. http://vegan.r-forge.r-project.org/ |
| Read D S, Gweon H S, Bowes M J, et al. 2015. Catchment-scale biogeography of riverine bacterioplankton[J]. The ISME Journal, 9(2): 516–526.DOI:10.1038/ismej.2014.166 |
| Savio D, Sinclair L, Ijaz U Z, et al. 2015. Bacterial diversity along a 2600 km river continuum[J]. Environmental Microbiology, 17(12): 4994–5007.DOI:10.1111/1462-2920.12886 |
| Staley C, Gould T J, Wang P, et al. 2015. Species sorting and seasonal dynamics primarily shape bacterial communities in the Upper Mississippi River[J]. Science of the Total Environment, 505(2015): 435–445. |
| Tian J, Zhu D, Wang J, et al. 2018. Environmental factors driving fungal distribution in freshwater lake sediments across the Headwater Region of the Yellow River, China[J]. Scientific Reports, 8(1): 3768.DOI:10.1038/s41598-018-21995-6 |
| Wang P, Chen B, Yuan R, et al. 2016. Characteristics of aquatic bacterial community and the influencing factors in an urban river[J]. Science of the Total Environment, 569-570(2016): 382–389. |
| 夏雨, 鄢帮有, 方豫. 2015. 鄱阳湖区乐安河流域营养盐负荷影响因素分析[J]. 湖泊科学, 2015, 27(2): 282–288. |
| 徐慧敏, 刘为锋, 吴燕, 等. 2016. 南京内秦淮河浮游细菌群落结构分析[J]. 环境科学与技术, 2016, 39(S1): 1–5. |
| 于洋, 王晓燕, 张鹏飞. 2012. 北运河水体浮游细菌群落的空间分布特征及其与水质的关系[J]. 生态毒理学报, 2012, 7(3): 337–344. |
| 张杰, 陈熙, 刘倩纯, 等. 2014. 鄱阳湖主要入湖口重金属的分布及潜在风险评价[J]. 长江流域资源与环境, 2014, 23(1): 95–100.DOI:10.11870/cjlyzyyhj201401014 |
