 , 王天玉1, 薛文娟2, 王国栋1,3, 贺鑫晋1, 吴盼红1, 陈剑杰1, 曹谨玲1
, 王天玉1, 薛文娟2, 王国栋1,3, 贺鑫晋1, 吴盼红1, 陈剑杰1, 曹谨玲1

1. 山西农业大学动物科技学院, 山西省生态畜牧与环境兽医学重点实验室, 太谷 030801;
2. 渭南职业技术学院, 渭南 714000;
3. 安阳工学院, 生物与食品工程学院, 安阳 455000
收稿日期: 2018-10-18; 修回日期: 2018-12-19; 录用日期: 2018-12-19
基金项目: 国家自然科学基金(No.31440087,31502141);中国博士后科学基金项目(No.2012M520601,2013T60267)
作者简介: 郭文静(1994-), 女, E-mail:710425649@qq.com
通讯作者(责任作者): 曹谨玲, E-mail:caojinling7928@aliyun.com
摘要: 为探究氟对斑马鱼甲状腺内分泌功能的干扰效应,本研究以雌性斑马鱼成鱼为研究对象,分别以不同浓度氟(0、20、40、80 mg·L-1)暴露45 d和90 d,对斑马鱼的生长发育指数进行测定,用组织学方法对斑马鱼甲状腺组织结构进行显微观察,用酶联免疫吸附法检测血浆中T3和T4激素水平,并用实时荧光定量PCR方法检测HPT轴上内分泌相关基因的表达.结果显示,与对照组相比,氟暴露组雌性斑马鱼的生长发育指数随着暴露浓度和时间的增加而呈下降趋势(p < 0.05);甲状腺组织病变程度随着氟暴露浓度的增大和时间的延长而加重;氟暴露45 d时,T3和T4水平呈升高趋势,90 d时,T4水平呈下降趋势且在80 mg·L-1组下降显著(p < 0.05);氟暴露45 d时,40 mg·L-1组除crh处,其他mRNA表达均显著下降(p < 0.05),80 mg·L-1组除tg、nis、ttr外其他mRNA表达均显著下降(p < 0.05);暴露90 d时tg、dio1、dio2的mRNA表达水平在40 mg·L-1和80 mg·L-1组显著上升(p < 0.05),ugt1ab mRNA表达在80 mg·L-1组显著下降(p < 0.05).综上,氟可通过影响雌性斑马鱼的生长发育、甲状腺组织结构、激素水平及HPT轴上内分泌相关基因的表达,从而对其甲状腺内分泌功能产生一定程度的干扰,进而影响机体的生长发育.本研究结果对水环境中氟的生态毒性效应及风险评估提供了理论资料.
关键词:氟化钠雌性斑马鱼甲状腺激素水平mRNA表达
Interference effects of fluoride on thyroid endocrine function in zebrafish
GUO Wenjing1
 , WANG Tianyu1, XUE Wenjuan2, WANG Guodong1,3, HE Xinjin1, WU Panhong1, CHEN Jianjie1, CAO Jinling1
, WANG Tianyu1, XUE Wenjuan2, WANG Guodong1,3, HE Xinjin1, WU Panhong1, CHEN Jianjie1, CAO Jinling1

1. State Key Laboratory of Ecological Animal Husbandry and Environmental Veterinary Medicine, College of Animal Science and Veterinary Medicine, Shanxi Agricultural University, Taigu 030801;
2. Weinan Vocational and Technical College, Weinan 714000;
3. School of Biotechnology and Food Engineering, Anyang Institute of Technology, Anyang 455000
Received 18 October 2018; received in revised from 19 December 2018; accepted 19 December 2018
Abstract: In order to investigate the interference effects of fluoride on thyroid endocrine function in female zebrafish, healthy female zebrafish were exposed to different concentrations of fluoride (0, 20, 40, 80 mg·L-1) for 45 and 90 days to measure the growth and development index, the thyroid microstructure by histological method, the levels of T3 and T4 in plasma by enzyme-linked immunosorbent assay (ELISA), and the expressions of endocrine-related mRNA in hypothalamus-pituitary-thyroid (HPT) axis by Quantitative Real-time PCR. The results showed that the growth and development index had a decreasing trend in fluoride-exposed groups with the increase of exposure concentration and time compared with the control group (p < 0.05). The lesion degree of thyroid tissue was aggravated with the increase of exposure dose and time. The levels of T3 and T4 had an increasing trend after exposure for 45 days, while the T4 level had a decreasing trend and was significantly reduced in 80 mg·L-1 fluoride group after exposure for 90 days (p < 0.05). After exposure for 45 days, all detected mRNA levels were significantly decreased in 40 mg·L-1 fluoride group except crh mRNA (p < 0.05), while the mRNA levels were remarkably reduced in 80 mg·L-1 fluoride group except mRNA of tg, nis, ttr (p < 0.05). After exposure for 90 days, the expressions of tg, dio1, dio2 mRNA were obviously elevated in 40 and 80 mg·L-1 fluoride groups (p < 0.05), while the ugt1ab mRNA levels were significantly decreased in 80 mg·L-1 fluoride group (p < 0.05). These results demonstrated that fluoride could disturb the thyroid endocrine function of female zebrafish by affecting the tissue structure of thyroid, the hormone levels, and the mRNA expressions in HPT axis, which inhibited the growth and development. All above provides the theoretical data for the ecotoxic effects and risk assessment of fluoride in aquatic environment.
Keywords: sodium fluoridefemale zebrafishthyroidhormone levelmRNA expression
1 引言(Introduction)氟是机体必需的微量元素, 摄入适量能维持机体正常的生命活动, 但它还是一种全身性毒物, 摄入过量会对机体、组织细胞产生一系列的毒性效应(陈剑杰等, 2016; Zhang et al., 2017).我国地下水及地方性饮用水中氟含量高的现象颇为严重(韩颖等, 2017; 刘茂等, 2018; 刘春华等, 2018).已有文献发现, 我国氟中毒病区地下水中氟含量约是国家生活饮用水卫生标准的2~10倍(Zheng et al., 2006), 部分地热水中氟含量可达45 mg·L-1 (Ren et al., 1988), 丁坚平等(1998)调查发现贵阳某氟化盐厂废水中氟含量甚至为95.6 mg·L-1.关于水氟含量过高对生物体产生的毒性效应已有一些文献, 为进一步对其进行毒理学方面的研究提供了支持(刘茂等, 2018; 马燕燕等, 2018; 刘忠慧等, 2018).
鱼类等水生生物的生命活动都离不开水环境, 因此水氟对其造成的影响更直接.有关氟对鱼类的毒副作用国内外已有一些报道, 如Singh等(2017)研究发现氟暴露能够减弱促炎反应并诱导体内细胞凋亡, 使斑马鱼易受细菌感染; Li(2016)发现氟暴露可以对斑马鱼性腺中类固醇生成相关基因的结构和表达产生影响; Mukhopadhyay等(2015)发现氟能够对斑马鱼行为和脑内生物标志基因产生影响; 氟能对鲤鱼的肝、脑抗氧化系统产生负面影响从而引起组织的损伤(曹谨玲等, 2013; Cao et al., 2013); 氟能够诱导雌性斑马鱼肝脏氧化应激及相关转录效应(Mukhopadhyay et al., 2014).甲状腺在动物和人的生长发育和维持体内各种功能方面有着非常重要的作用(秦晓飞等, 2009; Jugan et al., 2010; Liu et al., 2011).鱼体内甲状腺活动受到下丘脑-垂体-甲状腺轴(hypothalamic-pituitary-thyroid axis, HPT)的调节, 即下丘脑分泌促肾上腺皮质激素释放激素(corticotropin releasing hormone, CRH), CRH刺激垂体分泌促甲状腺激素(thyroid stimulating hormone, TSH), TSH刺激甲状腺分泌甲状腺激素(thyroid hormones, THs), THs包括四碘甲腺原氨酸(3′-triiodothyronine, T4)和三碘甲腺原氨酸(3′-triiodothyronine, T3).THs的主要功能是调节生长、发育、代谢、生殖和行为.氟对机体内分泌腺的影响已成为近年来的研究热点, 而目前有关氟对鱼类特别是雌性鱼类的甲状腺功能干扰方面的研究却鲜有报道.
基于此本研究以雌性斑马鱼成鱼为研究对象, 采用不同浓度氟进行为期45 d和90 d暴露试验, 并测定生长发育指数, 用组织学方法对斑马鱼甲状腺组织结构进行显微观察, 用酶联免疫吸附法检测血浆中T3和T4激素水平, 并用实时荧光定量PCR方法检测HPT轴上内分泌相关基因的表达.从而揭示氟对斑马鱼甲状腺内分泌功能的干扰效应, 本研究为氟影响斑马鱼生长发育机制提供基础依据, 同时为氟的生态毒理学和生态风险评价研究提供一定的科学依据和理论基础.
2 材料与方法(Material and methods)2.1 试验鱼雌性斑马鱼((0.261±0.042) g)购自太原市花鸟鱼市场.在实验室内水族箱中暂养一周, 挑选大小均匀健康活泼的雌性斑马鱼进行试验.
2.2 主要试剂与仪器氟化钠购自天津天大化工实验厂; 苏木精、伊红购自广东台山化工厂; 斑马鱼T3、T4酶联免疫试剂盒购自上海桥杜生物科技公司; RNAiso Plus、反转录试剂盒、SYBR Green PCR kit均购自大连TaKaRa公司.
轮转切片机(KD-1508R, 浙江金华科迪仪器设备有限公司); 电子分析天平(AUY-120, 日本岛津); 显微成像系统(BX53, 日本奥林巴斯); 酶标仪(iMark, 美国BioRad公司); 实时荧光定量PCR仪(Mx3000P, 美国安捷伦); NanoDrop 2000和-80 ℃超低温冰箱(Thermo Fisher); 冷冻离心机(Allegra 25R, 上海强智生物科技有限公司).
2.3 试验方法将雌性斑马鱼随机分为4个组, 氟暴露浓度分别为0、20、40和80 mg·L-1, 每个浓度3个平行, 每个平行斑马鱼为30尾.试验期间定时定量投喂食物, 自然光照.
2.4 测定指标及方法2.4.1 生长性能测定分别在染毒45 d、90 d时, 随机对每组30尾鱼的体长L(cm)和体重W(g)进行测量.计算公式如下:
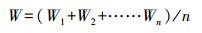 | (1) |
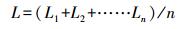 | (2) |
2.4.3 甲状腺激素T3和T4的测定将测量体长和体重后的30尾鱼, 断尾后采血并将每3条鱼的血浆合并, 用于测定血浆中甲状腺激素(T3、T4)含量, 操作步骤依照ELISA试剂盒说明书进行.
2.4.4 HPT轴相关基因表达量的测定氟暴露45 d和90 d时, 每组随机挑选10条鱼, 采用Trizol法提取斑马鱼总RNA, 使用DEPC ddH2O溶解至20 μL, 并用超微量核酸浓度检测仪检测其浓度; 利用TakaRa两步法反转录试剂盒的操作将总RNA反转录为cDNA, 并置于-20 ℃保存备用; 利用NCBI上的基因序列, 应用Beacon Designer 7.8设计特异性引物, 内参采用β-肌动蛋白(β-actin), 引物序列详情见表 1; 实时荧光定量RCR按照SYBR Green PCR kit说明书进行操作, 使用Mx3000P实时荧光定量PCR仪进行检测, 反应体系为20 μL.所得数据用2-△△CT方法处理.
表 1(Table 1)
| 表 1 Real-time PCR引物序列 Table 1 Nucleotide sequence of primers used for real-time PCR | ||||||||||||||||||||||||||||||||||||||||
表 1 Real-time PCR引物序列 Table 1 Nucleotide sequence of primers used for real-time PCR
| ||||||||||||||||||||||||||||||||||||||||
2.5 数据分析采用SPSS19.0对试验数据进行单因素方差分析, LSD法进行多重比较, 采用Pearson进行相关性分析, 以p < 0.05表示差异具有统计学意义.
3 结果与分析(Results and analysis)3.1 氟对斑马鱼生长性能的影响结果如图 1所示, 氟暴露45 d时, 20、40和80 mg·L-1氟暴露组雌性斑马鱼体重与对照组相比分别上升1.34%、下降3.33%和9.34%, 且80 mg·L-1组明显低于对照组(p < 0.05);相关分析显示, 暴露浓度与鱼体重呈负相关(Pearson系数为-0.883, p=0.000).氟暴露90 d时, 与对照组比较, 20、40和80 mg·L-1氟暴露组体重分别下降6.65%、13.29%和22.76%, 且在40 mg·L-1和80 mg·L-1组均明显低于对照组(p < 0.05);相关分析显示, 暴露浓度与鱼体重呈负相关(Pearson系数为-0.984, p=0.000).
图 1(Fig. 1)
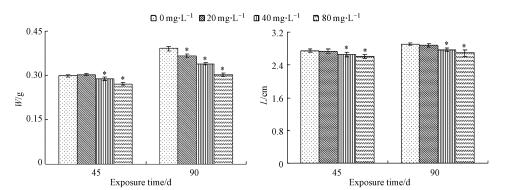 |
| 图 1 氟暴露45 d和90 d时对斑马鱼体重(W)和体长(L)的影响 Fig. 1Effects of fluoride on weight (W) and length (L) in female zebrafish exposed to different concentrations of fluoride for 45 and 90 days (*:p < 0.05) |
氟暴露45 d时, 与对照组比较, 20、40和80 mg·L-1氟暴露组雌性斑马鱼体长分别下降0.44%、3.28%和4.93%, 且40 mg·L-1组和80 mg·L-1组下降明显(p < 0.05);相关分析显示, 暴露浓度与鱼体长呈负相关(Pearson系数为-0.758, p=0.000).氟暴露90 d时, 雌斑马鱼体长与对照组比较, 20、40和80 mg·L-1组体长分别下降0.97%、4.69%和7.44%, 且40和80 mg·L-1组下降明显(p < 0.05);相关分析显示, 暴露浓度与鱼体长呈负相关(Pearson系数为-0.854, p=0.000).
3.2 氟对斑马鱼甲状腺组织结构的影响如图 2所示, 在氟暴露45 d时, 对照组斑马鱼甲状腺滤泡为圆形或椭圆形, 外部由界限分明的上皮细胞包围, 内部胶质均匀填充较为致密(图 2 a).20 mg·L-1组滤泡上皮组织发现增生, 胶质出现缺失(图 2b), 40 mg·L-1组滤泡上皮组织增生有所加重, 胶质缺失增多(图 2c); 80 mg·L-1组呈现出滤泡上皮组织增生进一步加剧和胶质缺失伴有空泡的现象(图 2d).在氟暴露90 d时, 对照组甲状腺滤泡胶质均匀, 上皮细胞规则(图 2 e), 20 mg·L-1组甲状腺滤泡胶质出现缺失, 可见轻微增生(图 2f), 40 mg·L-1组上皮组织增生有所加重, 胶质缺失加重(图 2 g), 80 mg·L-1组可观察到上皮组织增生加重, 胶质出现条形纹理, 胶质缺失加重的现象(图 2h).
图 2(Fig. 2)
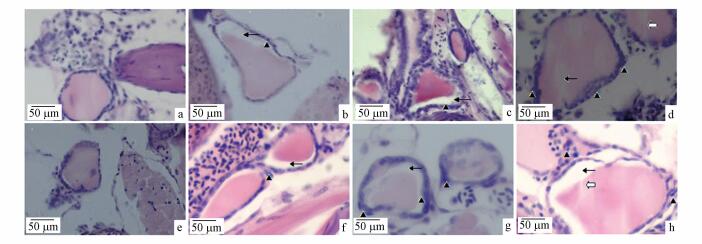 |
图 2 氟暴露45 d和90 d时斑马鱼甲状腺组织切片 (注:a、b、c为45 d时组织切片, d、e、f、为90 d时组织切片; a和d为对照组, b和c为40 mg·L-1组, c和f为80 mg·L-1组, ▲:细胞增生; 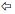 :胶质出现断裂纹理; ←:空泡) Fig. 2Histopathological images of thyroid follicle of female zebrafish after exposure to fluoride for 45 and 90 days :胶质出现断裂纹理; ←:空泡) Fig. 2Histopathological images of thyroid follicle of female zebrafish after exposure to fluoride for 45 and 90 days |
3.3 氟暴露对斑马鱼T3和T4含量的影响如图 3所示, T3含量在氟暴露45 d时, 与对照组比较, 20 mg·L-1组和40 mg·L-1组分别升高1.84%和4.87%, 但差异不明显; 80 mg·L-1组与对照组相比升高22.40%且差异显著(p < 0.05);相关分析显示, 暴露浓度与T3含量呈正相关(Pearson系数为0.559, p=0.01).氟暴露90 d时, 与对照组比较20 mg·L-1组T3含量升高7.03%, 但差异不显著; 40 mg·L-1组和80 mg·L-1组T3含量与对照组相比分别升高20.38%和21.48%且差异显著(p <0.05); 相关分析显示, 暴露浓度与T3含量呈正相关(Pearson系数为0.627, p=0.003).
T4含量在氟暴露45 d时, 与对照组相比20 mg·L-1组、40 mg·L-1组和80 mg·L-1组分别升高2.85%、1.89%和1.20%%, 且差异均不显著; 相关分析显示, 暴露浓度与T4含量呈正相关(Pearson系数为0.168, p=0.832).氟暴露90 d时, 20 mg·L-1组、40 mg·L-1与对照组相比T4含量分别下降0.89%、3.59%, 80 mg·L-1组与对照组相比T4含量下降14.86%且差异显著(p < 0.05), 相关分析显示, 暴露浓度与T4含量呈负相关(Pearson系数为-0.958, p=0.042).
图 3(Fig. 3)
 |
| 图 3 氟暴露45 d和90 d时斑马鱼T3和T4含量 (*:p < 0.05) Fig. 3The concentrations of T3 and T4 in female zebrafish after exposure to fluoride for 45 and 90 days |
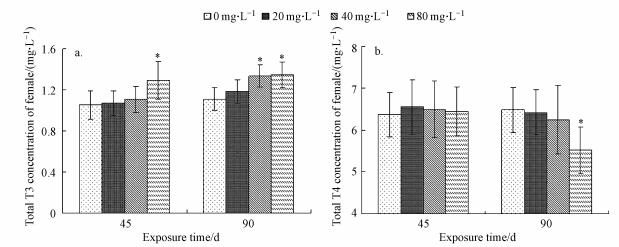
3.4 氟对斑马鱼HPT轴mRNA表达的影响氟暴露45 d时, 与对照组比较, 20 mg·L-1和40 mg·L-1组crh的mRNA表达水平显著上升(p < 0.05)而在80 mg·L-1组显著降低(p < 0.05) (图 4a), tsh、dio1、dio2和ugt1ab的mRNA表达水平在各染毒组均下降, 且在40 mg·L-1和80 mg·L-1组下降显著(p < 0.05) (图 4b~4h), nis的mRNA表达水平在20 mg·L-1显著升高(p < 0.05)而在40 mg·L-1组显著下降(p < 0.05)(图 4c), tg的mRNA表达水平在20 mg·L-1和40 mg·L-1组均显著下降(p < 0.05) (图 4d), ttr的mRNA表达水平在40 mg·L-1组显著下降(p < 0.05) (图 4e).
图 4(Fig. 4)
 |
| 图 4 氟对斑马鱼HPT轴mRNA表达的影响 (*:p < 0.05) Fig. 4Relative fold induction of mRNA levels in zebrafish exposed to fluoride |
氟暴露90 d时, 与对照组比较各染毒组crh、tsh和nis的mRNA表达水平均无显著差异(图 4a~4c), tg和dio1的mRNA表达水平在40 mg·L-1和80 mg·L-1组显著升高(p < 0.05) (图 4d、4f), dio2的mRNA表达水平在各染毒组升高均显著(p < 0.05), 而ttr的mRNA表达水平在40 mg·L-1组显著下降(p < 0.05) (图 4g、4e), ugt1ab的mRNA表达水平在20 mg·L-1和80 mg·L-1组均显著下降(p < 0.05) (图 4h).
4 讨论(Discussion)氟是动物机体生命活动至关重要的微量元素之一, 但过多的摄入也对会机体的正常生长发育造成负面影响.王明等(2016)研究发现高氟暴露能显著抑制蟾蜍幼体体重、体长的增长, 石小涛(2009)对西伯利亚鲟稚鱼研究发现高氟对鱼体生长产生抑制作用, 陈剑杰(2013)报道高氟暴露使鲤鱼生长速率降低, 李晓岚等(2016)研究发现氟中毒能够对儿童体格发育产生影响, 扈丽等(2018)研究也发现氟中毒能够影响仔鼠的生长发育, 米智等(2009)研究发现氟化物对家蚕生长发育存在的影响.本研究也发现, 与对照组相比, 45 d和90 d时氟暴露组鱼的体长、增重有抑制作用, 且具有时间剂量效应关系.
机体摄入过量氟对甲状腺组织及其功能有一定的影响(刘洪亮等, 2013; 崔玉山等, 2016; 王明等, 2016).本试验发现, 试验45 d时甲状腺滤泡可观察到上皮细胞增生和胶质缺失的变化, 这个可能是氟诱导甲状腺产生了自我保护反应, 以其来抵制外界污染物所造成的甲状腺干扰效应.试验90 d时甲状腺滤泡可观察到上皮扁平状和胶质缺损的现象, 揭示由于染毒时间增加以及氟浓度升高, 氟对甲状腺组织和功能的影响超出了其应激代偿能力, 表现出氟对甲状腺组织的负面效应从而呈现出病理变化.甲状腺激素作为HPT轴的关键分泌产物, 在鱼类的许多生理过程起着重要作用(Yamzno et al., 2005; 刘小燕等, 2017).许多环境毒物会对鱼类甲状腺激素水平产生影响, 如久效磷暴露能够造成金鱼体内T3及T3/T4值显著下降(Zhang et al., 2013), 三丁基锡和镉联合暴露2 d可导致鲤鱼血浆中T3、T4值显著下降(木伟娜, 2017), 丁草胺作用于斑马鱼能够使其血浆中T3和T4值升高(常菊花, 2012).本研究也发现氟暴露后能影响甲状腺激素水平, T3水平在所有氟暴露组的鱼中均呈升高趋势, 且在氟暴露45 d时, 与对照组相比80 mg·L-1组显著升高, 90 d时, 与对照组比较40 mg·L-1和80 mg·L-1组均显著升高, 而T4在氟暴露45d和90 d时, 其含量除90 d时80 mg·L-1组明显下降外, 其他各组变化均不显著, 甲状腺激素出现这种现象有可能是由氟暴露剂量的变化引起的.结合甲状腺组织结构的变化, 也暗示其可能在通过增强其合成能力来提高激素生成而抵御氟对其引起的负面效应.
HPT轴多个基因能够调控THs合成、分泌等过程, 如crh、tsh、tg和nis可以影响其合成, ttr能够调节其转运, 而dio1、dio2和ugt1ab能够影响其转化及或消除.环境污染物能够经由一系列的机制对机体HPT轴造成一定的影响, 从而干扰THs的合成和分泌, 最终干扰生物体的相关代谢而造成损伤(Jin et al., 2011).鱼体中CRH对TSH的分泌起重要的调控作用, TSH又可以作用于甲状腺, 从而影响机体中甲状腺激素的合成和分泌.本研究发现, 氟暴露45 d时, crh基因的表达量的变化的趋势与血液中T4含量的变化趋势相似, 这种现象出现的原因可能是氟暴露导致垂体和下丘脑中的相关基因受到影响而产生的.而暴露90 d时, crh基因的表达量呈升高趋势而血液T4含量为下降趋势, 这可能是因为T4含量下降而形成的负反馈调控, 导致基因的代谢增强, 因此在HPT轴上出现一连串的级联效应, 得以保持机体甲状腺激素的平衡.NIS是甲状腺的重要功能基因, 可以促进其碘和钠进入甲状腺的滤泡细胞, 从而促进其激素的合成(解雨春等, 2012).TG是甲状腺激素的前体蛋白, 与其合成和分泌的能力有关(涂文清, 2014).所以两者的变化可能影响到THs的生成.江鹏(2009)通过氟染毒FRTL细胞发现, 随着氟暴露浓度的上升, nis和tg的基因表达水平整体下降.张维东(2008)也发现随着氟暴露浓度的上升染毒大鼠nis和tg基因表达水平整体下降.本试验也发现, 氟暴露45 d时, 暴露组nis和tg的基因表达水平均低于对照组, 这可能是因为甲状腺激素含量升高, 致使tsh表达降低所致.而在氟暴露90 d时, tg的mRNA表达水平在40 mg·L-1和80 mg·L-1组升高明显, 这可能与氟暴露后导致甲状腺组织出现病理变化有关.TTR作为鱼类体内重要的甲状腺激素载运蛋白, 能够调控甲状腺激素的分配, 如果其基因表达遭受阻碍, 将会影响机体中THs水平的平衡(Schreiber, 2002).本试验发现, 在氟暴露45 d和90 d时, ttr基因表达整体呈现为下调, 这与血液中T3水平上升相反, 这可能是由于氟对TTR载运T3的功能形成了一定的干扰效应, 导致了负反馈的调控, 即当TTR载运功能下降时, 使T3含量增加.脱碘酶是一类催化生物体内THs脱碘转化过程的重要酶类, 其活性的变化不仅可以反映鱼类体内THs相互转化和降解的情况, 而且能反映外周组织对T3的需求程度(瞿璟琰等, 2008).脱碘酶在鱼类体内能表现出作用的主要是DIO1和DIO2, D1能够使T4外环脱碘为T3, 还能使T4内环脱碘为rT3, D2只可使T4外环脱碘为T3 (Yu et al., 2010; 刘莉云, 2017).本研究中氟暴露对dio1和dio2基因表达呈现出短期抑制, 长期诱导的作用, 与T4含量变化趋势一致.且暴露90 d时, T3含量上升显著, 这可能是氟诱导脱碘酶基因表达增强导致.UDPGT在甲状腺激素的代谢过程中也起着重要的生理作用(Hood et al., 2000; 谢鹏等, 2016).ugt1ab基因诱导UDPGT的产生, 一部分T4可以在UDPGT的作用下与葡萄糖醛酸形成水溶性比较强的复合物而失活(Davey et al., 2008).Yu等(2010)的研究发现DE-71暴露14 d的斑马鱼幼鱼体内ugt1ab基因表达增高, T4浓度水平降低.常菊花(2012)的研究发现丁草胺能够显著下调斑马鱼胚胎ugt1ab基因表达, T4浓度水平上升.本研究中也发现氟暴露45 d时ugt1ab基因表达降低而T4浓度水平升高.这可能是ugt1ab基因表达降低会减弱对T4的代谢和清除水平从而导致T4浓度水平升高.而在90 d时氟高浓度暴露udpgt表达和体内T4浓度水平都明显下降, 这可能是甲状腺组织受到氟暴露病理损伤后导致其功能下降引起的.
5 结论(Conclusions)氟可通过影响斑马鱼HPT轴中基因的表达来干扰机体内甲状腺激素的含量, 进而影响机体的生长发育.研究结果为氟影响斑马鱼生长发育机制提供基础依据, 同时为水环境中氟的生态毒性效应及风险评估提供了理论资料, 而有关氟对鱼类甲状腺内分泌功能干扰效应的机理还需进一步深入研究.
参考文献
| Aurea Orozco D, Valverde R C. 2005. Thyroid hormone deiodination in fish[J]. Thyroid, 15(8): 799–813.DOI:10.1089/thy.2005.15.799 |
| Bhatnagar C, Bhatnagar M, Regar B C. 2007. Fluoride-induced histopathological changes in gill, kidney, and intestine of fresh water teleost, Labeo rohita[J]. Fluoride, 40(1): 55–61. |
| Cao J L, Chen J J, Wang J D, et al. 2013. Effects of fluoride on liver apoptosis and Bcl-2, Bax protein expression in freshwater teleost, Cyprinus carpio[J]. Chemosphere, 91(8): 1203–1212.DOI:10.1016/j.chemosphere.2013.01.037 |
| 曹谨玲, 陈剑杰, 王俊东, 等. 2013. 氟对鲤鱼脑抗氧化系统及细胞凋亡的影响[J]. 环境科学学报, 2013, 33(3): 861–866. |
| Chen J J, Cao J L, Wang J D, et al. 2013. Effects of fluoride on growth, body composition and serum biochemical profile in a freshwater teleost, Cyprinus carpio[J]. Environmental Toxicology & Chemistry, 32(10): 2315–2321. |
| Chen J J, Xue W J, Cao J L, et al. 2016. Fluoride caused thyroid endocrine disruption in male zebrafish (Danio rerio)[J]. Aquatic Toxicology, 171: 48–58.DOI:10.1016/j.aquatox.2015.12.010 |
| 常菊花. 2012.丁草胺对斑马鱼的内分泌干扰效应研究[D].南京: 南京农业大学. 1-126http://cdmd.cnki.com.cn/Article/CDMD-10307-1013282619.htm |
| 崔玉山, 赵亮, 曾强, 等. 2016. 氧化应激在高碘高氟致甲状腺损伤中的作用[J]. 环境与职业医学, 2016, 33(1): 7–12. |
| Davey J C, Nomikos A P, Manida W, et al. 2008. Arsenic as an endocrine disruptor:arsenic disrupts retinoic acid receptor-and thyroid hormone receptor mediated gene regulation and thyroid hormone mediated amphibian tail metamorphosis[J]. Environmental Health Perspectives, 116(2): 165–172.DOI:10.1289/ehp.10131 |
| De Groef B, Van der Geyte n S, Darras V M, et al. 2006. Role of corticotropin-releasing hormone as a thyrotropin-releasing factor in non-mammalian vertebrates[J]. Gen Comp Endocrinol, 146(1): 62–68.DOI:10.1016/j.ygcen.2005.10.014 |
| 丁坚平, 毛健全, 顾尚义. 1998. 贵阳大坝地区熔岩地下水氟污染及其防治[J]. 环保科技, 1998, 3: 14–15. |
| 韩颖, 张宏民, 张永峰, 等. 2017. 大同盆地地下水高砷、氟、碘分布规律与成因分析及质量区划[J]. 中国地质调查, 2017, 4(1): 57–68. |
| Hood A, Klaassen C D. 2000. Differential effects of microsomal enzyme inducers on in vitro thyroxine (T4) and triiodothyronine (T3) glucuronidation[J]. Toxicological Sciences, 55(1): 78–84.DOI:10.1093/toxsci/55.1.78 |
| 扈丽, 王正蓉, 喻茂娟. 2018. 氟中毒对仔鼠生长和神经行为发育的影响[J]. 贵州医科大学学报, 2018, 7: 757–761. |
| 江鹏, 张维东, 柴春彦, 等. 2009. 氟化物对FRTL细胞甲状腺激素代谢相关基因表达的影响[J]. 中国兽医学报, 2009, 29(7): 885–888. |
| Jin Y, Chen R, Wang L, et al. 2011. Effects of metolachlor on transcription of thyroid system-related genes in juvenile and adult Japanese medaka (Oryzias latipes)[J]. General & Comparative Endocrinology, 170(3): 487–493. |
| Jugan M L, Levi Y, Blondeau J P. 2010. Endocrine disruptors and thyroid hormone physiology[J]. Biochemical Pharmacology, 79(7): 939–947.DOI:10.1016/j.bcp.2009.11.006 |
| 瞿璟琰, 施华宏, 刘青坡, 等. 2008. 四溴双酚-A和五溴酚对红鲫甲状腺激素和脱碘酶的影响[J]. 环境科学学报, 2008, 28(8): 1625–1630.DOI:10.3321/j.issn:0253-2468.2008.08.020 |
| Liu S, Chang J, Zhao Y, et al. 2011. Changes of thyroid hormone levels and related gene expression in zebrafish on early life stage exposure to triadimefon[J]. Environ Toxicol Pharmacol, 32(3): 472–477.DOI:10.1016/j.etap.2011.09.002 |
| 刘春华, 王威, 卫政润, 等. 2018. 微山湖流域高氟地下水的成因分析[J]. 地球学报, 2018, 39(3): 351–357. |
| 刘小燕, 刘珊, 张丽娟, 等. 2017. 六溴环十二烷对斑马鱼的甲状腺激素干扰效应研究[J]. 农业环境科学学报, 2017, 36(11): 2192–2198.DOI:10.11654/jaes.2017-0509 |
| 刘忠慧, 王洋, 李文凤, 等. 2018. 天津市儿童氟斑牙现状与水氟健康风险评价[J]. 公共卫生与预防医学, 2018, 3: 22–25. |
| 刘茂, 夏玉婷, 汪旸, 等. 2018. 江苏省17个病区县饮水型氟中毒监测结果分析[J]. 中华地方病学杂志, 2018, 37(1): 40–44.DOI:10.3760/cma.j.issn.2095-4255.2018.01.009 |
| 刘洪亮, 于林玉, 崔玉山, 等. 2013. 长期摄入过量氟对大鼠甲状腺形态和功能的影响[J]. 环境卫生学杂志, 2013, 5: 390–393. |
| 刘莉云. 2017.离子液体对人肝癌细胞HepG2活性氧水平和斑马鱼的毒性影响及机理研究[D].镇江: 江苏大学.37-52http://cdmd.cnki.com.cn/Article/CDMD-10299-1017717598.htm |
| 李晓岚, 张复兰. 2016. 氟中毒对儿童智力、体格发育及血清骨形态发生蛋白水平的影响[J]. 中国地方病防治杂志, 2016(8): 895–895. |
| 马燕燕, 周月红, 王敬花. 2018. 高氟水源对妇女体内性激素结合蛋白与雌二醇水平的影响[J]. 中国医药指南, 2018, 16(12): 163–164. |
| Manchado M, Infante C, Asensio E, et al. 2008. Thyroid hormones down-regulate thyrotropin β subunit and thyroglobulin during metamorphosis in the flatfish Senegalese sole (Solea senegalensis Kaup)[J]. General and Comparative Endocrinology, 155(2): 447–455.DOI:10.1016/j.ygcen.2007.07.011 |
| 米智, 柳照应, 朱勇. 2009. 氟化物对家蚕生长发育的影响[J]. 蚕学通讯, 2009, 29(3): 42–46.DOI:10.3969/j.issn.1006-0561.2009.03.010 |
| 木伟娜. 2017.低剂量三丁基锡和镉联合暴露对鲤鱼甲状腺轴及抗氧化指标的影响[D].武汉: 华中农业大学, 22-39http://cdmd.cnki.com.cn/Article/CDMD-10504-1017190937.htm |
| Mukhopadhyay D, Priya P, Chattopadhyay A. 2015. Sodium fluoride affects zebrafish behaviour and alters mRNA expressions of biomarker genes in the brain:Role of Nrf2/Keap1[J]. Environmental Toxicology & Pharmacology, 40(2): 352–359. |
| Mukhopadhyay D, Chattopadhyay A. 2014. Induction of oxidative stress and related transcriptional effects of sodium fluoride in female zebrafish liver[J]. Bull Environ Contam Toxicol, 93(1): 64–70.DOI:10.1007/s00128-014-1271-0 |
| 秦晓飞, 秦占芬, 徐晓白. 2009. 非洲爪蟾在生态毒理学研究中的应用:甲状腺干扰作用评价[J]. 环境科学学报, 2009, 29(8): 1589–159.DOI:10.3321/j.issn:0253-2468.2009.08.002 |
| Ren F H, Jiao S Q. 1988. Distribution and formation of high-fluorinegroundwater in China[J]. Environmental Geology, 12(1): 3–10. |
| Schreiber G. 2002. The evolutionary and integrative roles of transthyretin in thyroid hormone homeostasis[J]. Journal of Endocrinology, 175(1): 61–73. |
| 石小涛, 庄平, 章龙珍, 等. 2009. 水暴露下氟在西伯利亚鲟稚鱼硬骨和软骨中的积累和消除[J]. 生态毒理学报, 2009, 4(2): 218–223. |
| Shi X, Zhuang P, Zhang L, et al. 2009. The bioaccumulation of fluoride ion (F-) in Siberian sturgeon (Acipenser baerii) under laboratory conditions[J]. Chemosphere, 75(3): 376–380.DOI:10.1016/j.chemosphere.2008.12.042 |
| Singh R, Khatri P, Srivastava N, et al. 2017. Fluoride exposure abates pro-inflammatory response and induces in vivo apoptosis rendering zebrafish (Danio rerio) susceptible to bacterial infections[J]. Fish & Shellfish Immunology, 63(4): 314–321. |
| 涂文清. 2014.几种典型污染物对斑马鱼的甲状腺干扰效应[D].杭州: 浙江工业大学. 59-71http://cdmd.cnki.com.cn/article/cdmd-10337-1015502446.htm |
| 王明. 2016.氟化物对中华大蟾蜍和中国林蛙生长发育的毒理效应研究[D].西安: 陕西师范大学. 1-78http://cdmd.cnki.com.cn/Article/CDMD-10718-1017034822.htm |
| 解雨春, 李文, 汤金梅, 等. 2012. Aroclor1254对大鼠甲状腺结构及功能的影响[J]. 环境科学学报, 2012, 32(11): 2891–2897. |
| 谢鹏, 李婷婷, 季晖. 2016. 尿苷二磷酸葡萄糖醛酸转移酶的转录调节与疾病相关性的研究进展[J]. 药学研究, 2016, 35(5): 295–299. |
| Zhang X, Tian H, Wang W, et al. 2013. Exposure to monocrotophos pesticide causes disruption of the hypothalamic-pituitary-thyroid axis in adult male goldfish (Carassius auratus)[J]. Gen Comp Endocrinol, 193(4): 158–166. |
| Zheng L C, Luo H J, Kazurou B, et al. 2006. High fluoridegroundwater with high salinity and fluorite in aquifer sediments ininner Mongolia, China[J]. Chinese Journal of Geochemistry, 25(supplement 1): 103–103. |
| 张维东. 2008.氟诱发甲状腺肿的分子病理学研究[D].兰州: 甘肃农业大学. 1-84http://cdmd.cnki.com.cn/Article/CDMD-10733-2009029105.htm |
| Zhang J, Zhu Y, Shi Y, et al. 2017. Fluoride-induced autophagy via the regulation of phosphorylation of mammalian targets of rapamycin in mice leydig cells[J]. Journal of Agricultural & Food Chemistry, 65(40): 8966–8976. |
| 朱莉萍, 胡秀, 杨林, 等. 2016. 芪参二术汤对氟所致大鼠甲状腺损伤的保护作用研究[J]. 世界中西医结合杂志, 2016, 11(11): 1536–1539. |
