 , 韩芸1
, 韩芸1
 , 廖杰2, 张婷凤3, 刘琳3, 徐开钦4, 刘超翔3
, 廖杰2, 张婷凤3, 刘琳3, 徐开钦4, 刘超翔3

1. 西安建筑科技大学环境与市政工程学院, 西北水资源与环境生态教育部重点实验室, 西安 710055;
2. 厦门理工学院环境科学与工程学院, 厦门 361005;
3. 中国科学院城市环境研究所, 厦门 361021;
4. 日本国立环境研究所, 筑波 305-8506
收稿日期: 2018-07-11; 修回日期: 2018-09-20; 录用日期: 2018-09-20
基金项目: 福建省教育厅项目(No.JAT17041);福建省科技厅STS项目(No.2016T3006);福建省科技计划对外合作项目(No.2016I0016);陕西省自然科学基金(No.2017JM5090)
作者简介: 李杰(1993-), 男, E-mail:jielixiansheng@icloud.com
通讯作者(责任作者): 韩芸, Email:hanyun@xauat.edu.cn
刘超翔, Email:cxliu@iue.ac.cn
摘要: 厌氧氨氧化过程作为滨海生态系统氮去除的有效途径,对维持滨海生态系统氮元素收支平衡具有重要意义.本研究采用基于16S rRNA基因的荧光定量PCR(qPCR)技术,并结合环境因子,对红树林湿地中厌氧氨氧化菌基因丰度和相对丰度的存在特征进行考察.结果表明,在红树林湿地0~65 cm深度的沉积物中均检出厌氧氨氧化菌,随距排污口距离及深度的增加,本研究中厌氧氨氧化菌基因丰度和相对丰度未发现明显的分布规律.相关性分析表明,厌氧氨氧化菌基因丰度和相对丰度在红树林湿地沉积物中的空间分布与环境因子密切相关,厌氧氨氧化菌基因丰度与总氮(TN)、总有机碳(TOC)和总碳(TC)呈显著正相关,氨氮(NH4+-N)、亚硝氮(NO2--N)、硝态氮(NO3--N)和电导率(EC)是影响厌氧氨氧化菌基因丰度的重要因子;相对丰度与C:P、N:P比值呈显著正相关,C:N比值、总碳(TC)和电导率(EC)是影响厌氧氨氧化菌基因相对丰度的重要因子.综上,针对厌氧氨氧化菌16S rRNA定量分析在一定程度上揭示了红树林湿地厌氧氨氧化菌基因丰度、相对丰度与环境因子的耦合关系.
关键词:厌氧氨氧化菌丰度分布相对丰度分布环境因子
Existence characteristics of anaerobic ammonia oxidizing bacteria in wastewater treatment process from mangrove wetland
LI Jie1,3
 , HAN Yun1
, HAN Yun1
 , LIAO Jie2, ZHANG Tingfeng3, LIU Lin3, XU Kaiqin4, LIU Chaoxiang3
, LIAO Jie2, ZHANG Tingfeng3, LIU Lin3, XU Kaiqin4, LIU Chaoxiang3

1. Key Lab of Northwest Water Resources, Environment and Ecology, Ministry of Education, School of Environmental and Municipal Engineering, Xi'an University of Architecture and Technology, Xi'an 710055;
2. School of Environmental Science and Engineering, Xiamen University of Technology, Xiamen 361005;
3. Institute of Urban Environment, Chinese Academy of Sciences, Xiamen 361021;
4. National Institute of Environmental Studies, Tsukuba 305-8506, Japan
Received 11 July 2018; received in revised from 20 September 2018; accepted 20 September 2018
Abstract: Anaerobic ammonia oxidation (anammox) process as the effective pathway of promoting the nitrogen removal play the important role in the process of coastal ecosystem nitrogen balance. In this study, the existence characteristics of anammox bacteria genes abundance and relative abundance in wastewater treatment process from mangrove wetland were investigated based on quantitative real-time PCR(qPCR) and environmental factors analysis. The results showed that anammox bacteria genes was detected in the all samples from the mangrove wetland sediment at 0~65 cm depth. Although the obvious distribution regulation of anammox bacteria genes absolute abundance and relative abundance along with the increase of distance from sewage outlet and depth was not be found, the correlation analysis showed that the spatial abundance and relative abundance distribution of anammox bacteria genes was closely related to environmental factors. In term of absolute abundance, anammox bacteria genes abundance was significantly positively correlated with total nitrogen (TN), total carbon (TC) and total organic carbon (TOC), and ammonia nitrogen (NH4+-N), nitrite nitrogen (NO2--N), nitrate nitrogen (NO3--N) and electrical conductivity (EC) can also affect the abundance of anammox bacteria genes. In term of relative abundance, the relative abundance of anammox bacteria genes was significantly positively correlated with C:P and N:P ratio, and total carbon (TC), C:N ratio and electrical conductivity (EC) can also affect the relative abundance of anammox bacteria genes. To summarize, the relationship between anammox bacteria genes abundance, relative abundance and environmental factors was revealed by the quantitative analysis of anammox bacteria 16S rRNA in a certain degree.
Keywords: anammox bacteriaabundance distributionrelative abundance distributionenvironmental factors
1 前言(Introduction)长期以来, 氨的氧化被人们一直认为是在有氧的环境下进行的, 并且认为反硝化作用是将活性氮转化为氮气(N2)的唯一途径. 20世纪后期, Broda(1977)、Mulder(1992)、Van de Graaf(1995)等相继推测、发现和证明了厌氧/缺氧环境可将氨转化为氮气的生物转化新途径, 将其命名为厌氧氨氧化反应(anaerobic ammonium oxidation, anammox), 该反应是分别以氨盐(NH4+)和亚硝酸盐(NO2-)为电子供体和电子受体的生物脱氮过程.目前, 已有大量研究表明厌氧氨氧化菌和厌氧氨氧化反应广泛存在于海洋(Thamdrup et al., 2002; 付璐璐等, 2016)、淡水(Zhang et al., 2007)、陆地(Shen et al., 2013; 庄林杰等, 2017)、滨海湿地(Wang et al., 2012)等自然生态系统中.厌氧氨氧化过程已被证明是地球生物氮循环的重要组成部分(Strous et al., 2004).
基于分子生物学和同位素示踪方法的发展, 厌氧氨氧化菌在各个生态系统氮循环中发挥的重要作用陆续被证明(Dalsgaard et al., 2003; Zhu et al., 2011; Wang et al., 2012).同时有研究表明, 在生态系统中, 厌氧氨氧化菌的分布呈现出种群多样性(Dale et al., 2009; Hou et al., 2013);反硝化作用等脱氮过程和环境因子对厌氧氨氧化菌的群落、丰度和活性有着重要的影响(Li et al., 2011a; Nicholls et al., 2009; Zhou et al., 2014; 郑艳玲等, 2015; 付璐璐等, 2016), 但是对厌氧氨氧化菌影响因素和机理的了解仍不是十分清楚.
厌氧氨氧化是滨海生态系统氮去除的有效途径.红树林湿地作为典型的滨海湿地系统, 处于陆地和海洋之间, 由于沿海地区经济的迅猛发展, 特别是近海海产养殖业的发展, 其受大量人为污染物输入的影响日益严重.目前虽然有****对厌氧氨氧化菌在土壤表层和垂直方向的分布规律有少量研究, 但在受外源污染物冲击的滨海湿地中厌氧氨氧化菌的垂直分布规律仍不甚了解(Zhu et al., 2011; Shen et al., 2015; 夏超等, 2015).基于此, 本文通过采集红树林自然湿地不同深度的沉积物, 利用16S rRNA定量沉积物中的厌氧氨氧化菌, 研究厌氧氨氧化菌基因丰度和相对丰度的垂直分布规律, 并探讨影响其基因丰度和相对丰度的关键环境因子.此举丰富了中国红树林湿地中厌氧氨氧化菌基因丰度、相对丰度和环境因子之间耦合关系的数据, 可为今后研究红树林湿地中厌氧氨氧化菌的群落分布特性和基因丰度季节差异性提供基础理论依据.
2 材料与方法(Materials and methods)2.1 研究区概况龙海九龙江口红树林保护区(117°54′E~118°03′E, 24°20′N~24°32′N), 位于九龙江入海口的滩涂潮间带, 河海相互作用, 淡咸水交汇, 有潮汐作用, 以红树林生态系统和濒危动物物种为主要保护对象.该保护区属南亚热带海洋性季风气候, 暖热湿润, 干、湿季分明, 多年平均温度21 ℃.保护区面积420 hm2, 区内红树林林地面积已达379.8 hm2, 主要红树植物为秋茄(Kandelia obova-ta)、桐花树(Aegiceras coniculatum)、白骨壤(Avicennia marina)等(金亮等, 2018).
2.2 样品采集与保存根据九龙江红树林保护区的潮滩环境差异性和周边海产养殖户排污口设置特点, 以两个相距400 m左右的海产养殖排污口为横轴, 距其中一个排污口的距离分别为20 m(1#)、100 m(2#)、200 m(3#)选取3个采样点.用不锈钢铲从3个区域(100 cm × 100 cm范围内)采集潮滩表层(0~5 cm)、中层(10~15 cm、20~25 cm、30~35 cm)和深层(40~45 cm、50~55 cm、60~65 cm)沉积物密封置于无菌聚乙烯塑料袋中, 并在4 ℃冷藏保存, 回到实验室后立即对每个采样点不同深度的沉积物分别进行混匀.将部分沉积物保存于4 ℃待沉积物理化性质的分析, 另一部分沉积物样品保存于-20 ℃待DNA的提取和后续分子生物学的分析.
2.3 环境因子测定沉积物pH和电导率(EC)分别用ST3100 pH计和Muti 3620 IDS水质分析仪测定(无CO2去离子水:沉积物= 2.5:1).含水率(MC)以105 ℃下的失水量计算.将冷冻风干后的沉积物于马弗炉中550 ℃灰化3 h, 根据烧失量计算沉积物有机质(TOM), 然后取一定量灰化的样品经1 mol·L-1 HCl浸提后采用抗坏血酸-钼蓝比色法测定总磷(TP)(Murpgy et al., 1962).将冷冻风干研磨过筛的沉积物经浓盐酸熏蒸24 h后利用Elementar VARIO MAX CNS元素分析仪测定沉积物中有机碳的含量(TOC)(Harris et al., 2001).沉积物总碳(TC)、总氮(TN)和总硫(TS)是将沉积物冷冻风干研磨后利用Elementar VARIO MAX CNS元素分析仪测定.新鲜沉积物中可交换无机氮经2 mol·L-1 KCl浸提后, 氨氮(NH4+-N)采用纳氏试剂法测定(中国科学院南京土壤研究所, 1978), 亚硝氮(NO2--N)采用重氮偶氮法测定, 硝态氮(NO3--N)采用2% VCl3还原-重氮偶氮法测定(Emilio et al., 2014).沉积物样品所有的理化性质指标均进行3次重复测定, 并取其平均值为最终结果.
2.4 DNA提取和PCR扩增沉积物总DNA提取采用FastDNATM Spin Kit for Soil DNA提取试剂盒(MP Biomedicals, USA).称取约0.5 g沉积物样品参照试剂盒使用说明提取沉积物中总DNA, 并用Nano Drop 2000UV-Vis Spectrophotometer(Thermo Fisher Scientific, USA)测定浓度.用引物341f/534r(Nishijima et al., 2010)扩增总细菌16S rRNA基因片段;运用巢式PCR扩增方法扩增厌氧氨氧化菌16S rRNA基因片段, 初次PCR用PLA46f/1390r(Schmid et al., 2000)扩增浮霉状菌门16S rRNA, 再以初次扩增产物为模板采用引物Amx368f/Amx820r(Schmid et al., 2005)扩增厌氧氨氧化菌16S rRNA.均采用25 μL扩增体系:DNA模板1μL, 引物各1 μL, 2×Master Mix 12.5 μL, ddH2O 9.5 μL.扩增条件为:94 ℃ 3 min, 94 ℃ 30 s, 55 ℃ 30 s(Amx368f/Amx820r为56 ℃ 30 s), 72 ℃ 1 min, 30个循环.采用1%凝胶电泳检测扩增产物质量和特异性. PCR扩增产物外送用于总细菌16S rRNA、厌氧氨氧化菌16S rRNA质粒标准品的制备(美吉生物, 上海), 载体为pMD 18-T.
2.5 荧光定量PCR总细菌16S rRNA和厌氧氨氧化菌16S rRNA定量采用TransStart?Top Green qPCR SuperMix(SuperMix)试剂盒(全式金, 北京)进行荧光定量PCR(qPCR)反应(LightCycler480II, Roche, Germany).用引物341f/534r和Amx368f/Amx820r分别定量总细菌16S rRNA和厌氧氨氧化菌16S rRNA的拷贝数, 20 μL反应体系为:DNA模板2 μL, 引物各0.4 μL, SuperMix 10 μL, ddH2O 7.2 μL, 反应程序为:94 ℃ 30 s, 94 ℃ 5 s, 55 ℃ 15 s(Amx368f/Amx820r为56 ℃ 15 s), 72 ℃ 10 s, 40个循环.所得质粒标准品10倍梯度稀释, 同时添加阴性对照.最后以质粒拷贝数的对数值为横坐标, 以平均Ct值为纵坐标, 绘制标准曲线, 并换算沉积物样品中总细菌16S rRNA和厌氧氨氧化菌16S rRNA基因的拷贝数.每个样品做3次平行, 最终结果扩增效率在90%~110%之间, 可决系数R2> 0.99, 溶解曲线为单一峰.
3 结果(Results)3.1 厌氧氨氧化菌基因丰度和相对丰度红树林湿地0~5 cm、30~35 cm、60~65 cm深度的沉积物样品提取DNA后, 针对厌氧氨氧化菌16S rRNA基因进行巢式PCR扩增并经1%凝胶电泳特异性检测, 初步检出红树林湿地中存在厌氧氨氧化菌.通过qPCR定量沉积物样品中总细菌16S rRNA和厌氧氨氧化菌16S rRNA基因拷贝数, 厌氧氨氧化菌的相对丰度即厌氧氨氧化菌16S rRNA占总细菌16S rRNA基因拷贝数的比值.总细菌16S rRNA拷贝数范围为4.56×108~9.91×109 copies·g-1 (干重), 厌氧氨氧化菌16S rRNA拷贝数范围为3.31×104~2.80×107 copies·g-1(干重).厌氧氨氧化菌的基因丰度和相对丰度分布特性如图 1所示.
图 1(Fig. 1)
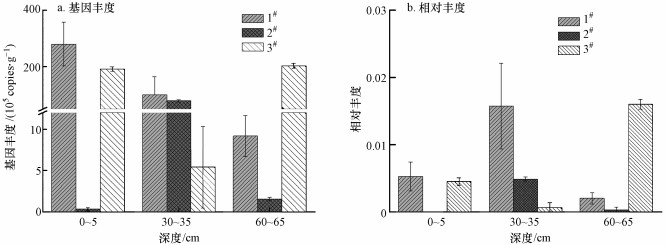 |
| 图 1 厌氧氨氧化菌的基因丰度和相对丰度分布特性 Fig. 1Distribution characteristics of genes abundance and relative abundance of anammox bacteria |
由图 1a可知, 1#、2#和3#点位的厌氧氨氧化菌基因丰度最大值分别为2.80×107、7.97 × 106、2.04×107 copies·g-1(干重).随深度的增加, 1#、2#和3#点位的厌氧氨氧化菌基因丰度分布并不完全一致, 1#的厌氧氨氧化菌基因丰度随深度增加呈逐渐降低的趋势, 2#的厌氧氨氧化菌基因丰度最大值出现在30~35 cm处, 3#的厌氧氨氧化菌基因丰度在30~35 cm处反而最低, 可见随距排污口距离及深度的增加, 厌氧氨氧化菌基因丰度未发现明显的分布规律.由图 1b可知, 1#、2#和3#点位的厌氧氨氧化菌相对丰度分布亦不完全一致, 1#、2#的厌氧氨氧化菌相对丰度最大值出现在30~35 cm处, 而3#表现为60~65 cm处厌氧氨氧化菌相对丰度最高.相较总细菌16S rRNA基因拷贝数, 厌氧氨氧化菌16S rRNA基因拷贝数很小, 仅占3.34×10-6~1.60×10-2, 由此可知, 厌氧氨氧化菌生物量占细菌总量的比例很小.
3.2 厌氧氨氧化菌与细菌总量及其比值之间的关系利用SPSS 22.0软件进行单样本K-S检验和双变量相关性分析(Pearson相关系数), 将经qPCR定量后的总细菌16S rRNA和厌氧氨氧化菌16S rRNA基因拷贝数及二者拷贝数比值做对数处理, 用单样本K-S检验验证总细菌16S rRNA和厌氧氨氧化菌16S rRNA基因丰度及相对丰度数值的正态性, 结果表明总细菌基因丰度(p=0.2 > 0.05)、厌氧氨氧化菌基因丰度(p=0.113 > 0.05)和厌氧氨氧化菌相对丰度(p=0.2 > 0.05)在本研究区域的红树林湿地中具有一定的空间异质性.对总细菌16S rRNA基因丰度和厌氧氨氧化菌16S rRNA基因丰度及相对丰度对数值进行双变量相关性验证(Pearson相关系数), 结果表明总细菌丰度与厌氧氨氧化菌丰度之间无显著相关性(p>0.05, r=0.053), 总细菌丰度与厌氧氨氧化菌相对丰度之间亦无显著相关性(p>0.05, r=-0.381), 而厌氧氨氧化菌丰度与其相对丰度之间存在显著的正相关性(p < 0.05, r=0.903).
3.3 红树林湿地沉积物环境因子的分布特征3.3.1 沉积物理化性质的分布特征红树林湿地沉积物基本理化性质的垂直分布特征如图 2所示. 1#、2#和3#点位沉积物的MC、pH和EC变化范围分别为47.83%~55.36%、6.0~7.97和4.84~10.63 mS·cm-1. 2#表层和中层沉积物中的EC变化规律与1#相似, 从整体来看, 1#和3#的EC稍大于2#. 1#、2#和3#点位沉积物的NH4+-N、NO2--N、NO3--N和TN含量变化范围为3.79~16.73 mg·kg-1、0.00~0.18 mg·kg-1、0.00~3.17 mg·kg-1和1.25~1.78 g·kg-1. NH4+-N在2#和3#点位沉积物中随深度增加呈波状增大趋势, 而在1#中呈下降趋势, 从整体来看, 2#点位NH4+-N含量稍高于1#和3#点.沉积物的NO2--N含量均较低, 且随深度的增加呈波状下降的趋势, 其中1#和2#点位NO2--N含量在表层沉积物中最高.沉积物的NO3--N含量均较低, 且无明显变化规律. TN在沉积物中随深度增加呈波状下降趋势, 2#和3#点位的表层沉积物中TN含量最高.
图 2(Fig. 2)
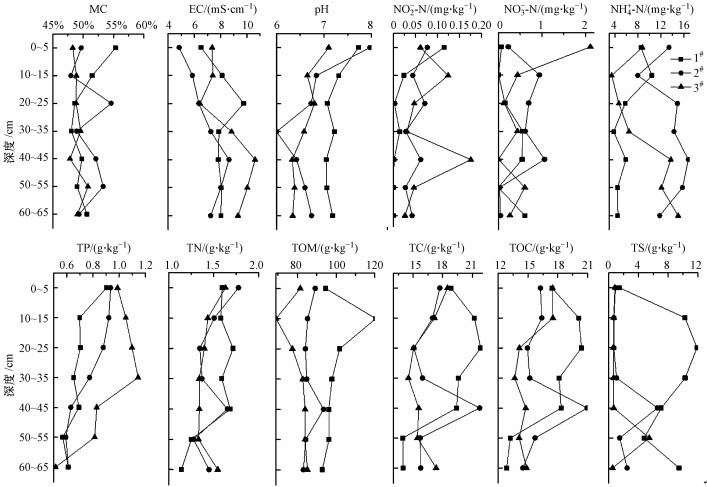 |
| 图 2 红树林湿地沉积物理化性质的垂直分布特征 Fig. 2Vertical distribution characteristics of the sediment physiochemical property in mangrove wetland |
1#、2#和3#点位沉积物的TOM、TP、TC、TOC和TS含量变化范围为69.04~120.42、0.51~1.14、13.94~21.84、13.22~20.96、0.52~11.88 g · kg-1.随深度增加, 1#、2#点位沉积物中TP含量变化规律较为一致, 呈波状下降趋势, 而3#的TP含量呈先增加再下降的趋势, 且从整体来看, TP含量呈现出3# > 2# > 1#.而TOM含量呈现出1#> 2# > 3#, 与TP相反. TOC/TC在沉积物样品的比值为91.37~99.88%, TOC和TC具有一致的变化趋势, 但无明显的变化规律. TS在沉积物中无明显的变化规律, 1#点位TS含量高于2#和3#.
3.3.2 沉积物元素比值的分布特征红树林湿地沉积物元素比值垂直分布见表 1. 1#、2#和3#点位沉积物中C : N、C : P、C : S、N : S和P : S比值范围分别为9.15~12.75、11.94~33.20、1.35~28.11、0.12~2.92和0.06~1.80.相较1#、2#和3#点位的C : N、C : P比值, C : S的差异较为显著, 且变化规律相反, C : N、C : P比值呈现1# > 2# > 3#, 而C : S比值却呈现出1# < 2# < 3#, N : S、P : S比值亦呈现出1# < 2# < 3#. 1#、2#点位的N : P比值较为相近, 平均值分别为2.20 ± 0.28、2.20 ± 0.40, 相较1#点位而言, 2#点位的各深度N : P比更为离散, 且从整体来看, 1#、2#的N : P均大于3#.
表 1(Table 1)
| 表 1 红树林湿地沉积物元素比值垂直分布特征 Table 1 Vertical distribution characteristics of the sediment elements ratio in mangrove wetland | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 1 红树林湿地沉积物元素比值垂直分布特征 Table 1 Vertical distribution characteristics of the sediment elements ratio in mangrove wetland
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
3.4 环境因子对厌氧氨氧化菌丰度及相对丰度的影响利用SPSS 22.0软件进行双变量相关性分析(Pearson相关系数).将厌氧氨氧化菌的基因丰度和相对丰度与红树林湿地沉积物的理化性质进行双变量相关性分析(Pearson相关系数), 以确定红树林湿地环境因子对厌氧氨氧化菌丰度和相对丰度的重要影响.厌氧氨氧化菌与环境因子的相关性分析见表 2.结果发现, 厌氧氨氧化菌基因丰度与TN和TOC呈显著正相关, 且其与TC呈极显著正相关, 而其余环境因子与厌氧氨氧化菌基因丰度无显著相关性, 这表明在红树林湿地不同深度的沉积物中, 沉积物中TN、TC、TOC含量在一定范围内对厌氧氨氧化菌的富集生长起积极的促进作用.厌氧氨氧化菌基因相对丰度与C : P、N : P呈显著正相关, 且其与C : N、TC呈倾向性显著相关, 其余环境因子与厌氧氨氧化菌基因相对丰度无显著相关性, 这说明在一定比值范围内的C : N、C : P、N : P、TC等4种土壤理化指标能在一定程度上提高厌氧氨氧化菌在红树林湿地总细菌中的占比.
表 2(Table 2)
| 表 2 厌氧氨氧化菌基因丰度和相对丰度与各环境因子之间的相关性分析(n=9) Table 2 Correlation analysis between environmental parameters and genes abundance, relative abundance of anammox bacteria (n=9) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 2 厌氧氨氧化菌基因丰度和相对丰度与各环境因子之间的相关性分析(n=9) Table 2 Correlation analysis between environmental parameters and genes abundance, relative abundance of anammox bacteria (n=9)
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
4 讨论(Discussion)本研究通过采用16S rRNA的分子生物学方法对红树林湿地沉积物中厌氧氨氧化菌定量分析, 探讨不同深度红树林湿地沉积物中厌氧氨氧化菌的分布规律, 并结合环境因子, 考察厌氧氨氧化菌与环境因子的耦合关系.
运用16S rRNA方法对红树林湿地沉积物中的厌氧氨氧化菌定量分析, 结果发现在红树林湿地不同深度沉积物中均检出厌氧氨氧化菌, 从整体看, 1#、2#和3#的厌氧氨氧化菌基因丰度和相对丰度随深度变化分布规律并非一致. Shen等(2015)对杭州西溪湿地不同水力条件土壤中厌氧氨氧化菌的垂直分布(0~100 cm)规律的研究发现, 长期经水浸没和周期性经水浸没土壤中的厌氧氨氧化菌基因丰度随深度增加而逐渐降低, 而长期未经水浸没土壤中的厌氧氨氧化菌基因丰度在20~30 cm处最高, 从整体看, 随深度增加厌氧氨氧化菌基因丰度呈逐渐降低趋势.在杭州稻田中发现, 随深度增加厌氧氨氧化菌基因丰度逐渐降低(Shen et al., 2014), 与本研究中1#点位的厌氧氨氧化菌基因丰度分布相似, 厌氧氨氧化菌基因丰度在1#点位随深度增加逐渐降低(图 1a).而Zhu等(2011)在水稻土壤中研究发现, 随深度增加厌氧氨氧化菌的多样性和基因丰度均表现出差异性, 基因丰度在40~45 cm处最高, 且在表层土壤至1 m的深处均检测到厌氧氨氧化菌, 这与本研究中2#点位的厌氧氨氧化菌基因丰度分布相似, 2#的基因丰度最大值出现在30~35 cm处(图 1a).在白洋淀岸边带的表层土壤(0~40 cm)中未检测到厌氧氨氧化菌的存在, 40 cm深度之后各点厌氧氨氧化菌丰度分布规律不尽相同, 且通过双变量相关性分析得知厌氧氨氧化菌丰度与深度无明显联系(夏超等, 2015). Shu等(2010)在南海沉积物中发现, 随深度增加, 与厌氧氨氧化菌相关的浮霉状菌门多样性水平降低, 且在超过5 m的深处未检测到厌氧氨氧化菌.以上对土壤中垂直方向厌氧氨氧化菌丰度分布规律的研究得到不同的结论, 说明随深度增加, 不同类型土壤中厌氧氨氧化菌的分布规律不同, 其分布规律比较复杂仍有待深入研究.
本研究中的厌氧氨氧化菌16S rRNA拷贝数为3.31×104~2.80×107 copies·g-1(干重)(图 1a), 与长江口潮滩地(3.33×105~3.78×106 copies·g-1)(郑艳玲等, 2015)、珠江口(4.22×105~2.55×106 copies·g-1) (Fu et al., 2015)、西溪湿地(2.5×105~8.6×106 copies·g-1)(Shen et al., 2015)、长江口近岸区(3.67×105~8.22×107 copies·g-1)(姜晓芳等, 2017)等的结果较为相似.而厌氧氨氧化菌占总细菌的比例却较低(3.34×10-6~1.60×10-2), 且跨度大(图 1b), 其比值与珠江口(0.02 × 10-4)(Fu et al., 2015)、长江口临近海域(0.26×10-4~5.2×10-4)(付璐璐等, 2016)有较大差异, 推测可能是因为厌氧氨氧化菌对氧气极为敏感, 生长极其缓慢, 其生长周期可达到14 d(王静等, 2014).随深度增加, 溶解氧、营养物质等环境因子也将随之发生差异, 从而进一步影响厌氧氨氧化菌的分布.
红树林湿地沉积物作为厌氧氨氧化菌的生存基质, 其各种环境理化因子必然对厌氧氨氧化菌的生长和富集起着重要的作用, 从而进一步影响厌氧氨氧化菌基因丰度和相对丰度的分布.本研究发现, 厌氧氨氧化菌基因丰度与TN、TC、TOC呈显著正相关, 与氨氮、亚硝态氮和硝态氮呈正相关, 而与MC呈负相关(表 2), 从整体来看, 其基因丰度分布与NH4+-N、TN、TC、TOC的变化趋势基本相符(图 2), 基本吻合以上相关性结论.亚硝态氮作为厌氧氨氧化反应的电子受体, 是厌氧氨氧化菌的反应产物, 而高的TOC含量会促进亚硝态氮的积累, 从而有利于厌氧氨氧化菌的富集生长, 因此高的TOC为厌氧氨氧化菌的生长提供了更多的反应产物, 从而为厌氧氨氧化菌的丰度创造了有利条件(Hou et al, 2013), 佐证了本研究中的厌氧氨氧化菌基因丰度与TOC、亚硝态氮呈正相关性的结论.而Li等(2011b)对香港米埔红树林不同季节的研究发现, 红树林沉积物中厌氧氨氧化菌群落结构受红树林影响较大, 厌氧氨氧化菌基因丰度与TOC呈显著负相关, 这与本研究结论相悖, 推测可能是因为受季节影响, 厌氧氨氧化菌群落发生变化所致, 且其发现厌氧氨氧化菌基因丰度与温度、亚硝酸盐、硝酸盐呈显著正相关, 与本研究类似.对锡林河湿地的研究发现, 厌氧氨氧化菌的基因丰度与TOC、TN呈显著正相关, 与氨氮呈正相关(曾静等, 2016);对近郊海域的沉积物中厌氧氨氧化菌的研究中也发现, 铵盐对厌氧氨氧化细菌的基因丰度影响较大(付璐璐等, 2016), 推测是因为铵盐作为厌氧氨氧化菌的反应产物, 会促进厌氧氨氧化菌的富集生长, 且与湿地沉积物中氨氮的分布趋势比较可以看出, 其厌氧氨氧化菌的丰度分布规律与氨氮的分布规律较为一致.本研究中发现厌氧氨氧化菌的丰度与硝态氮的正相关性较高, 表明硝态氮也是影响厌氧氨氧化过程的重要影响因子, 这与付璐璐等(2016)的研究结果较为不同, 其发现厌氧氨氧化菌基因丰度与硝酸盐呈负相关, 这可能是由于本次采集红树林湿地的样品数量较少或者是湿地环境中还存在其它与厌氧氨氧化菌耦合的过程, 硝酸盐对厌氧氨氧化菌丰度的影响还需与反硝化作用相结合进行进一步研究.同时本研究发现, 厌氧氨氧化菌的相对丰度与C : P、N : P呈显著正相关, 与C : N、TC呈倾向性显著相关(表 2). 庄林杰等(2017)对白洋淀岸边陆向深层土壤的研究发现, 厌氧氨氧化菌属中的Candidatus ‘Brocadia anmmoxidans’的相对丰度与TC及TS呈正相关, 其推测是因为厌氧氨氧化菌中的Candidatus ‘Brocadia anmmoxidans’菌属对TC的需要更大, 与TS呈正相关的规律还有待深入研究, 吻合本研究中相对丰度与TC相关性的结论.而C : N、C : P、N : P对厌氧氨氧化菌的影响还需结合红树林湿地沉积物的生源要素来源等方面进一步展开研究.厌氧氨氧化菌基因相对丰度体现了厌氧氨氧化菌在生态系统总细菌中所占的比例和优势性, 将其与环境因子进行相关性研究尤为重要, 而目前在此方面的研究还较少.
厌氧氨氧化菌多样性在河口区变化较大, 有研究认为盐度是影响厌氧氨氧化菌基因丰度的重要环境因子.土壤电导率(EC)反映了在一定水分条件下土壤盐分的实际状况(刘广明等, 2005), 在一定浓度范围内, 土壤含盐量与EC呈正相关, 土壤溶解的盐类越多, EC就越大(张建旗等, 2009).在本研究的红树林湿地中, 发现厌氧氨氧化菌基因丰度和相对丰度与EC并非显著相关, 但基因丰度与EC呈负相关, 而相对丰度与EC呈正相关(表 2). Dale(2009)、Hou(2013)、付璐璐(2016)等关于厌氧氨氧化菌基因丰度与盐度的相关性研究与本研究结论类似, 且Dale和Hou发现随盐度升高, 厌氧氨氧化菌属有所不同, 从Candidatus Brocadia转变为Scalindua属, 推测是因为厌氧氨氧化各菌属对盐度的耐受值不同, 从而引起其区域丰度分布的差异, 在河口的区域内, 河海水混合加强以致盐度上升, 不利于厌氧氨氧化菌部分菌群的生长, 因此导致其基因丰度与盐度呈负相关性.但对于相对丰度与EC呈较强的正相关性结论解释还需结合红树林湿地中总细菌对此复杂环境的响应, 有待深入研究.
5 结论(Conclusions)本文利用荧光定量PCR技术对红树林湿地不同深度的厌氧氨氧化菌16S rRNA进行拷贝数定量, 初步了解其在红树林湿地不同深度的空间分布情况, 且在红树林湿地中未发现厌氧氨氧化菌基因丰度和相对丰度明显的分布规律;并在一定程度上揭示了厌氧氨氧化菌丰度和相对丰度与环境因子之间的相关性, 发现TN、TOC、TC、EC和无机氮是影响厌氧氨氧化菌基因丰度的重要因子, C:P、N:P、C:N、TC和EC是影响厌氧氨氧化菌相对丰度的重要因子.本研究进一步丰富了红树林湿地中厌氧氨氧化菌的相关基础研究, 一定程度上为今后的相关研究提供了基础理论依据和方向.
参考文献
| Broda E. 1977. Two kinds of lithotrophs missing in nature[J]. Journal of Basic Microbiology, 17: 491–493. |
| Dalsgaard T, Canfield D E, Petersen J, et al. 2003. N2 production by the anammox reaction in the anoxic water column of Golfo Dulce, Costa Rica[J]. Nature, 422(6932): 606–608.DOI:10.1038/nature01526 |
| Dale O R, Tobias C R, Song B. 2009. Biogeographical distribution of diverse anaerobic ammonium oxidizing (anammox) bacteria in Cape Fear River Esturay[J]. Environmental Microbiology, 11(5): 1194–1207.DOI:10.1111/emi.2009.11.issue-5 |
| Emilio G R, Alfonso C, Sokratis P. 2014. A fast and direct spectroph-oTometric method for the sequential determination of nitrate and nitrite at low concentrations in small volumes[J]. Marine Chemistry(162): 30–36. |
| Fu B B, Liu J W, Yang H M, et al. 2015. Shift of anammox bacterial community structure along the Pearl Estuary and the impact of environmental factors[J]. Journal of Geophysical Research Oceans, 120(4): 2869–2883.DOI:10.1002/2014JC010554 |
| 付璐璐, 甄毓, 贺惠, 等. 2016. 长江口邻近海域沉积物中厌氧氨氧化细菌分布特性研究[J]. 环境科学, 2016, 37(10): 3914–3922. |
| Harris D, William R, Horwáth, et al. 2001. Acid fumigation of soils to remove carbonates prior to total organic carbon or Carbon-13 isotopic analysis[J]. Soil Science Society of America Journal, 65: 1853–1856.DOI:10.2136/sssaj2001.1853 |
| Hou L J, Zheng Y L, Liu M, et al. 2013. Anaerobic ammonium oxidation (anammox) bacterial diversity, abundance, and activity in marsh sediments of the Yangtze Estuary[J]. Journal of Geophysical Research Biogeosciences, 118(3): 1237–1246.DOI:10.1002/jgrg.v118.3 |
| 姜晓芳.2017.河口近岸厌氧氨氧化菌群结构、丰度及活性对盐度变化的响应[D].上海: 华东师范大学http://cdmd.cnki.com.cn/Article/CDMD-10269-1017062426.htm |
| 金亮, 吴明柔, 高梦岚, 等. 2018. 九龙江口红树林保护区水体浮游植物群落结构及营养状态评价[J]. 应用海洋学学报, 2018, 37(1): 129–134.DOI:10.3969/J.ISSN.2095-4972.2018.01.0015 |
| 刘广明, 杨劲松, 姚荣江. 2005. 影响土壤浸提液电导率的盐分化学性质要素及其强度研究[J]. 土壤学报, 2005, 42(2): 247–252.DOI:10.3321/j.issn:0564-3929.2005.02.011 |
| Li M, Hong Y G, Cao H L, et al. 2011. Mangrove trees affect the community structure and distribution of anammox bacteria at an anthropogenic-polluted mangrove in the Pear River Delta reflected by 16S rRNA and hydrazine oxidoreductase (HZO) encoding gene analysis[J]. Ecotoxicology, 20: 1780–1790.DOI:10.1007/s10646-011-0711-4 |
| Li M, Cao H L, Hong Y G, et al. 2011. Seasonal dynamics of anammox bacteria in estuarial sediment of the Mai Po Nature Reserve revealed by analyzing the 16sRNA and hydrazine oxidoreductase genes[J]. Microbes and Environments, 26(1): 15–22.DOI:10.1264/jsme2.ME10131 |
| Murpgy J, Riley J P. 1962. Amodified single solution method for the determination of Phosphate in the natural water[J]. Analytica Chimica Acta(27): 31–36. |
| Mulder A.1992.Anoxic ammonia oxidation[P].US: 5078884 |
| Nicholls J C, Trimmer M. 2009. Widespread occurrence of the anammox reaction estuarine sediments[J]. Aquatic Microbial Ecology, 55: 105–113.DOI:10.3354/ame01285 |
| Nishijima M, Lindsay D J, Hata J, et al. 2010. Association of thioautotrophic bacteria with deep-sea sponges[J]. Marine Biotechnology, 12: 253–260.DOI:10.1007/s10126-009-9253-7 |
| Schmid M C, Twachtmann U, Klein M, et al. 2000. Molecular evidence for genus level diversity of bacteria capable of catalyzing anaerobic ammonium oxidation[J]. Systematic and Applied Microbiology, 23: 93–106.DOI:10.1016/S0723-2020(00)80050-8 |
| Strous M, Jetten M S. 2004. Anaerobic oxidation of methane and ammonium[J]. Annual Review of Microbiology, 58: 99–117.DOI:10.1146/annurev.micro.58.030603.123605 |
| Schmid M C, Maas B, Dapena A, et al. 2005. Biomarkers for in situ detection of anaerobic ammonium-oxidizing (Anammox) bacteria[J]. Applied and Environmental Microbiology, 71(4): 1677–1684.DOI:10.1128/AEM.71.4.1677-1684.2005 |
| Shu Q L, Jiao N Z. 2010. Profiling planctomycetales diversity with reference to anammox-related bateria in a South Chian Sea, deep-sea sediment[J]. Marine Ecology, 29(4): 413–420. |
| Shen L D, Liu S, Lou L P, et al. 2013. Broad distribution of diverse anaerobic ammonium-oxidizing bacteria in Chinese agricultural soils[J]. Applied and Environmental Microbiology, 79(19): 6167–6172.DOI:10.1128/AEM.00884-13 |
| Shen L D, Liu S, Huang Q, et al. 2014. Evidence for the cooccurrence of nitrite-dependent anaerobic ammonium and methane oxidation processes in a flooded paddy field[J]. Applied and Environmental Microbiology, 80(24): 7611–7619.DOI:10.1128/AEM.02379-14 |
| Shen L D, Liu S, He Z F, et al. 2015. Depth-specific distribution and importance of nitrite-dependent anaerobic ammonium and methane-oxidising bacteria in an urban Wetland[J]. Soil Biology and Biochemistry, 83: 43–51.DOI:10.1016/j.soilbio.2015.01.010 |
| Thamdrup B, Dalsgaard T. 2002. Production of N2 through anaerobic ammonium oxidation coupled to nitrate reduction in marine sediments[J]. Applied and Environmental Microbiology, 68: 1312–1318.DOI:10.1128/AEM.68.3.1312-1318.2002 |
| Van de Graaf A A, Mulder A, De Brujin P, et al. 1995. Anaerobic oxidation of ammonium is a biologically mediated process[J]. Appllied Environmental Microbiology, 61: 1246–1251. |
| Wang S Y, Zhu G B, Peng Y Z, et al. 2012. Anammox bacterial abundance, activity, and contribution in riparian sediments of the Pearil River Estuary[J]. Environmental Science and Technology, 46: 8834–8842.DOI:10.1021/es3017446 |
| 王静, 郝建安, 张爱君, 等. 2014. 厌氧氨氧化反应研究进展[J]. 水处理技术, 2014, 40(3): 1–4. |
| 夏超, 祝贵兵, 邹雨璇, 等. 2015. 厌氧氨氧化细菌和反硝化厌氧甲烷氧化细菌在岸边带土壤中的分布规律[J]. 环境科学学报, 2015, 35(12): 3965–3975. |
| 中国科学院南京土壤研究所. 1978. 土壤理化分析[M]. 上海: 上海科学技术出版社. |
| Zhang Y, Ruan X H, Op den Camp H J M, et al. 2007. Diversity and abundance of aerobic and anaerobic ammonium-oxidizing bacteria in freshwater sediments of the Xinyi river (China)[J]. Environmental Microbiology, 9(9): 2375–2382.DOI:10.1111/emi.2007.9.issue-9 |
| 张建旗, 张继娜, 杨虎德, 等. 2009. 兰州地区土壤电导率与盐分含量关系研究[J]. 甘肃林业科技, 2009, 34(2): 21–24.DOI:10.3969/j.issn.1006-0960.2009.02.006 |
| Zhu G B, Wang S Y, Wang Y, et al. 2011. Anaerobic ammonia oxidation in a fertilized paddy soil[J]. The ISME Journal, 5: 1905–1912.DOI:10.1038/ismej.2011.63 |
| Zhou S, Borjigin S, Riya S, et al. 2014. The relationship between anammox and denitrification in the sediment of Aninland River[J]. Science of the Total Environment, 490: 1029–1036.DOI:10.1016/j.scitotenv.2014.05.096 |
| 郑艳玲.2015.长江口潮滩湿地氨氧化菌群动态和活性研究[D].上海: 华东师范大学 |
| 曾静.2016.锡林河湿地厌氧氨氧化菌群多样性、丰度和空间特征研究[D].呼和浩特: 内蒙古大学http://cdmd.cnki.com.cn/Article/CDMD-10126-1016133831.htm |
| 庄林杰, 夏超, 田晴, 等. 2017. 高通量测序技术研究典型湖泊岸边陆向深层土壤中厌氧氨氧化细菌的群落结构[J]. 环境科学学报, 2017, 37(1): 261–271. |
