 , 齐维晓2, 李静1
, 齐维晓2, 李静1

1. 河北工业大学土木与交通学院, 天津 300401;
2. 中国科学院生态环境研究中心, 北京 100085
收稿日期: 2018-02-08; 修回日期: 2018-03-23; 录用日期: 2018-03-23
基金项目: 国家自然科学基金(No.51778608)
作者简介: 莫小妤(1993-), 女, E-mail:673340157@qq.com
通讯作者(责任作者): 李静, E-mail:tdhjlj@163.com
摘要: 为了探究药品和个人护理用品(PPCPs)在岸滤系统中的转化过程及其影响因素,采集了不同类型的河床岸滤土壤,模拟岸滤系统中的反硝化和硫还原过程,探究该过程中磺胺甲恶唑(Sulfamethoxazole,SMX)及两种共存PPCPs(咖啡因、卡马西平)的转化过程及中间产物的生成.批次培养实验结果显示,至培养周期第87 d时SMX的生物降解率达到100%,反硝化过程中SMX自第5 d开始转化为两种衍生物-D-SMX及4-nitro-SMX,反硝化反应结束两种衍生物再次还原为SMX.SMX的转化率因有机质的不同而产生差异,添加乙酸钠有机质时SMX的转化率整体高于添加富里酸有机质的转化率;硫还原条件下SMX则完全降解;咖啡因(Caffeine,CFE)的生物降解率高于50%,不同河床土壤的理化性质差异及微生物的分布差异造成CFE的吸附及降解效果有很大差异,投加潮白河沉积物样品中CFE生物降解率高于投加密云水库沉积物样品;卡马西平(Carbamazepine,CMZ)的降解率范围在20%~35%,CMZ在岸滤系统中不易发生降解.
关键词:岸滤系统磺胺甲恶唑(SMX)咖啡因(CFE)卡马西平(CMZ)厌氧转化
Simulating study of anaerobic transformation of sulfamethoxazole, caffeine and carbamazepine during river bank filtration
MO Xiaoyu1
 , QI Weixiao2, LI Jing1
, QI Weixiao2, LI Jing1

1. Civil and Transportation College, Hebei University of Technology, Tianjin 300401;
2. Research Center for Eco-Environmental Sciences, Chinese Academy of Sciences, Beijing 100085
Received 8 February 2018; received in revised from 23 March 2018; accepted 23 March 2018
Supported by the National Natural Science Foundation of China(No.51778608)
Biography: MO Xiaoyu(1993—), female, E-mail: 673340157@qq.com
*Corresponding author: LI Jing, E-mail:tdhjlj@163.com
Abstract: In order to explore the transformation of PPCPs in river bank filtration system and the influencing factors on it, different soils from river bank were collected and were used to simulate denitrification and sulphate-reducing condition of river bank filtration. The transformation of sulfamethoxazole(SMX) and two coexisting PPCPs (caffeine and carbamazepine) in this system were studied. The result of anoxic water/sediment batch experiment shows that the biodegradation rate of SMX reached 100% on the 87th day. Since the 5th day SMX was converted to two kinds of derivatives during denitrification process, which were D-SMX and 4-nitro-SMX. After denitrification, two derivatives retransformed to SMX. The transformation rate varied with different organic matters matrix:the SMX transformation rate was rather higher when adding sodium acetate as the organic matter than that of adding fulvic acid. SMX was degraded completely in sulfur reduction condition. Biodegradation rate of caffeine(CFE) was higher than 50%. Moreover, different soils properties result in varied adsorption and degradation ability of CFE. The results show CFE biodegradation in Chaobai River bank simulating system was higher than that in Miyun Reservoir bank simulating system. Degradation rate of carbamazepine(CMZ) ranges from 20% to 35%. CMZ is not degraded or retained in river bank filtration system.
Keywords: river bank filtrationSMXCFECMZanaerobic transformation
1 引言(Introduction)目前, 药品和个人护理用品(PPCPs)对环境、生物和人类健康的影响已经发展成全球热点问题.其中, 磺胺甲恶唑(Sulfamethoxazole, SMX)作为抗生素类药物被广泛地用于人类及动物治疗(García-Galán et al., 2009).传统的废水处理技术难以将水中存在的SMX彻底去除(Watanabe et al., 2010;Heberer et al., 2002), 使得其广泛分布于地表水中.研究表明, SMX的生物降解率主要依赖于氧化还原条件、微生物作用及其初始浓度、停留时间等(Müller et al., 2013).此外, 从Conn等(2010)对污水的土壤处理研究中可以看出, SMX在孔隙水中呈现出不稳定且不规则的分布情况, 进一步强调了其环境行为的复杂性.N?dlerd等(2012)已对SMX在厌氧反硝化过程中两种可能的转化路径进行评估, 但其未考虑到其他共存PPCPs对SMX降解可能造成的影响.河床渗滤系统/岸滤(River Bank Filtration, RBF)作为一种天然的水质净化机制及饮用水前处理重要的一步, 对水质安全保障具有重要意义(Hiscock et al., 2002).研究SMX等PPCPs在岸滤系统中的转化规律对探究其在岸滤系统中的去除和衍生机制及优化后续的饮用水处理工艺具有重要的指导意义.近年来, 国内外****(Odríguezescales et al., 2016; Zhang et al., 2016; Ji et al., 2014; N?dler et al., 2012; Barbieri et al., 2012)通过现场调查和模拟研究, 探究了岸滤系统中SMX的转化规律, 但在SMX转化和衍生途径及共存微量污染物对其影响等方面仍需继续深入研究.
本文在已有研究(N?dler et al., 2012)基础上, 利用厌氧条件下的水/土批次培养实验, 探究SMX在氮还原和硫还原条件下及与其它微量污染物(咖啡因、卡马西平)共存时的转化规律及中间产物的衍生, 重点研究不同岸滤土质类型和有机质对该过程的影响.
2 材料与方法(Materials and methods)2.1 岸滤土样采集及处理本实验采样点有两个, 均设置在潮白河流域, 分别位于潮白河岸(40°16′19.87"N, 116°43′31.50"E)及密云水库北岸(40°32′14.00"N, 116°57′11.00"E), 具体位置如图 1所示.潮白河以密云水库为引水源, 通向市区的京密引水渠为北京市供水主动脉.密云水库位于北京市密云区城北13 km处, 是京津唐地区第一大水库.样品均采集于岸边带1 m深的好氧不饱和层处, 采集样品时间为2017年6月.采集土样贮存于-80 ℃冰箱, 土样彻底冻硬后放入冷冻干燥机将土样冻干, 之后放入-4 ℃冰箱保存.
图 1(Fig. 1)
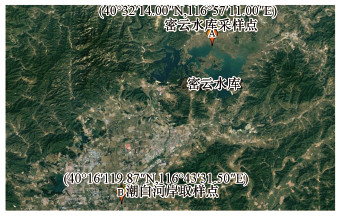 |
| 图 1 采样点位图 Fig. 1Sampling map |
2.2 化学试剂碳酸氢钠、氯化钾、磷酸二氢钾、六水合氯化镁、六水合硝酸镁、氯化钠、无水氯化钙、硫酸钠、氯化铵均为分析纯, 购于国药集团化学试剂有限公司;甲醇、乙腈均为色谱纯, 购自赛默飞世尔科技(中国)有限公司;磺胺甲恶唑(Sulfamethizole, SMX)标准品、卡马西平(Carbamazepine, CMZ)标准品、咖啡因(Caffeine, CFE)标准品均购自美国Sigma-Aldrich公司;超纯水仪购自美国MilliPore, 型号为Advantage型.
2.3 模拟水样的配置本文利用批次培养实验模拟岸滤系统中的水/土界面反应过程, 每升超纯水中加入43 mg碳酸氢钠、184 mg氯化钾、2.2 mg磷酸二氢钾、251 mg六水合氯化镁、8477 mg六水合硝酸镁、76 mg氯化钾、333 mg无水氯化钠、296 mg硫酸钠、5.9 mg氯化铵;配置完成后用氩气吹脱1 h以除去溶液中的溶解氧;两组模拟水样中分别加入171 mg乙酸钠、92 mg富里酸作为有机质;最后在水样中分别投加SMX、CMZ、CFE的甲醇溶液, 使得每种物质在模拟水样中的最终浓度为1 mg·L-1.
2.4 批次培养实验两组土壤在实验室冷冻干燥后过16目筛使土样粒径筛分至小于1 mm, 土壤1采集于潮白河, 土壤2采集于密云水库, 其理化性质见表 1.
表 1(Table 1)
| 表 1 两种土壤的物化指标参数 Table 1 Parameters of physicochemical indexes of the two kinds of sediment | ||||||||||||||||||||||||
表 1 两种土壤的物化指标参数 Table 1 Parameters of physicochemical indexes of the two kinds of sediment
| ||||||||||||||||||||||||
批次培养实验分组如图 2所示, 共设4组对照, 每组样品设2个平行培养瓶.本次生物/非生物批次培养时间分别为2、5、10、15、25、41、87 d.批次培养实验在氮气氛围下的手套式操作箱中进行操作, 称取120 g干燥土壤后缓慢倒入装有240 mL配置水样的250 mL玻璃厌氧瓶中, 螺帽盖子拧紧后, 轻晃瓶子使水样均匀并用铝箔纸包裹后放入温度为25 ℃的培养箱(型号Bluepard MGC-350HP-2).
图 2(Fig. 2)
 |
| 图 2 水/沉积物批次培养实验分组图 Fig. 2Schematic diagram of water/sediment batch experiment |
非生物批次培养实验需将土壤和模拟水样分别进行灭菌操作(高压灭菌锅, 1天1次, 连续3 d, 每次灭菌温度为121 ℃, 20 min).利用紫外线对手套式操作箱消毒20 min后, 再进行配置水样与沉积物样品混合操作.另外, 非生物批次样品水样中需加入60 mg·L-1的氯化汞以抑制培养过程中可能产生的生物活动.为了模拟河水流动时河底沉积物由于水流引起的波动, 在培养过程中需定期摇动瓶身:第1周时, 每2 d摇动1次;在接下来的3周, 每周摇动1次;剩余时间, 每30 d摇动1次.摇动时应尽量轻缓, 不破坏生物批次样品中已经形成的生物膜.
3 分析方法(Analysis methods)溶解氧(DO)采用便携式溶解氧测试仪(型号HACH Sension 156)检测;氧化还原电位(ORP)、氢离子浓度指数(pH)采用便携式多参数测定仪(型号Ponsel ODEON)检测;硝酸根、亚硝酸根及硫酸根离子浓度采用Dionex ICS-2000型离子色谱仪检测, Chromeleon色谱工作站, 色谱柱:AS 19分析柱和AG柱, 淋洗液为KOH溶液, 抑制器为ASRULTRAⅡ, 流速为1.0 mL·min-1, 进样量为5 mL, 离子色谱分析时间为16 min.
SMX及其他PPCPs浓度采用超高液相色谱串联四级杆质谱(型号Quattro Premier XE, Waters Co.)检测, 色谱柱为ACQUITY UPLC BEH C18(50 mm C18UP, 1.7 μm, Waters), 其色谱条件见表 2, 质谱工作条件见表 3.
表 2(Table 2)
| 表 2 SMX及其转化产物、CFE和CMZ色谱工作参数 Table 2 The operational parameters of chromatography for the determination of SMX and its corresponding metabolites, CFE and CMZ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 2 SMX及其转化产物、CFE和CMZ色谱工作参数 Table 2 The operational parameters of chromatography for the determination of SMX and its corresponding metabolites, CFE and CMZ
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 3(Table 3)
| 表 3 SMZ及其转化产物、CFE和CMZ质谱工作参数 Table 3 The operational parameters of mass spectrum for the determination of SMX and its corresponding metabolites, CFE and CMZ | ||||||||||||||||||||||||||||||||||||
表 3 SMZ及其转化产物、CFE和CMZ质谱工作参数 Table 3 The operational parameters of mass spectrum for the determination of SMX and its corresponding metabolites, CFE and CMZ
| ||||||||||||||||||||||||||||||||||||
4 结果与讨论(Results and discussion)4.1 硝酸盐、亚硝酸盐与硫酸盐浓度变化分析非生物批次培养实验中硝酸根及硫酸根浓度变化如图 3所示.由图可知, 硝酸根及硫酸根浓度无变化且没有亚硝酸生成.生物批次培养样品硝酸根、亚硝酸根及硫酸根浓度变化如图 4所示.由图可知, 自第2 d开始硝酸根浓度减小, 同时亚硝酸根的浓度逐渐升高.这表明在厌氧条件下, 厌氧瓶内发生着以硝酸盐作为能量代谢中电子受体的反硝化反应.硫酸根浓度在第41~87 d的时间里急剧下降为0 mmol·L-1, 表明这期间发生着以硫酸盐作为电子受体的硫还原反应.实验过程中, 土壤悬液DO值范围在0.1~0.7 mg·L-1, pH范围在6.0~8.0之间, 持续发生的反硝化及硫还原反应表明在批次培养试验过程中, 实验条件适合厌氧菌存活.
图 3(Fig. 3)
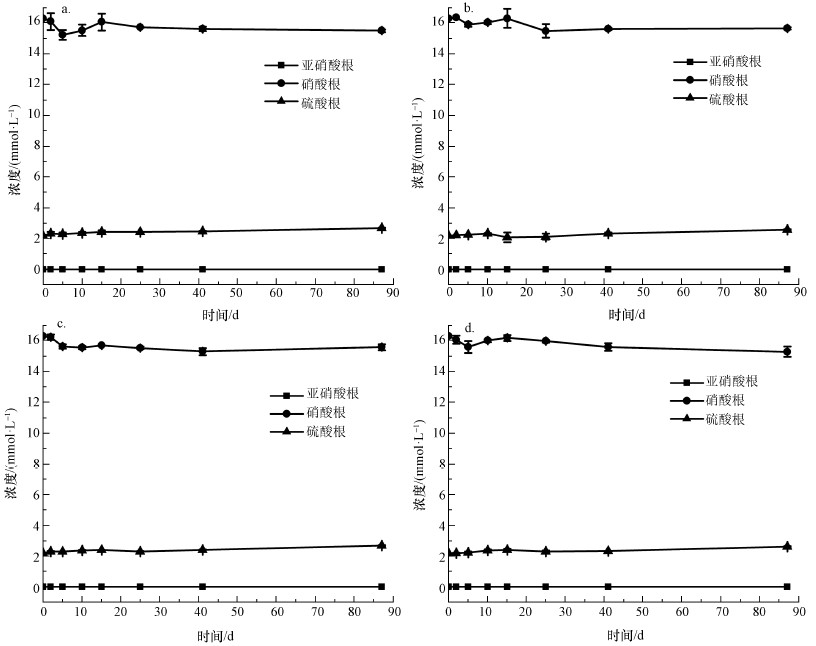 |
| 图 3 非生物批次培养样品中亚硝酸根、硝酸根及硫酸根浓度变化(a.土壤1(含乙酸钠), b.土壤2(含乙酸钠), c.土壤1(含富里酸), d.土壤2(含富里酸)) Fig. 3Concentrations of nitrate, nitrite and sulfate in abiotic experiment |
图 4(Fig. 4)
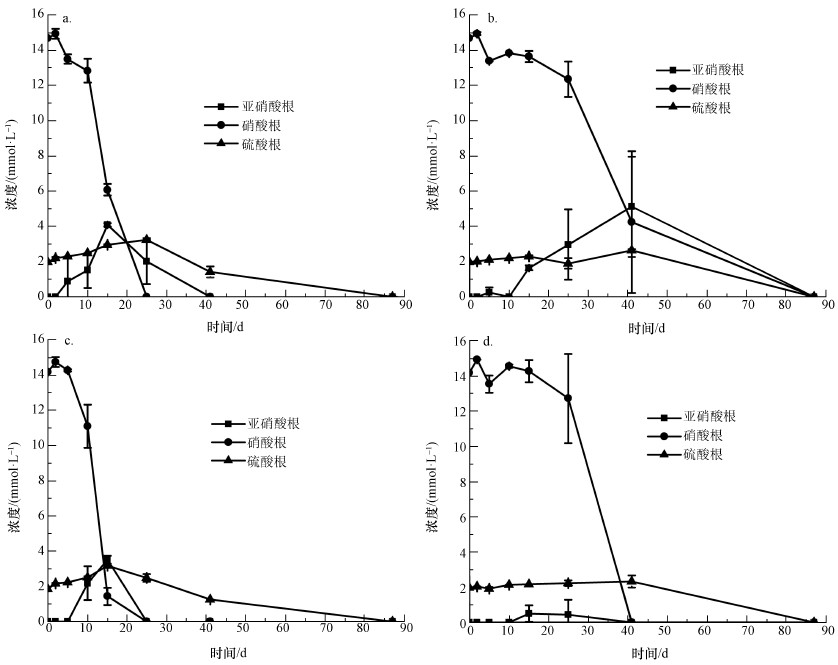 |
| 图 4 生物批次培养样品中亚硝酸根、硝酸根及硫酸根浓度变化(a.土壤1(含乙酸钠), b.土壤2(含乙酸钠), c.土壤1(含富里酸), d.土壤2(含富里酸)) Fig. 4Concentrations of nitrate, nitrite and sulfate in biotic experiment |
4.2 磺胺甲恶唑(SMX)及其产物浓度变化分析模拟水样中加入乙酸钠为微生物提供营养源, 促使微生物发生酶促作用, 生成亚硝酸盐并释放NO.根据Rodríguezescales和Sanchezvila的概念模型(Rodríguezescales et al., 2016), SMX通过脱氨基和亚硝化作用, 形成D-SMX和4-nitro-SMX两种代谢产物, 这两种代谢物不稳定, 转化过程强烈依赖反应条件, 因此, 反硝化反应结束时代谢产物会重新还原为SMX.
非生物批次样品中SMX的浓度变化如图 5所示, 至第87 d时非生物降解率分别为39.84%、54.46%、46.47%、48.83%, 样品中并未检测到D-SMX及4-nitro-SMX的存在.引起非生物条件下浓度曲线变化可能的原因是土壤的吸附作用造成浓度变化, 本实验中水土比约为2:1, 一开始SMX被土壤大量吸附, 第10 d后由于土壤处于长时间被淹没状态, 被吸附的SMX被浸出.在生物批次培养实验中, SMX、D-SMX及4-nitro-SMX浓度变化如图 5所示.以乙酸为有机质的两种不同土样进行对比, 在前41 d的周期里土壤1和土壤2悬液中的SMX从快速降解至消失再到浓度回升, 此阶段内现有研究基础(Rodríguezescales et al., 2016; N?dler et al., 2012; Pereira et al., 2011; Hollocher et al., 1983; Jr et al., 1982)上已知的两种转化产物D-SMX和4-nitro-SMX的浓度随着SMX的减少而逐渐上升, 随着反硝化产生的亚硝酸根的减少, 两种转化产物逐渐消失, SMX浓度回升;在41~81 d的周期中, SMX浓度再次降低直至减小为零.以富里酸为有机质的两种不同土样进行对比, 第25 d时土壤1悬液中的SMX已经完成可逆转化过程, 第41 d时SMX的浓度已经减小至接近于0 μg·L-1;土壤2悬液中SMX完成此过程相比土壤1缓慢.
图 5(Fig. 5)
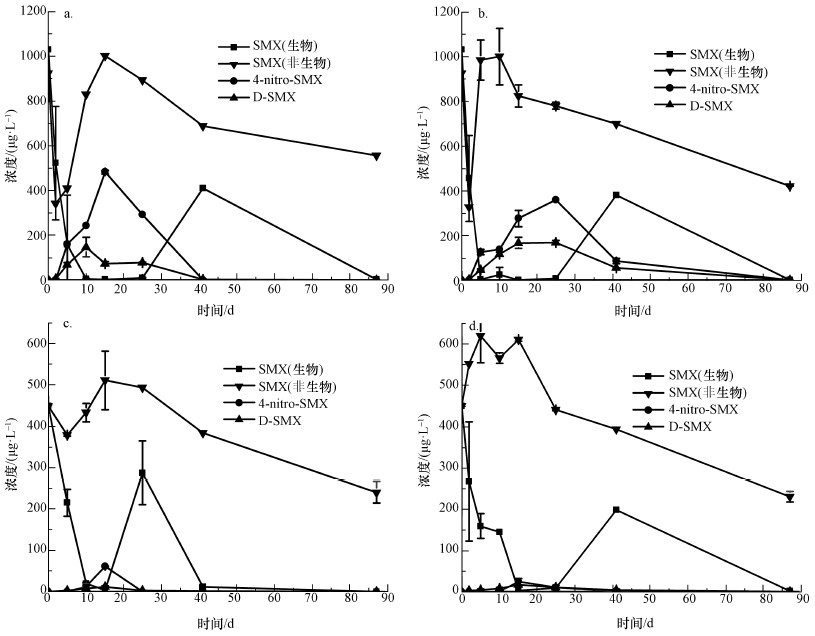 |
| 图 5 SMX、4-nitro-SMX及D-SMX浓度变化曲线(a.土壤1(含乙酸钠), b.土壤2(含乙酸钠), c.土壤1(含富里酸), d.土壤2(含富里酸)) Fig. 5Concentrations of SMX, 4-nitro-SMX and D-SMX |
根据图 5反应浓度变化曲线可将SMX的降解转化过程分为两个阶段:第一阶段, 转化产物有D-SMX和4-nitro-SMX, 但由于SMX与这两种转化产物之间存在着明显的摩尔浓度失衡现象, 由此猜测产生了至今没有被确定的其它转化产物.N?dler等(2012)已经证明SMX转化为4-nitro-SMX的过程中存在着中间产物—某种重氮阳离子化合物;同时, Lammerding等(1982)研究指出, 细胞化合物可能捕获大量的重氮离子, 且亚硝酸盐取代芳香族重氮阳离子的反应十分迅速, 因此, 很难检测到这种重氮阳离子.此外, 如表 4所示, 两种转化产物相比SMX具有更高的lgKow值, 说明与SMX相比, 两种转化产物D-SMX和4-nitro-SMX在土壤中更容易被吸附(Haderlein et al., 1996), 这也是摩尔浓度失衡的原因之一.第二阶段, D-SMX和4-nitro-SMX两种转化产物浓度接近于零, SMX的浓度逐渐减小为零, 由于整个实验过程中, 所有的厌氧瓶为保证避光条件都包裹在铝箔纸中, 排除SMX发生光化学降解的可能性, 在此阶段, 通过图 4观察到硫酸根浓度逐渐减小, 厌氧瓶内发生硫还原反应.当沉积物为土壤1时, 通过观察图 5a和5c能明显看出, 以乙酸钠为基质时SMX生物降解率大于非生物降解率, 猜测是由于在硫还原反应的作用下SMX在此阶段被完全降解或转化为其它未被确定的转化产物.但通过图 5b、5d曲线观察发现, 以富里酸为基质此阶段非生物条件下SMX的降解曲线与生物条件下的降解曲线接近平行, 认为此阶段的降解与硫还原反应无关, SMX的减少与土壤的吸附作用有关.
表 4(Table 4)
| 表 4 SMX及其转化产物理化性质 Table 4 The physicochemical properties of SMX, 4-nitro-SMX and D-SMX | ||||||||||||||||||||
表 4 SMX及其转化产物理化性质 Table 4 The physicochemical properties of SMX, 4-nitro-SMX and D-SMX
| ||||||||||||||||||||
从图 5a、5b与5c、5d的对比可明显看出, 两种不同的有机质对转化产物有显著影响.以富里酸为有机质的土壤悬液中SMX初始浓度测试值仅为实际值的50%, 这与富里酸本身的性质有关, 富里酸的分子结构中含有大量羰基、酚羟基等基团, 可以与有机物质发生相互作用, 从而对有机物的环境化学行为产生影响:一方面富里酸对SMX检测时产生的基质效应干扰大于乙酸钠, 影响了检测的效果;另一方面, 由于富里酸和有机物的相互作用使SMX在以富里酸为有机质的土壤悬液中的浓度测试值降低.且以乙酸为有机质的土壤悬液中的转化产物最大值能达到以富里酸为有机质的8倍, 一方面可能是由于在富里酸辅助作用下生成了其它未被确定的转化产物, 另一方面可能是富里酸对D-SMX和4-nitro-SMX两种转化产物的生成有一定程度的阻碍作用, 大分子的富里酸对生成这两种转化产物的反应的促进效果并没有乙酸钠效果理想.因此, 以富里酸为有机质的反应程度整体低于以乙酸钠为有机质的反应程度.
4.3 咖啡因(CFE)浓度变化分析在批次培养试验中, CFE浓度变化曲线如图 6所示.在图 6a、6c中自第2 d起, 生物条件下CFE浓度快速降低后下降速率开始平缓, 在第41 d再次开始快速下降直至第87 d检出浓度为零;非生物条件下CFE浓度在第2 d快速降低后第5 d开始回升并可达初始浓度水平, 此后CFE浓度保持在500 μg·L-1左右.图 6b、6d中两种不同有机质的土壤2悬液里, 自第2 d生物条件下CFE浓度快速降低, 第5 d后CFE浓度保持在300 μg·L-1左右;非生物条件下CFE浓度自第2 d快速降低, 第5 d后CFE浓度有小幅回升后保持在150 μg·L-1左右.
图 6(Fig. 6)
 |
| 图 6 咖啡因浓度变化曲线(a.土壤1(含乙酸钠), b.土壤2(含乙酸钠), c.土壤1(含富里酸), d.土壤2(含富里酸)) Fig. 6Concentrations variation of caffeine |
图 6中4种条件下CFE浓度由于土壤的吸附作用, 自第2 d浓度迅速降低直至达到吸附平衡后, 生物条件下土壤1悬液中的CFE浓度有短暂的保持期, 此阶段微生物所利用碳源为模拟水样中所投加的两种有机质, CFE被微生物降解的量小, 因此, 浓度变化不大.通过图 6a、6b与图 6c、6d的对比可以看出, 生物条件下第87 d土壤1的两组悬液中CFE的去除率能达到100%, 而土壤2的两组悬液中CFE的去除率分别为62.9%和53.1%;非生物条件下4种条件下(对应图 6a~6d)CFE的去除率分别为53.0%、84.6%、21.7%、78.3%.生物条件下造成降解率差异的原因主要是两种土质的不同.土壤1采集于潮白河岸, 潮白河上游均处于土石山区, 河流入库泥沙多为砂土, 因此, 土样颗粒直径大, 土质疏松, 土壤孔隙率大;土壤2采集于密云水库, 土样粒径小, 土质细软且孔隙率小.两种土壤中所存在的微生物种类有差异导致微生物的碳源选择有所不同.针对图 6b、6d土壤2两种不同有机质悬液, 非生物条件下CFE的最终去除率均大于75%, 根据现有的研究成果, CFE在土壤内的降解主要源于微生物作用, 同时由于避光环境, 排除CFE光降解的可能性, 由此猜测导致这种情况的原因为:首先, 土壤2是一种粘土, 且土壤2的有机质含量高于土壤1(表 1), 由于土壤有机质含量高会提高土壤的吸附能力(Javier álvarezbenedí et al., 1998; Singh et al., 1990; Briggs et al., 1981), 所以土壤2的土壤吸附能力强于土壤1, 因此, 土壤2中生物及非生物降解率均保持较高水平;其次, 体系内土壤与水相连接处已形成较为稳定的生物膜, 水中有机物在接触土壤前需穿过生物膜, 生物膜对吸附作用有重要的影响(John et al., 2015; Schorer et al., 1997), 就CFE而言, 此生物膜的存在使其在土壤的吸附量变小.
4.4 卡马西平(CMZ)浓度变化分析在批次培养试验中, CMZ浓度变化曲线如图 7所示.图中4种条件下不同的土壤悬液里, 生物条件下CMZ浓度全周期内缓慢降低, 最终去除率分别达到25.1%、23.5%、30.2%、32.3%;非生物条件下CMZ浓度在第2 d快速降低后迅速回复到初始水平, 之后浓度在1000 μg·L-1左右上下波动.通过图 7及以上数据分析可以看出, 整体的CMZ浓度除第2 d由于吸附作用对浓度造成较大的波动外其余时段浓度变化不大, 由此可以解释为CMZ在土壤中的去除率小, 不易被这两种土壤中的微生物所分解.根据Wu等(2010)所设计的对CMZ在土壤中降解及分散性的土柱淋滤实验结果显示:无论是在好氧还是缺氧条件下, CMZ都在土壤中持续存在;通过研究人员进一步的实验证明, CMZ会长时间在土壤中停留, 并且其对外界条件的变化不敏感(Müller et al., 2011; Rauchwilliams et al., 2010; Stuyfzand et al., 2007), 也就是说, CMZ在土壤中不易降解, 由此可以解释本实验中CMZ浓度曲线发生变化的原因.
图 7(Fig. 7)
 |
| 图 7 卡马西平浓度变化曲线(a.土壤1(含乙酸钠), b.土壤2(含乙酸钠), c.土壤1(含富里酸), d.土壤2(含富里酸)) Fig. 7Concentrations variation of carbamazepine |
5 结论(Conclusions)1) SMX在反硝化及硫还原条件下发生可逆转化, 4-nitro-SMX及D-SMX是SMX在反硝化条件下的两种已知转化产物, 硝酸盐还原反应结束时两种转化物会再次转化为SMX, 但尚未检测到是否存在其它转化产物;硫还原条件下SMX会发生降解, 降解途径未知.
2) 不同土质对SMX的转化效率造成差异, SMX在装有潮白河岸所采砂土的样品中拥有更高的降解效率.不同的有机质对SMX的降解具有不同影响:相较乙酸钠, 富里酸分子结构中含有大量的酮羰基和羟基, 会与水中有机物发生相互作用, 因此, 在转化反应中乙酸钠更适宜作为微生物的有机碳源, 对促进酶促反应发生的效果优于富里酸, 以乙酸钠为有机质的样品中SMX转化率整体高于以富里酸为有机质的样品.
3) 不同河床沉积物的土质理化性质差异及微生物群落种类不同造成CFE的吸附降解效果产生差异, 87 d周期内CFE在潮白河岸沉积物的生物降解作用下能被完全降解, 而密云水库沉积物对其仅有吸附作用;CMZ在河床岸滤系统中不易发生降解.
4) 在整个反应体系中, CFE能被土壤中的微生物作为碳源利用, 促进微生物的生物活动, 有助于其对SMX的降解;而CMZ在土壤中不易降解, 对SMX的降解转化无影响.
参考文献
| Alvarezbenedi J, Carton A, Fernandez J C. 1998. Sorption of tribenuron-methyl, chlorsulfuron, and imazamethabenz-methyl by soils[J]. Journal of Agricultural & Food Chemistry, 46(7): 2840–2844. |
| Barbieri M, Carrera J, Ayora C, et al. 2012. Formation of diclofenac and sulfamethoxazole reversible transformation products in aquifer material under denitrifying conditions:batch experiments[J]. Science of the Total Environment, 426(2): 256–263. |
| Briggs G G. 1981. Theoretical and experimental relationships between soil adsorption, octanol-water partition coefficients, water solubilities, bioconcentration factors, and the parachor[J]. Journal of Agricultural & Food Chemistry, 29(5): 1050–1059. |
| Conn K E, Siegrist R L, Barber L B, et al. 2010. Fate of trace organic compounds during vadose zone soil treatment in an onsite wastewater system[J]. Environmental Toxicology and Chemistry, 29(2): 285–293.DOI:10.1002/etc.v29:2 |
| Müller E, Schüssler W, Horn H, et al. 2013. Aerobic biodegradation of the sulfonamide antibiotic sulfamethoxazole by activated sludge applied as co-substrate and sole carbon and nitrogen source[J]. Chemosphere, 92(8): 969–978.DOI:10.1016/j.chemosphere.2013.02.070 |
| García-Galán M J, Díaz-Cruz M S, Barceló D, et al. 2009. Combining chemical analysis and ecotoxicity to determine environmental exposure and to assess risk from sulfonamides[J]. Trac Trends in Analytical Chemistry, 28(6): 804–819.DOI:10.1016/j.trac.2009.04.006 |
| Haderlein S B, And K W W, Schwarzenbach R P. 1996. Specific adsorption of nitroaromatic explosives and pesticides to clay minerals[J]. Environmental Science & Technology, 30(2): 612–622. |
| Heberer T. 2002. Occurrence, fate, and removal of pharmaceutical residues in the aquatic environment:a review of recent research data[J]. Toxicology Letters, 131(2): 5–17. |
| Hiscock K M, Grischek T. 2002. Attenuation of groundwater pollution by bank filtration[J]. Journal of Hydrology, 266(3): 139–144. |
| Hollocher T C. 1983. The pathway of nitrogen and reductive enzymes of denitrification[J]. Antonie Van Leeuwenhoek, 48(6): 531–544.DOI:10.1007/BF00399539 |
| Ji Y, Ferronato C, Salvador A, et al. 2014. Degradation of ciprofloxacin and sulfamethoxazole by ferrous-activated persulfate:Implications for remediation of groundwater contaminated by antibiotics[J]. Science of the Total Environment, 472: 800–808.DOI:10.1016/j.scitotenv.2013.11.008 |
| Headley J V, Gandrass J, Kuballa J, et al. 1998. Rates of sorption and partitioning of contaminants in river biofilm[J]. Environmental Science & Technology, 32(24): 3968–3973. |
| Jr W J, Sigel C W. 1982. The role of dietary nitrate and nitrite in the reductive deamination of sulfadiazine by the rat, guinea pig, and neonatal calf[J]. Life Sciences, 30(25): 2229–2234.DOI:10.1016/0024-3205(82)90298-3 |
| Lammerding A M, Bunce N J, Merrick R L, et al. 1982. Structural effects on the microbial diazotization of anilines[J]. Journal of Agricultural & Food Chemistry, 30(4): 644–647. |
| Müller B, Scheytt T, Zippel M, et al. 2011. A new approach to calculate EMEA's predicted environmental concentration for human pharmaceuticals in groundwater at bank filtration sites[J]. Water Air & Soil Pollution, 217(1/4): 67–82. |
| N?dler K, Licha T, Barbieri M, et al. 2012. Evidence for the microbially mediated abiotic formation of reversible and non-reversible sulfamethoxazole transformation products during denitrification[J]. Water Research, 46(7): 2131–2139.DOI:10.1016/j.watres.2012.01.028 |
| Pereira R, Pereira L, Zee F P V D, et al. 2011. Fate of aniline and sulfanilic acid in UASB bioreactors under denitrifying conditions[J]. Water Research, 45(1): 191–200.DOI:10.1016/j.watres.2010.08.027 |
| Rauchwilliams T, Hoppejones C, Drewes J E, et al. 2010. The role of organic matter in the removal of emerging trace organic chemicals during managed aquifer recharge[J]. Water Research, 44(2): 449.DOI:10.1016/j.watres.2009.08.027 |
| Rodríguezescales P, Sanchezvila X. 2016. Fate of sulfamethoxazole in groundwater:Conceptualizing and modeling metabolite formation under different redox conditions[J]. Water Research, 105: 540–550.DOI:10.1016/j.watres.2016.09.034 |
| Schorer M, Eisele M. 1997. Accumulation of inorganic and organic pollutants by biofilms in the aquatic environment[J]. Water, Air, and Soil Pollution, 99(1/4): 651–659.DOI:10.1023/A:1018384616442 |
| Singh G, Spencer W F, Cliath M M, et al. 1990. Sorption behaviour of s-triazine and thiocarbamate herbicides on soils[J]. Journal of Environmental Quality, 19(3): 520–525. |
| Stuyfzand P J, Segers W, van Rooijen N. 2007. Behavior of pharmaceuticals and other emerging pollutants in various artificial recharge systems in the Netherlands[C]. ISMAR6-6th International Symposium in Managed Aquifer Recharge-Management of Aquifer Recharge for Sustainability. Arlington, Virginia, USA. 23145http://hydrology-amsterdam.nl/personalpages/Stuyfzand/ISMAR6-Pharmaca.pdf |
| Watanabe N, Bergamaschi B A, Loftin K A, et al. 2010. Use and environmental occurrence of antibiotics in freestall dairy farms with manured forage fields[J]. Environmental Science & Technology, 44(17): 6591. |
| Wu C, Spongberg A L, Witter J D, et al. 2010. Dissipation and leaching potential of selected pharmaceutically active compounds in soils amended with biosolids[J]. Archives of Environmental Contamination & Toxicology, 59(3): 343–351. |
| Zhang L, Wang S, Xu Y, et al. 2016. Molecular characterization of lake sediment WEON by Fourier transform ion cyclotron resonance mass spectrometry and its environmental implications[J]. Water Research, 106: 196–203.DOI:10.1016/j.watres.2016.09.059 |
