 , 谢莹莹1, 党志1,2, 易筱筠1,2, 卢桂宁1,2
, 谢莹莹1, 党志1,2, 易筱筠1,2, 卢桂宁1,2

1. 华南理工大学环境与能源学院, 广州 510006;
2. 工业聚集区污染控制与生态修复教育部重点实验室, 广州 510006
收稿日期: 2018-01-11; 修回日期: 2018-02-14; 录用日期: 2018-02-14
基金项目: 国家自然科学基金(No.41330639,41720104004)
作者简介: 李君菲(1993-), 女, E-mail:lyjunfei@126.com
通讯作者(责任作者): 卢桂宁, E-mail:lutao@scut.edu.cn
摘要: 施氏矿物对水体中的重金属具有较强的吸附和固载能力,但随着环境条件的改变,施氏矿物可能会溶解并发生相转变,引起重金属的释放.利用化学合成的含Cr施氏矿物,探究其在不同Cu(Ⅱ)浓度与pH条件下含Cr施氏矿物的溶解和相转变.研究结果表明,在pH~3时,含Cr施氏矿物对Cu(Ⅱ)的吸附量较少,Cu(Ⅱ)对矿物溶解的影响不明显;在该pH条件下,含Cr施氏矿物会发生相转变生成部分针铁矿,但是随着溶液中初始Cu(Ⅱ)浓度的升高,矿物的相转变得到抑制.当pH升高至pH~5时,含铬施氏矿物对Cu(Ⅱ)的吸附量显著增加,Cu(Ⅱ)主要以Cu(OH)+与Cu2(OH)22+的形态吸附在含Cr施氏矿物表面,而高浓度Cu(Ⅱ)存在时也会生成部分Cu(OH)2固体直接沉淀在矿物表面,覆盖矿物的反应位点从而阻碍SO42-和CrO42-的释放,而且随着Cu(Ⅱ)浓度的升高,这种抑制作用显著增强.在不同pH条件下,Cu(Ⅱ)的存在能够有效促进含Cr施氏矿物的稳定性,促进矿物对重金属Cr的固载能力,这些结果对酸性矿山废水环境中施氏矿物的稳定性和重金属污染控制具有重要意义.
关键词:Cr施氏矿物Cu(Ⅱ)pH溶解相转变
Adsorption of Cu(Ⅱ) on chromate-doped schwertmannite and effect on the mineral's dissolution and phase transformation under acid mine drainage conditions
LI Junfei1
 , XIE Yingying1, DANG Zhi1,2, YI Xiaoyun1,2, LU Guining1,2
, XIE Yingying1, DANG Zhi1,2, YI Xiaoyun1,2, LU Guining1,2

1. School of Environment and Energy, South China University of Technology, Guangzhou 510006;
2. The Key Laboratory of Pollution Control and Ecosystem Restoration in Industry Clusters, Ministry of Education, Guangzhou 510006
Received 11 January 2018; received in revised from 14 February 2018; accepted 14 February 2018
Supported by the National Natural Science Foundation of China (No. 41573091, 41720104004)
Biography: LI Junfei (1993—), female, E-mail:lyjunfei@126.com
*Corresponding author: LU Guining, E-mail:lutao@scut.edu.cn
Abstract: Schwertmannite is an important scavenger for heavy metals in water environment. However, schwertmannite may undergo phase transformation with the change of environment, such as pH, redox conditions, and oxyanions or cations, thus leading to the release of heavy metals originally precipitated. This study investigated the dissolution and phase transformation of synthetic schwertmannite prepared in the presence of chromate, and with various Cu(Ⅱ) concentrations at different pH. The results show that chromate-doped schwertmannite adsorbed small amount of Cu(Ⅱ) at pH~3, and the presence of Cu(Ⅱ) has no significant effect on the dissolution of chromate-doped schwertmannite. Chromate-doped schwertmannite partially transformed into goethite in the absence of Cu(Ⅱ) or with a relatively lower Cu(Ⅱ) concentration at pH~3, and the mineral's transformation was delayed with the increasing initial copper concentration. While at pH~5, chromate-doped schwertmannite adsorbed more Cu(Ⅱ) compared with those at pH~3. Cu(Ⅱ) adsorbed on the surface of chromate-doped schwertmannite mainly in the form of Cu(OH)+ and Cu2(OH)22+. Additionally, high concentrations of Cu(Ⅱ) favored the precipitation of Cu(OH)2 solid on the surface of schwertmannite at pH~5. The adsorbed copper precipitate covered the mineral's reactive sites and delayed the release of sulfate and chromate from chromate-doped schwertmannite, and this kind of effect increased with the increasing initial Cu(Ⅱ) concentration. The presence of copper stabilized the structure of chromate-doped schwertmannite and promoted the immobility of chromate, which has important environmental implications for the stability of schwertmannite and the remediation of heavy metals under acid mine drainage (AMD) conditions.
Key words: ChromateschwertmanniteCu(Ⅱ)pHdissolutionphase transformation
1 引言(Introduction)铜(Cu)与铬(Cr)是矿区河流与农田环境中广泛存在的有毒重金属.在水环境中, Cr(Ⅵ)与Cr(Ⅲ)是Cr最常见的两种价态, 而Cr(Ⅵ)具有更大的溶解性、迁移性与毒性, 对动植物的危害更大(Dhal et al., 2013; Hsu et al., 2009), Cu主要以Cu(Ⅱ)的价态存在.有研究报道, 在广东省韶关市大宝山矿区, 上游河流沉积物中Cr含量达到147.86 mg·kg-1, Cu达到530.00 mg·kg-1(陈梅芹, 2015);邹晓锦等(2008)的调查发现大宝山矿区(上坝村)受污染土壤中Cu的含量为378.2~3440.3 mg·kg-1, 是国家土壤环境质量二级标准(GB15618—1995)的11.7倍.矿区周围河流水体和沉积物以及污染土壤中高浓度的Cr和Cu对矿区周围的居民、动植物的生存具有较高的潜在风险.
施氏矿物是一种普遍存在于酸性矿山废水(AMD, acid mine drainage)中的铁羟基硫酸盐矿物, 其典型的化学式是Fe8O8(OH)8-2x(SO4)x(1≤x≤1.75) (Bigham et al., 1996; Regenspurg et al., 2004).施氏矿物具有与四方纤铁矿(β-FeOOH)相似的晶体结构, 由于SO42-取代了β-FeOOH隧道结构中的Cl-, 导致其结构发生改变而形成弱晶型的施氏矿物结构(Bigham et al., 1990; Fernandez-Martinez et al., 2010).在AMD条件下, “管状隧道”结构中的SO42-能够被与其离子半径、所带电荷相似, 且与矿物结构中的Fe(Ⅲ)具有较强络合能力的AsO43-、CrO42-和MoO42-等含氧阴离子取代(Wilkinson et al., 1987; Dzombak et al., 1990; Antelo et al., 2012), 同时, 这些含氧阴离子能够增强施氏矿物的稳定性(Regenspurg and Peiffer, 2005).由于其特殊的“管状隧道”结构, 及较大的比表面积(100~200 m2·g-1)(J?nsson et al., 2005), 施氏矿物能够广泛吸附AMD环境中的有毒重金属.除含氧阴离子外, 施氏矿物对河流环境中的Cu2+、Zn2+和Cr3+等阳离子也具有较高的吸附容量, 周顺桂等(2007)和苏贵珍等(2009)的实验研究表明施氏矿物对Cu2+的最大吸持率可达99.3%, 最大吸附量可达84 mg·g-1.有研究表明河流环境中的阳离子Cu2+能够取代矿物结构中的Fe3+并生成含Cu施氏矿物, 从而影响施氏矿物的稳定性并提高施氏矿物对As(Ⅴ)的吸附能力(Antelo et al., 2013).
施氏矿物对水体中的Cr和Cu等重金属具有较强的吸附能力, 对河流环境中重金属污染表现出显著的修复潜力.但随着河流中环境条件的变化及时间的推移, 施氏矿物可能会发生相转变生成更稳定的针铁矿、水铁矿等矿物, 并引起重金属的释放(Xie et al., 2018).Chen等(2015)的研究表明, 在广东韶关大宝山矿区, 在pH 2.8~5.8的河流环境中, 随着pH的升高, 河流沉积物中的主要矿物由施氏矿物逐渐向针铁矿转变.Regenspurg和Peiffer (2005)研究了含Cr施氏矿物在不同pH条件下的相转变, 在一年时间内, 矿物在pH=4的条件下几乎没有发生相转变, 而在pH=2时矿物中SO42-、CrO42-及Fe3+均发生了明显的溶解释放.本文主要是基于大宝山等综合性多金属矿区河流环境中多种重金属离子共存的情况, 研究含Cr施氏矿物在不同Cu(Ⅱ)浓度时矿物的相转变及CrO42-的释放, 更进一步探索含重金属施氏矿物在无机阳离子条件下的相转变情况.
2 材料与方法(Materials and methods)2.1 实验材料实验用铬酸钾(K2CrO4, >99.5%)、氢氧化钠(NaOH, ≥98%)、2-(N-吗啡啉)乙磺酸(MES, C6H13NO4S·H2O, >99%)均购于阿拉丁试剂(上海)有限公司;盐酸(HCl, 36%~38%)、硝酸(HNO3, 65%~68%)购于广州化学试剂厂;无水硫酸钠(Na2SO4, >99%)购于上海泰坦科技有限公司;氯化铁(FeCl3·6H2O, >99%), 硝酸铜(Cu(NO3)2·3H2O, >99.5%)购于天津市大茂试剂厂;实验用透析袋截留分子量(MWCO)为8000~12000 Da.
2.2 样品制备2.2.1 含Cr施氏矿物的合成含Cr施氏矿物的合成主要参照Bigham等(1990)及Regenspurg和Peiffer(2005)的方法, 即将2 L去离子水置于恒温水浴锅中加热至60 ℃, 加入10.8 g FeCl3·6H2O (~40 mmol·L-1 Fe(Ⅲ))与3.0 g Na2SO4 (~10 mmol·L-1 SO4), 再加入0.7768 g K2CrO4(~2 mmol·L-1 CrO4)试剂, 搅拌溶解得到2 L母液, 在60 ℃的水浴锅中继续加热12 min, 然后冷却至室温;待母液冷却, 将其灌入透析袋中并以透析夹夹紧两端, 按母液:透析水=1 : 2的比例将透析袋放到水槽中透析, 每天更换透析水直至透析袋外侧水的离子强度EC < 5 μS·cm-1;持续时间为27 d, 将透析袋内的溶液收集, 冷冻干燥并研磨过200目筛, 得到含Cr施氏矿物.
2.2.2 不同浓度的Cu(Ⅱ)溶液的制备用预先配制好的1 mol·L-1 HNO3将去离子水pH调至pH ~3.15左右, 将Cu(NO3)2·3H2O溶于已调pH的去离子水中, 配制成pH ~3.10的0、0.1、1.0、10 mmol·L-1的系列Cu(NO3)2溶液.根据Liu等(2015)的方法配制pH ~5.2的缓冲溶液, 同理, 以该缓冲溶液为溶剂配制pH ~5.10的0、0.1、1.0、10 mmol·L-1的系列Cu(NO3)2溶液.
2.3 矿物稳定性实验在一系列25 mL的玻璃反应瓶中装入0.03 g含Cr施氏矿物, 然后加入20 mL pH ~3.10或pH~5.10的Cu(NO3)2溶液, 每个处理设置3个重复.最终得到的矿物悬浮液pH分别为pH=3.0±0.1及pH=5.0±0.1.将装有含Cr施氏矿物悬浮液的玻璃反应瓶放入25 ℃、150 r·min-1的恒温摇床中振荡.每隔一段时间定期取样.将取出的玻璃反应瓶静置2 h, 测定各溶液pH, 用10 mL注射器吸取上层清液经0.25 μm微孔滤膜过滤, 滤液置于4 ℃冰箱保存备用;矿物固体置于40 ℃烘箱烘干备用.
2.4 分析方法与仪器称取0.05 g初始合成的含Cr施氏矿物溶解于6 mol·L-1 HCl, 消解12 h后, 稀释矿物消解液.用电感耦合等离子体质谱仪(ICP-MS, Agilent 7900)测定矿物溶液中的Fe、Cr含量, 用电感耦合等离子体发射光谱仪(ICP-OES, SPECTRO ARCOS MV)测定矿物中的S含量.矿物相转变过程中Cu浓度的变化采用火焰原子吸收光谱仪(AAS, SHIMADZU AA-6880)测定, Cu(Ⅱ)的吸附量等于溶液初始Cu(Ⅱ)总含量与溶液中残留的Cu(Ⅱ)含量之差;Fe(Ⅲ)、CrO42-的释放量采用ICP-MS测定;SO42-的释放量采用离子色谱(IC, Dionex ICS-90)测定.
取少许初始合成的含Cr施氏矿物进行X-射线衍射光谱(XRD)分析, 使用Cu靶波长为λ=0.15418 nm, 加速电压为40 kV, 加速电流为40 mA, 扫射角范围为10°~80°, 步长为0.02°·s-1.另外, 取少许含Cr施氏矿物粉末进行傅里叶红外光谱(FTIR, VERTEX 70)分析矿物分子结构及官能团特征.同理, 矿物相转变产物的形态鉴定也采用上述方法.
3 结果与讨论(Results and discussion)3.1 含Cr施氏矿物的合成与鉴定化学合成含Cr施氏矿物的XRD谱图如图 1所示, 图上出现26.3°、35.2°、39.5°、46.5°、55.3°和61.3°等6个标准施氏矿物特征峰, 具有施氏矿物的结构特征, 表明共沉淀的CrO42-并没有改变施氏矿物的结构.含Cr施氏矿物FTIR谱图如图 2所示.有研究表明, 位于~1630 cm-1是H—O—H或者—OH的伸缩振动特征峰, 420 cm-1和704 cm-1处的峰是Fe—O伸缩振动特征峰(Paikaray and Peiffer, 2010;Regenspurg, 2002).矿物上SO42-分子的伸缩振动特征峰主要包括3部分, 位于~610 cm-1处的ν4(SO4)是SO42-分子内三重简并面外弯曲振动的特征峰, Paikaray和Peiffer认为这个峰是对应施氏矿物隧道结构中的SO42-分子内振动;~985 cm-1处是SO42-分子内对称伸缩振动产生的ν1(SO4)特征峰;而在1050~1200 cm-1范围内, 会形成SO42-分子内三重简并反对称伸缩振动宽峰ν3(SO4), 分别是位于1130 cm-1的尖锐峰和两个位于1050 cm-1和1195 cm-1的肩峰(Regenspurg, 2002;Boily et al., 2010), 而Paikaray和Peiffer认为ν1(SO4)和ν3(SO4)这两个特征峰对应的是矿物外层的SO42-.从图 2可以看出,本研究与文献中报道的施氏矿物特征峰一致.这也表明合成的含Cr施氏矿物具有典型施氏矿物的结构特征.经过元素分析测定, 含Cr施氏矿物的组成为Fe8O8(OH)5.50(SO4)1.15Cr0.1.BET测试结果表明含Cr施氏矿物的比表面积为198.43 m2·g-1.
表 1(Table 1)
| 表 1 矿物组成及化学式 Table 1 Components and chemical formula of synthetic schwertmannite prepared in the presence of chromate | ||||||||||
表 1 矿物组成及化学式 Table 1 Components and chemical formula of synthetic schwertmannite prepared in the presence of chromate
| ||||||||||
图 1(Fig. 1)
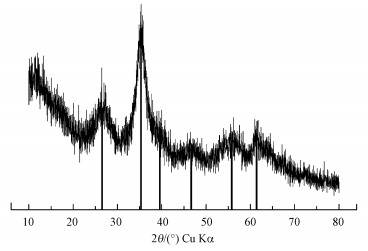 |
| 图 1 含Cr施氏矿物XRD衍射图谱 Fig. 1XRD pattern of original synthetic chromate-doped schwertmannite |
图 2(Fig. 2)
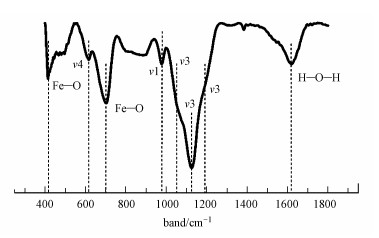 |
| 图 2 含Cr施氏矿物的红外光谱 Fig. 2FTIR spectra of original synthetic chromate-doped schwertmannite |
3.2 Cu(Ⅱ)和pH对含Cr施氏矿物稳定性的影响3.2.1 含Cr施氏矿物对Cu(Ⅱ)的吸附含Cr施氏矿物在不同条件下对Cu(Ⅱ)的吸附量如图 3所示.随着初始Cu(Ⅱ)浓度的升高, 含Cr施氏矿物对Cu(Ⅱ)的吸附量也逐渐增加.当Cu(Ⅱ)浓度升高到10 mmol·L-1, Cu(Ⅱ)的吸附量在pH~3和pH~5时显著增加到20.0 mg·g-1与75.0 mg·g-1左右.而随着pH值的升高, 含Cr施氏矿物对Cu(Ⅱ)的吸附量也随之增大.在不同Cu(Ⅱ)浓度下, 矿物在pH~5时对Cu(Ⅱ)的吸附量较pH~3时均高出两倍左右.这些结果与文献中报道的研究结果一致(Swedlund and Webster, 2001;Otero-Fari?a et al., 2015;刘奋武等, 2013).有研究发现, 施氏矿物对Cu2+的吸附是单层吸附(苏贵珍等, 2009), 矿物在吸附Cu2+的同时会与表面羟基结合或置换出表面羟基中的H+(Rodda et al., 1996);或者与矿物表面组分络合形成≡ FeOHCuSO4三元络合物(Swedlund and Webster, 2001).本研究中, 施氏矿物在pH~3和pH~5时对Cu(Ⅱ)的吸附主要是通过Cu2+与矿物表面OH-的络合生成Cu(OH)+或Cu2(OH)22+, 或通过Cu2+与H+之间的交换作用;另外也存在部分Cu(Ⅱ)取代矿物结构中的Fe(Ⅲ), 因为矿物中Fe(Ⅲ)的释放量在Cu(Ⅱ)存在的条件下会显著增加(图 4).但随着pH的升高, 矿物溶液中及矿物表面的羟基组分含量增加, 会有大量的Cu(Ⅱ)吸附到矿物表面(Rodda et al., 1996; Swedlund and Webster, 2001).在不同条件下, 这些吸附在施氏矿物结构或表面上的Cu(Ⅱ)对矿物的溶解、再沉淀及矿物中重金属的释放都可能产生重要的影响.
图 3(Fig. 3)
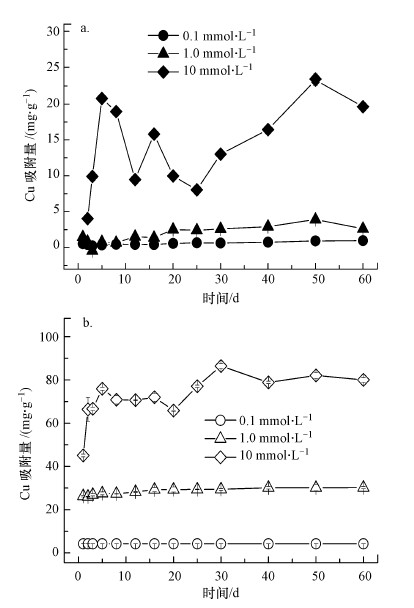 |
| 图 3 含Cr施氏矿物在pH~3 (a)和pH~5 (b)时在不同初始Cu(Ⅱ)浓度下对Cu(Ⅱ)的吸附 Fig. 3Adsorption of Cu(Ⅱ) on the synthetic chromate-doped schwertmannite during incubations at pH ~3 (a) and pH ~5 (b), and with various initial copper concentration |
图 4(Fig. 4)
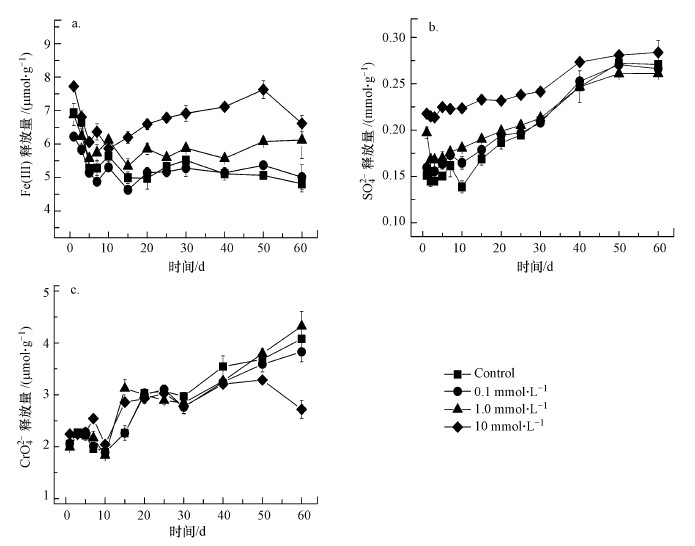 |
| 图 4 含Cr施氏矿物中Fe(Ⅲ) (a)、SO42- (b)和CrO42- (c)在pH ~3时在不同初始Cu(Ⅱ)浓度条件下的释放 Fig. 4Soluble Fe(Ⅲ) (a), sulfate (b) and chromate (c) released from synthetic chromate-doped schwertmannite during incubations at pH ~3 with various initial Cu(Ⅱ) concentration |
3.2.2 Cu(Ⅱ)浓度对含Cr施氏矿物稳定性的影响含Cr施氏矿物在pH~3条件下的溶解如图 4所示.在pH~3时, Fe(Ⅲ)的释放量在60 d的实验期间一直很少, 空白对照处理中Fe(Ⅲ)的溶解量仅为5.5 μmol·g-1左右, 低于矿物中总Fe含量的0.1%, 与Xie等(2017)的研究结果相似.尽管Fe(Ⅲ)的溶解量很少, Cu(Ⅱ)的存在一定程度上仍能够促进Fe(Ⅲ)的释放, 这可能是由于少部分Cu(Ⅱ)取代了矿物结构中的Fe(Ⅲ).其中, 在0.1 mmol·L-1 Cu(Ⅱ)浓度时, 矿物中Fe(Ⅲ)的释放量与对照组差异较小, 这是由于在该浓度下吸附的Cu(Ⅱ)含量极少(< 1.0 mg·g-1), 对矿物中Fe(Ⅲ)的释放影响很小.另一方面, SO42-的溶解量在第一天就达到0.15~0.2 mmol·g-1的水平, 而且随着时间推移其释放量逐渐增加, 在两个月的时间内, 含Cr施氏矿物中的SO42-的释放量在10 mmol·L-1 Cu(Ⅱ)浓度下达到了0.28 mmol·g-1, 对照组的释放量为0.27 mmol·g-1, 约为初始矿物中SO42-总含量(1.08 mmol·g-1)的25%.而Antelo等(2013)的研究结果表明在pH~3条件下, 纯施氏矿物(pure schwertmannite)在60 d时SO42-的释放量约为0.2 mmol·g-1, 占SO42-总量的19.4%.这种差异可能是由于矿物结构、组成及试验条件的不同所导致的, 如矿物溶液固液比等差异.从图 4b中可以看出Cu(Ⅱ)在一定程度上能够促进含Cr施氏矿物中SO42-的释放, 然而, 随着时间的推移, 添加了Cu(Ⅱ)的实验处理组与对照处理之间的差异越来越小.在pH~3时, CrO42-的释放在整个实验过程中逐渐增加, 但是Cu(Ⅱ)的存在对矿物中CrO42-的释放没有显著影响.对比SO42-的释放, CrO42-在整个实验期间(60 d)释放量则较少(< 5%).总体来说, 在pH~3时, 含Cr施氏矿物的溶解程度较低, 而Cu(Ⅱ)的存在前40 d的时间内对矿物的溶解有一定的促进作用, 但随着时间的推移, 这种促进作用逐渐减弱, 至实验结束(60 d)时Cu(Ⅱ)对矿物溶解的促进作用不明显.
含Cr施氏矿物在pH ~5时的溶解结果如图 5所示.由于在整个实验过程中, ICP-MS未检测到Fe(Ⅲ)的释放, 图 5仅提供SO42-与CrO42-的溶解结果.从图 5可以看出, Cu(Ⅱ)的存在能显著抑制含Cr施氏矿物中SO42-的释放, 且随着Cu(Ⅱ)吸附量的增加, 该抑制作用也逐渐增强.同时, CrO42-的释放在Cu(Ⅱ)存在时也会受到一定程度的抑制, 在溶液初始Cu(Ⅱ)浓度为10 mmol·L-1时, 几乎没有检测到CrO42-的释放.这可能是由于吸附到含Cr施氏矿物表面上的Cu(OH)+及Cu2(OH)22+覆盖了矿物表面的释放位点, 从而对矿物的溶解产生抑制作用.
图 5(Fig. 5)
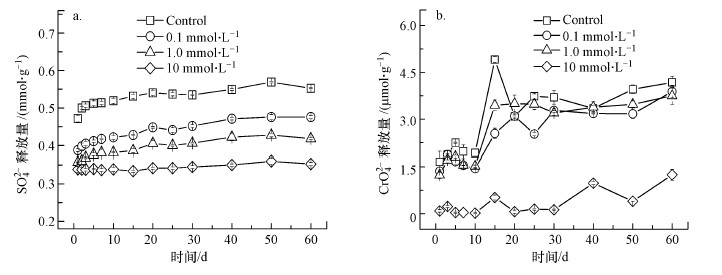 |
| 图 5 含Cr施氏矿物中SO42- (a)和CrO42- (b)在pH~5时在不同初始Cu(Ⅱ)浓度条件下的释放 Fig. 5Soluble sulfate (a) and chromate (b) released from synthetic chromate-doped schwertmannite during incubations at pH ~5 with various initial Cu(Ⅱ) concentration |
3.2.3 pH对含Cr施氏矿物稳定性的影响含Cr施氏矿物对Cu(Ⅱ)的吸附量在不同pH条件下呈现较大差异(图 3), pH~5时矿物对Cu(Ⅱ)的吸附量高于pH~3.有研究显示施氏矿物对Cu2+的吸附量在pH 3~8的范围内随pH的升高而升高(Otero-Fari?a et al., 2015).另外, 有广泛的研究表明pH是影响施氏矿物溶解和相转变的重要因素(Regenspurg et al., 2004;HoungAloune et al., 2015).这些作者认为施氏矿物在pH为3~4时最稳定, 矿物中SO42-的释放量最低.本研究中, 含Cr施氏矿物中SO42-的释放量在pH~5时较pH~3时更高(图 4b, 图 5a).这是由于当pH升高时, Fe羟基氧化物矿物表面所带正电荷减少, 对矿物表面的SO42-的吸附性能降低;同时, 随着pH的升高SO42-与OH-的交换作用增强(Rose and Elliott, 2000), SO42-的释放量也随之增加.相反, Fe(Ⅲ)的释放量在低pH时更高, 这是由Fe氢氧化物的溶解性所决定的.从含Cr施氏矿物相转变产物的XRD谱图(图 6)可以看出, 矿物在pH~3和pH~5时相转变程度均较小, 仅出现少数微弱的针铁矿特征峰, 结果表明在pH 3~5范围内, 含Cr施氏矿物结构均较为稳定, 受pH变化的影响较小.
图 6(Fig. 6)
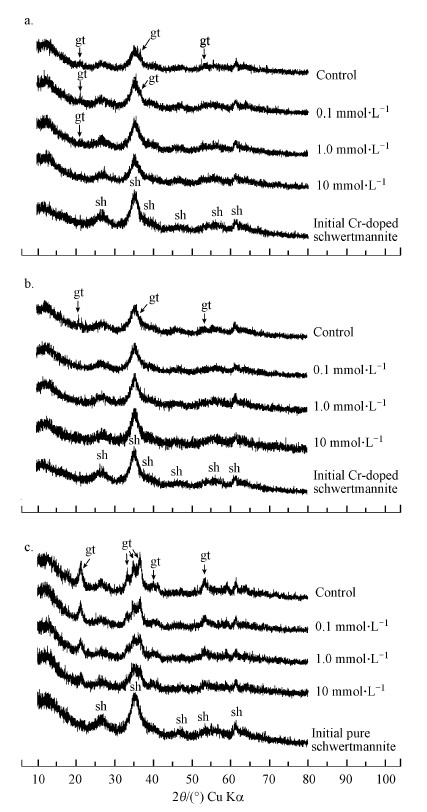 |
| 图 6 含Cr施氏矿物与纯施氏矿物在不同初始Cu(Ⅱ)浓度下相转变产物的XRD图谱(a.含Cr施氏矿物, 60 d, pH~3;b.含Cr施氏矿物, 60 d, pH~5;c.纯施氏矿物, 30 d, pH ~3) Fig. 6XRD patterns of synthetic chromate-doped schwertmannite obtained before that start (Initial Cr-doped schwertmannite) and after 60 days of aging in the absence or presence of Cu(Ⅱ), and at pH~3 (a) and pH~5 (b), and pure synthetic schwertmannite obtained before that start (Initial pure schwertmannite) and after 30 days of aging in the absence or presence of Cu(Ⅱ) at pH ~3 (c) |
本研究中, pH对溶解体系的影响主要表现为两方面:pH直接影响含Cr施氏矿物的溶解与相转变;另一方面, pH影响含Cr施氏矿物对Cu(Ⅱ)的吸附, 从而间接影响矿物的稳定性.在pH~3时, 含Cr施氏矿物的溶解程度较低(Fe3+ < 0.1%, SO42- < 30%, CrO42- < 5%), 而矿物对Cu(Ⅱ)的吸附量也较少, Cu(Ⅱ)主要是以Cu2+阳离子的形态吸附于矿物表面, 可能也存在少量Cu(Ⅱ)取代结构中的Fe(Ⅲ).在该pH条件下, 在前40 d的时间内, Cu(Ⅱ)在一定程度上能促进含Cr施氏矿物的溶解, 但是到实验结束(60 d)时, Cu(Ⅱ)对矿物溶解的作用并不明显.当pH升高到pH~5时, 含Cr施氏矿物中SO42-的释放量较高(>30%).但随着pH的升高, 矿物溶液中及矿物表面的羟基组分增加, 大量的Cu(Ⅱ)会吸附到矿物表面(图 3b).吸附在矿物上的Cu(Ⅱ)主要是以Cu(OH)+或Cu2(OH)22+形态固定在矿物表面从而占据含Cr施氏矿物的表面位点(Rodda et al., 1996), 阻碍矿物中SO42-和CrO42-的释放.而在pH~5时, 也存在部分Cu(OH)2固体直接沉淀在矿物表面, 占据施氏矿物表面的活性位点. Baleeiro等(2018)的研究表明在pH 5.5~6.0的范围内, 有大量Cu(OH)2固体沉淀在施氏矿物表面影响矿物的反应.
3.2.4 含Cr施氏矿物的相转变含Cr施氏矿物相转变产物的XRD谱图如图 6a和图 6b所示.鉴定结果表明, 共沉淀了CrO42-的施氏矿物在pH~3和pH~5时均比较稳定, 经过60 d的老化, 矿物组成主要还是施氏矿物, 仅有部分实验处理中发现了针铁矿的生成.在pH~3条件下, 纯施氏矿物在30 d时, 其产物XRD谱图上就可以发现部分针铁矿的特征峰(图 6c), 而Antelo等(2013)的研究结果表明纯施氏矿物在47 d时会发生相转变生成针铁矿.这表明施氏矿物中共沉淀的CrO42-能够促进施氏矿物的稳定性, 与Regenspurg和Peiffer(2005)的研究结果一致.两种pH条件下, 对照处理中的含Cr施氏矿物产物的XRD谱图中均出现了针铁矿的特征峰(2θ=21.2°, 36.7°, 53.3°), 表明有少部分的针铁矿生成;在pH~3条件下, 初始Cu(Ⅱ)浓度为0.1 mmol·L-1和1.0 mmol·L-1时也出现了针铁矿的特征峰(2θ=21.2°).而当Cu(Ⅱ)浓度升高到10 mmol·L-1时, 含Cr施氏矿物在60 d的时间内几乎不发生相转变.类似的研究结果已有前人报道过, 如Antelo等(2013)发现在同等条件下, 合成过程中添加了Cu(Ⅱ)的施氏矿物在老化过程中, 其结构比未添加Cu(Ⅱ)的纯施氏矿物结构更稳定.
图 7(Fig. 7)
 |
| 图 7 初始含Cr施氏矿物与不同初始Cu(Ⅱ)浓度下相转变产物的红外光谱图(pH~3 (a);pH~5 (b)) Fig. 7FTIR spectra of synthetic chromate-doped schwertmannite obtained before that start (Initial Cr-doped schwertmannite) and after 60 days of aging in the absence or presence of Cu(Ⅱ), and at pH~3 (a) and pH~5 (b) |
含Cr施氏矿物的FTIR谱图(图 7)显示, 在pH~3且当溶液中Cu(Ⅱ)浓度为10 mmol·L-1时, 矿物老化产物上SO42-分子三重简并反对称伸缩振动宽峰ν3(SO4)的强度减弱, 这表明矿物外层的SO42-流失较严重, 这与J?nsson等(2005)的研究结果一致, 即矿物外层SO42-的流失要早于结构内SO42-.另外, 在795 cm-1和890 cm-1处出现两个新的OH特征峰(图 7a), 随着Cu(Ⅱ)浓度的升高, 这两个OH特征峰强度逐渐减弱.有文献报道在~795 cm-1和~895 cm-1处的特征峰是针铁矿的OH特征峰(Regenspurg and Peiffer, 2005), 这表明当溶液不存在Cu(Ⅱ)或Cu(Ⅱ)浓度较低时, 含Cr施氏矿物老化产物会发生相转变生成针铁矿.但随着初始Cu(Ⅱ)浓度的升高, 矿物的相转变逐渐得到抑制, 与XRD结果(图 6a)一致.在pH ~5时, 不同Cu(Ⅱ)浓度下矿物老化产物上SO42-分子三重简并反对称伸缩振动宽峰ν3(SO4)出现分裂, 形成多个独立的特征峰, 分别位于1050、1120和1195 cm-1处的位置, 而且特征峰强度明显减弱.这一结果表明矿物中SO42-释放量较大, 对矿物结构已经产生一定影响, 但是没有现象表明生成了针铁矿或水铁矿等矿物.
4 结论(Conclusions)矿物溶液中初始Cu(Ⅱ)浓度与pH变化均会影响含Cr施氏矿物的溶解与相转变.在pH ~3时, 含Cr施氏矿物对Cu(Ⅱ)的吸附量较少, Cu(Ⅱ)主要是通过Cu2+与OH-络合或通过Cu2+与H+的交换作用吸附在矿物表面, 也可能存在部分Cu(Ⅱ)取代矿物结构中的Fe(Ⅲ).Cu(Ⅱ)的存在对矿物溶解的影响不明显.含Cr施氏矿物在老化过程中会发生相转变生成少部分的针铁矿, 但是随着溶液中初始Cu(Ⅱ)浓度的升高, 矿物的相转变逐渐得到抑制.在pH ~5时, 含Cr施氏矿物对Cu(Ⅱ)的吸附量最高达到75 mg·g-1, 大量的Cu(Ⅱ)主要以Cu(OH)+或Cu2(OH)22+的形态吸附在矿物的表面, 当溶液中Cu(Ⅱ)浓度较高时, 也存在部分Cu(OH)2固体直接沉淀在矿物的表面, 对矿物中SO42-、CrO42-的释放形成阻碍作用.随着初始Cu(Ⅱ)浓度的升高, Cu(Ⅱ)对矿物溶解的阻碍作用越显著.在pH~5的条件下, 施氏矿物中SO42-的释放量较多, 但是无明显新的矿物生成.
参考文献
| Antelo J, Fiol S, Gondar D, et al. 2012. Comparison of arsenate, chromate and molybdate binding on schwertmannite:Surface adsorption vs anion-exchange[J]. Journal of Colloid and Interface Science, 386: 338–343.DOI:10.1016/j.jcis.2012.07.008 |
| Antelo J, Fiol S, Gondar D, et al. 2013. Cu(Ⅱ) incorporation to schwertmannite:effect on stability and reactivity under AMD conditions[J]. Geochimica et Cosmochimica Acta, 119: 149–163.DOI:10.1016/j.gca.2013.05.029 |
| Baleeiro A, Fiol S, Otero-farina A A, et al. 2018. Surface chemistry of iron oxides formed by neutralization of acidic mine waters:Removal of trace metals[J]. Applied Geochemistry, 89: 129–137.DOI:10.1016/j.apgeochem.2017.12.003 |
| Bigham J M, Schwertmann U, Carlson L, et al. 1990. A poorly crystallized oxyhydoxysulfate of iron formed by bacterial oxidation of Fe(Ⅱ) in acid mine waters[J]. Geochimica et Cosmochimica Acta, 54: 2743–2758.DOI:10.1016/0016-7037(90)90009-A |
| Bigham J M, Schwertmann U, Traina S J, et al. 1996. Schwertmannite and the chemical modeling of iron in acid sulfate waters[J]. Geochimica et Cosmochimica Acta, 60: 2111–2121.DOI:10.1016/0016-7037(96)00091-9 |
| Boily J F, Gassman P L, Peretyazhko T, et al. 2010. FTIR spectral components of schwertmannite[J]. Environmental Science & Technology, 44: 1185–1190. |
| Chen M Q, Lu G N, Guo C L, et al. 2012. Sulfate migration in a river affected by acid mine drainage from the Dabaoshan mining area, South China[J]. Chemosphere, 119: 734–743. |
| 陈梅芹. 2015. 硫酸根在金属硫化物矿物AMD污染河流中的迁移过程及其作用机制[D]. 广州: 华南理工大学 |
| Dhal B, Thtoi H N, Das N N, et al. 2013. Chemical and microbial remediation of hexavalent chromium from contaminated soil and mining/metallurgical solid waste:A review[J]. Journal of Hazardous Materials, 250. |
| Dzombak D A, Morel F M M. 1990. Surface Complexation Modeling-Hydrous Ferric Oxide[M]. New York: Wiley-Interscience. |
| Fernandez-Martinez A, Timon V, Roman-Ross, et al. 2010. The structure of schwertmannite, a nanocrystalline iron oxyhydroxysulfate[J]. American Mineralogist, 95(8/9): 1312–1322. |
| HoungAloune S, Hiroyoshi N, Ito M. 2015. Stability of As(Ⅴ)-sorbed schwertmannite under porphyry copper mine conditions[J]. Minerals Engineering, 74: 51–59.DOI:10.1016/j.mineng.2015.01.003 |
| Hsu N H, Wang S L, Lin Y C, et al. 2009. Reduction of Cr (Ⅵ) by crop-residue-derived black carbon[J]. Environmental Science & Technology, 43: 8801–8806. |
| J?nsson J, Persson P, Sj?berg S, et al. 2005. Schwertmannite precipitated from acid mine drainage:phase transformation, sulphate release and surface properties[J]. Applied Geochemistry, 20: 179–191.DOI:10.1016/j.apgeochem.2004.04.008 |
| 刘奋武, 卜玉山, 田国举, 等. 2013. 温度与pH对生物合成施氏矿物在酸性环境中溶解行为及对Cu2+吸附效果的影响[J]. 环境科学学报, 2013, 33(9): 2445–2451. |
| Liu Y Y, Mou H Y, Chen L C, et al. 2015. Cr(Ⅵ)-contaminated groundwater remediation with simulated permeable reactive barrier (PRB) filled with natural pyrite as reactive material:Environmental factors and effectiveness[J]. Journal of Hazardous Materials, 298: 83–90.DOI:10.1016/j.jhazmat.2015.05.007 |
| Otero-Fari?a A, Gago R, Antelo J, et al. 2015. Surface complexation modelling of arsenic and copper immobilization by iron oxide precipitates derived from acid mine drainage[J]. Boletín de la Sociedad Geológica Mexicana, 67: 493–508.DOI:10.18268/BSGM2015v67n3a12 |
| Paikaray S, Peiffer S. 2010. Dissolution kinetics of sulfate from schwertmannite under variable pH conditions[J]. Mine Water and the Environment, 29: 263–269.DOI:10.1007/s10230-010-0118-0 |
| Regenspurg S. 2002. Characterisation of schwertmannite-geochemical interactions with arsenate and chromate and significance in sediments of lignite opencast lakes[D]. Bayreuth: Universit?t Bayreuth |
| Regenspurg S, Brand A, Peiffer S. 2004. Formation and stability of schwertmannite in acidic mining lakes[J]. Geochimica et Cosmochimica Acta, 68: 1185–1197.DOI:10.1016/j.gca.2003.07.015 |
| Regenspurg S, Peiffer S. 2005. Arsenate and chromate incorporation in schwertmannite[J]. Applied Geochemistry, 20: 1226–1239.DOI:10.1016/j.apgeochem.2004.12.002 |
| Rodda D P, Wells J D, Johnson B B. 1996. Anomalous adsorption of copper (Ⅱ) on goethite[J]. Journal of Colloid and Interface Science, 184: 564–569.DOI:10.1006/jcis.1996.0652 |
| Rose S, Elliott C. 2000. The effects of pH regulation upon the release of sulfate from ferric precipitates formed in acid mine drainage[J]. Applied Geochemistry, 15: 27–34.DOI:10.1016/S0883-2927(99)00015-3 |
| 苏贵珍, 陆建军, 陆现彩, 等. 2009. 施氏矿物吸附Cu2+及氧化亚铁硫杆菌的实验研究[J]. 岩石矿物学杂志, 2009, 128(6): 575–580. |
| Swedlund P J, Webster J G. 2001. Cu and Zn ternary surface complex formation with SO4 on ferrihydrite and schwertmannite[J]. Applied Geochemistry, 16: 503–511.DOI:10.1016/S0883-2927(00)00044-5 |
| Wilkinson G, Gillard R D, McCleverty J A. 1987. Comprehensive Coordination Chemistry[M]. Oxford: Pergamon Print. |
| Xie Y Y, Lu G N, Ye H, et al. 2017. Role of dissolved organic matter in the release of chromium from schwertmannite:kinetics, repartition, and mechanisms[J]. Journal of Environmental Quality, 46: 1088–1097.DOI:10.2134/jeq2017.03.0122 |
| Xie Y Y, Lu G N, Yang C F, et al. 2018. Mineralogical characteristics of sediments and heavy metal mobilization along a river watershed affected by acid mine drainage[J]. PLoS One. |
| 周顺桂, 周立祥, 陈福星. 2007. 施氏矿物Schwertmannite的微生物法合成, 鉴定及其对重金属的吸附性能[J]. 光谱学与光谱分析, 2007, 27(2): 367–370. |
| 邹晓锦, 仇荣亮, 周小勇, 等. 2008. 大宝山矿区重金属污染对人体健康风险的研究[J]. 环境科学学报, 2008, 28(7): 1406–1412. |
