 , 程军
, 程军
 , 刘建忠, 周俊虎, 岑可法
, 刘建忠, 周俊虎, 岑可法浙江大学能源清洁利用国家重点实验室, 杭州 310027
收稿日期: 2017-09-01; 修回日期: 2017-10-24; 录用日期: 2017-10-25
基金项目: 国家重点研发项目(No.2016YFE0117900);浙江省重点研发项目(No.2017C04001)
作者简介: 丁灵侃(1991-), 男, E-mail:dlkschumi@zju.edu.cn
通讯作者(责任作者): 程军(1974—), 男, 浙江大学教授, 博士生导师, 研究领域为新能源和节能环保, 重点研究生物质能和太阳能、燃煤污染物控制及CO2减排利用等高效清洁转化技术. E-mail:juncheng@zju.edu.cn
摘要: 采用只消耗乙酸盐而不消耗氢气的甲烷丝菌与螺旋藻混合培养,以提高螺旋藻利用自身多糖在自身氢酶作用下暗发酵产氢量.通过培养基调控提高了螺旋藻生长富集的总糖产量,当NaCl浓度由239 mmol·L-1增加到739 mmol·L-1,螺旋藻总糖产量提高了107.7%,达到0.54 g·L-1.螺旋藻在黑暗厌氧条件下加入甲烷丝菌混养后的自发酵产氢量提高了33.8%,达到43.8 mL·g-1;液相主要代谢产物乙酸盐则提高了69.2%,达到1639.1 μmol·g-1.同时,螺旋藻加入甲烷丝菌混养后自发酵过程的能量转换效率由6.7%提高到11.6%.甲烷丝菌通过消耗乙酸盐促进了螺旋藻自发酵产氢的乙酸途径反应正向进行,从而提高了氢气产量和能量转换效率.
关键词:甲烷丝菌螺旋藻产氢自发酵液相代谢产物
Improvement of hydrogen production from Arthrospira maxima through autofermentation by adding Methanothrix concilii
DING Lingkan
 , CHENG Jun
, CHENG Jun
 , LIU Jianzhong, ZHOU Junhu, CEN Kefa
, LIU Jianzhong, ZHOU Junhu, CEN Kefa State Key Laboratory of Clean Energy Utilization, Zhejiang University, Hangzhou 310027
Received 1 September 2017; received in revised from 24 October 2017; accepted 25 October 2017
Supported by the National Key Research and Development Program (No.2016YFE0117900) and the Zhejiang Provincial Key Research and Development Program (No.2017C04001)
Biography: DING Lingkan (1991—), male, E-mail:dlkschumi@zju.edu.cn
*Corresponding author: CHENG Jun, E-mail:juncheng@zju.edu.cn
Abstract: The effect of Methanothrix concilii, which consumes acetate as its lone energy source, on hydrogen production from Arthrospira (Spirulina) maxima through autofermentation was investigated for the first time. During A. maxima cultivation, the effect of different NO3- and Na+ concentrations on cell growth and the accumulation of carbohydrates was also explored. At a Na+ concentration of 739 mmol·L-1, the total carbohydrate yield increased by 107.7% to 0.54 g·L-1. The harvested A. maxima suspension was treated under dark and anaerobic conditions to produce hydrogen in autofermentation, with M. concilii added during the fermentation. By adding M. concilii, the hydrogen yield reached up to 43.8 mL·g-1, an increase of 33.8%. Furthermore, the acetate, as the predominant soluble metabolite product, increased by 69.2% to 1639.1 μmol·g-1, whilst the energy conversion efficiency was enhanced from 6.7% to 11.6%. By consuming acetate, M. concilii facilitated the acetate metabolic pathway in the autofermentation of A. maxima, resulting in the enhanced hydrogen yield and significantly increased energy conversion efficiency.
Key words: Methanothrix conciliiArthrospira(Spirulina)maximahydrogen productionautofermentationsoluble metabolite products
1 引言(Introduction)利用微藻发酵制氢具有能耗低、环境友好和碳中性等优点(Argun et al., 2011; Holladay et al., 2009; Singh et al., 2011; Xia et al., 2013; 2015a;2015b), 是目前国际氢能领域的研究热点.螺旋藻(Arthrospira fusiformis)具有生长速度快、生物质产量高、养殖不占用陆地面积及易收获等优点, 在生物质发酵制氢领域获得高度关注(Xia et al., 2015b; Ananyev et al., 2008; Carrieri et al., 2008; 2009; Kebede et al., 1996; Schutz et al., 2004).与其他藻类生物质需要外加暗发酵细菌进行异相发酵制氢不同的是, 螺旋藻还可以利用自身细胞光合作用积累的碳水化合物, 在黑暗厌氧条件下利用自身[NiFe]氢酶催化进行自相发酵制氢(Aoyama et al., 1997; Carrieri et al., 2010; Cheng et al., 2012; Dismukes et al., 2008).在螺旋藻自发酵制氢领域, 已有一些****进行了一定的探索.日本国家先进工业科学技术研究院的Aoyama等(1997)利用A. platensis NIES-46湿藻生物质在1.6~4.1 g·L-1底物浓度下得到的最大自发酵氢气产率约为47.0 mL·g-1.美国普林斯顿大学的Carrieri等(2010)利用A. maxima CS-328湿藻生物质在0.75~1.5 g·L-1底物浓度下得到的最大自发酵氢气产率约为20.2 mL·g-1.Ananyev等(2008)利用A. maxima CS-328湿藻生物质通过暗光两步循环法自发酵, 在15.1 g·L-1底物浓度下得到了36.0 mL·g-1的最大氢气产率.Xia等(2012)利用钝顶螺旋藻A. platensis湿藻发酵, 在10~20 g·L-1的高底物浓度下得到的自发酵氢气产率仅为11.0~16.1 mL·g-1.而沈阳大学李全顺等(2009)则利用生长条件优化后的盐泽螺旋藻A. subsalsa进行自发酵产氢研究, 得到的最大产氢速率达到了98 nmol·mg-1·h-1.中科院海洋研究所的何梅琳(2013)比较了3种螺旋藻在不同培养基条件下的产氢效果, 发现淡水螺旋藻A. maxima IOAC037F在缺氮条件下的产氢量最大, 且产氢诱导时间最短.但螺旋藻自发酵产氢效率低下, 如何采取有效措施提高自发酵产氢量是一个难题.
甲烷丝菌(Methanothrix sp.)是目前已知的仅有的两种仅以乙酸盐为能量来源、通过厌氧代谢生成甲烷而不利用氢气和二氧化碳的产甲烷菌之一(Jetten et al., 1992; Tindall, 2014), 该菌对乙酸盐的浓度要求较低(最低浓度7~70 μmol·L-1时即可利用, 而甲烷八叠球菌Methanosarcina则需要0.2~1.2 mmol·L-1)(Jetten et al., 1992).能否利用甲烷丝菌仅消耗乙酸盐而不消耗氢气的特点提高螺旋藻自发酵产氢量是一个令人十分感兴趣的问题, 但至今尚未有相关文献报道.
本文将螺旋藻在黑暗厌氧条件下首次加入甲烷丝菌混养, 利用其仅消耗乙酸盐而不消耗氢气的特点促进螺旋藻自发酵产氢, 以提高整体能量转换效率.
2 实验材料与方法(Materials and methods)2.1 藻种及菌种的培养实验采用的藻种为极大螺旋藻Arthrospira (Spirulina) maxima.螺旋藻在30 ℃恒温条件下, 在容积为20 L的光生物反应器中培养34 d, 通入空气使藻细胞和营养成分保持均匀状态.荧光灯照射生物反应器表面, 光强约为40 μmol·m-2·s-1, 昼夜比12 h:12 h循环以模拟自然条件.采用修正Zarrouk培养基(6.5 g·L-1 NaHCO3和7.0 g·L-1 Na2CO3取代18.0 g·L-1 NaHCO3, 10~30 mmol·L-1 NaNO3, 初始pH为9.8), 增加0~500 mmol·L-1 NaCl和1 μmol·L-1 NiSO4 (Carrieri et al., 2008).
甲烷丝菌Methanothrix concilii在35 ℃、厌氧条件下培养约6个月, 培养基成分(g·L-1)如下:CH3COONa 6.8, KH2PO4 0.3, NaCl 0.6, MgCl2·6H2O 0.1, CaCl2·2H2O 0.08, NH4Cl 1.0, Resazurin 0.001, KHCO3 4.0, Cysteine-HCl·H2O 0.3, Na2S·9H2O 0.3, 微量元素液10.0 mL, 维生素液10.0 mL.其中, 微量元素液成分为(g·L-1):氨三乙酸12.8, FeCl3·6H2O 1.35, MnCl2·4H2O 0.1, CoCl2·6H2O 0.02, CaCl2·2H2O 0.1, ZnCl2 0.1, CuCl2·2H2O 0.025, H3BO3 0.01, Na2MoO4·2H2O 0.024, NaCl 1.0, NiCl2·6H2O 0.12, Na2SeO3·5H2O 0.026.维生素液成分为(mg·L-1):生物素2.0, 叶酸2.0, 盐酸维生素B6 10.0, 二水合盐酸硫胺5.0, 核黄素5.0, 烟酸5.0, D-泛酸钙5.0, 维生素B12 0.1, 对氨基苯甲酸5.0, 硫辛酸5.0.
2.2 螺旋藻自发酵产氢螺旋藻培养结束后, 利用真空抽滤装置(5 μm孔径滤膜)收集螺旋藻细胞, 随后使之再次悬浮于新的产氢缓冲液(50 mmol·L-1 Na2HPO4, 100 mmol·L-1 NaCl)中.3 mL悬浮液被装入总体积为12.1 mL的发酵瓶(Fisher Scientific)中, 实验组接种具有生物活性的甲烷丝菌培养液0.6 mL, 参照组接入湿热灭菌(121 ℃, 30 min)后不具有生物活性的甲烷丝菌培养液0.6 mL, 密封并且通氩气(每个样品20 min)造成厌氧条件.利用锡箔纸包覆发酵瓶避光以防止螺旋藻通过光合作用产生氧气, 在35 ℃恒温条件下产氢.每隔24 h测量一次气相成分和液相成分, 所有时间点上的气相成分和液相成分的测试样品都有3个平行样.
2.3 分析测量方法螺旋藻干重是利用真空抽滤装置(5 μm孔径滤膜)收集10 mL藻液后, 在75 ℃的烘箱中经过24 h烘干至恒重后得到.藻细胞内的总糖含量利用硫酸蒽酮法进行测量(Trevelyan et al., 2008).利用Origin 9.0软件对培养结束后螺旋藻细胞密度、总糖含量及总糖产量进行方差分析, 应用Tucky检验对其平均值进行显著性分析, 显著性水平设定为0.05.螺旋藻热值用快速量热仪(长沙开元5E-KC5410)测量得到.
利用气密进样针(Hamilton, 瑞士)进200 μL生物气, 在装备有热导检测器(TCD)和5A分子筛色谱柱(Φ3 mm×3 m)的气相色谱仪(GC, 安捷伦7820A, 美国)上分析生物气中的H2浓度.进样口、柱箱和TCD检测器的温度分别为200、65和300 ℃, 载气为氩气, 流速为27 mL·min-1.液相成分利用核磁共振仪(Bruker Avance-Ⅱ, 瑞士)进行测量, 测量参数与文献(Carrieri et al., 2009)一致.
螺旋藻自发酵产氢的质量转换效率ηm和能量转换效率ηe计算方法分别如公式(1)和(2)所示.
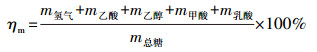 | (1) |
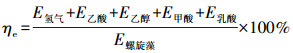 | (2) |
3 结果与讨论(Results and discussion)3.1 培养基调控提高螺旋藻生长富集的总糖产量螺旋藻自发酵产氢量与其自身的碳水化合物含量有很大关系.在标准培养条件下螺旋藻的总糖含量仅在15%左右, 然而在缺乏NO3-和增加Na+压力下, 自身糖类物质含量能大幅度提高(达到30%~50%), 从而提高自发酵产氢量和液相代谢物产量(Carrieri et al., 2010; Warr et al., 1985).本文为了提高螺旋藻的总糖产量, 调整培养基中的NaNO3和NaCl浓度, 得到培养34 d后收获的螺旋藻的细胞密度及总糖含量, 结果如表 1所示.可见, 当NaNO3浓度不变、NaCl浓度由239 mmol·L-1增加到739 mmol·L-1时, 虽然藻细胞密度由1.78 g·L-1降低到1.51 g·L-1, 但细胞内总糖含量则由14.5%提高到35.6%, 总糖产量比标准工况提高了107.7%, 达到0.54 g·L-1.这是因为在钠离子胁迫下, 螺旋藻为了维持细胞渗透压, 合成了更多的葡萄糖甘油和海藻糖等形式的小分子糖作为“渗透压保护剂”, 从而增加整体糖类含量(Warr et al., 1985).当NaCl浓度不变、NaNO3浓度由30 mmol·L-1降低到10 mmol·L-1时, 藻细胞密度明显降低到1.07 g·L-1, 细胞内总糖含量轻微增加到19%, 故总糖产量甚至低于标准工况.这是因为在缺氮条件下, 螺旋藻细胞合成蛋白质途径受阻, 导致能源物质更多的以大分子糖类形式(如糖原)存在, 但细胞无法合成足够自身生长所需的蛋白质使得藻细胞密度降低.当NaCl浓度由239 mmol·L-1增加到739 mmol·L-1且NaNO3浓度由30 mmol·L-1降低到10 mmol·L-1时, 螺旋藻细胞内总糖含量在加钠缺氮的协同作用下达到最高(39.2%), 但细胞生长受到的抑制也最为严重, 藻细胞密度最低(0.98 g·L-1), 故总糖产量(0.38 g·L-1)仅为中等.因此, 在后续实验中仅选取总糖产量最高的加钠培养条件下的螺旋藻液进行自相发酵制取氢气.
表 1(Table 1)
| 表 1 缺氮加钠条件下螺旋藻的细胞密度和总糖含量 Table 1 Cell densities, total carbohydrate contents, and yields at different concentrations of NO3- and Na+ | ||||||||||||||||||||||||||||||||||||
表 1 缺氮加钠条件下螺旋藻的细胞密度和总糖含量 Table 1 Cell densities, total carbohydrate contents, and yields at different concentrations of NO3- and Na+
| ||||||||||||||||||||||||||||||||||||
3.2 甲烷丝菌混养提高螺旋藻自发酵产氢及液相副产物螺旋藻与甲烷丝菌的混合培养对螺旋藻自发酵产氢过程的影响如图 1所示, 可见在前24 h内两者氢气产量几乎没有差别;到了自发酵进行到48 h时, 加入甲烷丝菌的螺旋藻自发酵产氢量达到了30.6 mL·g-1, 比未加甲烷丝菌的产氢量(25.5 mL·g-1)要高20%;到72 h时, 两者差距更加明显, 加入甲烷丝菌混养的螺旋藻自发酵产氢量达到了43.8 mL·g-1, 比未加甲烷丝菌的产氢量(32.7 mL·g-1)要高33.8%.
图 1(Fig. 1)
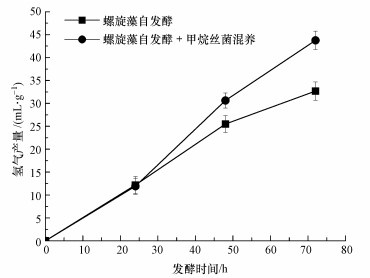 |
| 图 1 螺旋藻自发酵与螺旋藻甲烷丝菌混养自发酵产氢对比 Fig. 1Hydrogen yields from A. maxima and A. maxima mixed with M. Concilii during autofermentation |
螺旋藻自发酵产氢的反应可用乙酸途径(式(3))和甲酸途径(式(4))表示, 与产氢过程竞争的反应则可用乙醇途径(式(5))和乳酸途径(式(6))表示.而甲烷丝菌在生长代谢过程中是以乙酸盐为主要的能量来源物质, 代谢过程可用式(7)表示.在甲烷丝菌作用下螺旋藻自发酵产氢的代谢副产物乙酸盐被消耗, 从而促进了自发酵产氢的代谢反应向右进行, 更多的糖类物质被分解成为乙酸盐和甲酸盐, 从而生成更多的NADH, 并在螺旋藻自身的[NiFe]氢酶作用下产生氢气, 提高了自发酵氢气产量.
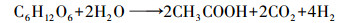 | (3) |
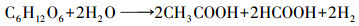 | (4) |
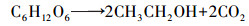 | (5) |
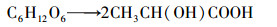 | (6) |
 | (7) |
图 2(Fig. 2)
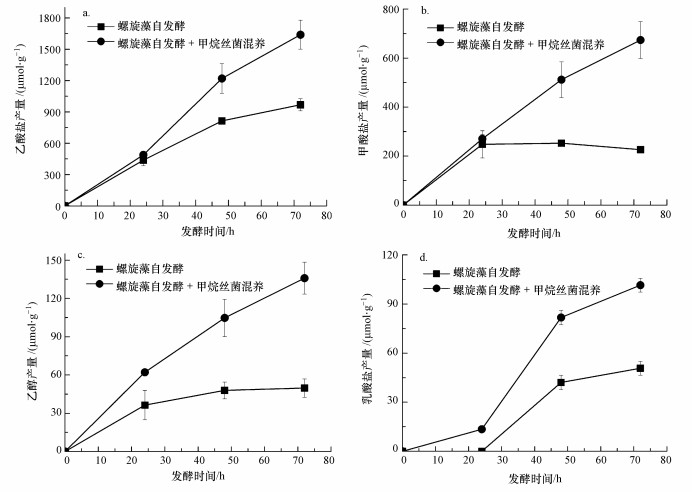 |
| 图 2 螺旋藻自发酵与螺旋藻甲烷丝菌混养自发酵液相产物产量对比(a.乙酸盐, b.甲酸盐, c.乙醇, d.乳酸盐) Fig. 2Soluble metabolite product yields from A. maxima and A. maxima mixed with M. Concilii during autofermentation (a. acetate, b. formate, c.ethanol, d.lactate) |
这是由于在螺旋藻自发酵产氢过程中, 先是糖原等大分子糖及海藻糖等二糖降解为小分子的葡萄糖单糖, 葡萄糖再降解为丙酮酸, 并生成NADH和ATP.然后丙酮酸通过以下3个途径继续反应(Cheng et al., 2012):①丙酮酸生成乙酰辅酶A并释放出二氧化碳和NADH, 而乙酰辅酶A在不同条件下转化为乙酸和乙醇等末端代谢产物;乙酸途径不消耗NADH, 而乙醇途径会消耗NADH氧化生成NAD+;②丙酮酸分解成乙酰辅酶A和甲酸, 此时不消耗也不产生NADH;③丙酮酸直接生成乳酸, 会消耗大量NADH氧化生成NAD+.通过以上一系列反应后, 剩余NADH在螺旋藻自身[NiFe]氢酶作用下还原氢离子生成H2, 故当最终液相代谢产物为乙酸盐时会生成更多的H2.当加入甲烷丝菌后螺旋藻自发酵产氢过程的主要代谢副产物乙酸盐的产量占总代谢副产物的比例由74.8%降低到64.3%, 说明甲烷丝菌的加入消耗了一定的乙酸盐, 同时由于乙酸盐的消耗促进了螺旋藻自发酵产氢的乙酸途径正向进行, 提高了氢气产量和液相代谢产物产量.但由于氢气分压的提高又会反向抑制产氢反应, 从而导致加入甲烷丝菌混养后螺旋藻的自发酵产氢量的提高比例相比液相代谢产物(尤其是产氢竞争的代谢副产物乙醇和乳酸盐)提高比例要低.
许丽丽等(2014)将转基因莱茵衣藻与日本慢生大豆根瘤菌进行混合培养, 从而将衣藻的产氢量提高了3.5倍.虽然也是通过细菌与微藻的混合强化微藻产氢过程, 但其强化原因与本研究显著不同:衣藻光合产氢时会生成氧气, 而氧气会抑制氢酶活性, 因此, 在衣藻与根瘤菌混养体系中, 好氧的根瘤菌降低了体系中氧气浓度从而提高了衣藻细胞内的氢酶活性, 进而强化了产氢过程;而本研究中, 螺旋藻是在黑暗厌氧条件下利用自身积累的糖类物质自发酵产氢, 甲烷丝菌的作用则是消耗自发酵产氢生成的液相代谢副产物乙酸从而促进产氢反应正向进行.
3.3 甲烷丝菌混养提高螺旋藻自发酵产氢的质量和能量转换效率由于螺旋藻自发酵产氢利用的原料为自身细胞内的糖类物质, 因此, 可通过计算自发酵过程中产生的氢气和液相副产物与发酵前细胞内糖类质量之比得到质量转换效率, 结果如图 3a所示.可见加入甲烷丝菌混养使螺旋藻自发酵72 h后的质量转换效率达到41.8%, 与单纯螺旋藻自发酵相比提高了90.0%, 而且氢气、乙酸和甲酸3种产物的质量转换效率都有大幅度提高, 说明加入甲烷丝菌混养后螺旋藻细胞内的糖类转化利用效率得到明显提高.
图 3(Fig. 3)
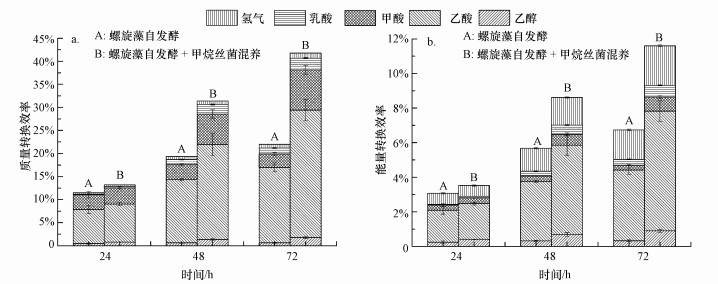 |
| 图 3 螺旋藻自发酵与螺旋藻甲烷丝菌混养自发酵质量转换效率(a)和能量转换效率(b)对比 Fig. 3Mass conversion efficiencies(a) and energy conversion efficiencies(b) from A. maxima and A. maxima mixed with M. Concilii during autofermentation |
通过计算螺旋藻自发酵产氢过程所生成的所有代谢产物的热值与螺旋藻自身热值之比, 可以得到自发酵过程的能量转换效率, 结果如图 3b所示.可见当螺旋藻自发酵时间从24 h增加到72 h时, 能量转换效率从3.1%增长到6.7%, 而加入甲烷丝菌混养后的能量转换效率则从3.5%提高至11.6%.加入甲烷丝菌混养条件下螺旋藻自发酵的最终能量转换效率与单纯螺旋藻自发酵相比提高了72.2%, 同时自发酵产氢过程的3种主要代谢产物(氢气、乙酸和甲酸)的能量转换效率之和由6.1%提高到10.0%.
利用螺旋藻加入甲烷丝菌混养明显促进了螺旋藻自发酵产氢过程, 产氢量达到了43.8 mL·g-1, 相比美国普林斯顿大学的Ananyev等(2008)和Carrieri等(2010)利用A. maxima得到的自发酵氢气产率(20.2~36.0 mL·g-1)有显著提高, 然而与螺旋藻通过外加产氢细菌进行异相发酵的产氢量(78.7~92.0 mL·g-1)相比仍有一定差距(Cheng et al., 2011; 2012).这是由于自发酵过程是藻细胞利用自身氢酶对细胞内的糖类进行利用产氢, 在产氢的同时要维持藻细胞自身代谢正常运转, 不会对细胞内所有糖类进行完全利用, 而异相发酵过程中, 外加的产氢细菌则可以对螺旋藻细胞内的所有糖类进行利用.但螺旋藻自发酵具有无需外加产氢细菌和可循环的优势, 即螺旋藻可在白天通过光合作用生长累积糖类等营养物质, 而在夜晚黑暗厌氧条件下通过氢酶分解糖类产生氢气, 从而形成一个在螺旋藻生命周期内“光合作用生长-黑暗厌氧产氢”的循环.然而在这一循环中, 如何及时利用产氢液相副产物对自发酵产氢过程至关重要, 因此在本文基础上, 今后有必要研究如何将螺旋藻自发酵产氢产乙酸过程与甲烷丝菌消耗乙酸过程进行热动力学匹配, 调节螺旋藻和甲烷丝菌的混养比例, 优化整体自发酵产氢量, 同时研究如何及时降低自发酵体系的氢气分压, 进一步提高能量转换效率.
4 结论(Conclusions)利用甲烷丝菌仅消耗乙酸盐而不消耗氢气的特点能够明显促进螺旋藻自发酵产氢.通过加钠等培养基调控提高了螺旋藻生长富集的总糖产量, 螺旋藻在黑暗厌氧条件下加入甲烷丝菌混养后的自发酵产氢量提高到43.8 mL·g-1, 液相主要代谢产物乙酸盐等产量也明显提高.螺旋藻加入甲烷丝菌混养后自发酵过程的能量转换效率由6.7%提高到11.6%, 今后有必要研究螺旋藻和甲烷丝菌的混养比例在自发酵系统中对氢气产量及副产物乙酸积累量的影响, 优化藻菌混养产氢效果, 进一步提高能量转换效率.
参考文献
| Ananyev G, Carrieri D, Dismukes G C. 2008. Optimization of metabolic capacity and flux through environmental cues to maximize hydrogen production by the cyanobacterium Arthrospira (Spirulina) maxima[J]. Applied and Environmental Microbiology, 74(19): 6102–6113.DOI:10.1128/AEM.01078-08 |
| Ananyev G, Dismukes G C. 2005. How fast can photosystem Ⅱ split water? Kinetic performance at high and low frequencies[J]. Photosynthesis Research, 84(1/3): 355–365. |
| Aoyama K, Uemura I, Miyake J, et al. 1997. Fermentative metabolism to produce hydrogen gas and organic compounds in a cyanobacterium, Spirulina platensis[J]. Journal of Fermentation and Bioengineering, 83(1): 17–20.DOI:10.1016/S0922-338X(97)87320-5 |
| Argun H, Kargi F. 2011. Bio-hydrogen production by different operational modes of dark and photo-fermentation:An overview[J]. International Journal of Hydrogen Energy, 36(13): 7443–7459.DOI:10.1016/j.ijhydene.2011.03.116 |
| Carrieri D, Ananyev G, Garcia Costas A, et al. 2008. Renewable hydrogen production by cyanobacteria:Nickel requirements for optimal hydrogenase activity[J]. International Journal of Hydrogen Energy, 33(8): 2014–2022.DOI:10.1016/j.ijhydene.2008.02.022 |
| Carrieri D, Mcneely K, De Roo A C, et al. 2009. Identification and quantification of water-soluble metabolites by cryoprobe-assisted nuclear magnetic resonance spectroscopy applied to microbial fermentation[J]. Magnetic Resonance in Chemistry, 47(Suppl 1): 138–146. |
| Carrieri D, Momot D, Brasg I A, et al. 2010. Boosting autofermentation rates and product yields with sodium stress cycling:application to production of renewable fuels by cyanobacteria[J]. Applied and Environmental Microbiology, 76(19): 6455–6462.DOI:10.1128/AEM.00975-10 |
| Cheng J, Xia A, Song W, et al. 2012. Comparison between heterofermentation and autofermentation in hydrogen production from Arthrospira (Spirulina) platensis wet biomass[J]. International Journal of Hydrogen Energy, 37(8): 6536–6544.DOI:10.1016/j.ijhydene.2012.01.025 |
| Cheng J, Zhang M, Song W, et al. 2011. Cogeneration of hydrogen and methane from Arthrospira maxima biomass with bacteria domestication and enzymatic hydrolysis[J]. International Journal of Hydrogen Energy, 36(2): 1474–1481.DOI:10.1016/j.ijhydene.2010.11.009 |
| Dismukes G C, Carrieri D, Bennette N, et al. 2008. Aquatic phototrophs:efficient alternatives to land-based crops for biofuels[J]. Current Opinion in Biotechnology, 19(3): 235–240.DOI:10.1016/j.copbio.2008.05.007 |
| 何梅琳. 2013. 高效光合产氢藻株的筛选及其产氢机制研究[D]. 青岛: 中国科学院海洋研究所http://cdmd.cnki.com.cn/Article/CDMD-80068-1013299973.htm |
| Holladay J D, Hu J, King D L, et al. 2009. An overview of hydrogen production technologies[J]. Catalysis Today, 139(4): 244–260.DOI:10.1016/j.cattod.2008.08.039 |
| Jetten M S M, Stams A J M, Zehnder A J B. 1992. Methanogenesis from acetate-a comparison of the acetate metabolism in Methanothrix soehngenii and Methanosarcina spp.[J]. FEMS Microbiology Letters, 88(3/4): 181–197. |
| Kebede E, Ahlgren G. 1996. Optimum growth conditions and light utilization efficiency of Spirulina platensis (=Arthrospira fusiformis) (Cyanophyta) from Lake Chitu, Ethiopia[J]. Hydrobiologia, 332(2): 99–109.DOI:10.1007/BF00016689 |
| 李全顺, 徐成海, 贾庆舒, 等. 2009. 盐泽螺旋藻的生长及放氢的实验研究[J]. 沈阳大学学报, 2009, 21(4): 65–67. |
| Schutz K, Happe T, Troshina O, et al. 2004. Cyanobacterial H2 production-a comparative analysis[J]. Planta, 218(3): 350–359.DOI:10.1007/s00425-003-1113-5 |
| Singh A, Nigam P S, Murphy J D. 2011. Renewable fuels from algae:An answer to debatable land based fuels[J]. Bioresource Technology, 102: 10–16.DOI:10.1016/j.biortech.2010.06.032 |
| Tindall B J. 2014. The genus name Methanothrix Huser et al. 1983 and the species combination Methanothrix soehngenii Huser et al. 1983 do not contravene Rule 31a and are not to be considered as rejected names, the genus name Methanosaeta Patel and Sprott 1990 refers to the same taxon as Methanothrix soehngenii Huser et al. 1983 and the species combination Methanothrix thermophila Kamagata et al. 1992 is rejected: Supplementary information to Opinion 75[J]. International Journal of Systematic and Evolutionary Microbiology, 64: 3597-3598 |
| Trevelyan W E, Harrison J S. 1952. Studies on yeast metabolism.1.Fractionation and microdetermination of cell carbohydrates[J]. Biochemical Journal, 50(3): 298–303.DOI:10.1042/bj0500298 |
| Warr S R C, Reed R H, Chudek J A, et al. 1985. Osmotic adjustment in Spirulina platensis[J]. Planta, 163(3): 424–429.DOI:10.1007/BF00395153 |
| Xia A, Cheng J, Lin R, et al. 2013. Sequential generation of hydrogen and methane from glutamic acid through combined photo-fermentation and methanogenesis[J]. Bioresource Technology, 131: 146–151.DOI:10.1016/j.biortech.2012.12.009 |
| Xia A, Cheng J, Song W, et al. 2015a. Fermentative hydrogen production using algal biomass as feedstock[J]. Renewable and Sustainable Energy Reviews, 51: 209–230.DOI:10.1016/j.rser.2015.05.076 |
| Xia A, Herrmann C, Murphy J D. 2015b. How do we optimize third-generation algal biofuels?[J]. Biofuels, Bioproducts & Biorefining, 9(4): 358–367. |
| 许丽丽, 王全喜, 吴双秀, 等. 2014. 转基因莱茵衣藻hemHc-lbac和根瘤菌共培养提高产氢培养条件的优化[J]. 生态科学, 2014, 33(1): 106–112. |
