 , 陈静2
, 陈静2
 , 李秋梅3, 张高生2, 刘子全1
, 李秋梅3, 张高生2, 刘子全1

1. 烟台大学环境与材料工程学院, 烟台 264005;
2. 中国科学院烟台海岸带研究所, 中国科学院海岸带环境过程与生态修复重点实验室, 山东省海岸带环境工程技术研究中心, 烟台 264003;
3. 烟台大学海洋学院, 烟台 264005
收稿日期: 2017-06-14; 修回日期: 2017-07-20; 录用日期: 2017-07-20
基金项目: 国家自然科学基金(No.51478457,51678562);中国科学院重点部署项目(No.KZZD-EW-14)
作者简介: 杨雪(1991—), 女, E-mail:yxue0116@126.com
通讯作者(责任作者): 陈静(1981—), 女, 博士, 助理研究员, 主要从事新型多功能环境材料的研发与污染水体的修复技术研究. E-mail:jchen@yic.ac.cn
刘子全(1963—), 男, 副教授, 硕士生导师, 主要研究方向为催化材料的研制与超微粉的制备.E-mail:lzqytu@163.com
摘要: 采用共沉淀法制备了一种新型铁铜铝三元复合氧化物吸附剂,系统研究了其对磷的吸附行为,并对吸附磷前后的吸附剂进行了表征.吸附实验结果表明,铁铜铝三元复合氧化物对磷具有优异的吸附去除效能,Freundlich吸附等温线模型能更好地拟合其对磷的吸附,最大吸附量为62.6 mg·g-1(pH=7.0),显著高于多数文献报道的磷吸附剂;吸附速率较快,吸附动力学更符合Elovich模型;溶液pH对磷吸附有一定影响,随着pH的升高,磷吸附量降低,离子强度则影响不大;共存阴离子对磷吸附具有抑制作用,影响的大小顺序为SiO32- > SO42- > CO32- > Cl-,而共存阳离子Ca2+和Mg2+则对磷吸附略有促进作用.Zeta电位、红外谱图(FTIR)和X射线光电子能谱(XPS)表征分析表明,磷在铁铜铝三元复合氧化物表面发生了特性吸附,磷酸根主要通过取代复合氧化物表面的羟基形成内表面络合物而被吸附去除.溶出实验结果表明,当pH在5.0~8.5范围内,Fe3+、Cu2+、Al3+的溶出量均较低.由此可知,铁铜铝三元复合氧化物是一种具有良好应用前景的除磷吸附剂.
关键词:铁铜铝三元复合氧化物磷吸附机制吸附剂
The adsorption of phosphate on a novel Fe-Cu-Al trimetal oxide: Behavior and mechanism
YANG Xue1
 , CHEN Jing2
, CHEN Jing2
 , LI Qiumei3, ZHANG Gaosheng2, LIU Ziquan1
, LI Qiumei3, ZHANG Gaosheng2, LIU Ziquan1

1. Environment and Material Engineering College, Yantai University, Yantai 264005;
2. Key Laboratory of Coastal Environmental Processes and Ecological Remediation, Research Center for Coastal Environment Engineering and Technology of Shandong Province, Yantai Institute of Coastal Zone Research, Chinese Academy of Sciences, Yantai 264003;
3. Marine College, Yantai University, Yantai 264005
Received 14 June 2017; received in revised from 20 July 2017; accepted 20 July 2017
Supported by the National Natural Science Foundation of China(No.51478457, 51678562) and the Key Research Program of the Chinese Academy of Sciences(No.KZZD-EW-14)
Biography: YANG Xue(1991—), female, E-mail:yxue0116@126.com
*Corresponding author: CHEN Jing, E-mail:jchen@yic.ac.cn
LIU Ziquan, E-mail:lzqytu@163.com
Abstract: A novel Fe-Cu-Al trimetal oxide adsorbent was fabricated via a facile co-precipitation process, assessed for effective phosphate adsorption, and was characterized by multiple techniques. The isotherm data was well fitted by the Freundlich model and the maximal adsorption capacity was 62.6 mg·g-1 at pH 7.0, which outperformed the majority of phosphate adsorbents reported. The adsorption of phosphate was very fast and the Elovich model was more suitable for describing the kinetic data. The adsorption of P was pH-depended and the efficiency decreased with increasing pH; whereas ionic strength had little influence on the adsorption. Further, coexisting anion inhibited phosphate adsorption and the effects decreased in the order of SiO32- > SO42- > CO32- > Cl-. In contrast, coexisting cations Ca2+ and Mg2+ slightly enhanced phosphate adsorption. Results of Zeta potential, FTIR and XPS analysis indicate specific adsorption occurred at the aqueous phosphate/adsorbent interface. Phosphate was probably removed by replacing the hydroxyl groups on the surface of the adsorbent and forming inner-sphere complex. Leaching of Fe3+, Cu2+ and Al3+ was low at the pH range of 5.0~8.5. This further makes Fe-Cu-Al trimetal oxide a promising adsorbent for phosphate removal from water.
Key words: Fe-Cu-Al trimetal oxidephosphateadsorptionmechanismadsorbent
1 引言(Introduction)磷是生物生长必需的营养元素, 但水体中过量的磷将会导致藻类快速生长、水生植物和动物死亡、水质恶化, 进而引发赤潮和水华(Mor et al., 2016;Wang et al., 2016).近年来, 随着水体富营养化程度日益严峻, 人们愈加重视对含磷工业废水和生活污水的除磷处理.目前, 除磷技术主要有生物法(Jena et al., 2016;赵兴敏等, 2014)、化学沉淀法(李柏林等, 2016)、离子交换法(Blaney et al., 2007)、电化学法(Huang et al., 2016)、膜分离法(Rai et al., 2016;Zheng et al., 2016;申禹等, 2013)、人工湿地法(魏泽军等, 2012)和吸附法(Jia et al., 2016;Han et al., 2016;李国亮等, 2012).与其他方法相比, 吸附法具有经济、高效、适应性强并且能够有效处理含磷量较低的废水, 被认为具有良好的应用前景.文献报道的除磷吸附剂主要有针铁矿(Chitrakar et al., 2006;张小梅等, 2017)、粉煤灰(王宇等, 2011;Wang et al., 2011)、硅藻土(Chen et al., 2016)、赤泥(Yue et al., 2010)、金属氧化物(Zeng et al., 2004;Chubar et al., 2005;Mustafa et al., 2006)及稀土氧化物等(Guo et al., 2011), 其中, 金属(铁、锰、铝)的水合氧化物对水体中的阴离子有较好的吸附效果, 并且成本低廉、环境友好, 是广受关注的一类除磷吸附材料.
近年来研究发现, 金属复合氧化物比单一金属氧化物具有更好的吸附效果, 因此, 两种或多种金属复合氧化物吸附剂的开发越来越受到关注, 文献报道的复合氧化物除磷吸附剂有铁锰(Zhang et al., 2009;李海宁等, 2016)、铁锆(Ren et al., 2012)、铁铝(Sousa et al., 2012)、铁铜(Li et al., 2014)和铁铝锰(Lü et al., 2013)等.前期研究表明, 铁铜复合氧化物对磷具有较高的吸附容量, 且应用pH范围广, 在较高的pH条件下仍有较好的吸附能力, 但其存在成本较高的缺点(Li et al., 2014).铝氧化物表面活性位点多, 价格相对低廉, 其对水中的含氧阴离子具有较好的吸附效果(Lü et al., 2013).由此预见, 在铁铜复合氧化物的基础上引入铝氧化物制成铁铜铝三元复合氧化物, 可进一步提升吸附剂对磷的去除效率, 并可显著降低吸附剂的成本.
本文采用共沉淀法制备铁铜铝三元复合氧化物吸附剂, 系统研究吸附等温线、动力学及溶液pH、离子强度和共存离子对磷吸附的影响, 并对吸附磷前后的铁铜铝三元复合氧化物进行Zeta电位、FTIR和XPS的表征分析, 并提出可能的磷吸附去除机制, 以期为工业废水与生活污水的深度除磷提供一种具有良好应用前景的新型吸附剂.
2 材料与方法(Materials and methods)2.1 实验试剂与仪器试剂:NaOH、HNO3、NaNO3、FeCl3·6H2O、CuSO4·5H2O、Al2(SO4)3·18H2O、均为分析纯, KH2PO4为优级纯;磷储备液(100 mg·L-1)用KH2PO4配置, 使用时根据需要逐级稀释;采用0.1 mol·L-1的NaOH或HNO3调节溶液的pH值, 实验用水均为去离子水.
实验仪器:HZQ-C型空气恒温振荡器、DH-201型电热恒温干燥箱、磁力搅拌器、TU-1810型紫外可见分光光度计、奥立龙3 STAR型台式pH计.
2.2 铁铜铝三元复合氧化物的制备采用共沉淀法制备铁铜铝三元复合氧化物, 其中, 铁、铜、铝的物质的量比为1:1:4.将0.01 mol的FeCl3·6H2O、0.01 mol的CuSO4·5H2O和0.04 mol的Al2(SO4)3·18H2O溶于500 mL去离子水中, 搅拌过程中加入适量的NaOH, 使溶液呈弱碱性, 继续搅拌1 h, 静置陈化4 h后, 用去离子水多次洗涤, 抽滤, 55 ℃烘干, 研磨并在干燥器中保存, 得到的粉末材料即为铁铜铝三元复合氧化物.
2.3 铁铜铝三元复合氧化物的表征2.3.1 TEM观测将制备的铁铜铝三元复合氧化物粉末利用超声均匀分散于水中, 挂膜, 烘干后用透射电子显微镜(日立H-800, 电压200 kV)观察吸附剂的微观形貌.
2.3.2 XRD表征通过X射线衍射仪(D/max 2500VPC, Cu Kα, λ为0.15418 nm)测定铁铜铝三元复合氧化物的XRD图谱, 采用MDI Jade 6软件对其氧化物的组分与结构进行分析.
2.3.3 Zeta电位测定配置一系列50 mL溶液, 其中, 铁铜铝三元复合氧化物的浓度为200 mg·L-1, 背景电解质为0.01 mol·L-1的NaNO3, 磷离子浓度为10 mg·L-1(测吸附前的Zeta电位时不必加磷离子), 用NaOH和HNO3调节溶液pH为3~11.将溶液在(25±1) ℃、170 r·min-1的振荡器中平衡48 h, 中间调4~5次pH, 记录最终pH, 用Zeta电位分析仪(Malvern, Nano-ZS90)测定各pH对应的Zeta电位.
2.3.4 FTIR谱图测定分别取1~2 mg吸附磷前后的铁铜铝三元复合氧化物, 干燥研磨后与溴化钾粉末混合均匀, 装入磨具内, 在压片机上压制成片, 利用傅氏变换拉曼红外谱仪(Nicolet is10, Thermo Scientific)测定其FTIR谱图, 分析复合氧化物表面官能团的特征与结构信息.
2.3.5 XPS谱图测定利用X射线光电子能谱分析仪(Thermo VG ESCALAB 250, Al Kα为1486.6 eV, 功率为150 W)测定铁铜铝三元复合氧化物吸附磷前后的XPS谱图, 采用XPS PEAK41软件分析磷、氧在复合氧化物表面的化学价态与特征.
2.4 吸附实验吸附实验均在(25±1) ℃、170 r·min-1的振荡器中平衡24 h, 前8 h每2 h调一次pH, 使pH稳定在7.0±0.1(pH对吸附剂的影响实验除外).背景电解质为0.01 mol·L-1的NaNO3, 铁铜铝三元复合氧化物的浓度为200 mg·L-1, 吸附完成后样品经0.45 μm醋酸纤维滤膜过滤, 采用钼锑抗分光光度法测定上清液中磷浓度.为了降低滤膜对磷吸附的影响, 过滤时前3 mL滤液弃去不用.
2.4.1 铁铜铝三元复合氧化物对磷的吸附等温线吸附等温线测定实验是在一系列盛有50 mL不同磷浓度(0~40 mg·L-1)的溶液中进行, 分别投加10 mg复合氧化物, 背景电解质为0.01 mol·L-1的NaNO3.吸附完毕, 取样, 过膜, 测定磷浓度.
2.4.2 铁铜铝三元复合氧化物对磷的吸附动力学吸附动力学实验是在1.5 L初始磷浓度分别为5.0、10.0、20.0 mg·L-1的3种溶液中进行, 背景电解质为0.01 mol·L-1的NaNO3.用HNO3和NaOH调节溶液的pH, 使其稳定在7.0±0.1.复合氧化物的投加量为300 mg.每隔一定的时间(0 min、1 min、5 min、10 min、20 min、40 min、1 h、2 h、4 h、6 h、8 h、12 h、24 h、36 h)取样, 过膜, 测定溶液中的磷浓度.动力学实验结束后, 将吸附磷的复合氧化物回收、烘干, 进行FTIR与XPS表征.
2.4.3 pH及离子强度对铁铜铝三元复合氧化物吸附磷的影响在一系列盛有50 mL初始磷浓度为10 mg·L-1的溶液中进行此实验, 分别投加10 mg复合氧化物, 考察不同pH值(4.0~10.0)和3种不同离子强度NaNO3 (0.1、0.01、0.001 mol·L-1)对磷吸附的影响.用HNO3和NaOH调节溶液的pH, 使pH稳定在不同预定值, 吸附实验结束后记录最终的pH, 取样, 过膜后测定溶液中的磷浓度.
2.4.4 共存离子对铁铜铝三元复合氧化物吸附磷的影响在一系列盛有50 mL磷浓度为10 mg·L-1的溶液中进行此实验, 分别投加10 mg复合氧化物, 考察SO42-、CO32-、SiO32-、Cl-、Ca2+与Mg2+6种离子在4种不同浓度(0、0.1、1.0、10 mmol·L-1)时对磷吸附的影响.
2.4.5 金属离子的溶出在一系列盛有50 mL磷浓度为10 mg·L-1的溶液中进行此实验, 分别投加10 mg复合氧化物, 用HNO3或NaOH调节溶液pH, 使最终pH稳定在不同预定值(4~10), 24 h吸附平衡后, 取样过膜, 利用电感耦合等离子体质谱仪(PerkinElmer, Optima DV7000)分析过膜后溶液中Fe3+、Cu2+、Al3+的浓度.
2.5 数据分析2.5.1 磷吸附量的计算磷吸附量计算公式为:
 | (1) |
2.5.2 吸附等温线模型拟合吸附等温线用于描述不同平衡浓度下的吸附容量, 且通过对吸附过程的拟合可以得到吸附剂对吸附质的最大吸附容量.本研究中对磷的吸附结果分别用Langmuir模型(式(2))与Freundlich模型(式(3))进行拟合.
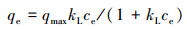 | (2) |
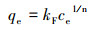 | (3) |
2.5.3 吸附动力学模型拟合吸附剂对吸附质的吸附速率通过吸附动力学实验进行考察.本研究选择准一级动力学模型(式(4))、准二级动力学模型(式(5))和Elovich模型(式(6))来描述此过程的吸附动力学.
 | (4) |
 | (5) |
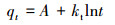 | (6) |
3 结果和讨论(Results and discussion)3.1 铁铜铝三元复合氧化物的表征铁铜铝三元复合氧化物的透射电镜(TEM)照片如图 1所示.由图可知, 铁铜铝三元复合氧化物是由纳米级不规则的颗粒团聚而成, 颗粒堆积成团且无序, 粒径范围为20~300 nm.
图 1(Fig. 1)
 |
| 图 1 铁铜铝三元复合氧化物的透射电镜照片 Fig. 1TEM image of Fe-Cu-Al trimetal oxide |
铁铜铝三元复合氧化物的XRD图谱如图 2所示.由图面积在10.4°和20.8°处出现的两个特征峰与标准谱图对比发现, 分别与无定形的水合氧化铝与水合氢氧化铝的特征峰衍射峰一致(Wu et al., 2012);在35.6°处出现的较宽特征峰为水合氧化铜与水合氧化铁的复合峰, 而在63.8°处出现的特征峰则与2-线性水铁矿的特征峰一致(Zhang et al., 2013).由此表明, 铁铜铝三元复合氧化物为一种无定形结构的水合铁氧化物、铜氧化物与铝氧化物的复合氧化物.
图 2(Fig. 2)
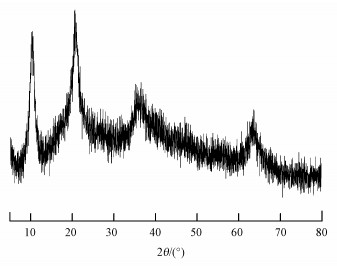 |
| 图 2 铁铜铝三元复合氧化物的XRD图 Fig. 2XRD diffraction pattern of Fe-Cu-Al trimetal oxide |
3.2 铁铜铝三元复合氧化物的磷吸附行为3.2.1 铁铜铝三元复合氧化物对磷的吸附等温线吸附等温线用来描述平衡浓度与吸附量之间的关系, 从而得到吸附剂的最大吸附容量.在pH=7.0条件下, 铁铜铝三元复合氧化物对磷的吸附等温线如图 3所示.由图可知, 磷吸附量随着溶液中磷平衡浓度的升高而逐渐增大.在低平衡浓度时, 吸附量随着磷平衡浓度的增加而迅速上升;当平衡浓度大于5 mg·L-1后, 吸附量随着平衡浓度的增加而缓慢增加, 平衡浓度超25 mg·L-1后, 吸附量基本达到最大值.由此可知, 铁铜铝三元复合氧化物更适用于低浓度含磷废水的处理.
图 3(Fig. 3)
 |
| 图 3 铁铜铝三元复合氧化物对磷的吸附等温线(pH=7.0±0.1, T=(25±1) ℃, 平衡时间24 h) Fig. 3Adsorption isotherm of phosphate by Fe-Cu-Al trimetal oxide |
本研究分别用Langmuir吸附模型和Freundlich吸附模型对实验数据进行拟合.其中, Langmuir方程较适用于描述吸附剂表面有相同吸附位点的单层吸附, 吸附位点的数量限制吸附剂的吸附能力;而Freundlich方程则比较适用于描述吸附剂表面位点不均匀、键能不同、具有不同吸附能力的多分子层吸附.从表 1的吸附等温线拟合结果, 可以看出, Freundlich模型(R2=0.990)比Langmuir模型(R2=0.974)更适合描述该吸附过程.这表明铁铜铝三元复合氧化物对磷的吸附是非均质多分子层吸附.一般认为, 1/n在0.1~1.0之间时吸附比较容易进行, 而当1/n大于2时, 吸附较难进行(张小梅等, 2017).本文拟合结果中, 1/n为0.129, 表明该反应过程容易进行.采用Freundlich模型计算磷的最大吸附容量为62.6 mg·g-1 (pH=7.0), 显著高于铁铜复合氧化物的吸附容量35.2 mg·g-1(pH=7.0)(Li et al., 2014).显然, 铝氧化物的引入显著强化了铁铜铝三元复合氧化物对磷的吸附去除效果.此外, 与文献报道的其它磷吸附剂(表 2)相比, 铁铜铝三元复合氧化物也展现了较高的吸附容量.
表 1(Table 1)
| 表 1 Langmuir和Freundlich吸附等温线拟合结果 Table 1 Langmuir and Freundlich isotherms parameters for phosphate adsorption | |||||||||||||||||||||
表 1 Langmuir和Freundlich吸附等温线拟合结果 Table 1 Langmuir and Freundlich isotherms parameters for phosphate adsorption
| |||||||||||||||||||||
表 2(Table 2)
| 表 2 文献报道吸附剂的磷最大吸附容量 Table 2 Maximum phosphate adsorption capacities of some reported adsorbents | ||||||||||||||||||||||||||||||||
表 2 文献报道吸附剂的磷最大吸附容量 Table 2 Maximum phosphate adsorption capacities of some reported adsorbents
| ||||||||||||||||||||||||||||||||
3.2.2 铁铜铝三元复合氧化物对磷的动力学吸附动力学是评估吸附剂吸附能力的重要参数.在pH=7.0时, 考察了在不同初始磷浓度(5.0、10.0、20.0 mg·L-1)条件下, 铁铜铝三元复合氧化物对磷的吸附动力学.如图 4所示, 磷在铁铜铝三元复合氧化物上的吸附动力学过程可以分为3个阶段:前3 h吸附速率最快, 吸附量迅速增加, 达到总吸附量的90%, 这段时期是磷酸盐的快速去除时期, 主要因为吸附初期, 吸附剂表面的吸附位点较多, 液相与固相表面离子浓度差较大, 磷容易结合到吸附剂的表面, 在这段过程中最大的限制因素为时间;随后3~10 h为减速吸附期, 吸附速率明显下降, 原因可能是离子浓度差减小, 吸附剂表面吸附了大量的磷酸盐导致吸附位点急剧减少;10 h以后为慢速时期, 溶液中磷酸盐的浓度持续降低, 吸附剂的吸附位点也逐渐饱和, 吸附剂只能吸附很少量的磷酸根, 而且这个阶段需要较长时间.
图 4(Fig. 4)
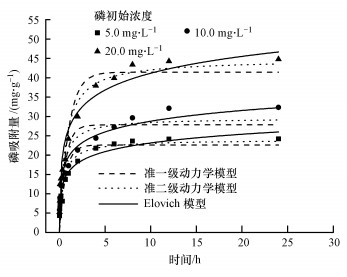 |
| 图 4 吸附时间对铁铜铝三元复合氧化物吸附不同初始浓度磷的影响(pH=7.0±0.1, T=(25±1) ℃, 平衡时间24 h) Fig. 4Effect of contact time on the adsorption capacity of phosphate with different initial concentrations by Fe-Cu-Al trimetal oxide |
分别采用准一级动力学模型、准二级动力学模型和Elovich模型对3种不同磷初始浓度的吸附过程进行拟合, 拟合参数见表 3.由R2值可知, Elovich模型能更好地拟合铁铜铝三元复合氧化物对磷的吸附过程, 说明磷的吸附过程包括多个反应机制, 如磷在溶液体相或界面处的扩散、表面的活化与去活化作用等(张伟等, 2014).
表 3(Table 3)
| 表 3 吸附动力学拟合参数 Table 3 Kinetic parameters for the phosphate adsorption | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 3 吸附动力学拟合参数 Table 3 Kinetic parameters for the phosphate adsorption
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
3.2.3 pH及离子强度对铁铜铝三元复合氧化物吸附磷的影响溶液pH是影响固液界面上吸附过程的重要因素.pH与离子强度对复合氧化物吸附磷过程的影响如图 5所示.在酸性条件下, 磷去除率较高, 随着pH的升高, 磷去除率逐渐下降, 这与铁铜复合氧化物对磷的吸附结果一致(Li et al., 2014).当pH高于8.0以后, 磷去除率明显降低, 这与水中磷酸盐的种类和金属氧化物的表面电荷有关.铁铜铝三元复合氧化物吸附剂的等电点为8.7, 在pH为4.0~7.2时, H2PO4-是磷的主要存在形式, 此时吸附剂的表面质子化, 表面带正电, 有利于H2PO4-吸附到其表面, 故吸附量较大;在pH为7.2~10时, HPO42-是磷的主要存在形式, 此时吸附剂表面正电荷逐渐减少并开始带大量的负电荷, 金属氧化物表面与磷酸盐离子之间发生静电斥力从而导致磷去除率降低.
图 5(Fig. 5)
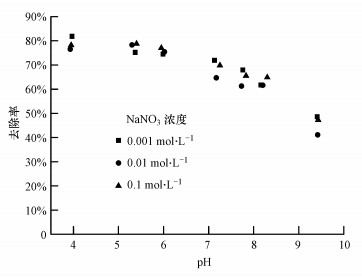 |
| 图 5 pH值及离子强度对铁铜铝三元复合氧化物吸附磷的影响(磷初始浓度10.0 mg·L-1, pH=7.0±0.1, T=(25±1) ℃, 平衡时间24 h) Fig. 5Effect of pH and ionic strength on phosphate adsorption by Fe-Cu-Al trimetal oxide |
离子强度从0.001 mol·L-1增加到0.1 mol·L-1, 对磷酸根的吸附几乎没影响.一般而言, 阴离子的吸附量随着离子强度的增加而增大或者不变, 则说明磷在吸附剂上形成内层表面络合物, 反之, 则形成外层表面络合物(McBride, 1997;Zhang et al., 2009).本研究中离子强度的增加对磷酸根的去除影响不大, 表明磷是在铁铜铝三元复合氧化物的表面形成了内层表面络合物的特性吸附.
3.2.4 共存离子对铁铜铝三元复合氧化物吸附磷的影响废水中存在大量共存阴离子、阳离子, 可能与磷产生竞争吸附, 从而影响对磷的吸附效果.因此, 对水中常见的4种阴离子(SO42-、CO32-、SiO32-、Cl-)和2种阳离子(Ca2+、Mg2+)在4种不同浓度(0、0.1、1.0、10 mmol·L-1)下对吸附剂吸附磷的影响进行了研究, 结果如图 6所示.共存的CO32-和Cl-对磷的去除几乎没有影响, 而SO42-和SiO32-略微抑制了磷的去除, 4种阴离子对磷吸附的影响大小为:SiO32->SO42->CO32->Cl-.共存的Ca2+和Mg2+均对磷吸附有一定的促进作用, 可能的原因是共存阳离子附着到吸附剂表面, 使得吸附剂表面的正电性增强, 强化了吸附剂表面与磷酸根阴离子之间的静电作用力, 从而促进了对磷酸根的去除.
图 6(Fig. 6)
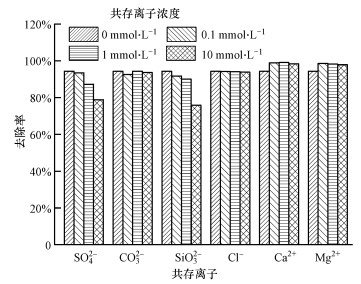 |
| 图 6 共存离子对铁铜铝三元复合氧化物吸附磷的影响(磷初始浓度10.0 mg·L-1, pH=7.0±0.1, T=(25±1) ℃, 平衡时间24 h) Fig. 6Effect of coexisting anions on phosphate adsorption by Fe-Cu-Al trimetal oxide |
3.3 铁铜铝三元复合氧化物的磷吸附机制3.3.1 Zeta电位分析铁铜铝三元复合氧化物吸附剂吸附磷前后的Zeta电位如图 7所示.铁铜铝三元复合氧化物的等电点为8.7, 表明该吸附剂在通常的水体环境中带正电荷, 有利于带负电荷阴离子的吸附去除.铁铜铝三元复合氧化物吸附磷后, 等电点降低至5.6.一般金属氧化物对阴离子的特性吸附会导致金属氧化物表面有更多的负电荷, 吸附量越大, 吸附剂表面带的负电荷越多, 则吸附剂的等电点移向低pH(Long et al., 2011).铁铜铝三元复合氧化物在吸附磷以后等电点降低, 表明铁铜铝三元复合氧化物和磷溶液之间发生了特性吸附而不仅仅是静电引力的作用(Zhang et al., 2009).
图 7(Fig. 7)
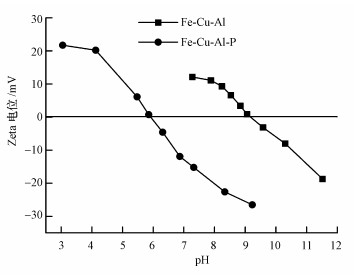 |
| 图 7 铁铜铝三元复合氧化物吸附磷前后的Zeta电位(磷初始浓度10.0 mg·L-1, pH=7.0±0.1, T=(25±1) ℃, 平衡时间72 h) Fig. 7Zeta potential of Fe-Cu-Al trimetal oxide before and after phosphate adsorption |
3.3.2 FTIR分析铁铜铝三元复合氧化物吸附磷前后的红外谱图如图 8所示.曲线a为吸附磷前的红外谱图, 其中, 3423 cm-1处为Fe—OH与物理结合水分子中的H2O—OH的伸缩振动峰(崔蒙蒙, 2017;刘星群等, 2017), 1642 cm-1处的吸收峰为水分子的弯曲振动峰(Li et al., 2014), 1115 cm-1和977 cm-1处为SO42-的振动吸收峰(吴秋月等, 2015), 由制备铁铜铝吸附剂时洗涤残留的SO42-吸附在材料表面造成的, 610 cm-1处为Cu—OH(Li et al., 2014)的振动吸收峰, 549 cm-1处为Al—OH的振动吸收峰(Lü et al., 2013).当铁铜铝三元复合氧化物吸附磷后(曲线b与c), 3423 cm-1和1642 cm-1的吸收峰强度减弱, 峰宽变宽, 1115 cm-1与549 cm-1处的吸收峰减弱, 977 cm-1与610 cm-1处的吸收峰消失, 但在1100 cm-1处出现了新的P—O不对称伸缩振动峰(Lü et al., 2013), 且随着磷浓度的增加愈加显著.由此推断, 磷在吸附剂上的吸附是主要是磷酸根取代了铁铜铝三元复合氧化物表面的羟基, 此外, 磷酸根与复合氧化物表面的SO42-也存在离子交换作用.
图 8(Fig. 8)
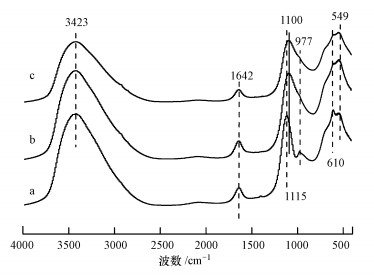 |
| 图 8 铁铜铝三元复合氧化物吸附磷前后的红外谱图(a.反应前;b.与10 mg·L-1磷反应后;c.与20 mg·L-1磷反应后;平衡时间24 h, pH=7.0±0.1, T=(25±1) ℃) Fig. 8FTIR spectra of Fe-Cu-Al trimetal oxide before and after phosphate adsorption |
3.3.3 XPS分析为了进一步理解吸附剂对磷的吸附机制, 对吸附磷前后的铁铜铝三元复合氧化物材料进行了XPS分析, 结果如图 9所示.对比吸附磷前后铁铜铝三元复合氧化物的XPS谱图(图 9a)可知, 吸附磷后铁铜铝三元复合氧化物除含有铁、铜、铝的结合能特征峰外, 新出现了P 2p结合能特征峰(133.8 eV), 表明磷吸附在铁铜铝三元复合氧化物的表面, 并且S 2p结合能特征峰减弱, 这与FTIR分析结果一致.
图 9(Fig. 9)
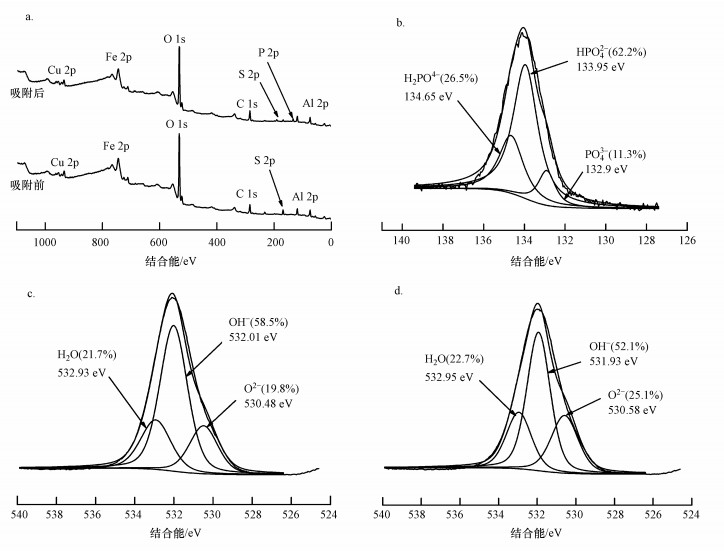 |
| 图 9 铁铜铝三元复合氧化物吸附磷前后的XPS谱图(a.全谱图;b.吸附磷后的P 2p谱图;c.吸附磷前的O1s谱图;d.吸附磷后的O1s谱图) Fig. 9XPS spectra of Fe-Cu-Al trimetal oxide before and after phosphate adsorption |
图 9b为铁铜铝三元复合氧化物吸附磷后P 2p的谱图.由图可知, P 2p的结合能为133.8 eV, 表明磷在吸附剂表面的存在价态为+5价, 表明吸附过程中磷的化合价没有发生变化, 而磷的3种结合形态H2PO4-、HPO42-、PO43-的比率为27:61:11.图 9c、d为铁铜铝三元复合氧化物吸附磷前后的O1s谱图, 其中, O2-与H2O的比例分别由吸附磷前的19.8%与21.7%增加至25.1%与22.8%, 而OH-的比例由吸附磷前的58.5%下降至52.1%, 表明铁铜铝三元复合氧化物上的羟基在吸附磷后显著减少, 即磷酸根通过取代复合氧化物表面的OH-形成内表面络合物, 从而被吸附到复合氧化物的表面上.
上述结果表明, 磷在铁铜铝三元复合氧化物(用M-OH表示)表面发生了化学吸附, 形成了内层表面络合物, 这与文献报道的金属氧化物磷吸附机制类似(Dou et al., 2011;Lü et al., 2013;吴秋月等, 2015).同类研究(Lü et al., 2013;Oyama et al., 2001)亦表明, 磷与金属氧化物形成了单齿单核和双齿双核的内配位络合物, 其中以双齿双核结构为主.因此, 可以推测磷酸根在铁铜铝表明可能形成单齿单核和双齿双核的内层络合物, 磷酸根与铁铜铝三元复合氧化物表面发生的吸附过程可以描述如下:
 |
图 10(Fig. 10)
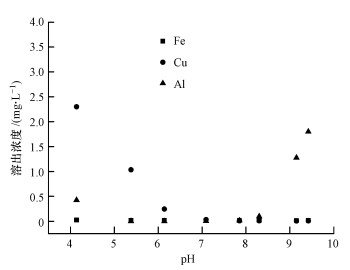 |
| 图 10 不同pH条件下金属离子溶出情况 Fig. 10Metal ion dissolution in the process of phosphorus removal at different pH |
4 结论(Conclusions)1) 本研究采用共沉淀法制备的铁铜铝三元复合氧化物是由无定形结构的纳米颗粒聚集而成, 对磷具有优异的吸附去除效能, 最大吸附量为62.6 mg·g-1(pH=7.0), 吸附速率较快, 对磷的吸附是一个包括多个反应机制的非均质多分子层吸附.
2) 溶液pH对磷吸附有一定影响, 但离子强度影响不大;共存阴离子对磷吸附具有抑制作用, 而共存阳离子对磷吸附略有促进作用.磷酸根主要通过取代铁铜铝三元复合氧化物表面的羟基形成内表面络合物而被吸附去除.
3) 当溶液pH在5.5~8.5范围内时, Fe3+、Cu2+、Al3+从复合氧化物中溶出的浓度均较低, 符合相应的水质标准, 说明该复合氧化物具有良好的应用前景.
参考文献
| Blaney L M, Cinar S, SenGupta A K. 2007. Hybrid anion exchanger for trace phosphate removal from water and wastewater[J]. Water Research, 41(7): 1603–1613.DOI:10.1016/j.watres.2007.01.008 |
| Chen J, Yan L G, Yu H Q, et al. 2016. Efficient removal of phosphate by facile prepared magnetic diatomite and illite clay from aqueous solution[J]. Chemical Engineering Journal, 287: 162–172.DOI:10.1016/j.cej.2015.11.028 |
| Chitrakar R, Tezuka S, Sonoda A, et al. 2006. Phosphate adsorption on synthetic goethite and akaganeite[J]. Journal of Colloid and Interface Science, 298(2): 602–608.DOI:10.1016/j.jcis.2005.12.054 |
| Chubar N I, Kanibolotskyy V A, Strelko V V, et al. 2005. Adsorption of phosphate ions on novel inorganic ion exchangers[J]. Colloids and Surfaces A:Physicochemical and Engineering Aspects, 255(1): 55–63. |
| 崔蒙蒙. 2017. 水铁矿对含磷废水的吸附性能及机理分析[D]. 苏州: 苏州科技大学http://cdmd.cnki.com.cn/Article/CDMD-10332-1017020346.htm |
| Dou X M, Zhang Y, Zhao B, et al. 2011. Arsenate adsorption on an Fe-Ce bimetal oxide adsorbent:EXAFS study and surface complexation modeling[J]. Colloids and Surfaces A:Physicochemical and Engineering Aspects, 379(1): 109–115. |
| Guo H C, Li W J, Wang H Y, et al. 2011. A study of phosphate adsorption by different temperature treated hydrous cerium oxides[J]. Rare Metals, 30(1): 58–62.DOI:10.1007/s12598-011-0197-5 |
| Han C Y, Liu H, Chen H R, et al. 2016. Adsorption performance and mechanism of As(Ⅴ) uptake over mesoporous Y-Al binary oxide[J]. Journal of the Taiwan Institute of Chemical Engineers, 65: 204–211.DOI:10.1016/j.jtice.2016.05.003 |
| Huang H M, Zhang P, Zhang Z, et al. 2016. Simultaneous removal of ammonia nitrogen and recovery of phosphate from swine wastewater by struvite electrochemical precipitation and recycling technology[J]. Journal of Cleaner Production, 127: 302–310.DOI:10.1016/j.jclepro.2016.04.002 |
| Jena J, Kumar R, Saifuddin M, et al. 2016. Anoxic-aerobic SBR system for nitrate, phosphate and COD removal from high-strength wastewater and diversity study of microbial communities[J]. Biochemical Engineering Journal, 105: 80–89.DOI:10.1016/j.bej.2015.09.007 |
| Jia Y S, Wang H Y, Zhao X S, et al. 2016. Kinetics, isotherms and multiple mechanisms of the removal for phosphate by Cl-hydrocalumite[J]. Applied Clay Science, 129: 116–121.DOI:10.1016/j.clay.2016.05.018 |
| 李柏林, 梁亚楠, 张程琛, 等. 2016. 粉煤灰-铝土矿改性制备铝铁复合混凝剂的除磷性能及混凝机理研究[J]. 环境科学学报, 2016, 36(7): 2503–2511. |
| Li G L, Gao S, Zhang G S, et al. 2014. Enhanced adsorption of phosphate from aqueous solution by nanostructured iron (Ⅲ)-copper (Ⅱ) binary oxides[J]. Chemical Engineering Journal, 235: 124–131.DOI:10.1016/j.cej.2013.09.021 |
| 李国亮, 张高生, 陈静, 等. 2012. 纳米结构Fe3O4/Y2O3磁性颗粒的制备、表征及磷吸附行为研究[J]. 环境科学学报, 2012, 32(9): 2167–2175. |
| 李海宁, 陈静, 李秋梅, 等. 2016. 铁锰复合氧化物包覆海砂的吸附除磷研究[J]. 环境科学学报, 2016, 36(3): 880–886. |
| 刘星群, 谢水波, 曾凡勇, 等. 2017. 亚铁铝类水滑石吸附铀的性能与吸附机制[J]. 复合材料学报, 2017, 34(1): 183–190. |
| Long F, Gong J L, Zeng G M, et al. 2011. Removal of phosphate from aqueous solution by magnetic Fe-Zr binary oxide[J]. Chemical Engineering Journal, 171(2): 448–455.DOI:10.1016/j.cej.2011.03.102 |
| Lü J B, Liu H J, Liu R P, et al. 2013. Adsorptive removal of phosphate by a nanostructured Fe-Al-Mn trimetal oxide adsorbent[J]. Powder Technology, 233(1): 146–154. |
| McBride M B. 1997. A critique of diffuse double layer models applied to colloid and surface chemistry[J]. Clays and Clay minerals, 45(4): 598–608.DOI:10.1346/CCMN |
| Mor S, Chhoden K, Ravindra K. 2016. Application of agro-waste rice husk ash for the removal of phosphate from the wastewater[J]. Journal of Cleaner Production, 129: 673–680.DOI:10.1016/j.jclepro.2016.03.088 |
| Mustafa S, Zaman M I, Khan S. 2006. pH effect on phosphate sorption by crystalline MnO2[J]. Journal of colloid and interface science, 301(2): 370–375.DOI:10.1016/j.jcis.2006.05.020 |
| Oyama S T, Clark P, Teixeira da Silva V L S, et al. 2001. XAFS characterization of highly active alumina-supported molybdenum phosphide catalysts (MoP/Al2O3) for hydrotreating[J]. The Journal of Physical Chemistry B, 105(21): 4961–4966.DOI:10.1021/jp004500q |
| Rai J, Kumar D, Pandey L K, et al. 2016. Potential of cyanobacterial biofilms in phosphate removal and biomass production[J]. Journal of Environmental Management, 177: 138–144.DOI:10.1016/j.jenvman.2016.04.010 |
| Ren Z M, Shao L N, Zhang G S. 2012. Adsorption of phosphate from aqueous solution using an iron-zirconium binary oxide sorbent[J]. Water, Air, & Soil Pollution, 223(7): 4221–4231. |
| 申禹, 李玲. 2013. 天然水体中生物膜对磷的吸附动力学特征[J]. 环境科学学报, 2013, 33(4): 1023–1027. |
| Sousa A F D, Braga T P, Gomes E C C, et al. 2012. Adsorption of phosphate using mesoporous spheres containing iron and aluminum oxide[J]. Chemical Engineering Journal, 210(4): 143–149. |
| Tofik A S, Taddesse A M, Tesfahun K T, et al. 2016. Fe-Al binary oxide nanosorbent:Synthesis, characterization and phosphate sorption property[J]. Journal of Environmental Chemical Engineering, 4(2): 2458–2468.DOI:10.1016/j.jece.2016.04.023 |
| Wang D, Chen N, Yu Y, et al. 2016. Investigation on the adsorption of phosphorus by Fe-loaded ceramic adsorbent[J]. Journal of colloid and Interface Science, 464: 277–284.DOI:10.1016/j.jcis.2015.11.039 |
| Wang Y, Chen J Y, Li X M, et al. 2011. Simultaneous removal of ammonium and phosphate in waste water by La-modified synthetic zeolite from coal flyash[J]. China Environmental Science, 31(7): 1156. |
| 王宇, 谌建宇, 李小明, 等. 2011. 镧改性粉煤灰合成沸石的同步脱氨除磷研究[J]. 中国环境科学, 2011, 31(7): 1152–1158. |
| 魏泽军, 谢建平, 黄玉明. 2012. 潜流人工湿地演变对废水中有机物、氮及磷去除的影响[J]. 环境科学, 2012, 33(11): 3812–3819. |
| Wu K, Liu T, Xue W, et al. 2012. Arsenic (Ⅲ) oxidation/adsorption behaviors on a new bimetal adsorbent of Mn-oxide-doped Al oxide[J]. Chemical Engineering Journal, 2 192: 343–349. |
| 吴秋月, 陈静, 张伟, 等. 2015. 新型纳米结构铈锰复合氧化物的磷吸附行为与机制研究[J]. 环境科学学报, 2015, 35(6): 1824–1832. |
| Yue Q, Zhao Y, Qian L, et al. 2010. Research on the characteristics of red mud granular adsorbents (RMGA) for phosphate removal[J]. Journal of Hazardous Materials, 176(1/3): 741–748. |
| Zeng L, Li X M, Liu J D. 2004. Adsorptive removal of phosphate from aqueous solutions using iron oxide tailings[J]. Water Research, 38(5): 1318–1326.DOI:10.1016/j.watres.2003.12.009 |
| Zhang G S, Liu H J, Liu R P, et al. 2009. Removal of phosphate from water by a Fe-Mn binary oxide adsorbent[J]. Journal of Colloid and Interface Science, 335(2): 168–174.DOI:10.1016/j.jcis.2009.03.019 |
| Zhang G S, Ren Z M, Zhang X W, et al. 2013. Nanostructured iron (Ⅲ)-copper (Ⅱ) binary oxide:a novel adsorbent for enhanced arsenic removal from aqueous solutions[J]. Water Research, 47(12): 4022–4031.DOI:10.1016/j.watres.2012.11.059 |
| 张伟, 陈静, 张高生. 2014. 铁镧复合氧化物纳米吸附剂的制备、表征及As(Ⅲ)吸附性能研究[J]. 环境科学, 2014, 35(11): 4198–4204. |
| 张小梅, 李睿华, 刘卓, 等. 2017. 天然菱铁矿去除水中磷的性能研究[J]. 环境科学学报, 2017, 37(1): 219–226. |
| 赵兴敏, 赵兰坡, 李明堂, 等. 2014. 水体底泥及岸边土壤有机无机复合体对磷吸附特征对比[J]. 环境科学学报, 2014, 34(5): 1285–1291. |
| Zheng X D, Pan J M, Zhang F S, et al. 2016. Fabrication of free-standing bio-template mesoporous hybrid film for high and selective phosphate removal[J]. Chemical Engineering Journal, 284: 879–887.DOI:10.1016/j.cej.2015.09.033 |
