全文HTML
--> --> --> 铅酸蓄电池是世界各类电池中产量最大、用途最广的一种电池,其耗铅量占全球总耗铅量的80%以上[1]。据统计,我国铅酸蓄电池的产量占全球总产量的1/3,每年报废的铅酸蓄电池超过3×108只,其中含铅量接近4×107 t,再生回收铅酸蓄电池既能满足清洁生产、实现可持续发展战略的需要,同时也能减少铅对生存环境造成的破坏。废铅酸蓄电池主要由板栅、铅膏、废硫酸溶液、隔板外壳等组成[2]。铅膏的处理是废铅酸蓄电池回收的研究重点及难点[3-4],其处理方法主要有火法熔炼、湿法熔炼和预脱硫低温熔炼法3种[5]。火法熔炼需要在高温条件下进行,能耗高同时还会产生大量铅蒸气、铅烟尘以及SO2等重污染气体[6-7]。湿法熔炼虽然生产过程中污染少,有较好的可控性和精确性,但工艺流程过于复杂,设备投资高,电耗高[8]。预脱硫低温熔炼法避免了火法熔炼带来的环境污染,而且不需要电解,能耗低,是当前比较普遍的铅膏处理方法。
目前,国内外普遍采用以Na2CO3为脱硫剂的预脱硫低温熔炼技术对铅膏进行脱硫处理[9-11],取得了较好的效果。但是反应生成的脱硫副产品Na2SO4在我国资源丰富,产能处于过剩状态[12],附加值低。对铅膏脱硫技术进行创新,进一步提高铅膏脱硫的经济效益是实现清洁生产的迫切需要。NH4HCO3和(NH4)2CO3与铅膏反应生成的脱硫副产品(NH4)2SO4作为氮肥有较好的市场价值,且NH4HCO3比(NH4)2CO3廉价。因此,采用NH4HCO3作为铅膏脱硫剂可大大提高铅膏脱硫的经济效益,具有良好的应用前景。
顾怡卿等[13]用Na2CO3和NH4HCO3作脱硫剂,采用正交实验研究了湿法再生时铅膏的碳酸盐化脱硫转化工艺;舒月红等[14]用BET、XRD、SEM等多种分析表征方法对废铅膏脱硫前、后的成分进行分析,并通过正交实验及方差分析研究了Na2CO3、NH4HCO3和(NH4)2CO3等不同碳酸盐在不同条件下对废铅膏脱硫效果的影响;丁希楼等[15]以Na2CO3、NH4HCO3和K2CO3 3种脱硫剂进行正交实验设计,考查铅膏硫酸盐转化为碳酸盐的工艺,并分析不同条件下各因素对转化率的影响程度;俞小花等[16]用NH4HCO3+NH3·H2O对PbSO4进行碳酸化处理,考察不同条件对PbSO4转化率的影响,并确定最佳实验条件;郭光辉等[17]用NH4HCO3+NH3·H2O作脱硫剂,考察不同条件对铅膏脱硫率和铅回收率的影响;谢伟[18]用Na2CO3、NH4HCO3和K2CO3 3种脱硫剂通过正交实验考察铅膏碳酸盐化脱硫,并对转化过程中的热力学进行研究;刘文科等[19]以NH4HCO3和(NH4)2CO3作脱硫剂考察不同条件参数对脱硫率的影响,确定了最佳工艺条件。从以上研究中可以发现,以NH4HCO3作脱硫剂进行铅膏脱硫,在一定条件下,脱硫率可达90%以上,能取得较好的效果。这些研究主要集中在不同碳酸盐对铅膏脱硫转化的影响以及反应的条件优化上,对NH4HCO3与铅膏反应的动力学过程缺乏研究,而该反应的转化速度取决于传质过程的扩散速度[16]。针对此问题,本研究在铅膏铵法预脱硫工艺条件实验的基础上,对铅膏脱硫反应的动力学过程进行研究,从搅拌速度、反应温度及NH4HCO3浓度等几个方面研究铅膏脱硫反应过程的控制步骤,以了解反应过程的反应速度控制因素及NH4HCO3的表观反应级数,从而在生产实践中有针对性地采取相应措施对铅膏脱硫反应进行强化,为改善铅膏铵法预脱硫技术、提高铅膏脱硫转化效率提供参考。
1.1. 实验原料与试剂
实验所用铅膏由广西省骆驼集团华南蓄电池有限公司提供,经过破碎分选系统后,筛选得到。铅膏主要包括PbSO4、PbO2、PbO等组分[20],用化学分析方法测定各组分的含量,结果如下:PbSO4 46%~55%,PbO2 28%~35%,PbO 9%~12%,Pb 3%~4%,其他2%~3%。碳酸氢铵(分析纯,500 g,天津市恒兴化学试剂制造有限公司),氯化钡(分析纯,500 g,台山市化工厂有限公司),无水硫酸钠(化学纯,25 g,上海麦克林生化科技有限公司),无水碳酸钠(分析纯,500 g,天津市科密欧化学试剂有限公司),碳酸铵(分析纯,500 g,天津市风船化学试剂科技有限公司),氯酸钾(分析纯,500 g, 天津市科密欧化学试剂有限公司),盐酸(分析纯,500 mL,湖南汇虹试剂有限公司),硝酸(分析纯,500 mL,湖南汇虹试剂有限公司),氨水(分析纯,500 mL,湖南汇虹试剂有限公司),甲基橙(指示剂,25 g,天津市光复科技发展有限公司)。
1.2. 实验方法
将铅膏用超纯水清洗以去除残留在铅膏上的硫酸等物质,然后置于110 ℃的鼓风干燥箱中,干燥24 h,取出冷却至室温,进行筛分得到粒径为0.15~0.25 mm的铅膏颗粒,备用。考虑到实验所用铅膏为不同批次取得的,将在每批次铅膏实验前确定其初始含硫率。铅膏的初始含硫率用硫酸钡重量法测得。取一定质量的铅膏固体,试样经饱和氯酸钾硝酸溶液溶解,用氨水分离铁、锰及酸不溶物等,在1.5%盐酸溶液中,用氯化钡使硫酸盐生成硫酸钡沉淀,过滤灼烧,称重计算硫的含量。
将装有600 mL超纯水和20 g铅膏的烧杯置于数显型恒温水浴锅中,缓慢搅拌并加热到指定温度,然后加入一定量的NH4HCO3,迅速将搅拌速度调至预定值,计时。反应过程中的温度波动范围为±1 ℃,定时用移液枪取样,每次取4 mL浆液,过滤稀释后,用离子色谱法检测定容后溶液中硫酸根离子浓度,并根据式(1)计算PbSO4的转化率。
式中:ω为PbSO4转化率;ρ为离子色谱法检测的硫酸根离子浓度,mg·L?1;V为总溶液体积,L;f为样品的稀释倍数;m为初始铅膏中所含硫酸根离子的质量,g。
1.3. 实验原理
铅膏的脱硫转化是为了将铅膏中的硫酸铅转化为易于处理或者可低温分解的其他铅盐化合物[21]。用碳酸氢铵作脱硫剂就是将铅膏中的硫酸铅转化为易于处理的碳酸铅,反应后,硫以硫酸铵的形式进入溶液,不再参与之后脱硫铅膏的回收处理工艺。反应原理是:碳酸铅比硫酸铅更难溶,碳酸铅的溶度积Ksp为7.4×10?14,硫酸铅的溶度积Ksp为1.6×10?8,两者相差6个数量级,反应[22]很容易发生。主要的反应方程式见式(2)。2.1. 搅拌速度对脱硫率的影响
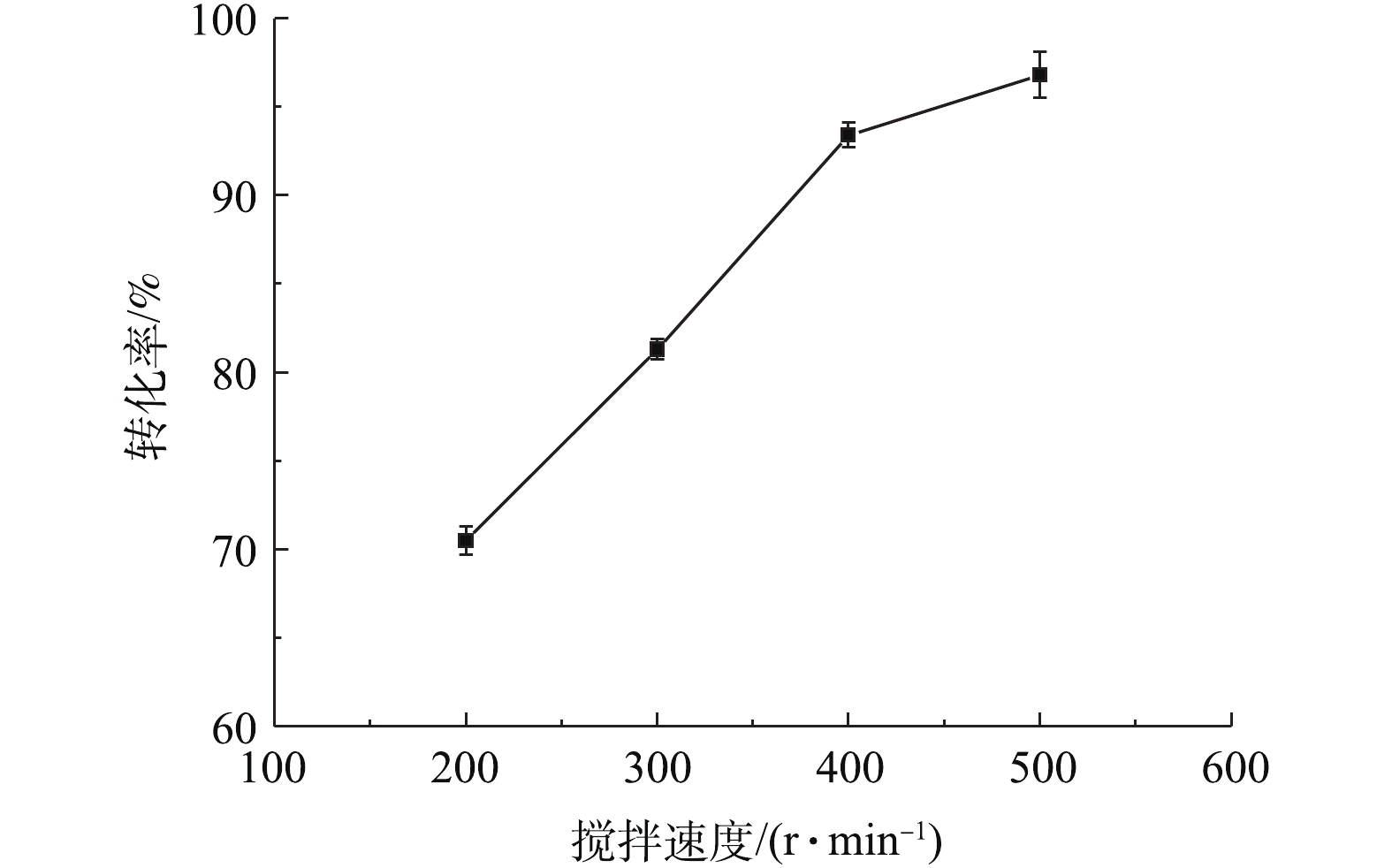
在铅膏粒度为0.15~0.25 mm、NH4HCO3浓度为理论用量(0.2 mol·L?1)、反应时间为30 min、反应温度为室温(20 ℃)条件下,考察了不同搅拌强度对PbSO4转化率的影响,结果如图1所示。可以看出,PbSO4转化率随着搅拌速度的增大而提高,搅拌速度从200 r·min?1增大到400 r·min?1,PbSO4转化率可以从70.5%提高到93.4%。增大搅拌速度,可减小液膜扩散层的厚度,加快NH4HCO3扩散到铅膏颗粒表面的速度。继续增大搅拌速度到500 r·min?1,PbSO4转化率只增加了3%左右,说明反应的搅拌速度为400 r·min?1时,能基本消除外扩散对反应的影响,在后续实验中,将以此搅拌速度为标准。根据湿法冶金动力学原理[23-24],在固液多相反应中,若反应的控制步骤为外扩散控制,搅拌速度的增加通常能提高转化率40%~70%。由此可知,搅拌速度对本实验转化率的影响程度为20%左右,因此,可以证明外扩散不是本反应的控制步骤,本反应的转化速率取决于内扩散或化学反应速率。
2.2. 温度对脱硫率的影响
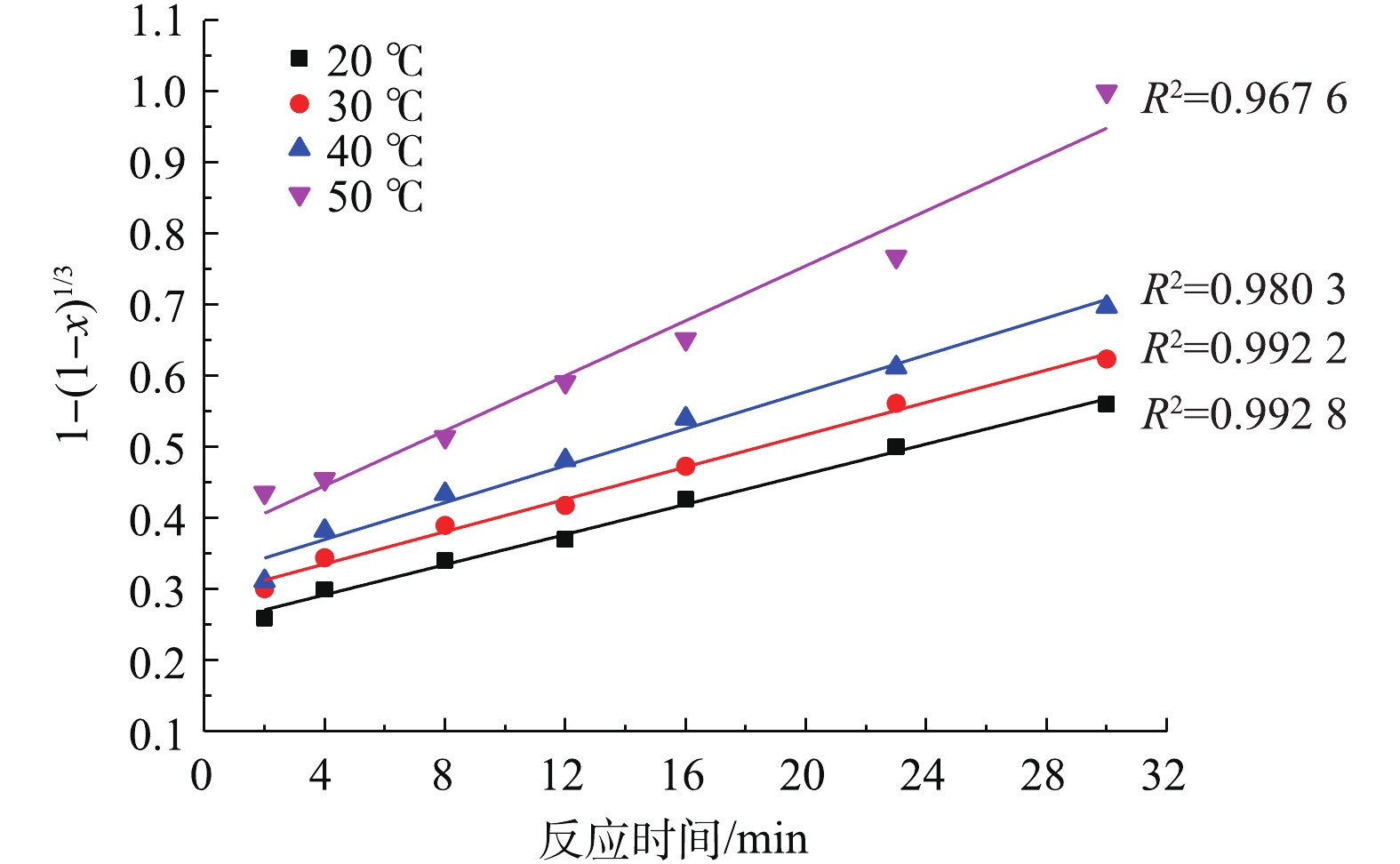
在铅膏粒度为0.15~0.25 mm、NH4HCO3浓度为0.3 mol·L?1、反应时间为30 min、搅拌速度为400 r·min?1的条件下,考察了不同反应温度对PbSO4转化率的影响,结果如图2所示。可以看出,反应温度对PbSO4转化率有一定的影响,PbSO4的转化率随着温度的上升有一定程度的增加。在整个反应过程中,随着反应时间的延长,PbSO4转化率在前期明显增大,在2 min时,各温度的PbSO4转化率都超过60%,50 ℃时甚至大于80%;继续延长反应时间,各温度下的PbSO4转化率开始缓慢上升并逐渐趋于平缓。在反应时间为30 min、反应温度为50 ℃时,PbSO4转化率可达99%。当反应的控制步骤为化学反应控制时,增大反应温度可大幅提高转化速度[25],温度每升高10 ℃,化学反应速率可提高数倍[26]。根据图2的实验结果,虽然温度的升高对反应速率有影响,但是并不显著。因此,可以大致推断该反应不是化学反应控制,其控制步骤可能是内扩散控制。2.3. 脱硫剂浓度对脱硫率的影响
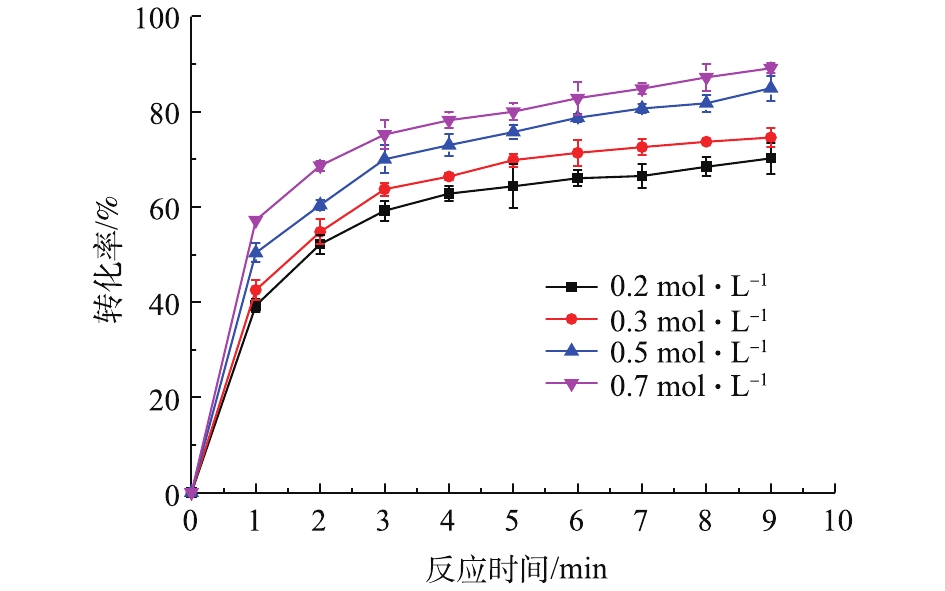
在铅膏粒度为0.15~0.25 mm、反应时间为10 min、反应温度为20 ℃、搅拌速度为400 r·min?1的条件下,考察了不同浓度的NH4HCO3对PbSO4转化率的影响,结果如图3所示。可以看出,在同一NH4HCO3浓度下,PbSO4转化率随反应时间的延长而增大。在反应开始后的2 min内,PbSO4转化率迅速上升,2 min后,上升幅度逐渐变缓。说明在反应前期反应速度较快,在2 min之后,反应速度减慢。NH4HCO3浓度对PbSO4转化率的影响较为明显,NH4HCO3浓度增大,PbSO4转化率提高。反应9 min,NH4HCO3浓度从0.2 mol·L?1增加到0.7 mol·L?1,PbSO4转化率从70%上升到89%。2.4. 反应动力学分析
PbSO4与NH4HCO3的反应是一个固液多相反应过程,固态的PbSO4在NH4HCO3溶液中与之反应生成固态的PbCO3和液态的(NH4)2SO4。反应首先在固体颗粒表面发生,在反应过程中,逐渐向固体颗粒内部收缩,反应产物附着在固体颗粒表面并随着反应的进行逐渐增厚,形成产物层,而未反应核逐渐缩小。因此,PbSO4与NH4HCO3的反应过程可用未反应核收缩模型[13,27]来描述。具体反应过程经历5个步骤[28-29]:1)脱硫剂通过液相边界层向颗粒表面扩散(外扩散);2)脱硫剂通过产物层向颗粒内部继续扩散(内扩散);3)脱硫剂通过产物层后与颗粒发生化学反应;4)生成的不溶产物使产物层增厚,可溶性产物通过产物层向外扩散(内扩散);5)生成的可溶性产物通过边界层扩散到溶液中(外扩散)。未反应核收缩模型按照不同控制步骤可分为液膜外扩散控制、化学反应控制和内扩散控制。由2.1节实验结果可知,本反应的反应速率不受外扩散控制,其取决于化学反应或内扩散。如果反应过程为化学反应控制,则反应动力学方程[30-32]见式(3)。
如果反应过程为内扩散控制,则反应动力学方程[32-33]见式(4)。
式中:KC为化学反应速率常数;KD为扩散速率常数;x为转化率;t为反应时间,min。
根据Arrhenius公式,温度T与反应速率常数k之间的关系见式(5)。
式中:T为热力学温度,K;k为温度T时的反应速率常数;A为指前因子;R为摩尔气体常数,8.314 J·(mol·K)?1;Ea为表观活化能,kJ·mol?1。
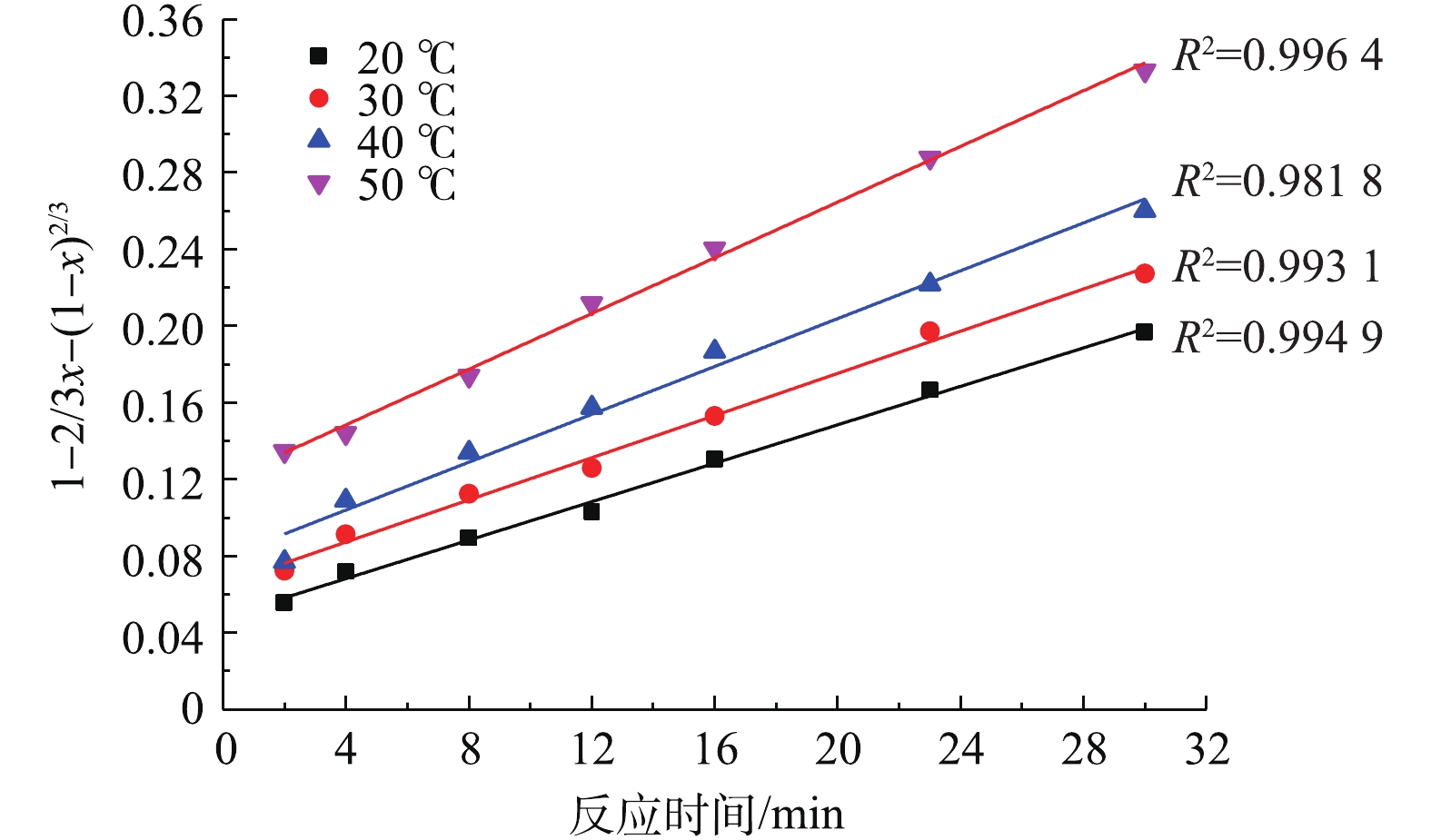
将图2中的反应时间t及不同温度下与之对应的PbSO4转化率x分别代入式(3)和式(4)进行拟合,结果如图4和图5所示。
对比图4、图5中的可决系数R2发现,不同温度下,1?2/3x?(1?x)2/3与反应时间t的线性关系要优于1?(1?x)1/3与t的线性关系。因此,本研究体系中PbSO4与NH4HCO3的反应符合内扩散控制规律。
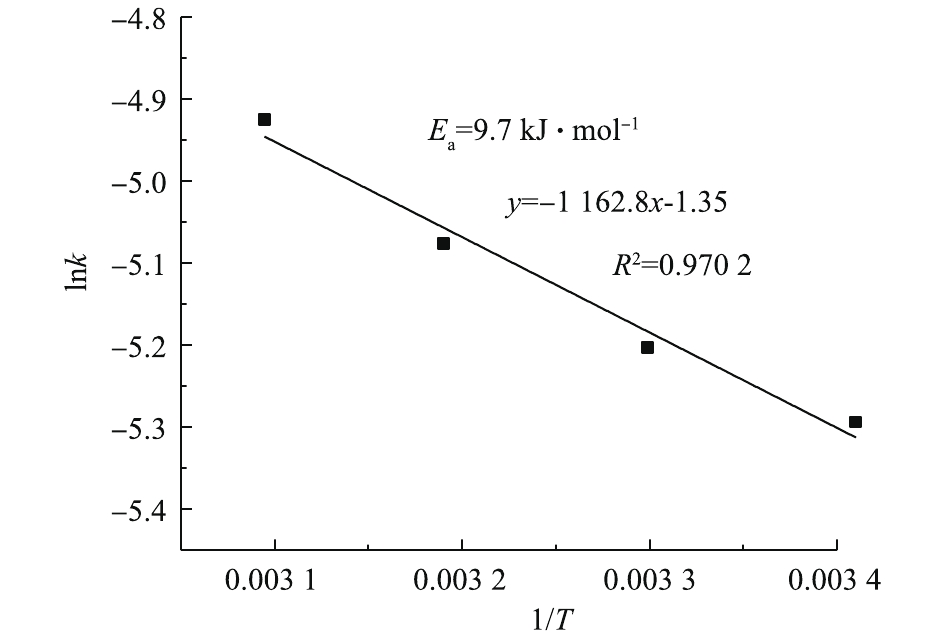
将图2中不同温度下1?2/3x?(1?x)2/3与时间t的关系进行线性回归分析,所得的直线斜率即为对应温度下PbSO4的反应速率常数K。将图4中不同温度下的直线斜率K以lnK的形式对1/T进行线性拟合,结果如图6所示。该直线方程为y=?1 162.8x?1.35。根据Arrhenius公式(式4),可求出反应的表观活化能Ea=9.7 kJ·mol?1。化学反应控制的表观活化能应大于41.8 kJ·mol?1,而内扩散控制的表观活化能小,一般仅为4~12 kJ·mol?1[32]。反应的表观活化能为4~12 kJ·mol?1,这进一步证明了PbSO4与NH4HCO3的反应过程为内扩散控制过程。
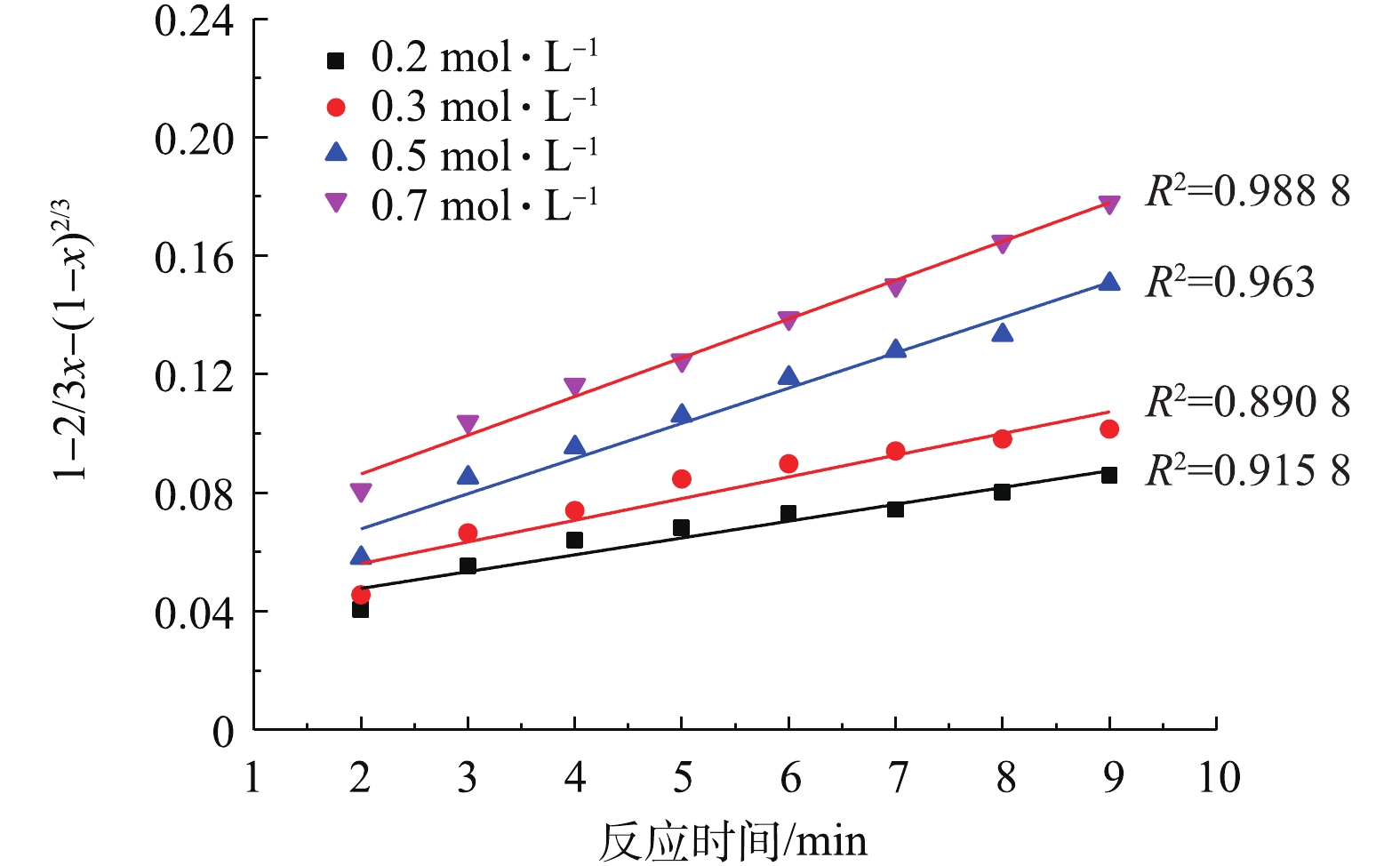
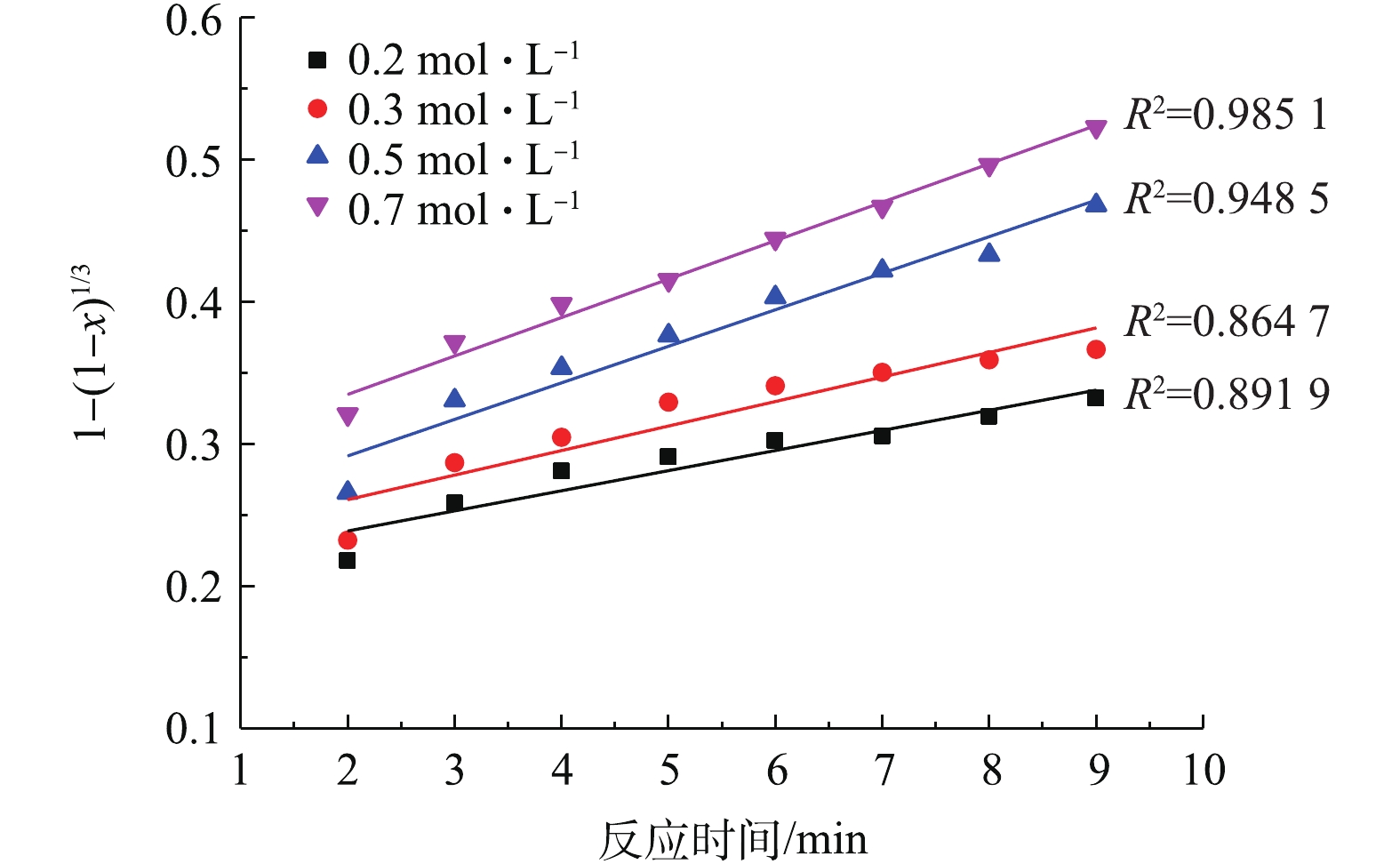
将2.3节中不同NH4HCO3浓度得到的PbSO4转化率分别带入式(3)和式(4)中进行拟合,结果如图7和图8所示。
比较图7和图8中的可决系数R2可知,不同NH4HCO3浓度下,1?2/3x?(1?x)2/3与反应时间t的线性关系要优于1?(1?x)1/3与t的线性关系。这验证了PbSO4与NH4HCO3的反应过程为内扩散控制过程[34-35]。此外,在低NH4HCO3浓度下,拟合的线性偏离较大,而在高NH4HCO3浓度下,有较好的线性拟合关系。推测可能是因为动力学是在假定NH4HCO3浓度不变的前提下推导的,而0.2 mol·L?1和0.3 mol·L?1的NH4HCO3浓度与反应的理论用量接近,随着反应的进行,NH4HCO3不断被消耗,浓度逐渐下降,从而导致了线性偏离。
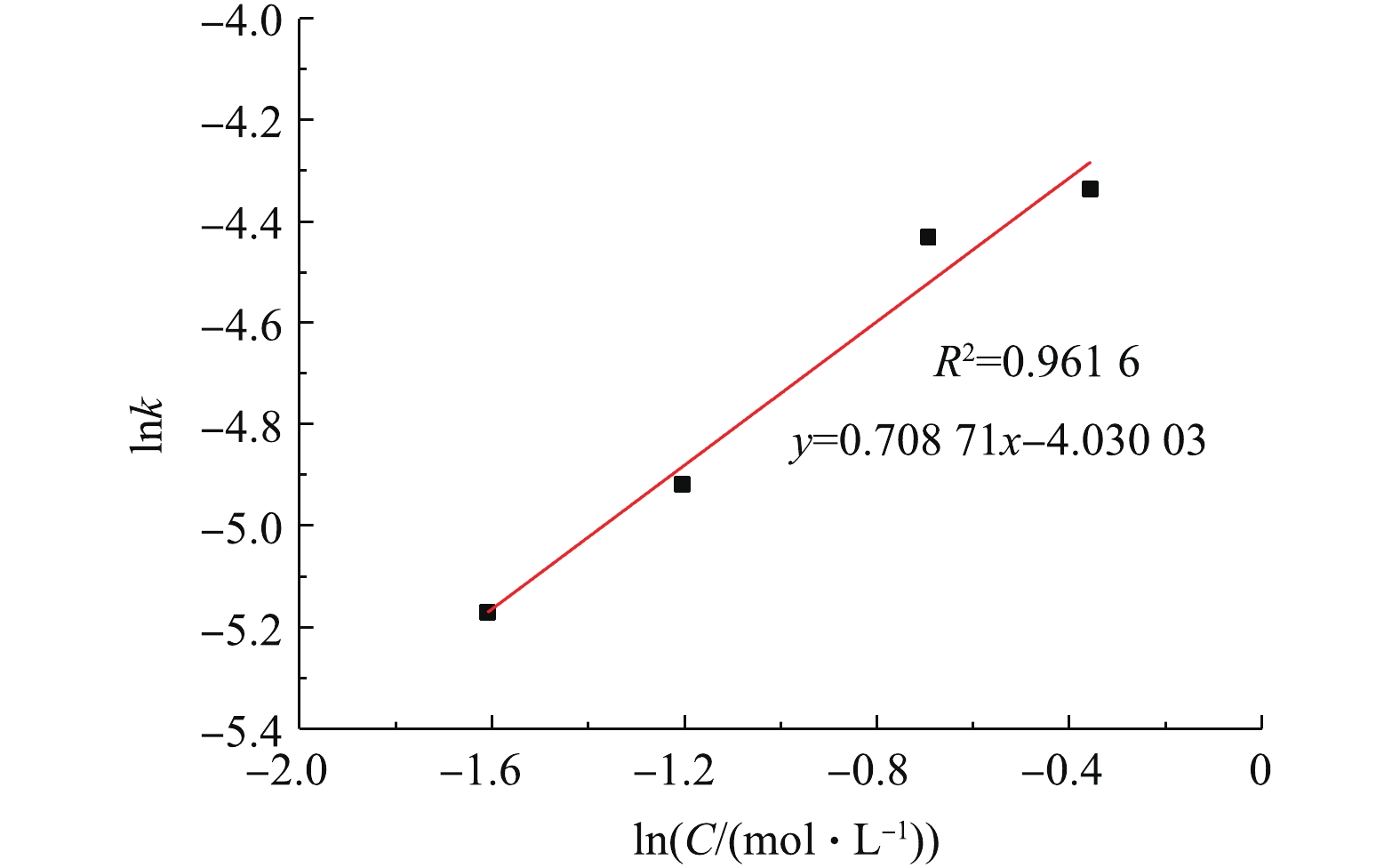
用线性回归法求出图7中各直线的斜率即各浓度下的反应速率常数K,如表1所示。随着NH4HCO3浓度的增加,反应速率常数也在增大,说明反应速率加快。以lnK对lnC(C为NH4HCO3浓度)作图,结果如图9所示,线性回归得出直线的斜率=0.71,即反应的表观反应级数为0.71。
2) NH4HCO3与铅膏中PbSO4的反应过程符合固液多相反应的未反应核收缩模型,且反应受内扩散控制。在实验选取的条件范围内,其表观活化能为9.7 kJ·mol?1,表观反应级数为0.71。
3)由于NH4HCO3与铅膏反应过程受内扩散控制,因此,在该反应体系中,单一通过提高反应温度或增加NH4HCO3浓度的途径来提高铅膏脱硫转化率及转化速率是有限的;而通过水力剪切、机械研磨、超声破碎等外力作用实现反应过程中反应颗粒的“表面更新”才是改善铅膏铵法预脱硫技术、提高铅膏脱硫转化率的关键。
参考文献
 下载:
下载: 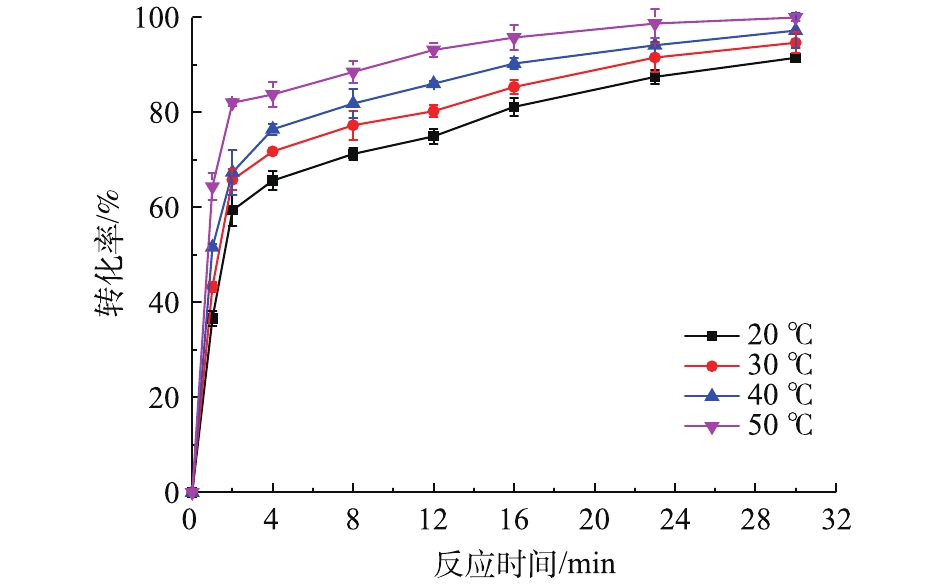
 点击查看大图
点击查看大图