电离辐射诱导DNA损伤并导致细胞死亡是辐射造成机体损伤的重要基础。探索电离辐射诱导DNA损伤及其修复的深入机制,并寻找促进DNA损伤修复的新靶点是近年来放射医学研究的前沿热点问题。NRF2(Nuclear factor erythroid 2-related factor 2)是一种核转录因子,可以调控细胞内多种抗氧化基因表达。由于NRF2具有较强的抗氧化调控能力,所以NRF2表达升高被普遍认为是细胞发生辐射抵抗的重要原因。然而,NRF2在DNA损伤修复过程中的具体角色及其作用仍不明确。
该团队发现NRF2可以通过非依赖调控ROS(Reactive oxygen species)的途径直接参与DNA损伤修复过程。降低NRF2表达水平会导致细胞基因组不稳定性升高,DNA损伤修复能力减弱,同源重组修复(HR,Homologous recombination repair)效率降低,DNA损伤修复过程中的G2期细胞周期阻滞减弱。
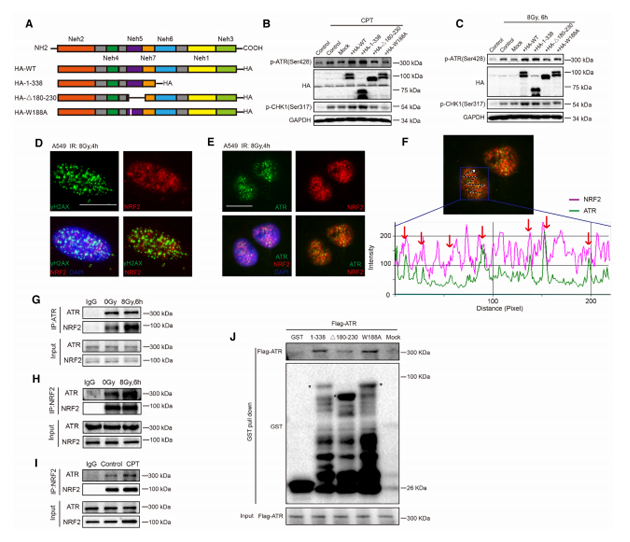
作者进一步探究其作用机制时发现,NRF2可以与DNA损伤应答中的重要激酶ATR在DNA损伤位点结合并调控其磷酸化过程,并且ATR下游CHK1、CDC2、CyclinA等蛋白的活化同样受到NRF2的调控。另外,氨基酸序列分析显示NRF2具有“AAD”(ATR activation domain)结构域,通过进一步的实验研究发现,NRF2可通过AAD结构域与ATR直接结合并发挥对ATR-CHK1-CDC2信号通路的调控作用。同时,作者通过体内移植瘤实验发现,NRF2抑制剂Brusatol可以明显抑制DNA辐射损伤的修复,起到辐射增敏作用。
该项工作发现了NRF2在电离辐射诱导DNA损伤修复中的新机制,同时为研究肺癌细胞放疗抵抗机制提供了新思路,也为放疗增敏药物的研发提供了新靶点。
该研究得到中国医学科学院医学与健康科技创新工程(2017-I2M-1-016, 2019-I2M-2-006)和国家自然科学基金(31670859和81772243)等资助。中国医学科学院放射医学研究所刘强研究员、徐畅副研究员和杜利清研究员为论文的共同通讯作者,中国医学科学院放射医学研究所孙晓辉博士为论文的第一作者。
论文链接:https://academic.oup.com/nar/article-pdf/48/16/9109/33746584/gkaa631.pdf
文字|放射所
