0 引言
【研究意义】磷是植物体生长发育所需的大量元素之一,它在膜系统的构成、物质和能量代谢、遗传等生理生化过程中扮演着极其重要的角色[1]。研究表明,耕地土壤中的磷主要以无机磷、有机磷及其他金属螯合磷的形式存在;一般情况下,植物以吸收无机磷为主,而无机磷当中可被直接吸收利用的有效磷却占总磷含量的不足0.5%[2-3]。如今植物当季从土壤中吸收的磷大多来源于人为施加的磷肥,而磷肥在土壤中很容易被吸附和固定,并且耕地中的可溶性磷易随着灌溉和降雨流失,这不仅导致了磷肥的当季利用率低下,也造成耕地土壤无效磷库的逐年增长,更引发了许多环境问题[4-5]。小麦是中国第二大粮食粮作物,在种植过程中普遍面临着土壤有效磷不足的问题;随着人口的不断增长、生活质量需求的不断提高和不断缩小的耕地面积,培育稳产、高产的耐低磷胁迫小麦迫在眉睫[6-7]。因而发掘新的耐低磷胁迫基因,通过转基因技术创制耐低磷胁迫小麦具有重要的实际意义。【前人研究进展】目前,在拟南芥、烟草、水稻等植物低磷逆境胁迫研究中发现了许多起重要作用的转录因子。其中WANG等[8]和RUBIO等[9]在拟南芥中发现了一个以AtPHR1蛋白为中心的磷信号调控网络,AtPHR1蛋白属于MYB-CC家族转录因子,能在低磷条件下调控其下游基因的表达(如磷转运蛋白基因AtPHT1.2等),增强拟南芥对磷及其他元素的吸收,提高其对低磷的耐受性,该基因还能通过增加单穗的结实率从而促进转基因小麦的增产。DEVAIAH等[10]在拟南芥中发现了WRKY型转录因子AtWRKY75,它的表达受低磷胁迫诱导,并且其RNAi突变体对低磷的敏感度更高,表现出提早的花青素积累。SANO等[11]发现,给受到低磷胁迫的烟草BY2细胞补充磷元素能够诱导NbPhi-2(bZIP类)的表达。YI等[12]在水稻中发现了OsPTF1(表达bHLH型转录因子),在水稻低磷处理条件下,过表达OsPTF1能提高水稻对磷的吸收,表现在转基因植株根系和茎生物量的增加,进而提升转基因水稻的低磷耐受性。ZHANG等[13]发现大豆在低磷胁迫条件下能诱导GmMyb48的表达,其表达产物通过与GmSPX1互作,对大豆应答低磷胁迫中起负调控作用。基于前人的研究,表明不同类型的转录因子在植物对抗低磷非生物胁迫中发挥着重要的作用。【本研究切入点】拟南芥AtTGA4属于bZIP转录因子家族成员,ZHONG等[14]研究发现,在拟南芥中AtTGA4能被干旱和低氮胁迫诱导表达,该基因的过表达可以显著提高转基因拟南芥的抗旱性,但是AtTGA4还未有任何与植物低磷胁迫响应相关的研究报导。而本研究将AtTGA4通过基因枪介导法转化至常规小麦品种石4056中,通过PCR检测获得4个稳定转基因小麦株系,用以进行田间低磷胁迫试验。【拟解决的关键问题】本研究通过试验鉴定转AtTGA4小麦的低磷耐受性,创制耐低磷胁迫转基因小麦新材料,分析AtTGA4提高石4056小麦低磷耐受性的生理机制,为小麦耐低磷胁迫分子育种奠定基础。1 材料与方法
1.1 材料及种植条件
采用最小表达框的基因枪转化法,将AtTGA4和Bar分别与只含有启动子(Ubiquitin)、目的基因、终止子(Nos)的DNA片段连接,通过轰击石4056小麦的愈伤组织,共获得7株T0代阳性植株。后经逐年的筛选、鉴定和繁育,共获得4个稳定遗传AtTGA4的T3代转基因株系供试,依次命名为AtTGA4-L1、AtTGA4-L2、AtTGA4-L3和AtTGA4-L4。试验地位于北京市顺义区后桑园村中国农业科学院顺义试验基地(40º18′N,116º28′E)。2015年10月秋播前,以S型土样采集办法在不同营养地块均匀的采集6份土样,用以测定土壤中碱解氮、有效磷和速效钾含量,后根据《北京市土壤养分指标评定规则》和测定结果进行施肥[15]。供试材料采用完全随机区组的种植方式,通过自动播种机按照3.14×106·hm-2基本苗进行播种,每个种植小区6 m2(1.5 m×4 m),每个营养地块3个生物学重复。播种后的日常田间管理由试验基地相关责任人负责。
1.2 转基因小麦的常规PCR检测
采用GMO作物提取检测试剂盒(TIANGEN)提取转基因小麦全基因组DNA(于拔节期从每个转基因株系中随机选取10株对其倒二叶进行全基因组DNA的提取),并根据AtTGA4和Nos终止子序列、Bar和Nos终止子序列通过DNAman软件设计引物对其进行常规PCR检测。AtTGA4的检测引物:正向引物为5′-TCAAGCT GATCATCTGAGACAT-3′;反向引物为5′-ATAAAAA CCCATCTCATAAATAACG-3′,扩增片段为300 bp。PCR反应体系为10 μL 2×Taq PCR StarMix with Loading Dye(GenStar)、正向引物和反向引物各0.8 μL(10 μmol·L-1)、200—600 ng的DNA模板,补加蒸馏水至20 μL。PCR反应程序采用Touchdown的方法:95℃ 10 min;95℃ 30 s,58℃ 30 s(从第二个循环开始,每一轮循环降低0.5℃),72℃ 30 s,20个循环;95℃ 30 s,52℃ 30 s,72℃ 30 s,20个循环;72℃ 10 min,4℃保存。
Bar的检测引物:正向引物为5′-CGATTCCCAGT CATCAAGTG-3′;反向引物为5′-ATTCAGCGACTT CTGGCA-3′,扩增片段大小为380 bp。PCR反应体系为10 μL 2×Taq PCR StarMix with Loading Dye(GenStar)、正向引物和反向引物各0.5 μL(10 μmol·L-1)、200—600 ng的DNA模板,补加蒸馏水至20 μL。PCR反应程序为95℃ 10 min;95℃ 30 s,56℃ 30 s,72℃ 30 s,25个循环;72℃ 10 min,4℃保存。
扩增产物经1%浓度的琼脂糖凝胶检测并拍照。
1.3 转基因小麦产量及部分农艺性状分析
虽然产量及其农艺性状受田间多种因素的影响,但其能直观的反应出供试材料在实际农业生产环境下的产出状况[16-19]。因此,在收获期进行产量及以下农艺性状的统计和分析:产量(kg·hm-2)由小区产量折算;分穗数(×104/hm2)则通过在小区长势均匀的样段中随机选取2段1 m行长的样段进行全分蘖数的统计,折算成小区实际分蘖数,进而换算;穗粒数则是在小区长势均匀的样段中随机取完整的20个穗子进行穗粒数清点而得出。1.4 转基因小麦开花期部分生理指标的测定
1.4.1 PSⅡ原初光能转化效率(Fv/Fm) 于晴天的14:00时在小区中随机选取3棵单株,用捷克产的FluorPen手持叶绿素荧光仪进行原初光能转化效率的测定。1.4.2 叶绿素相对含量(SPAD) 于晴天在小区中随机选取5棵单株,用产自日本的SPAD-502型叶绿素仪对其旗叶的叶基、叶片中部和叶尖进行叶绿素相对含量的测定,取平均值。
1.4.3 气冠温差(CTD) 于晴天的13:00至14:00时段,用德国产的Optris红外测温仪对供试材料小区的两端和中部进行冠层温度和大气温度的测量,通过计算得出气冠温差。
1.5 转基因小麦不同组分磷含量的测定
为了比较转基因材料与受体的磷吸收、利用能力,在小麦成熟末期对供试材料根、茎、叶和籽粒的磷浓度和吸收、残留总量进行了测定和统计分析。采用浓H2SO4-H2O2消煮法结合全自动流动分析仪测定供试材料不同组分磷浓度:小麦成熟后,从小区中选取10株长势一致的小麦进行根、茎、叶、籽粒的分离,用蒸馏水洗净后,烘干、称重,并用FW100型高速万能粉碎机(天津)进行充分粉碎;每份粉碎样品称取3份0.5000 g进行H2SO4-H2O2消煮,最后稀释到合适的浓度并通过全自动流动分析仪进行全磷含量的测定[20]。由于根系无法完整的取样,只能对成熟末期供试材料地上部各组分吸收、残留总磷含量进行统计和分析。
1.6 转基因小麦AtTGA4的定量表达分析
取正常营养条件下的转基因株系苗期叶片,采用DP432植物总RNA提取试剂盒(TIANGEN,北京)提取总RNA,反转录采用全式金公司的RNA反转录试剂盒,采用qPCR Master Mix(SYBR Green)试剂盒进行Real-time PCR分析。通过NCBI设计的AtTGA4正向引物为5′-TGGAGGCTTTGGTCAGCTTT-3′,反向引物为5′-ACGTTGGTTCACGTTGCCTA-3′;小麦内参所用正向引物为5′-TGCTATCCTTCGTTTGGAC CTT-3′,反向引物为5′-AGCGGTTGTTGTGAGGGAG T-3′[21]。2 结果
2.1 基因枪法线性转化片段
AtTGA4和Bar线性转化片段如图1所示,由于转化片段中不含有任何载体骨架序列,最大程度地减少了由于载体骨架序列可能带来的安全风险;此外,由于AtTGA4和Bar分别单独构制在2个线性转化片段中,为日后在转基因材料后代中筛选Bar筛除的转基因株系提供了可能性。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1线性转化片段示意图
-->Fig. 1Structure of linear transformation fragments
-->
2.2 转基因小麦的PCR检测
T4代AtTGA4转基因小麦PCR检测结果表明,AtTGA4已成功的整合受体石4056小麦基因组中,并稳定的遗传至T4代(图2);并没有检测到Bar,说明Bar在后代中发生了分离而被人为筛除,该转基因材料中只含有目的基因,而不含有筛选标记基因。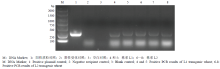 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2转基因小麦AtTGA4的PCR检测
-->Fig. 2PCR results of AtTGA4 transgenic wheat
-->
2.3 试验地土壤养分含量测定结果及实际施肥情况
试验地土壤养分含量测定结果显示,正常和低磷处理土壤中有效氮、磷、钾养分的含量都比较一致。其中,正常和低磷处理中速效钾含量分别为256.39和254.54 mg·kg-1;碱解氮的含量则都偏高,分别为91.68和83.08 mg·kg-1,有效磷的含量则都偏低,分别为34.59和32.64 mg·kg-1。因此,在播种前分别施与适当的氮肥(尿素)和磷肥(过磷酸钙),实际施肥情况如下:正常处理地块施加过磷酸钙(812.39 kg·hm-2)和尿素(97.57 kg·hm-2);而低磷处理地块则只施加尿素(97.57 kg·hm-2)。2.4 灌浆期田间表型
研究发现AtTGA4的2个转基因株系L1和L2在灌浆期相对于受体石4056表现出一定的生长优势。其中,株系L1的表型尤其明显(图3),在正常营养条件下,株系L1与受体长势基本一致;而在低磷处理条件下,受体明显比株系L1提早结束灌浆,主穗普遍提早变黄。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3灌浆期田间表型
-->Fig. 3Phenotypes of wild type and transgenic wheat during filling stage
-->
2.5 低磷对转基因小麦产量及部分农艺性状的影响
从产量及部分农艺性状的统计结果(表1)可以看出,2个转基因株系在正常和低磷处理条件下的产量都显著高于受体,增幅在4.45%—8.60%;低磷对供试材料的株高没有明显的影响,但是普遍都降低了植株的分蘖和单穗结实率,表现在低磷处理条件下,供试材料的分蘖数和穗粒数都较正常营养条件下的低,分蘖减少9.84%—15.24%,穗粒数减少10.07%—13.38%;相反的,磷养分的缺少反而促进了供试材料籽粒重量的增加,表现在低磷胁迫条件下供试材料的千粒重都较正常条件下的要高,并且转基因株系L1和L2在低磷条件下的千粒重显著比受体提高8.10%—9.91%。该统计结果表明,低磷胁迫虽然促进了供试材料籽粒重量的增加,但由于普遍降低了其分蘖和单穗结实率,以致产量的下降;但由于2个转基因株系在不同处理条件下的分蘖和穗粒数与受体相当,籽粒重量比受体高,因而导致转基因材料在正常和低磷胁迫条件下的产量都要显著高于受体。Table 1
表1
表1产量和部分农艺性状统计分析
Table 1Statistical results of yield and some agronomic traits of transgenic wheats
| 营养条件 Nutritional conditions | 材料 Materials | 分穗数(×104/hm2) Number of tillers (×104/hm2) | 穗粒数(粒) Grain number per spike (grain) | 千粒重 Thousand seed weight (g) | 产量 Yield (kg·hm-2) | 增产率 Increase rate of yield (%) |
|---|---|---|---|---|---|---|
| 正常条件 Normal condition | 石4056 Shi 4056 | 641.30±32.85 | 31.08±5.35 | 44.53±0.41 | 7483.87±48.91 | |
| AtTGA4-L1 | 619.71±77.08 | 31.47±1.56 | 45.08±1.25 | 8127.38±369.94* | 8.60 | |
| AtTGA4-L2 | 607.01±8.80 | 33.10±5.14 | 49.12±0.66** | 7884.00±165.18* | 5.35 | |
| 低磷处理 Low phosphorus treatment | 石4056 Shi 4056 | 543.52±77.83 | 27.95±2.65 | 46.30±1.28 | 7370.62±63.98 | |
| AtTGA4-L1 | 558.76±11.64 | 27.37±0.75 | 50.05±1.17* | 7936.90±309.00* | 7.68 | |
| AtTGA4-L2 | 529.55±38.66 | 28.67±2.69 | 50.89±2.35* | 7698.81±79.36** | 4.45 |
新窗口打开
2.6 低磷对转基因小麦开花期部分生理指标的影响
如图4田间部分生理指标测定结果所示,在开花期,供试材料在低磷处理条件下的Fv/Fm都比正常条件下要低,降幅在8.40%—11.40%,正常营养条件下供试材料的Fv/Fm无明显差别;而低磷处理条件下,2个转基因株系L1和L2的光合速率都显著强于受体。开花期气冠温差测定结果表明,低磷条件下,2个转基因株系的CTD值都显著高于受体,表明转基因株系开花期体内水分代谢强度都要显著强于受体。然而开花期SPAD的测定结果却显示低磷胁迫对受体和转基因株系的叶绿素相对含量都没有表现出很明显的负面影响作用,受体和转基因株系之间的叶绿素相对含量也没有明显的差别。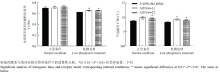 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4开花期Fv/Fm和CTD测定结果
-->Fig. 4Results of Fv/Fm and CTD assay during flowering stage
-->
2.7 低磷对转基因小麦不同组分磷含量的影响
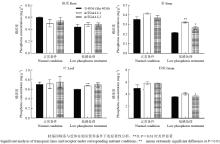
成熟末期,供试材料不同组织部位磷浓度测定结果如图5所示,受低磷条件的影响,供试材料在低磷胁迫条件下的各组分磷浓度都有不同程度的下降。在低磷处理条件下,2个转基因株系的茎杆磷浓度都要显著高于受体,L1和L2株系的茎杆磷浓度是受体的1.37—1.52倍,株系L1的叶片磷含量和L2的籽粒磷浓度也较受体显著提高;正常条件下的则都无显著差异。虽然转基因材料不同组分的磷浓度在除了茎杆以外的其他组织中相对于受体而言没有普遍的差异,但是成熟末期地上部各部位的磷吸收、残留总量统计结果(表2)却显示,2个转基因材料在茎杆、叶片中的磷残留总量在低磷胁迫条件下显著的高于受体,籽粒吸收的总磷含量在低磷条件下也显著的比受体高,而2个转基因材料在低磷营养胁迫条件下的茎杆、叶片和籽粒干重未发现有显著差异,这可能与作物开花后叶片、茎杆等组织中磷养分的再利用与分配有关[22-23]。结果表明,AtTGA4转基因小麦材料在低磷胁迫条件下地上部各部位对磷的保有能力都要显著高于受体石4056;低磷条件下,转基因小麦地上部整体总磷含量较受体增幅达6.38%—17.47%。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5各组分磷浓度测定结果
-->Fig. 5Results of phosphorus density in different tissues
-->
Tab. 2
表2
表2各组分磷吸收、残留总量统计结果
Tab. 2Statistical results of total phosphorus absorbed or remained in different tissues
| 营养条件 Nutritional conditions | 材料 Materials | 磷吸收、残留总量Total amount of absorbed or relict phosphorus (kg·hm-2) | |||
|---|---|---|---|---|---|
| 茎 Stem | 叶 Leaf | 籽粒 Grain | 地上部 Overground part | ||
| 正常条件 Normal condition | 石4056 Shi 4056 | 0.95±0.12 | 1.50±0.16 | 47.09±4.87 | 49.54±4.91 |
| AtTGA4-L1 | 1.14±0.03 | 1.59±0.37 | 52.10±0.34 | 54.83±0.13 | |
| AtTGA4-L2 | 0.99±0.11 | 1.76±0.50 | 48.32±1.67 | 51.08±1.40 | |
| 低磷处理 Low phosphorus treatment | 石4056 Shi 4056 | 0.62±0.03 | 1.37±0.03 | 26.23±0.39 | 28.22±0.38 |
| AtTGA4-L1 | 0.95±0.05** | 1.56±0.03** | 30.65±2.53* | 33.15±2.49* | |
| AtTGA4-L2 | 0.77±0.08* | 1.71±0.20* | 27.55±0.39* | 30.02±0.66* | |
新窗口打开
2.8 转基因材料AtTGA4的定量分析
为了解释2个转基因株系在应对低磷胁迫时的表现差异,通过qRT-PCR分析,结果(图6)显示,以株系L1中的AtTGA4表达量为标准,株系L2中目标基因的表达量要比株系L1的低,是株系L1中的0.69倍。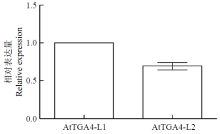 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图6转基因材料中AtTGA4的qRT-PCR分析
-->Fig. 6qRT-PCR analysis of AtTGA4 in transgenic wheat
-->
3 讨论
AtTGA4转录因子是bZIP转录因子家族成员之一,其亮氨酸拉链区能够特异的识别并结合TGACG调控序列,对靶基因进行转录激活/抑制的调节,参与植物抵御众多生物/非生物逆境胁迫的反应[24-26]。已有研究表明,不同物种、同一物种的不同基因型间对磷吸收和利用效率存在着遗传差异[8]。小麦属于异源六倍体植物,基因组庞大,遗传背景相对于玉米、水稻等其他作物要复杂得多[27]。在拟南芥中已经发现了一个以PHR为中心的调控网络,在水稻、小麦等植物中也发现了其同源基因。拟南芥AtPHR1能够识别并结合到其下游基因启动子的P1BS顺式作用元件上,调控其表达,参与植物应对低磷营养胁迫,而有研究表明,大多数磷饥饿响应基因的启动子区都拥有P1BS结构域[9,28-29]。植物一方面在不同的生长阶段对营养的需求有很大的不同,另一方面由于体内代谢的需要,养分在植物体内的分配与再利用也随着生长阶段的变化而在不断的调整中[30-31]。但是到了生殖生长后期,绝大多数一年生植物都会调动营养器官中的养分向生殖器官进行转运和再利用,以繁衍后代[32-33]。小麦TaPHR1-A1与AtPHR1同源,研究发现,在小麦中过表达TaPHR1-A1能够增强转基因小麦在低磷营养条件下对磷养分的吸收,并主要通过穗粒数的增加而致使增产,但是吸收的总磷量转化效率(磷收获指数)并没有提升[8];同样的,这种磷养分吸收的增加在AtPHR1和OsPHR2的过表达株系低磷胁迫研究中也出现过[34-35]。在本研究中,过表达AtTGA4转基因小麦株系在田间低磷营养胁迫条件下主要通过籽粒重量的增加而导致增产,这可能与转基因株系开花期较强的养分吸收和延长的灌浆期有关;此外,成熟期转基因株系低磷胁迫条件下地上部各部位磷吸收、残留总量都显著比受体要高,表明AtTGA4增强了小麦在低磷条件下对磷的吸收和磷养分由根系向地上部运输的强度,这与NILSSON[34]和ZHOU[35]等关于PHR1类蛋白的研究结果相似。但是,AtTGA4在小麦应对低磷营养胁迫中发挥的作用又与PHR1不尽相同,在本研究中转基因小麦材料在正常和低磷营养条件下的分蘖和穗粒数都与受体无明显差异,反而是千粒重相对于受体得到了明显的增加。目前还没有数据证明PHR1与AtTGA4有关联。土壤中磷养分的缺乏会降低植株叶片光合速率及各项叶绿素荧光参数(Fv/Fm,最大荧光等)[36],与本研究开花期Fv/Fm测定结果相同,供试材料低磷条件下的Fv/Fm都低于正常营养条件下的,但转基因株系在低磷条件下的Fv/Fm仍旧显著高于受体;而根系对土壤中养分的吸收、叶片光合作用对CO2的同化作用是植物体正常生长发育的基础,直接或间接的影响了作物产量的形成[37]。在光合作用中,光合色素对光能的吸收、转换和传递起着至关重要的作用,但是光合色素含量的高低与光合速率并无偶联关系[38]。本研究中,供试材料在开花期低磷条件下的SPAD与正常营养条件下的相当,同一营养条件下受体与转基因株系间的SPAD也无明显差异;此外,虽然CTD通常在评价植物抗旱强弱方面作为一个关键性指标,其往往反映的是植物从土壤中吸收有限水分进行体内各种生理代谢的能力,但是在土壤水分供应充足的情况下,通过测定CTD也能反映出不同植物、不同品系间体内生理代谢的强弱差异[39-40],在本研究中,转基因株系在开花期两种营养条件下的CTD都普遍高于受体,表明转基因株系在开花期午间时段的体内生理代谢水平要比受体强,有利于光合作用的碳同化。
此外,由于外源基因的插入位点、插入拷贝数以及受体自身转录翻译调控等原因,不同转基因株系在应对外界生物/非生物胁迫时会产生不同程度的响应。本研究中,转基因株系L1在正常和低磷营养条件下的亩产、籽粒/地上部磷吸收总量和不同组织的磷浓度表现都要普遍优于株系L2,这刚好与株系L1中AtTGA4较高的表达量相对应,表明株系L1在应对低磷胁迫时相对于株系L2在各方面变现出来的优越性可能与其较高的AtTGA4表达有关。本研究从表型、产量及农艺性状等方面初步分析了AtTGA4提高石4056小麦低磷胁迫耐受性的生理机制,相关的作用机理有待后续进一步的深入研究。
4 结论
在低磷胁迫条件下,转AtTGA4小麦产量及各项生理生化指标均有提升,显著提高了转基因小麦对低磷胁迫的耐性。The authors have declared that no competing interests exist.
