0 引言
【研究意义】全世界有超过10亿hm2的土地受到盐碱胁迫的影响,中国盐碱土面积巨大,还有近1/5耕地发生盐渍化[1]。西部干旱半干旱地区是中国重要的葡萄主产区,大部分葡萄都栽培于盐碱地上,生长季节经常出现大面积的黄化现象[2,3]。褪黑素(melatonin,MT)作为一种新发现的强抗氧化剂,对抵御低温、高温、臭氧、重金属、UV等多种非生物胁迫方面有积极作用[4,5,6,7,8]。研究外源MT对NaCl胁迫的缓解作用及内源MT及其关键代谢物的含量变化对MT的应用具有重要意义。【前人研究进展】盐胁迫能够诱导向日葵[9]及羽扇豆[10]等植物内源MT的增加,而研究表明,施加外源MT能有效地保护盐溶液灌根处理的黄瓜幼苗的光合系统,提高黄瓜幼苗对盐的耐受性[11]。外源MT可以通过提高植株抗氧化酶活性及含量等来降低质膜过氧化水平,保持细胞膜的完整性和功能,从而增强黄瓜幼苗对低温、弱光的适应性[12]。外源MT也可减缓紫外辐射引起的烟草氧化胁迫损伤[13]。外源MT还可以通过提高叶绿素的含量减缓大麦的衰老过程[14]。徐向东等[15]还发现外源MT能降低黄瓜在高温胁迫下H2O2含量和O2·-的产生速率,提高植株体内抗氧化酶活性及热激蛋白的含量,提高碳氮代谢相关酶活性,从而有效提高黄瓜果实碳水化合物及氮素的含量[16]。【本研究切入点】使用外源MT是否能缓解NaCl胁迫对葡萄叶片的伤害,以及在应对胁迫反应过程中MT及其关键代谢物的代谢规律都尚未见报道。【拟解决的关键问题】研究NaCl胁迫下根施MT对葡萄叶片叶绿素荧光特性的影响,以及在应对胁迫反应过程中内源MT及其关键代谢物的含量变化,以探讨MT在缓解NaCl胁迫方面的作用和机制,为MT在未来农业方面的应用提供理论依据。1 材料与方法
试验于2016年在山东农业大学核心葡萄示范园(东经117.06°,北纬36.11°)进行。1.1 试验设计
试材为种间杂交品种‘威代尔’(Vidal Blanc)葡萄,其亲本为Ugni blanc×Rayon d'Or,采用一年生自根苗,种植于直径25 cm、高35 cm的花盆中,培养基质为壤土:沙:草炭=1:2:1,待长至8—10片完全展开叶时,进行以下处理:对照(CK):浇等量清水;
处理1(NaCl):根浇NaCl溶液(100 nmol·L-1);
处理2(NaCl +MT):根浇NaCl+ MT溶液(100 nmol·L-1)。
第一次按不同处理要求浇透至流出,以后每3—4 d浇施一次溶液,对照浇等量清水,共浇施4次,每个处理10盆,每盆1株。处理7 d后,于17:00—18:00取其中5株的嫩梢(顶端3—4 cm)、成叶和新根测定MT、MT的关键合成前体物质5-羟色胺(5-HT)和MT的代谢产物2-羟基褪黑素(2-OHMel)的含量。继续处理到14 d后,取另外5株测定各项生理指标,然后于当天的17:00—18:00取嫩梢、成叶和新根测定MT、5-HT和2-OHMel的含量。
1.2 测定项目与方法
1.2.1 褪黑素、5-羟色胺和2-羟基褪黑素的测定 提取方法:参照尹丽媛[17]的方法稍作修改。葡萄样品在采样并处理后迅速放入液氮中冷冻,存放在-40℃低温冰箱中。待制样时取出,用冷冻研磨机(IKA,A11 basic S25)磨成冻粉,真空式冷冻干燥机(北京博医康试验仪器有限公司,FD-1A-50)冷冻干燥(≥48 h)。称取0.5 g葡萄样品冻干粉,置于10 mL试管中,加入5 mL甲醇(天津市永大化学试剂有限公司,分析纯),涡旋震荡后,浸提10 h。然后用超声波清洗机(昆山市超声仪器有限公司,KQ-300E)低温超声15 min(300 W),随后在4℃、10 000 r/min条件下用高速冷冻离心机(Anke,GL-20G-II)离心15 min,收集上清液并用0.22 μm滤膜进行过滤,置于新试管中。再加入5 mL甲醇到原离心管中,涡旋混匀,同样的条件再次离心。将两次上清液混合在一起,用循环水式多用真空泵(郑州长城科工贸有限公司,SHB-III)和旋转蒸发仪(上海亚荣生化仪器厂,SY-2000)低温旋转蒸发(不超过30℃)。将蒸干后的物质用3 mL 5%甲醇水溶液重新溶解下来,涡旋振荡,过0.22 μm有机滤膜。然后用固相萃取装置(Agilent,20 pcs)进行固相萃取,将过滤好的上清液过C18固相萃取小柱(Agilent,100 mg 1 mL),按活化、平衡、上样、淋洗的顺序分别加入5 mL甲醇、5 mL超纯水、样品、5 mL 5%甲醇溶液,速度控制在1 mL·min-1,最后用1 mL 90%甲醇溶液进行洗脱定容到1 mL,过0.22 μm有机滤膜后加入到一次性的液相进样管中,等待上样检测。MT、5-HT和2-OHMel标准品购自美国SIGMA公司,用色谱级甲醇准确配制各标准品溶液后上样检测。检测条件:仪器为三重四级杆高效液相色谱-质谱联用仪(DIONEX,UltiMate 3000;Thremo,TSQ Quantum Access max),流动相为甲醇(Thremo,色谱纯)和0.05%乙酸水溶液(Thremo,色谱纯),流速为0.3 mL·min-1,梯度洗脱条件:流动相为甲醇(A)和含0.05%乙酸的水(B),0—0.8 min时80% B;0.8—2 min时,线性减小至40% B;2—5 min时,维持40% B;5—5.1 min时,线性增大至80% B;5.1—8 min时,维持40% B,结束。进样量5 μL,柱温25℃,质谱模式为ESI(电喷雾离子化)正离子模式,检测方式为SRM(质谱多反应监测),喷雾气介质是N2,毛细管温度为300℃,喷雾电压温为3 000 V,喷雾器温度为300℃,辅助气压为15 V,鞘气压为35 V,定性与定量离子、碰撞电压和保留时间等质谱条件参数见表1。
Table 1
表1
表1褪黑素、5-羟色胺和2-羟基褪黑素的质谱条件参数
Table 1MS parameters of melatonin, 5-hydroxytryptamine and 2-hydroxymelatonin
| 分析物 Analyte | 母离子 Precursor ion (m/z) | 子离子 Production (m/z) | 碰撞电压 Collision energy (eV) | 保留时间 Retention time (min) |
|---|---|---|---|---|
| 褪黑素 Melatonin | 233.087 | 130.171 | 40 | 4.09 |
| 174.13* | 13 | |||
| 5-羟色胺 5-hydroxytryptamine | 177.12 | 115.207 | 29 | 0.93 |
| 160.161* | 12 | |||
| 2-羟基褪黑素 2-hydroxymelatonin | 249.106 | 162.166 | 29 | 3.79 |
| 190.179* | 20 |
新窗口打开
1.2.2 叶绿素荧光诱导动力学OJIP曲线的测定及JIP-test分析 用连续激发式荧光仪(Handy PEA,Hansatech,英国)测定充分暗适应30 min后的叶片叶绿素荧光诱导动力学曲线(OJIP曲线),测定时间为上午9:00—10:00,自然光强在800—1 200 μmol·m-2·s-1,温度不高于35℃。从OJIP曲线上可直接获得如下参数[18,19]:Fo,O点为最小荧光(20 μs);Fk,K点(300 μs)的荧光;FJ,J点[20]的荧光;FI,I点(30 ms)的荧光;Fm,最大荧光,P点的荧光。参考STRASSER等[20]的方法,将OJIP曲线进行O-P段标准化,得到相对可变荧光(Vt)=(Ft-Fo)/(Fm-Fo),ΔVt=(Vt)处理-(Vt)CK,PSII最大光化学效率(Fv/Fm)=(Fm-Fo)/Fm,其中Ft为任意时刻的荧光数值,Vt为任意时刻的可变荧光数值。单位面积有活性反应中心数目(RC/CSm)= Fm×φPo×(Vj/Mo),捕获的激子将电子传递到QA以后的其他电子受体的概率(Ψo)=ETo/TRo=(1-Vj),其中φPo 为PSⅡ最大量子效率,Mo为相对荧光曲线的初始斜率,Vj为j点的相对可变荧光。
1.2.3 叶绿素荧光参数的测定 采用英国Hansatech公司的FMS-2型便携脉冲调制式荧光仪测定荧光参数,测定程序如下:首先对处理前叶片进行30 min暗适应,打饱和脉冲光(12 000 μmol·m-2·s-1),测定起始暗适应下的最大荧光(Fm)。
用Dual-PAM-100(Heinz Walz)双通道荧光仪参照SUN等[21]的方法,首先对处理前叶片进行30 min暗适应,打饱和脉冲光(12 000 μmol·m-2·s-1),测定起始暗适应下的最大荧光(Fm),光强按10、23、41、113、212、287、565、780和1 215 μmol photons·m-2·s-1的顺序每60 s升高一次,每一次照光结束后,打一个饱和脉冲光测定荧光参数,测定参数包括:PSII光化学量子效率Y(II)=(Fm'-Fs)/Fm';PSII的电子传递速率ETR(II)=0.84×0.5×Y(II)×PPFD;PSII实际光化学效率(ФPSII)=(Fm'-Fs)/Fm';光下最大捕光效率(Fv'/Fm')=(Fm'-Fo')/Fm';光化学淬灭系数(qP)=(Fm'-Fs)/(Fm'-Fo');非光化学淬灭(NPQ)=Fm/Fm'-1。PSI光化学量子效率Y(I)=(Pm′-P)/Pm,PSI的电子传递速率ETR(I)=0.84×0.5×Y(I)×PPFD。Fo',光适应下的叶片最小荧光;Fm',光照后的最大叶绿素荧光;Fs,光适应下的叶绿素稳定荧光;P,P700光下信号强度;Pm,P700最大氧化水平;Pm',光下P700最大氧化水平。
1.3 数据处理
用Microsoft Excel软件处理数据和制图,DPS软件进行单因素方差分析,并进行LSD多重比较,差异显著性为 P<0.05。2 结果
2.1 NaCl胁迫下葡萄各器官褪黑素、5-羟色胺和2-羟基褪黑素的含量变化
将MT、5-HT和2-OHMel标准样品溶液上样检测,结果如图1。MT标准样品保留时间为4.11 min,5-HT标准样品保留时间为1.03 min,2-OHMel标准样品保留时间为3.85 min;葡萄器官提取物色谱图结果见图2,目标峰保留时间与标准样品基本一致。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1褪黑素、5-羟色胺和2-羟基褪黑素标准样品色谱图
-->Fig. 1Chromatogram of MT, 5-HT and 2-OHMel standard sample
-->
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2葡萄器官提取物色谱图
-->Fig. 2Chromatogram of grape organs sample
-->
由图3可以看出,NaCl胁迫7 d后,各器官中的MT和2-OHMel含量与对照的分布规律一致,MT均以新根的含量最高,嫩梢其次,成叶中的含量最低;2-OHMel以嫩梢的含量最高,成叶其次,新根中的含量最低;而各器官5-HT含量在同一水平。NaCl胁迫14 d后,各器官的MT含量减少,2-OHMel含量增加,分布变化均为嫩梢>成叶>新根;5-HT含量分布为成叶>新根>嫩梢。
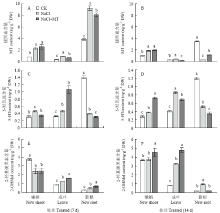 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3根施褪黑素对NaCl胁迫下葡萄各器官褪黑素、5-羟色胺和2-羟基褪黑素含量的影响 CK:对照;NaCl:NaCl处理;NaCl+MT:NaCl和MT处理。不同字母表示处理间差异显著( P<0.05)。下同
-->Fig. 3Effects of root-applied MT on MT, 5-HT and 2-OHMel contents in different organs of grapevines under NaCl stress CK: Control; NaCl: NaCl treatment; NaCl+MT: NaCl+MT treatment. Different letters (a, b, c) in the same figure indicate significant difference between treatments at P<0.05. The same as below
-->
胁迫7 d后,NaCl+MT处理的各器官MT含量仍保持了原趋势,即以根中的最高,成叶中的最少(图3-A);不同器官5-HT含量拉开差距,表现为成叶>嫩梢>新根,2-OHMel的含量分布为嫩梢>成叶>新根(图3-C、E)。NaCl+MT处理14 d后,MT的含量分布为嫩梢>新根>成叶(图3-B),5-HT的含量以地上部器官较高,表现为嫩梢>成叶>新根(图3-D),2-OHMel含量以成叶和嫩梢较高,新根很低(图3-F)。
盐胁迫显著提高了各器官的MT含量,胁迫7 d后,植株嫩梢、成叶和新根的MT含量分别比清水处理的提高了1.78、1.54和1.4倍(图3-A),而NaCl+MT处理下嫩梢中的MT含量与NaCl胁迫相比略有升高但无显著性差异,成叶和新根中的MT含量分别比单纯NaCl胁迫的减少了25.8%和12.7%(图3-A);NaCl胁迫显著提高了地上部嫩梢和成叶的5-HT含量,比CK提高了45.6%和45.1%,但根系却比CK降低了72.1%,而NaCl+MT处理的成叶中5-HT的含量比单独NaCl胁迫提高了1.28倍(图3-C);单独NaCl胁迫的成叶和新根中的的2-OHMel含量分别比CK提高了44%和88.5%,嫩梢中的含量则比CK下降了35.2%;NaCl+MT处理的嫩梢、成叶和新根中2-OHMel含量则分别比单独NaCl胁迫提高了2.5%、27.3%和44.9%(图3-E)。
NaCl胁迫14 d后,嫩梢和成叶中的MT含量分别比CK升高了97.9%和46.7%,新根中的含量则比CK减少了90.6%;NaCl+MT处理的新根中MT含量比NaCl胁迫大幅度提高了236%,嫩梢仅增加了4.8%,成叶则减少了50%(图3-B)。单独NaCl胁迫的嫩梢和成叶中的5-HT含量在胁迫14 d后分别比CK升高了40.7%和110%,新根中的含量则比CK下降了57.5%(图3-D);NaCl+MT处理的嫩梢中的5-HT含量比NaCl胁迫提高了89.5%,成叶和新根中则分别减少了19.0%和31.4%(图3-D);盐胁迫14 d后的嫩梢、成叶和新根中的2-OHMel含量分别比CK升高了3.3%、300%和357%;而NaCl+MT处理的嫩梢和成叶中的2-OHMel含量与单独盐胁迫相比分别增加了19.8%和47.8%,新根中的含量则减少了75%(图3-F)。
2.2 根施MT对NaCl胁迫下葡萄叶片快速叶绿素荧光动力学曲线的影响
叶绿素荧光蕴含着丰富的与光合原初反应有关的信息,叶绿素荧光诱导动力学曲线(OJIP)能够提供很多关于光系统II(photosystem II,PSII)的光化学信息,荧光检测技术已经被广泛用于检测PSII活性[22,23,24]。正常生长的‘威代尔’葡萄叶片叶绿素荧光动力学曲线经JIP-test分析发现其表现出典型的OJIP曲线形状,而在NaCl胁迫14 d后用PEA测定发现,NaCl胁迫导致OJIP曲线发生明显变形(图4-A)。O点荧光强度Fo明显升高,表明反应中心和天线色素可能发生了解离,而O点荧光是暗适应后的光合机构全部PSII中心完全开放时的荧光强度,反映了PSII天线色素受激发后的电子密度;P点荧光强度即Fm值反映了PSII的电子传递状况[25],NaCl胁迫使叶片的Fm值降低了31.6%,说明PSII的电子传递受到了抑制。施加MT处理(NaCl+MT)其Fo值与对照无差异,比单独NaCl胁迫的Fo值提高了12.9%,表明根施MT可以有效减缓NaCl胁迫对叶片PSII的伤害。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4根施褪黑素对NaCl胁迫下葡萄叶片快速叶绿素荧光动力学曲线的影响 O:最小荧光数值;K:300 μs时的荧光数值;J:2 ms时的荧光数值;I:30 ms时的荧光数值;P:最大荧光数值
-->Fig. 4Effects of root-applied MT on the OJIP curves of grapevine leaves under NaCl stress O: Minimum fluorescence value; K: Fluorescence value at 300 μs; J: Fluorescence value at 2 ms; I: Fluorescence value at 30 ms; P: Maximum fluorescence value
-->
对原始OJIP曲线进行标准化后得到相对荧光曲线(图4-B),与CK相比,NaCl胁迫使K点和J点分别显著升高了28%和21.5%,表明放氧复合体(OEC)受到伤害,天线捕获的光能进入电子传递链的比例降低;而根施MT使K和J分别降低了23.6%和11.3%,表明MT对电子传递链有一定保护作用。
以上结果说明NaCl胁迫降低了PSII的光化学活性,减少了叶片单位面积吸收的光能,而根施MT能够保护天线色素,缓解NaCl胁迫对葡萄叶片PSII的光化学活性的影响,提高电子传递效率。
2.3 根施褪黑素对NaCl胁迫下葡萄叶片Fv/Fm、RC/CSm和ΨO的影响
从荧光动力学曲线可以计算与PSII活性相关的参数, 其中PSII的最大光化学效率(Fv/Fm)反映了PSII反应中心原初光能的转换效率,RC/CSm反映了叶片单位面积内有活性反应中心的数量。从图5-A可以看出,NaCl胁迫使叶片Fv/Fm呈下降趋势,与CK相比降低了11.6%;根施MT减缓了Fv/Fm降低的程度,与NaCl胁迫相比增加了7.4%。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5根施褪黑素对NaCl胁迫下葡萄叶片Fv/Fm、RC/CSm和ΨO的影响
-->Fig. 5Effects of root-applied MT on Fv/Fm, RC/CSm and ΨO of grapevine leaves under NaCl stress
-->
RC/CSm表示叶片单位面积内有活性反应中心的数量,ΨO表示捕获的激子将电子传递到QA以后的其他电子受体的概率[26]。如图5-B、C所示,NaCl胁迫下,RC/CSm比CK下降了38.4%,ΨO下降了25.3%;根施MT后,RC/CSm和ΨO的值分别比单纯NaCl胁迫升高了30%和15.9%。
以上结果表明NaCl胁迫伤害了PSII电子供体侧和受体侧,根施MT对NaCl胁迫有明显的缓解作用,提高了NaCl胁迫下叶片的最大光化学效率。
2.4 根施褪黑素对NaCl胁迫下葡萄叶片激发能分配的影响
光下最大光化学效率Fv'/Fm'反映了开放的PSII反应中心原初光能捕获效率。与CK相比,NaCl处理显著降低了Fv'/Fm'的值,达48.8%(图6-A),而添加MT显著缓解了NaCl对Fv'/Fm'的抑制,NaCl+MT处理比NaCl处理提高了11.3%。ΦPSII是PSII电子传递量子产量,反映PSII反应中心在部分关闭情况下的实际原初光化学效率,NaCl处理使叶片ΦPSII降至0.4,比对照降低了34.9%(图6-B),根施MT后使ΦPSII值升高了22.9%。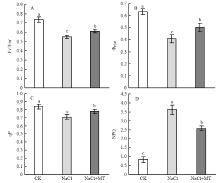 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图6根施褪黑素对NaCl胁迫下葡萄叶片荧光淬灭的影响
-->Fig. 6Effects of root-applied MT on ΦPSII, Fv'/Fm', qP and NPQ of grapevine leaves under NaCl stress
-->
NaCl胁迫下叶片光化学淬灭qP降低了18.3%,非光化学淬灭NPQ显著提高了333%;而根施MT使qP升高了9.6%,NPQ降低了207%(图6-C、D)。表明NaCl胁迫下叶片吸收的光能更多的以热耗 散形式消耗,根施MT后,叶片吸收的光能被用来进行碳固定的能量显著增加,而用来热耗散的相应减少。
2.5 根施褪黑素对NaCl胁迫下葡萄叶片电子传递速率的影响
如图7所示,NaCl胁迫下,光系统I电子传递速率ETR(I)和光系统II电子传递速率ETR(II)明显低于对照,光强最大时PSI和PSII的电子传递速率分别比对照下降了34.9%和49.4%,表明NaCl胁迫对叶片光系统造成了伤害,电子传递速率受到了抑制。根施MT后,光强最大时的ETR(I)和ETR(II)分别比NaCl胁迫升高了28%和46.9%,表明NaCl胁迫下MT对光系统有一定的保护作用,提高了电子传递速率。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图7根施褪黑素对NaCl胁迫下葡萄叶片电子传递速率的影响
-->Fig. 7Effects of root-applied MT on ETR(I) (A) and ETR(II) (B) of grapevine under NaCl stress
-->
3 讨论
3.1 根施褪黑素加速了NaCl胁迫下葡萄内源MT的代谢和运转
非生物胁迫能够诱导植物内源MT的积累。前人研究表明,NaCl胁迫显著提高了向日葵[9]及羽扇豆[10]等植物中的MT含量;高温和强光诱导产生的丙二醛(MDA)与上调MT的合成直接相关[27];暴露在紫外光下的植株MT含量更高, 这被认为是MT清除了紫外光辐射诱导产生的自由基从而产生了光保护作用[28]。MUKHERJEE等[9]研究表明NaCl胁迫提高了向日葵根部和子叶中5-HT和MT的含量,同时MT合成酶HIOMT的活性也显著提高。本试验结果显示,当葡萄植株遭受到NaCl胁迫时,各器官中的MT及其代谢物水平发生相应改变,NaCl胁迫前期(7 d),植株各部位的内源MT含量都有所增加,这与在羽扇豆上的研究结果一致[10];胁迫14 d后,各器官中的MT含量与7 d时相比显著下降,说明胁迫后期MT大量消耗用于抵御NaCl胁迫。分析MT合成前体物质5-HT的含量发现,胁迫7 d时地上部器官5-HT含量显著升高,新根中的含量一直低于对照;胁迫14 d后,成叶中的5-HT含量显著增加,嫩梢中的含量与7 d时相比有所下降但仍高于对照水平,新根中也有所增加但低于对照。WANG等[29]的研究发现,线粒体作为褪黑素合成的主要部位,重组线粒体内干旱诱导型的MzSNAT5蛋白在35℃下表现出高的催化5-HT对N-乙酰维生素的酶活性,使植物线粒体内的MT合成增加,从而作为一种有效的自由基清除剂减少植物在胁迫下产生的活性氧升高引起的氧化应激反应,提高植株的抗逆性。而MT的主要代谢产物2-OHMel在植株不同器官及胁迫不同时间的变化规律与MT及5-HT明显不同,有随着胁迫时间延长而增加的趋势,NaCl胁迫14 d后,2-OHMel在成叶和新根中大量积累,嫩梢中的略有增加,表明成叶和新根中MT代谢旺盛,大量消耗。与NaCl胁迫相比,根施MT后并没有直接促进前期各器官MT含量的增加,但却促进了MT合成前体物质5-HT在成叶中的积累,以及代谢产物2-OHMel在成叶和新根中的积累,嫩梢和新根中的5-HT则显著下降,表明施加外源MT促进了成叶和新根中MT的代谢;随着胁迫时间延长,各器官中的MT含量持续下降,但新根中的MT含量显著高于单独NaCl胁迫处理的;嫩梢和成叶中的2-OHMel大量积累,新根中的显著下降。说明施加外源MT加速了植株MT的代谢和运转,表现为新根中的MT含量升高,嫩梢和成叶中的MT大量消耗,代谢为2-OHMel,提高了植株对NaCl胁迫的抗性。
3.2 根施褪黑素缓解了NaCl胁迫对葡萄荧光特性的影响
盐胁迫可破坏植株离子稳态,使Na+含量升高,K+含量下降,导致渗透胁迫[30]。随着胁迫时间的延长,植物体内过氧化氢(H2O2)、MDA含量和超氧阴离子(O-2)合成速率均显著上升[31],活性氧诱发膜脂过氧化、膜结合酶活性降低,膜结构破坏,膜透性增加,叶片细胞结构发生显著变化[32,33]。叶绿素荧光动力学参数是反映植物对光能的吸收、转化、传递、分配情况的灵敏探针,当发生胁迫时,PSII反应中心会造成损伤,使光合电子传递和PSII的光合作用活力受到抑制,光合受阻,光合速率下降[34,35]。本研究发现,NaCl胁迫下,葡萄叶片OJIP曲线形状发生改变,J点和K点明显上升,RC/CSm和ΨO下降,表明PSII 活性降低,电子受体侧和供体侧活性均受到抑制[36],光合机构出现损伤。同时ΦPSII、Fv'/Fm'、qP和表观电子传递速率显著降低,NPQ升高,说明胁迫抑制了PSII和PSI的电子传递[37,38],降低了光化学量子产量,天线色素的激发能用于光化学反应途径减少,非光化学淬灭量增加。一方面是光合机构受损而导致光化学反应能力降低,天线色素激发能向非光化学热耗散转化;另一方面也是植物在非生物胁迫下通过热耗散消耗过剩光能,对光合机构进行光保护的应激反应,这与杜天浩等[39]在番茄上的研究结果一致。MT作为一种有效的内源性自由基清除剂、有价值的启动剂,能直接清除胁迫产生H2O2等活性氧[40,41],调节代谢体内平衡包括氮和主要碳水化合物代谢,离子转运,激素代谢和光合作用的转录物等,增加光合作用和碳水化合物的代谢或通过调节抗氧化系统相关基因的转录水平,调节转录因子、酶和各种信号分子[42,43,44,45],提高植物的抗氧化能力,增加光合作用和碳水化合物的代谢,加强光合运转效率,从而缓解胁迫对植株造成的伤害[46,47]。本研究结果显示,根施MT能缓解NaCl胁迫下叶片OJIP曲线中K点的上升幅度,受体侧电子传递至QA以后的其他电子受体的概率( ΨO)和单位面积有活性反应中心数量(RC/CSm)显著升高,PSI电子传递速率ETR(I)显著升高,表明MT对电子传递链具有一定的保护作用,电子传递活性有所提高[37,48],叶片吸收的光能更多的用于光合电子传递,提高了叶片的光化学活性,减缓了NaCl胁迫造成的光系统损伤,增加了植株的光合性能。
4 结论
NaCl胁迫严重抑制葡萄叶片光系统活性,但其诱导了植物源褪黑素(MT)的积累,根施MT处理能促进MT在植株各器官中的代谢和运转;另外,根施MT缓解了NaCl对光系统活性的抑制程度,提升了叶片最大荧光Fm和光下最大光化学效率Fv'/Fm',缓解了NaCl胁迫对葡萄叶片光合作用的伤害程度。表明MT能提高葡萄植株对NaCl胁迫的耐受性。(责任编辑 赵伶俐)
The authors have declared that no competing interests exist.
