经典NF-κB通路在各种髓样细胞介导的先天免疫应答中起重要作用,该途径的激活也与炎症性肠病(IBD)的发生密切相关。研究表明,具有突变Nfkb1基因(编码p105)的IBD患者病理表现更为严重,而不能表达p105的突变体小鼠会出现自发性肠道炎症的情况。因此,IKKβ对p105的选择性识别和激活在IBD的发生发展过程中起重要作用。由于NF-κB参与各种生理病理过程,目前抑制该通路的药物具有广泛的副作用,不能实现临床上有效的肠道炎症治疗。
2021年1月13日,生研院靳津教授及东南大学李异媛共同通讯在Science Advances 在线发表题为“Substrate-specific recognition of IKKs mediated by USP16 facilitates autoimmune inflammation”的研究论文。他们发现即使在缺失IκBα招募蛋白NEMO的情况下,p105仍然存在一定程度的磷酸化。在经典NF-κB通路的活化过程中,IKKβ被非蛋白水解性的泛素化修饰,而这种泛素化修饰作用抑制了IKKβ磷酸化p105的能力,但又不影响另一种底物IκBα。通过质谱分析,他们确定了一种特异结合IKKα和IKKβ的去泛素化酶USP16。USP16缺失的髓样细胞中p105的活化明显减少,而IκBα不受影响,且在受到Toll样受体(TLR)激动剂刺激时,NF-κB通路靶向的促炎因子IL-6、IL-12a、TNF-α的分泌能力明显下降。生化实验表明,USP16参与经典NF-κB信号通路的激活,与IKKβ结合后,USP16特异性擦除IKKβ上K6和K33-linked多聚泛素化链,去泛素化的IKKβ选择性识别并磷酸化p105,从而实现对NF-κB信号通路的进一步激活。髓样细胞中条件性敲除USP16的小鼠在实验性结肠炎和结肠癌模型中,表现出明显减轻的炎性症状,肿瘤发生也明显减少。
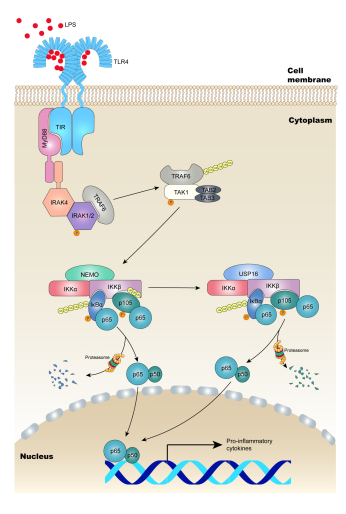
该研究将USP16及其介导的IKKβ泛素化确定为NF-κB信号传导和炎症性肠病发生的新型调节机制,并提示了USP16在结肠炎介导的结直肠癌发病机理中的重要作用,为髓样细胞介导的炎症性肠病治疗提供了新的干预靶点。
生研院靳津教授课题组的博士生余见帅,黄涛和张瑜为本文的共同第一作者,生研院靳津教授和东南大学李异媛副研究员为本文的共同通讯作者。
原文链接:https://advances.sciencemag.org/content/7/3/eabc4009
