2020年10月1日,浙江大学基础医学院刘冲研究员团队以封面长文形式(Full Papers)在Advanced Science杂志在线发表了题为Oncogenic State and Cell Identity Combinatorially Dictate the Susceptibility of Cells within Glioma Development Hierarchy to IGF1R Targeting的研究论文。该研究通过以神经干细胞(NSCs)或少突胶质细胞前体细胞(OPCs)为胶质瘤细胞起源的小鼠原发胶质瘤遗传学模型,证明了在胶质瘤的发育层级中,原癌状态和细胞身份将共同决定细胞对IGF1R敲除的敏感性。IGF1R的敲除,只会选择性的影响突变的和恶性转化的OPCs,而不会影响正常的OPCs以及突变的NSCs。作者认为这是由于原癌突变改变了OPCs的细胞内信号网络,使其生长更加依赖于IGF1R。同时,作者开发了新一代可以穿透血脑屏障的,适合口服给药的IGF1R抑制剂,可以抑制脑中胶质瘤细胞生长。
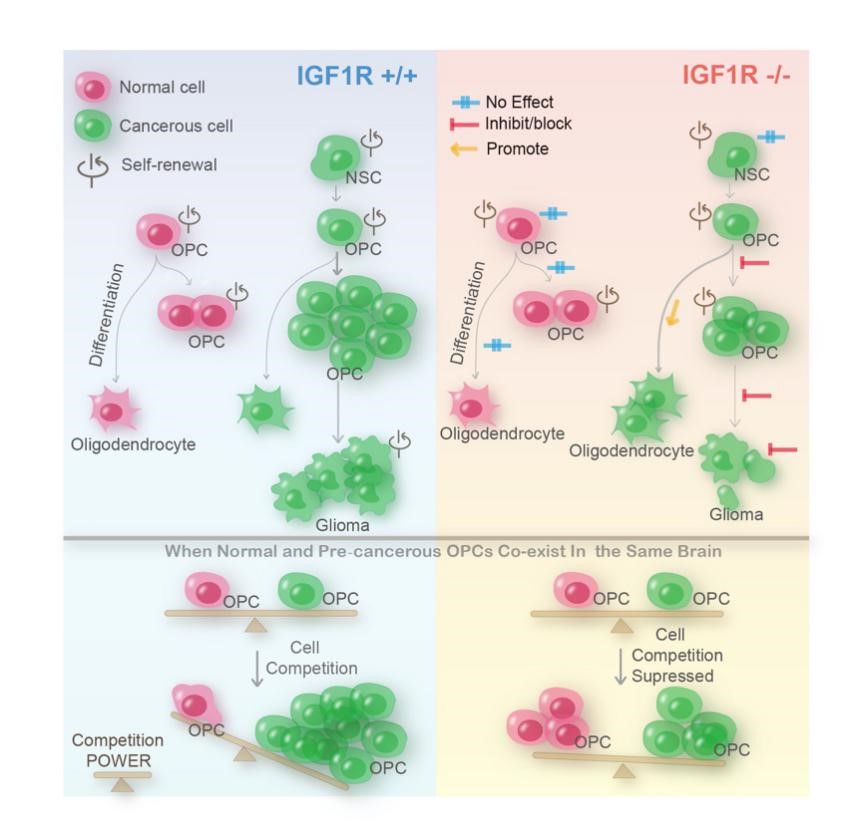
首先,作者利用单细胞测序的方法,揭示了在以OPC作为细胞起源的胶质瘤自发模型中,OPC样细胞拥有肿瘤起始细胞(即肿瘤干细胞)的功能。在上述模型中,特异性的敲除OPC中的IGF1R,可以显著的抑制胶质瘤的发生发展。这一结果表明,IGF1R的功能不仅对于胶质瘤的发展至关重要,对于胶质瘤的起始也有决定作用,暗示IGF1R不仅是胶质瘤的治疗靶点,也可能成为有效的预防靶点。
为了进一步阐明IGF1R的特异性,作者比较了突变OPCs和野生型OPCs对IGF1R敲除的敏感性,通过对四种模型小鼠(CKO_NG2,CKO_NG2_IGF1R,WT_NG2,WT_NG2_IGF1R)肿瘤发生前期OPC的增殖和分化能力进行了分析,发现IGF1R敲除显著抑制了突变OPCs的增殖,促进了其分化,但是并不影响野生型OPC的增殖和分化能力。作者同时又用一种更加精巧的双标记嵌合体分析(MADM)胶质瘤模型,进一步验证了上述的结论。
为了阐述胶质瘤发育层级中不同细胞身份对IGF1R的敏感性的差别,作者利用以NSC为肿瘤细胞起源的胶质瘤原发模型,揭示了IGF1R的敲除并不影响突变NSCs的增殖。只有突变NSCs进一步分化成突变OPCs后,其增殖能力才会受到IGF1R靶向的影响。这提示,细胞身份也是决定IGF1R靶向敏感性的重要因素。
接下来,作者富集胶质瘤患者来源的肿瘤OPC,通过MirRNA敲降IGF1R,验证其对IGF1R靶向的敏感性。并在分子层面揭示了在肿瘤OPC中,IGF1R在控制生长因子信号的输入方面起了非常重要的作用。
最后,作者克服了现有IGF1R小分子抑制剂无法通过血脑屏障的缺陷,通过定向设计的方案,开发了新一代可以穿透血脑屏障并适合口服给药的IGF1R抑制剂PB-020,同时验证了其抑制体内胶质瘤成瘤并延长荷瘤小鼠生存的能力。
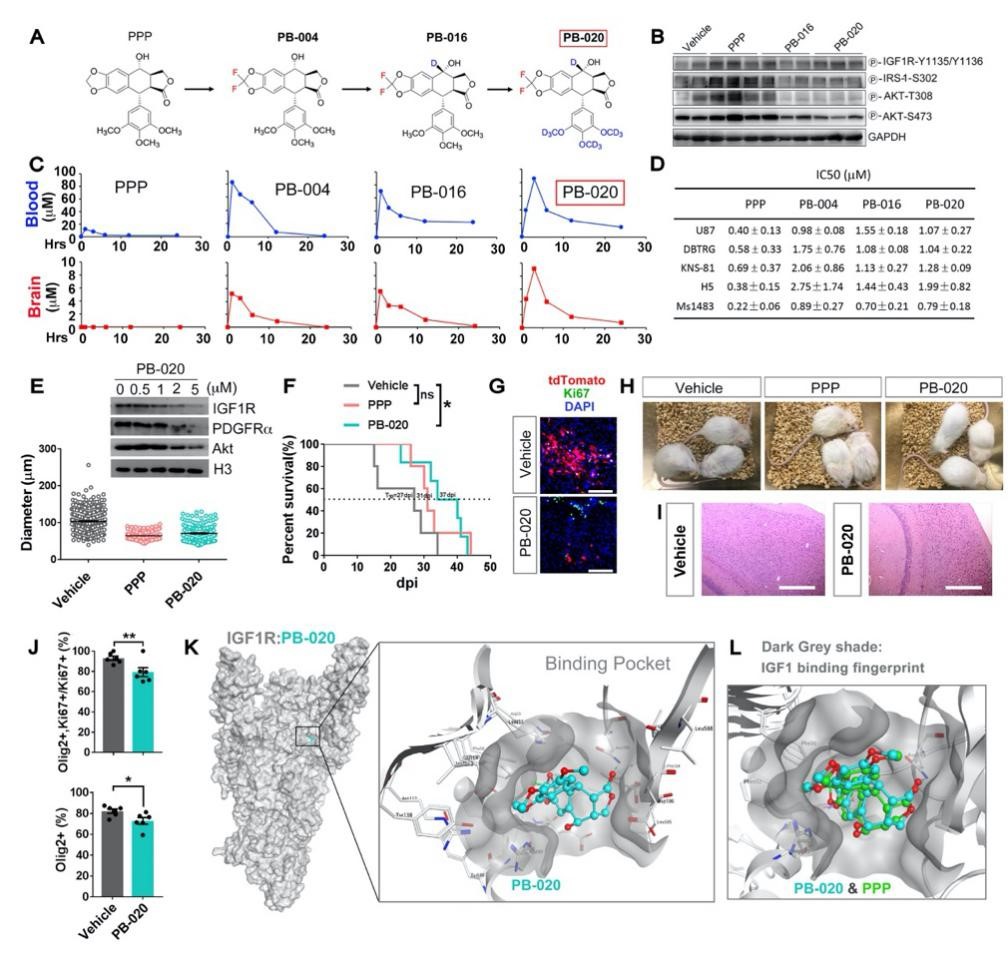
总的来说,该项工作揭示了胶质母细胞瘤预防和治疗过程中,原癌状态和细胞身份将共同决定靶向治疗的效果。明确了IGF1R作为胶质瘤特异性的治疗靶点并确定了其靶向治疗的细胞窗口,同时开发了有临床转化潜力的针对胶质母细胞瘤的IGF1R靶向治疗药物PB-020。
据悉,浙江大学基础医学院的刘冲研究员为该研究的通讯作者。浙江大学基础医学院博士生田安好,浙江大学附属第一医院助理研究员康博,浙江大学附属第二医院病理科副主任医师李百周为论文的共同第一作者。PB-020的研发得到了浙江大学第一附属医院王英杰研究员的大力支持。另据,PB-020的临床一期测试正在积极计划进行中。
原文链接为http://dx.doi.org/10.1002/advs.202001724
