2020年7月3日,Science Advances在线发表了浙江大学药学院彭丽华副教授、高建青教授团队题为“Engineering bacterial outer membrane vesicles as transdermal nanoplatforms for photo-TRAIL–programmed therapy against melanoma”的研究论文。皮肤黑色素瘤是一种位于表皮基底层与真皮层、进展快、转移迅速的恶性肿瘤。临床常采用手术切除或光热治疗来清除肿瘤实体,但病灶深部残留及弥散性分布的黑色素瘤细胞易导致术后肿瘤快速复发及转移。该文首次报道了利用转基因工程菌制备纳米囊泡经修饰后构建一种自带活性蛋白,且兼具透皮、靶向功能,能同时提供光热干预、控制释放活性蛋白的多功能一体化纳米制剂。该纳米制剂涂布于肿瘤局部后,能通过纳米尺寸效应与皮肤的融合作用高效穿透角质层,并进一步特异识别黑色素瘤细胞,在近红外光刺激下,通过光热效应清除肿瘤实体,并响应释放活性蛋白,诱发残存的肿瘤细胞凋亡,实现光热-蛋白程序性干预,大大增强了抗肿瘤效果,延缓了肿瘤复发及转移,为人体浅表肿瘤的治疗提供了全新策略。论文链接:https://advances.sciencemag.org/content/6/27/eaba2735
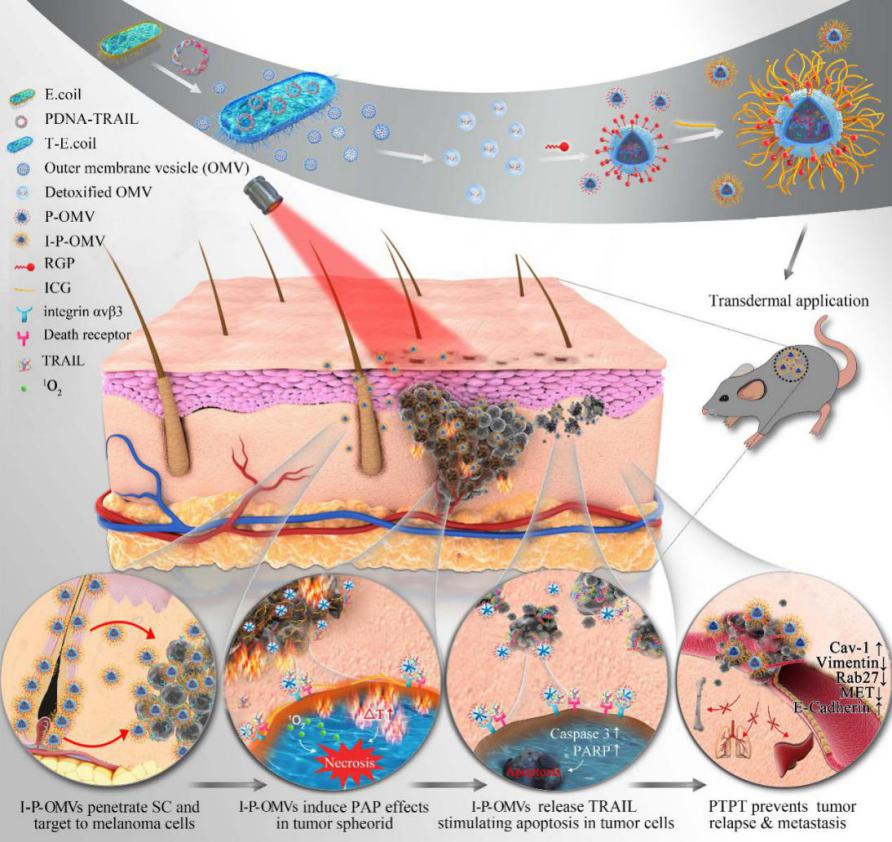
多功能一体化纳米制剂的构建与其抗肿瘤作用示意图
从转基因大肠杆菌中得到细胞外膜纳米囊并脱毒,采用自主合成筛选的黑色素瘤细胞靶向肽与光敏剂共同镶嵌在囊泡表面,得到多功能一体化纳米囊泡,能高效识别肿瘤细胞并特异地结合。I-P-OMVs具有显著的光热效应,并能在近红外光刺激下快速释放单线态氧与目标蛋白。I-P-OMVs+NIR对鼠源和人源黑色素瘤细胞均表现出显著的抑制增殖、迁移,加速凋亡的作用。采用分子测序及验证结果表明I-P-OMVs+NIR对黑素瘤细胞调控凋亡和转移的分子网络具有综合的多向调节作用,显著提升了黑色素瘤细胞对TRAIL蛋白的敏感性,显著增强了TRAIL蛋白对耐受肿瘤细胞的干预效果。
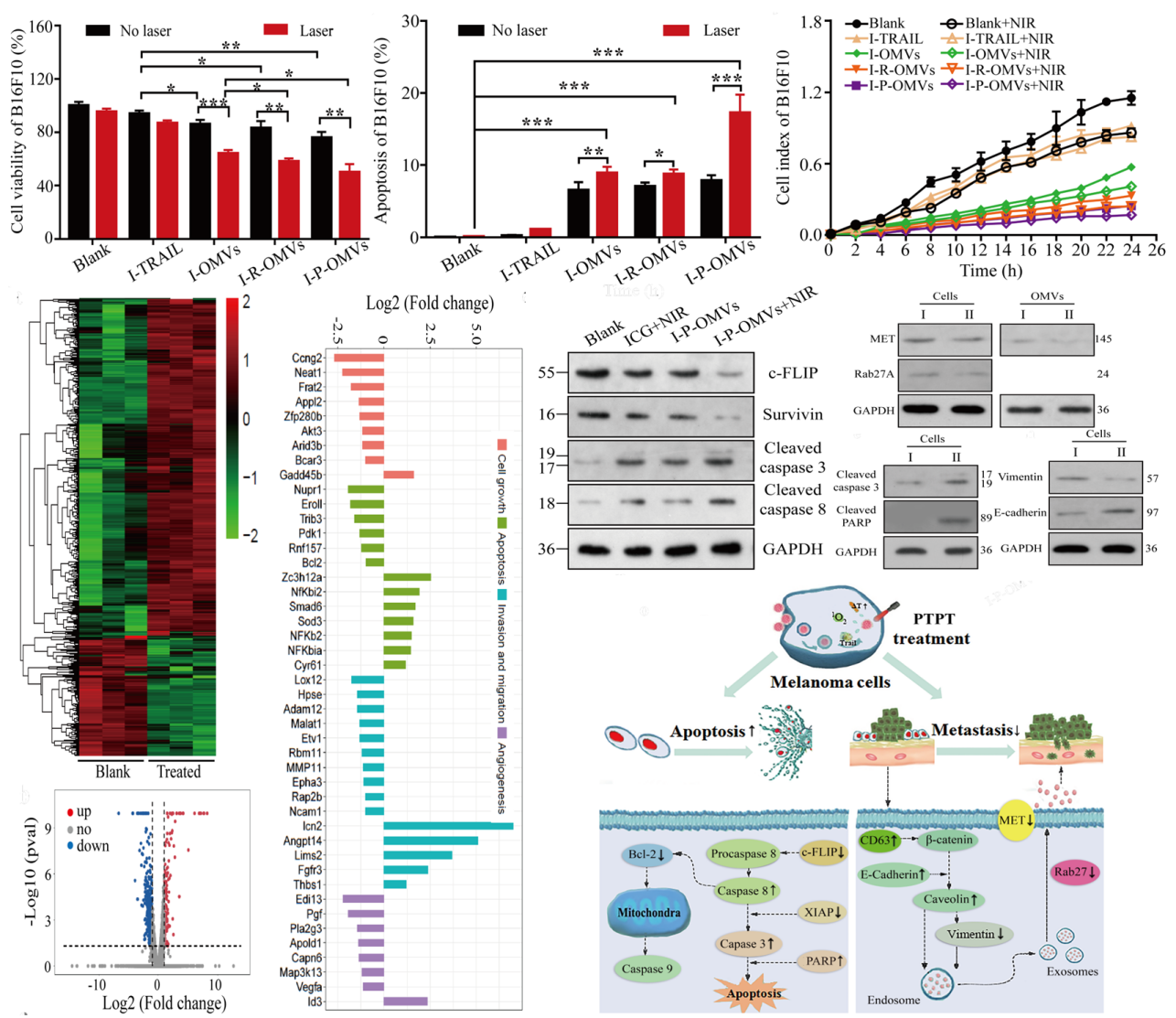
部分体外药效学评价、分子机制研究及验证结果
通过皮肤脂质通道与毛囊孔道,I-P-OMVs能够高效穿透角质层到达表皮与真皮层,并高度富集于肿瘤部位。经I-P-OMVs+NIR治疗后,第二天肿瘤几乎完全消失,肿瘤组织内部凋亡显著。随着时间延长,各治疗组出现不同程度的肿瘤复发,但I-P-OMVs+NIR 组复发率最低,在观察期内没有鉴定出明显的黑色素瘤细胞,与此同时,肿瘤组织的转移性得到显著得抑制。
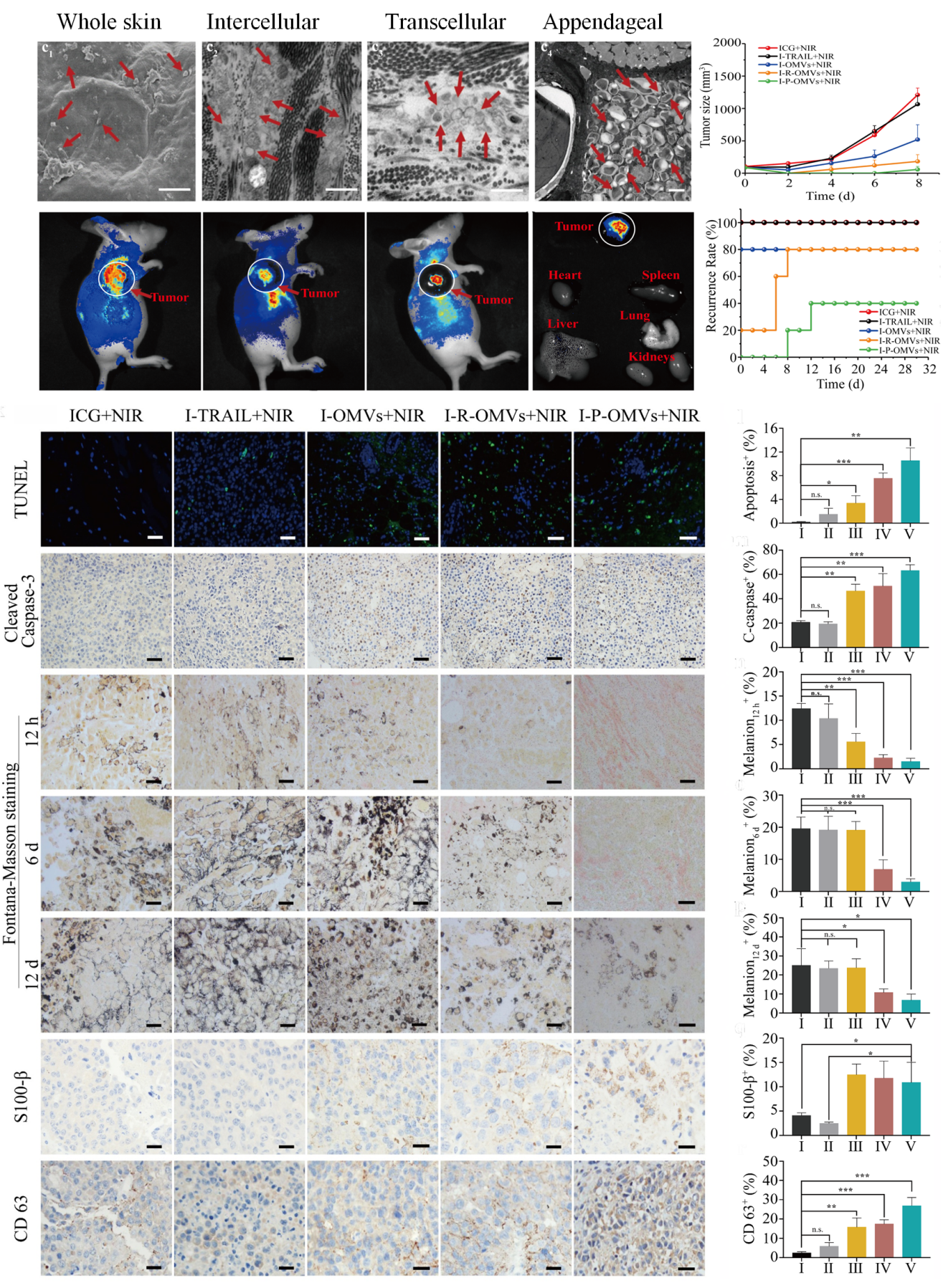
多功能纳米制剂体内外透皮效率与部分体内抗肿瘤效果
本研究为手术、光疗联合药物干预的程序性治疗提供了一种高效、安全、普适的递送平台、所构建的多功能一体化纳米制剂在肿瘤、多种皮肤科疾病治疗中具有广阔的应用前景。本论文浙江大学药学院药物制剂研究所彭丽华副教授为第一及通讯作者,高建青教授为共同通讯作者,合作方为南京大学现代工程与应用科学学院宁兴海教授。
药学院青年教师彭丽华副教授长期致力于生物材料结合纳米技术构建新型经皮与局部智能递药系统的特色研究,用于肿瘤、基于干细胞的神经、皮肤再生的治疗,取得了系列创新性成果。以第一或通讯作者在Science Advances、Advanced Functional Materials、Journal of Controlled Release、Biomaterials等知名杂志发表SCI论文40余篇,受到国内外同行广泛的正面引用。相关技术与成果在药剂学、组织工程学、再生医学等领域具有广阔的应用前景,未来将进一步开展更加深入交叉的创新基础与转化研究。
(药学院供稿)
