2019年10月16日,浙江大学转化医学研究院吕志民研究组与南京医科大学公共卫生学院钱旭研究组在Molecular Cell杂志发表题为KDM3A senses oxygen availability to regulate PGC-1a-mediated mitochondrial biogenesis的长文文章,揭示了去甲基化酶KDM3A作为氧气感受器(oxygen sensor),通过感受微环境氧气浓度调节PGC-1a甲基化水平,影响PGC-1a活性从而调控线粒体生物合成的分子机制。
过氧化物酶体增殖物激活受体γ辅激活物-1(PGC-1)家族包括PGC-1a、PGC-1b和PRC,通过结合并提高多种转录因子(如NRF1/2、ERRa、PPARa)活性,促进线粒体生物合成。该研究首先发现,在低氧情况下, PGC-1a的224位赖氨酸(Lys,K)残基发生单甲基化修饰(K224me)。该修饰阻止PGC-1a与NRF1/2结合,从而抑制NRF1/2转录活性,导致线粒体DNA拷贝数降低和氧化呼吸能力减弱,最终减少线粒体耗氧能力。为了进一步明确低氧导致PGC-1a发生甲基化修饰的原因,研究人员通过筛选发现,组蛋白去甲基化酶KDM3A参与其中。KDM3A能够去除PGC-1aK224甲基化修饰,并且这一生物化学反应需要氧气参与。在低氧情况下,KDM3A由于缺少氧气而活性降低,导致PGC-1aK224甲基化水平升高,线粒体生物合成和氧气消耗水平降低,肿瘤细胞生存能力增强。研究人员还发现,PGC-1aK224甲基化水平与胶质瘤患者肿瘤组织微环境氧气浓度密切相关:氧气浓度越低,PGC-1aK224甲基化水平越高,提示该研究所发现的分子机制具有重要的病理参考价值。
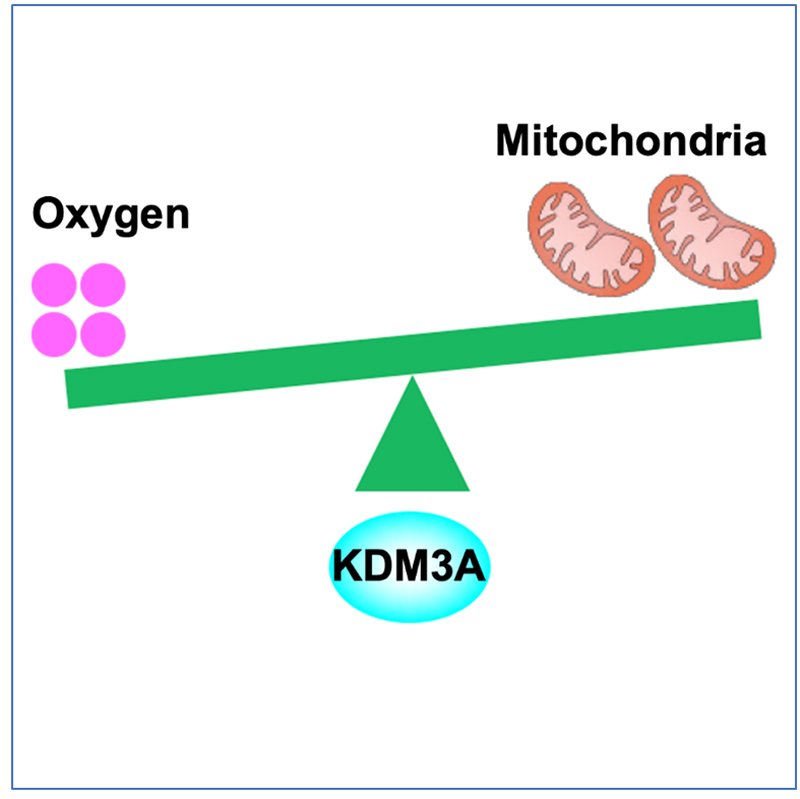
图1. KDM3A感受氧气浓度,调节线粒体生物合成模式图
