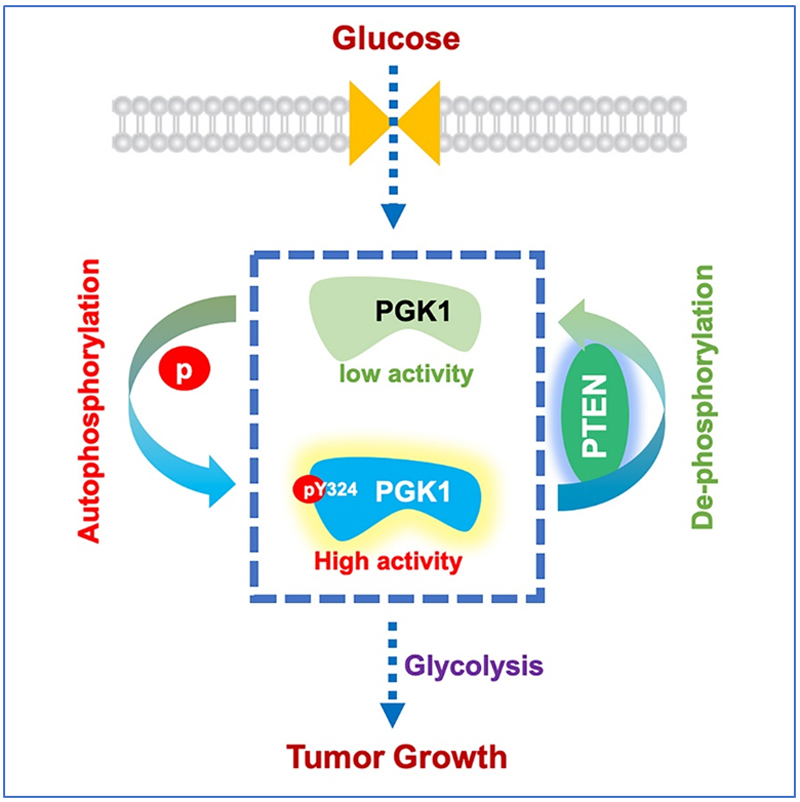
2019年9月3日,浙江大学转化医学研究院吕志民 (Lu, Zhimin) 研究团队在Molecular Cell杂志发表题为PTEN suppresses glycolysis by dephosphorylating and inhibiting autophosphorylated PGK1的长文文章,揭示了PTEN通过抑制自磷酸化的PGK1,发挥对糖酵解的直接抑制作用。
该研究发现,PGK1作为蛋白激酶,可以在324位酪氨酸(Tyr, Y)残基发生自磷酸化;该自磷酸化极大增强了PGK1的代谢酶活性,提高肿瘤细胞糖酵解能力。PTEN兼具脂质磷酸酶(lipid phosphatase)和蛋白磷酸酶(protein phosphatase)活性。PTEN对PI3K/AKT信号通路的抑制作用就是通过其脂质磷酸酶功能实现的。该研究发现,PTEN是自磷酸化的PGK1的蛋白磷酸酶,可以去除PGK1的磷酸化,降低PGK1代谢酶活性,从而抑制肿瘤细胞糖酵解活性。在PTEN活性缺失的胶质瘤病人组织中,PGK1自磷酸化水平升高,并且与病人不良预后密切相关。
这是吕志民研究团队在Molecular Cell杂志连续四年发表的第四篇关于PGK1的研究论文。前三篇论文分别揭示了PGK1协调糖酵解与三羧酸循环(Molecular Cell2016)、激活自噬(Molecular Cell2017)以及促进DNA复制(Molecular Cell2018),促进肿瘤增殖和生存。
本论文第一作者钱旭原为吕志民课题组博后现为南京医科大学教授,同时也是该论文的共同通讯作者。
