 11月10日,南开大学生命科学学院王宁宁教授团队联合南开大学药物化学生物学国家重点实验室、细胞应答交叉科学中心的结构生物学家饶子和院士团队和美国内华达大学生物信息学家JefferyShen教授,在Science子刊ScienceAdvances在线发表了题为“DualactivitiesofACCsynthase:NovelcluesregardingthemolecularevolutionofACSgenes”的研究论文,为揭示乙烯合成关键酶ACS的分子演化路径带来了新线索。
11月10日,南开大学生命科学学院王宁宁教授团队联合南开大学药物化学生物学国家重点实验室、细胞应答交叉科学中心的结构生物学家饶子和院士团队和美国内华达大学生物信息学家JefferyShen教授,在Science子刊ScienceAdvances在线发表了题为“DualactivitiesofACCsynthase:NovelcluesregardingthemolecularevolutionofACSgenes”的研究论文,为揭示乙烯合成关键酶ACS的分子演化路径带来了新线索。研究人员发现,除了具有ACS活性以外,种子植物的ACS蛋白还普遍具有催化以胱氨酸或半胱氨酸为底物生成丙酮酸的Cβ-S裂解酶活性,暗示ACS可能起源于C-S裂解酶,打破了乙烯合成关键酶ACS起源于氨基转移酶的传统观念,为ACS基因的分子演化提供了新的视角。作者还发现,演化过程中N末端两个保守域包括Q98相应位点的获得是植物ACS-like蛋白获得ACS活性的关键事件,并提出了ACS标准结构模型。通过对来源于不同演化地位植物的ACS-like蛋白的活性测定与结构域分析,证明ACC依赖的乙烯合成路径是种子植物所特有的,厘清了非种子植物中可能有依赖和不依赖ACC的两种乙烯合成路径并存的传统观念。
此外,研究人员还解析了典型的ACS双酶及其单酶突变体的蛋白晶体结构,提出了种子植物ACS双酶活性的新催化机制。尤为重要的是,作为Cβ-S裂解酶时ACS的催化产物之一丙酮酸是糖酵解的终产物和线粒体三羧酸循环的能量底物,在植物生长发育和抵抗多种逆境胁迫中发挥重要作用。ACS蛋白具有双酶活性的发现,为人们对ACS基因功能的认知带来了传统观念以外的一个崭新视野,开辟了新的探索领域,“相信对相关领域的深入研究,将为我们更好地了解ACS基因家族的功能以及乙烯合成的调控带来突破。”研究人员说。
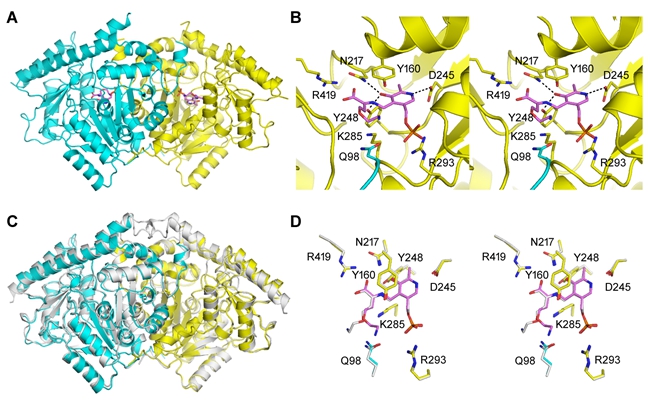 拟南芥AtACS7蛋白的结构解析、活性位点分析及与苹果MdACS1的比较
拟南芥AtACS7蛋白的结构解析、活性位点分析及与苹果MdACS1的比较南开大学生命科学学院王宁宁教授和饶子和院士团队李鑫副教授以及美国内华达大学JefferyShen教授为文章共同通讯作者,生命科学学院研究生徐畅、郝博威、孙公岭以及青年教师梅圆圆为共同第一作者。
全文链接:https://www.science.org/doi/10.1126/sciadv.abg8752
