
端粒是一种存在于真核细胞线状染色体末端的一小段DNA-蛋白质复合体,它与端粒结合蛋白一起构成了染色体的“帽子”结构,作用是保持染色体的完整性和细胞的分裂能力。“端粒如同螺丝钉中的螺丝帽,一圈圈拧紧了,就可以保证轮子运行稳定、防止轮子跑偏。”高绍荣介绍,它能防止染色体末端的重组和降解,对维持细胞染色体的稳定性具有重要作用。
但是,随着年龄的增长,这个螺丝帽渐渐老化,变小了、短了,最终导致螺丝失去稳定的管束,车轮渐渐就跑偏了、出故障了,成体细胞的细胞分裂最终停滞下来了。因此,端粒缩短是引发个体衰老的重要原因,人类衰老的诸多疾病都是因它而起的。
如何才能保证螺丝帽的“青春常在”?就是让端粒的长度维持在一个衡定的状态。乐融融介绍,端粒不萎缩、不老化,可以通过两种机制来实现:端粒酶依赖机制和不依赖端粒酶的端粒延长机制(Alternative lengthening of telomeres,即端粒延伸替代机制,缩写为:ALT)。所谓端粒酶,是在细胞中负责端粒延长的一种酶,犹如建筑上常用的修补材料。我们探讨的是端粒延伸替代机制(ALT),因为目前人们对于其发生过程中的分子机制知之甚少。
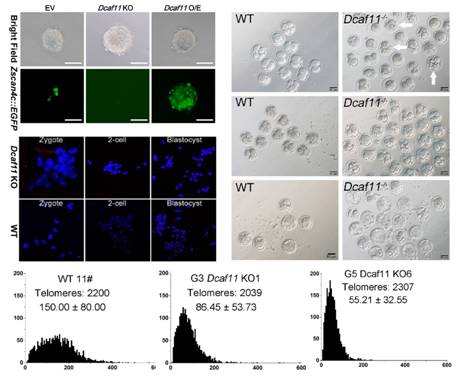
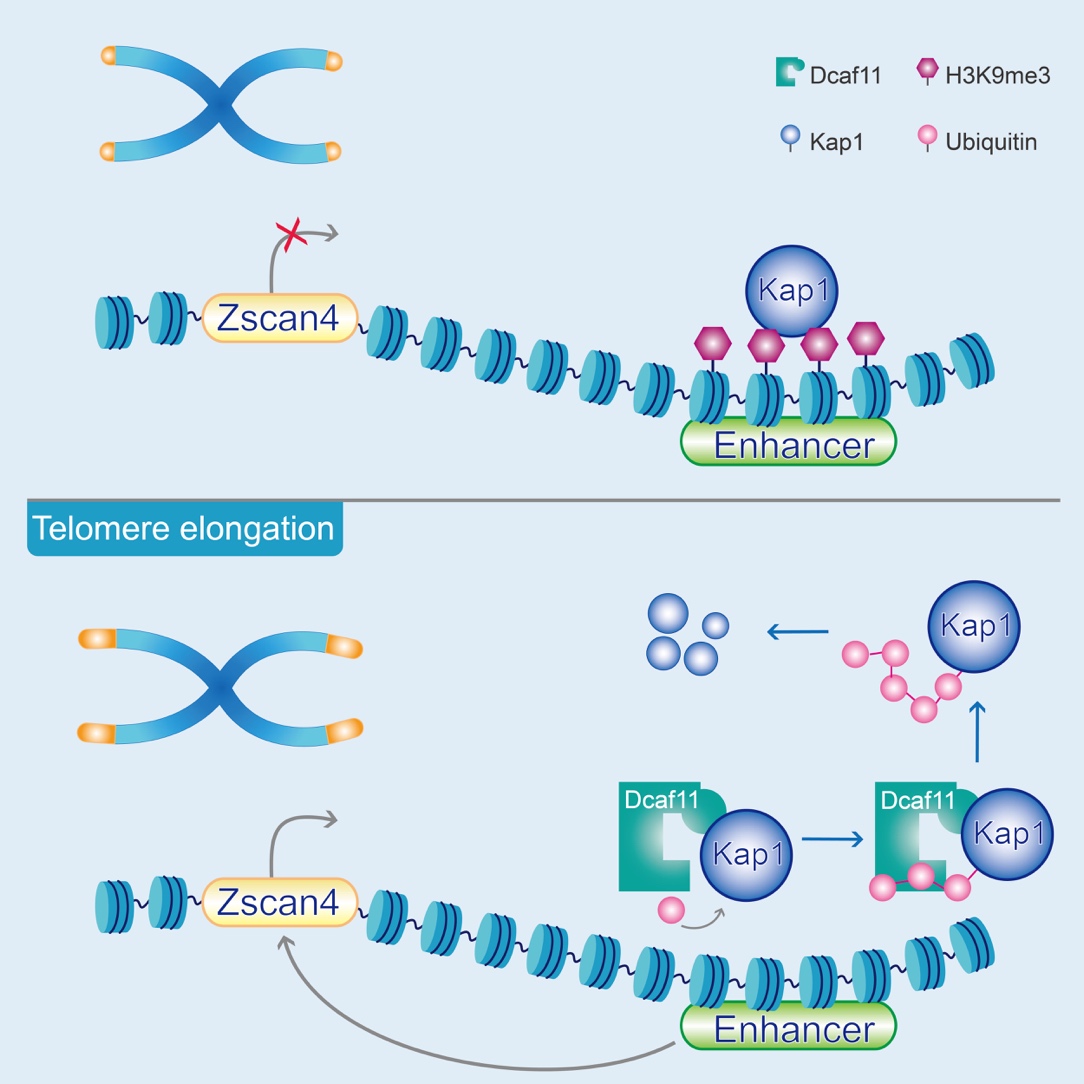
该研究在小鼠胚胎干细胞中进行了ALT相关因子的筛选,发现Dcaf11在小鼠早期胚胎和胚胎干细胞ALT介导的端粒延伸和维持中发挥重要作用。Dcaf11缺失会导致小鼠端粒缩短,进而引发小鼠骨髓造血干细胞功能异常和应激状态下损伤修复能力的显著下降。随后,研究人员研究了Dcaf11的互作蛋白,发现Dcaf11可促进Kap1(一种转录中介因子,在诸多转录调控复合体中起桥梁作用)的泛素化(指一类低分子量的蛋白质分子在一系列特殊的酶作用下,将细胞内的蛋白质分类,从中选出靶蛋白分子,并对靶蛋白进行特异性修饰的过程)降解,进而激活ALT相关基因Zscan4(在早期胚胎和胚胎干细胞中发挥重要作用,端粒延伸是其中一个重要作用)的表达。研究成果揭示了早期胚胎ALT过程中的关键因子及作用机制,为进一步理解早期胚胎ALT机制提供了重要线索。
据悉,2014年,高绍荣课题组的乐融融博士利用端粒酶敲除小鼠模型研究了核移植技术、iPS(人工诱导多能干细胞)技术重编程端粒缺陷的能力,研究表明早期胚胎中存在高效修复供体细胞端粒缺陷的ALT因子。但是,ALT为何能修复端粒缺陷,机制还尚不明晰。
Dcaf11对Zscan4激活、胚胎发育以及端粒延长和维持的影响
为了解答这个问题,课题组利用高灵敏的蛋白定量质谱技术,检测了小鼠植入前胚胎受精卵、2-细胞、4-细胞、8-细胞、桑葚胚和囊胚等六个时期的蛋白质组信息,成功确认了植入前胚胎中四千多个蛋白的含量变化信息,并首次绘制了小鼠植入前胚胎蛋白质组动态图谱。在此基础上,课题组成员进一步筛选ALT相关基因,结果发现 Dcaf11可显著提高胚胎干细胞ALT的活跃程度。
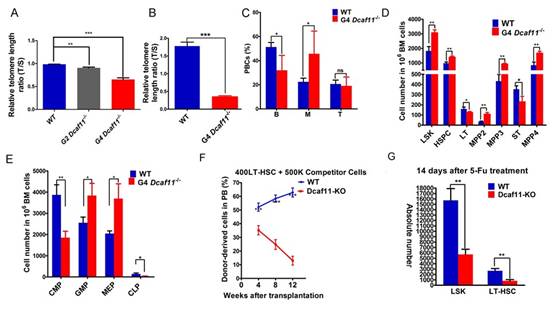
为了进一步验证这一新发现,研究人员敲除了小鼠的Dcaf11基因。缺失了Dcaf11的小鼠胚胎发育率明显下降、基因表达出现异常、卵裂期胚胎端粒延伸速率明显下降。随着Dcaf11敲除小鼠代数的递增,小鼠端粒一代一代逐渐缩短。晚代小鼠骨髓造血干细胞的造血重建能力、应激状态下的损伤修复能力都显著下降。
Dcaf11敲除小鼠骨髓造血干细胞造血重建能力和损伤修复能力显著下降
研究人员进一步研究Dcaf11促进端粒延长机制发现,Dcaf11作为E3泛素连接酶(是一个能够将泛素分子连接到目的蛋白质的某个赖氨酸上的酶)的识别蛋白,靶向底物Kap1(转录调控中的一个桥梁分子)并促进其降解。在Dcaf11敲除的ESC(胚胎干细胞)中,敲降Kap1后可重新激活Zscan4,进而修复Dcaf11缺失而引发的端粒缺陷,激活端粒延伸机制。
乐融融介绍,这项研究为进一步理解早期胚胎端粒延伸和调控机制提供重要线索,其成果将有助于揭示人类衰老之谜,并找到长寿的钥匙。
据了解,同济大学高绍荣课题组助理教授乐融融、直博生黄忆鑫、助理研究员张艳平、暨南大学鞠振宇课题组教授汪虎、同济大学高绍荣课题组硕士生林嘉明为该论文的共同第一作者,高绍荣教授、鞠振宇教授、乐融融助理教授为共同通讯作者。(程国政)
