
 , 王一鸣, 李帅平
, 王一鸣, 李帅平 东北大学 材料科学与工程学院, 辽宁 沈阳 110819
收稿日期:2020-09-25
基金项目:辽宁省自然科学基金资助项目(2016020028)。
作者简介:张雅静(1964-),女,辽宁沈阳人,东北大学副教授。
摘要:通过机械合金化、粉末压坯及热挤压的方法制备了医用可降解Fe30MnxCa(x=0, 1.5, 3.0, 4.5)合金棒材, 运用金相显微镜、SEM、拉伸测试、电化学测试和SBF浸泡腐蚀等研究了Ca的添加对合金组织及性能的影响.结果发现, Fe30MnxCa合金均由奥氏体组成, 且随着Ca质量分数增加, 该合金硬度增加, 伸长率和强度降低, 降解性能显著提高, 腐蚀速率从Fe30Mn的0.113 0 mg/(cm2·d)增至Fe30Mn4.5Ca的0.226 0 mg/(cm2·d).细胞毒性实验表明其生物相容性为0~1级.
关键词:机械合金化可降解金属Fe30MnxCa合金腐蚀速率生物相容性
Preparation and Properties of Biodegradable Fe30MnxCa Alloys
ZHANG Ya-jing

 , WANG Yi-ming, LI Shuai-ping
, WANG Yi-ming, LI Shuai-ping School of Material Science & Engineering, Northeastern University, Shenyang 110819, China
Corresponding author: ZHANG Ya-jing, E-mail: Zhangyj@smm.neu.edu.cn.
Abstract: The medical degradable Fe30MnxCa(x=0, 1.5, 3.0 and 4.5)alloy bars were prepared by mechanical alloying, powder pressing and hot extrusion. The effect of Ca addition on the microstructure and properties of the alloy was studied by optical metallographic microscope, scanning electron microscope (SEM), tensile test, electrochemical test and SBF solution immersion corrosion test. The results show that the Fe30MnxCa alloy is composed by the austenite phase and with the increasing mass fraction of Ca, the hardness increases, and the tensile strength and final elongation decrease.Meanwhile, the degradation performance of the alloy is significantly improved, where the corrosion rate increases from 0.113 0 mg/(cm2·d)of Fe30Mn to 0.226 0 mg/(cm2·d)of Fe30Mn4.5Ca in the corrosion tests. The cytotoxicity test indicates that the biocompatibility is 0 ~ 1 grade.
Key words: mechanical alloyingbiodegradable metalFe30MnxCa alloycorrosion ratebiocompatibility
在心血管支架材料研究领域, 能在早期为损伤血管提供足够的力学支撑, 且在完成血管修复任务后不引起局部和系统毒性的前提下, 以合适的速度被机体降解吸收的可降解金属材料是人们关注的焦点[1-2].Fe及Fe合金由于具有优异的力学性能、良好的生物相容性和可降解性而备受关注[3-5].
铁基材料的铁磁性和植入机体后降解慢的问题一直困扰着人们[6], 近年来, Fe-Mn系合金以优异的机械性能和腐蚀性能以及良好的核磁共振相容性得到了广泛研究[7-16], 研究者尝试添加Si, C, Ag及Cu等元素加速其降解并改善生物相容性[10-15].国内外很少有报道Ca元素的添加, 而Ca作为人体中含量最多的无机盐组成元素, 其标准电极电位(-2.80 V)和密度明显低于Fe(-0.44 V), 可以降低合金的腐蚀电位, 有效提高合金降解性能, 并降低合金密度[16].为进一步探究铁基生物可降解合金的可行性, 本文采用机械合金化的方法制备Fe30MnxCa合金, 并研究添加不同含量的Ca对合金组织和性能的影响.
1 实验材料及方法1.1 实验材料及测试实验设计了Fe30MnxCa合金(x=0, 1.5, 3.0, 4.5), 实验原料为Fe粉(纯度99.97%)、Mn粉(纯度99.92%)及Ca粉(纯度99.95%).采用QM-3SP4行星式球磨机进行球磨, 加入1g硬脂酸作为过程控制剂; 粉末压坯后在YH032-200型多功能粉末固结系统中加热至1 150 ℃, 保温1 min后挤压成直径为10 mm的棒材, 挤压比9∶1.
采用OLYMPUS DSX500型金相显微镜进行金相组织观察; 采用RIGAKU-3014型X射线衍射仪分析合金的相组成;使用ZEISS Ultra Plus场发射扫描电镜对合金样品进行微观组织特征观察和能谱检测; 样品的硬度在401MVDTM型数显硬度仪下检测; 拉伸测试在AG-X plus型电子万能试验机上进行.
本实验利用CHI660E型电化学工作站对合金样品进行动电位极化和阻抗谱测试.极化曲线以动电位扫描法进行测定, 扫描速率设定为5×10-4 V/s, 扫描电压范围为-1.2~-0.4 V.阻抗测试采用幅值为5 mV的正弦波交流信号, 测试频率范围为1 MHz~0.01 Hz.于36.5 ℃的恒温培养箱中采用人体模拟体液(SBF)浸泡样品60 d, 并测量浸泡前后质量, 浸泡结束后对样品表面腐蚀产物进行扫描检测.腐蚀速率计算公式见式(1):
 | (1) |
1.2 细胞毒性实验1.2.1 样品制备及细胞培养选取生长状态良好的人脐静脉血管内皮细胞(HUVEC), 配制成1×104个细胞/mL的细胞悬液, 注入96孔培养板, 每孔100 μL, 共接种3块培养板, 置于细胞培养箱(37 ℃, 5%CO2)培养, 24 h后弃去培养液.阴性对照组加入单纯的10%胎牛血清(FBS)+1 640培养液.浸提液按合金样品表面积与浸提液介质体积比为1.25 cm2/mL配制,将浸提液稀释12.5%, 25%, 50%和100%备用.
1.2.2 细胞毒性评价于倒置显微镜下观察培养0, 24 h后的细胞形态, 然后将CCK8液注入96孔板中, 孵育2 h后, 用酶表检测仪在波长450 nm处测量其吸光度.最后计算细胞相对增殖率(RGR), 计算如式(2)所示:
 | (2) |
表 1(Table 1)
| 表 1 细胞毒性评价标准 Table 1 Cytotoxicity evaluation criteria |
2 实验结果及分析2.1 物相及微观组织分析图 1为合金样品物相检测结果, 可以发现, Fe30MnxCa合金均由单相奥氏体组成; 加Ca后的合金未出现第二相和单质Ca的衍射峰, 且随着Ca质量分数的增加, 合金衍射峰向低角度方向偏移程度增加.表 2为计算得出的合金的晶面间距, 随着Ca质量分数的增加, 各晶面间距均相应地变大.说明Ca一定程度上固溶于Fe30Mn合金基体中, 使得基体晶格常数增大, 随着Ca添加量的增加, 其固溶量增加.
图 1(Fig. 1)
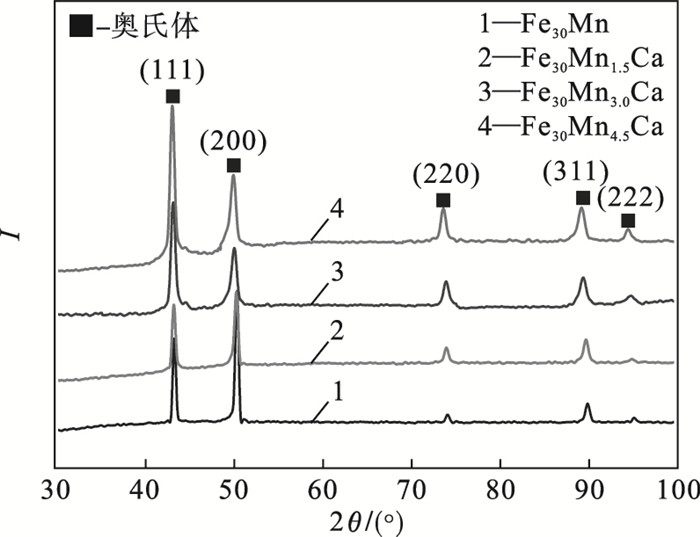 | 图 1 Fe30MnxCa合金样品XRD图谱Fig.1 The XRD patterns of Fe30MnxCa samples |
表 2(Table 2)
| 表 2 Fe30MnxCa合金的晶面间距 Table 2 Interplanar distance of Fe30MnxCa samples? | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
图 2为Fe30MnxCa合金样品的金相组织.可以看出, 合金横截面晶粒为等轴状, 并存在分散的夹杂物和微孔, 其数量随Ca含量的增加而增加; 由纵截面组织发现, 夹杂物沿挤压方向呈絮状分布, 这是由夹杂物在挤压变形过程中被拉长、破碎, 并沿挤压方向移动所造成.机械合金化过程中杂质的引入不可避免, 但通常所引入的杂质含量较小[17].从Fe30Mn合金的纵截面图可以看到, 部分晶粒内有滑移带存在.
图 2(Fig. 2)
 | 图 2 Fe30MnxCa合金样品微观组织Fig.2 Microstructure of Fe30MnxCa samples (a)-Fe30Mn; (b)-Fe30Mn1.5Ca; (c)-Fe30Mn3.0Ca; (d)-Fe30Mn4.5Ca; 1-横截面金相组织; 2-纵截面金相组织. |
图 3为Fe30Mn1.5Ca合金横截面扫描照片及EDS检测结果.可以看出, 合金表面存在明显的不规则孔洞, 这是一种典型的烧结特征; 同时分布有亮灰色的夹杂物.对沿晶界分布的夹杂物进行EDS分析, 发现夹杂物含有的元素主要为O, Mn和Ca, 推测为Mn和Ca的氧化物, 可能是由于实验过程中有较高表面能的粉末与氧气接触生成的氧化物.
图 3(Fig. 3)
 | 图 3 Fe30Mn1.5Ca合金SEM和EDS测试结果Fig.3 SEM images and EDS analysis of Fe30Mn1.5Ca alloy (a)-低倍SEM; (b)-高倍SEM. |
2.2 力学性能表 3为合金力学性能.从表 3可以看出, 随着Ca含量增加, 合金硬度从284.1 HV增至338.4 HV, 可能是Ca固溶于合金基体中, 起到了固溶强化作用; 以及组织中分散存在的夹杂物, 起到弥散强化作用.抗拉强度和屈服强度随Ca含量的增加而下降, 其中1.5%Ca和3.0%Ca合金强度符合心血管支架材料强度要求; 伸长率显著降低, 数值范围在0.9%~2.0%低于心血管支架材料伸长率的要求, 合金由韧性断裂转变为脆性断裂; 这归因于组织中夹杂物和孔隙的存在.夹杂物沿基体晶界位置分布, 提供了更多断裂裂纹萌生位置, 使合金在变形过程中更易断裂; 孔隙则是材料内部薄弱部位, 在拉伸时会造成应力集中, 使得材料抵抗塑性变形的能力大大降低[18].随着Ca含量增加, 夹杂物数量增多, 而夹杂物在热挤压过程中对基体金属流动性的影响和在挤出棒材冷却过程中与基体金属的收缩不一致性, 使得材料在热挤压过程中易产生孔隙, 孔隙率从4.4%增至8.9%.拉伸断口可以看到明显的单颗粒和许多孔洞(烧结孔)存在, 说明组织中存在的夹杂物严重影响了颗粒界面转化, 使得颗粒界面结合强度不足, 进而引起脆断.综上分析, 材料强度和伸长率降低主要是由夹杂物数量和孔隙率的增加所造成.合金材料的力学性能(特别是伸长率)可以通过制备工艺的进一步优化来提高.
表 3(Table 3)
| 表 3 Ca含量对Fe30MnxCa合金力学性能的影响 Table 3 Effect of Ca content on mechanical properties of Fe30MnxCa alloy |
2.3 金属的耐蚀性能2.3.1 电化学测试图 4为合金试样在SBF中的极化曲线和阻抗谱.各合金的极化曲线形状相似, 表明其腐蚀机理相同.腐蚀电位和腐蚀电流密度可以从曲线中得出, 经计算发现, Fe30MnxCa合金的腐蚀电位随Ca含量的增加而降低, 从Fe30Mn的-0.711 V降至Fe30Mn4.5Ca的-0.777 V, 表明其热力学腐蚀倾向提高; 腐蚀电流密度随着Ca含量增加而增加, 从Fe30Mn的5.57 μA/cm2增至Fe30Mn4.5Ca的13.81 μA/cm2, 表明其动力学腐蚀倾向提高.上述结果验证了Ca的添加可以提高Fe30Mn合金的降解性能.
图 4(Fig. 4)
 | 图 4 Fe30MnxCa合金试样在SBF中的极化曲线与阻抗谱Fig.4 Polarization curves and electrochemical impedance spectroscopies of Fe30MnxCa alloy in the SBF (a)-极化曲线;(b)-阻抗谱. |
合金试样的电荷转移电阻和表面膜层电阻与容抗弧直径成正比[19-20].据图 4b所示阻抗谱, 容抗弧半径均随着Ca含量的增加而减小, 表明其耐蚀性降低, 降解速率提高, 这与极化测试结果一致.
2.3.2 浸泡腐蚀结果分析体外静态模拟腐蚀实验表明, 随着Ca含量增加, Fe30MnxCa(x=0, 1.5, 3.0, 4.5)合金腐蚀速率逐渐加快, 分别为0.113 0, 0.141 3, 0.200 9, 0.226 0 mg/(cm2·d), 这与电化学测试结果趋势一致, 表明Ca元素对合金材料的腐蚀性能具有促进作用.这是由于Ca的固溶降低合金的腐蚀电位, 增加腐蚀倾向; 同时孔隙率的增加提高基体材料与腐蚀溶液接触面积, 进而加快腐蚀速率; 且孔隙结构的存在使合金产生了缝隙腐蚀, 显著提高合金的降解性能[21]; 此外, 随着Ca含量增加, 合金中的缺陷和夹杂物增加, 缺陷的存在增加了应力腐蚀的可能性, 夹杂物的增多则提供了更多原电池反应位置.本实验中腐蚀溶液为静态, 仅反映合金初始腐蚀情况, 当支架植入体内后, 材料暴露于流动的液体中, 降解过程将加速.
图 5为Fe30Mn1.5Ca合金浸泡腐蚀产物的SEM检测形貌图和EDS检测结果.分析发现, 合金试样长期浸泡在模拟体液中, 表面形成的腐蚀产物大致分为两种类型: 一种是在试样表面形成的具有一定厚度的偏黑色膜层; 另一种呈白色絮状或颗粒状, 沉积在膜层表面.能谱检测发现腐蚀产物中含有Ca, P, O, Cl, Fe和Mn等元素; 腐蚀产物可能为含钙磷氧化合物(如Ca3(PO4)2), 以及Fe, Mn的磷酸盐[22].
图 5(Fig. 5)
 | 图 5 Fe30Mn1.5Ca合金浸泡腐蚀产物的SEM和EDS检测结果Fig.5 SEM images and EDS analysis of corrosion products of Fe30Mn1.5Ca alloy (a)-低倍SEM;(b)-高倍SEM. |
2.4 细胞毒性分析将人脐静脉血管内皮细胞(HUVEC)置于Fe30MnxCa合金的不同浓度浸提液下培养24 h, 得出实验组与阴性对照组细胞活性的细胞相对增殖率对比结果, 如图 6所示.可以发现, 各合金不同浓度浸提液在培养HUVEC上总体表现出较好的生物相容性, 各浸提液中的细胞生长活性均随着Ca含量的增加先升高后降低, 细胞毒性等级为0~1级, 满足细胞毒性要求, 其中Fe30Mn1.5Ca合金细胞相对增殖率在各种浓度下为最高(在98%以上), 表现出最好的生物相容性.这可能是因为少量Ca的加入改善了Fe30Mn合金的生物相容性, 若Ca过多则使浸提液的碱性增加(浸泡实验结果随Ca含量增加, SBF的pH值增加), 对细胞培养产生不利影响.
图 6(Fig. 6)
 | 图 6 细胞在Fe30MnxCa合金的浸提液中培养24 h后的生长活性Fig.6 Cell viability cultured in Fe30Mnx Ca alloy extraction medium for 24 h |
图 7为HUVEC在Fe30Mn1.5Ca合金试样各浓度浸提液下培养0, 24 h后的细胞形态照片.可以看出, 细胞贴壁生长, 形态正常, 生长良好.相比于0 h, 培养24 h后的细胞密集程度增加.与阴性对照组细胞相比, 合金浸提液下的细胞增殖的数量略有增加, 细胞形态无明显差别.各培养液中均出现一定的细胞皱缩现象, 这属于正常的细胞凋亡.
图 7(Fig. 7)
 | 图 7 人脐静脉血管内皮细胞在Fe30Mn1.5Ca合金各浓度浸提液中培养后的形态照片Fig.7 The morphology of HUVEC cultured in Fe30Mn1.5 Ca alloy extraction medium (a)-阴性对照组; (b)-12.5%; (c)-25%; (d)-50%; (e)-100%;1-培养0 h; 2-培养24 h. |
3 结论1) Fe30MnxCa(x=0, 1.5, 3.0, 4.5)合金均由奥氏体单相组成, 具有良好的核磁共振相容性.随Ca含量增加, 合金的硬度提高、抗拉强度及塑性降低, 合金的自腐蚀电位逐渐降低, 腐蚀电流密度逐渐增加, 阻抗减小, 浸泡腐蚀速率从0.113 0 mg/(cm2·d)增至0.226 0 mg/(cm2·d), 降解性能显著提高.
2) 细胞毒性实验表明, Fe30MnxCa合金均具有良好的生物相容性, 细胞毒性等级在0~1级, 均满足医用材料细胞毒性要求, 其中Fe30Mn1.5Ca合金生物相容性最佳.
参考文献
| [1] | Hermawan H, Dubé D, Mantovani D. Developments in metallic biodegradable stents[J]. Acta Biomaterialia, 2010, 6(5): 1693-1697. DOI:10.1016/j.actbio.2009.10.006 |
| [2] | Zheng Y F, Gu X N, Witte F. Biodegradable metals[J]. Materials Science & Engineering: R, 2014, 77(2): 1-34. |
| [3] | Peuster M, Hesse C, Schloo T, et al. Long-term biocompatibility of a corrodible peripheral iron stent in the porcine descending aorta[J]. Biomaterials, 2006, 27(28): 4955-4962. DOI:10.1016/j.biomaterials.2006.05.029 |
| [4] | Zhang E, Chen H, Shen F. Biocorrosion properties and blood and cell compatibility of pure iron as a biodegradable biomaterial[J]. Journal of Materials Science, 2010, 21(7): 2151-2163. DOI:10.1007/s10856-010-4070-0 |
| [5] | Francis A, Yang Y, Virtanen S, et al. Iron and iron-based alloys for temporary cardiovascular applications[J]. Journal of Materials Science: Materials in Medicine, 2015, 26(3): 1-16. DOI:10.1007/s10856-015-5473-8 |
| [6] | Liu R Y, He R G, Xu L Q, et al. Design of Fe-Mn-Ag alloys as potential candidates for biodegradable metals[J]. Acta Metallurgica Sinica (English Letters), 2018, 31(6): 584-590. DOI:10.1007/s40195-018-0702-z |
| [7] | Hermawan H, Dub D, Mantovani D. Degradable metallic biomaterials: design and development of Fe-Mn alloys for stents[J]. Journal of Biomedical Materials Research: Part A, 2010, 93(1): 1-11. |
| [8] | Hermawan H, Purnama A, Dube D, et al. Fe-Mn alloys for metallic biodegradable stents: degradation and cell viability studies[J]. Acta Biomaterialia, 2010, 6(5): 1852-1860. DOI:10.1016/j.actbio.2009.11.025 |
| [9] | Till J, Eckhard Q, Christiane Z. Magnetron sputtering as a fabrication method for a biodegradable Fe32Mn alloy[J]. Materials, 2017, 10(10): 1196. DOI:10.3390/ma10101196 |
| [10] | Liu B, Zheng Y F, Ruan L. In vitro investigation of Fe30Mn6Si shape memory alloy as potential biodegradable metallic material[J]. Materials Letters, 2011, 65(3): 540-543. DOI:10.1016/j.matlet.2010.10.068 |
| [11] | Mouzou E, Paternoster C, Tolouei R, et al. In vitro degradation behavior of Fe-20Mn-1.2C alloy in three different pseudo-physiological solutions[J]. Materials Science & Engineering: C, 2016, 61: 564-573. |
| [12] | Hufenbach J, Kochta F, Wendrock H, et al. S and B microalloying of biodegradable Fe-30Mn-1C-Effects on microstructure, tensile properties, in vitro degradation and cytotoxicity[J]. Materials & Design, 2018, 142: 22-35. |
| [13] | Liu R Y, He R G, Xu L Q, et al. Design of Fe-Mn-Ag alloys as potential candidates for biodegradable metals[J]. Acta Metallurgica Sinica (English Letters), 2018, 31(6): 584-590. DOI:10.1007/s40195-018-0702-z |
| [14] | Bagha P S, Khakbiz M, Sheibani S, et al. In vitro degradation, hemocompatibility, and cytocompatibility of nanostructured absorbable Fe-Mn-Ag alloys for biomedical application[J]. ACS Biomaterials Science and Engineering, 2020, 6(4): 2094-2106. DOI:10.1021/acsbiomaterials.0c00263 |
| [15] | Zheng M, Ming G, Di N, et al. Study on a biodegradable antibacterial Fe-Mn-C-Cu alloy as urinary implant material[J]. Materials Science and Engineering: C, 2019, 103: 1-8. |
| [16] | Hong D, Chou D T, Velikokhatnyi O I, et al. Binder-jetting 3D printing and alloy development of new biodegradable Fe-Mn-Ca/Mg alloys[J]. Acta Biomaterialia, 2016, 45(1): 375-386. |
| [17] | 陆山. 可生物降解Fe-Zn合金的粉末治金法制备及性能研究[D]. 大连: 大连理工大学, 2012. (Lu Shan.Preparation of powder metallurgy and properties investigation of biodegradable Fe-Zn alloy[D].Dalian: Dalian University of Technology, 2012. ) |
| [18] | Xu Z, Hodgson M A, Cao P. A comparative study of powder metallurgical (PM) and wrought Fe-Mn-Si alloys[J]. Materials Science & Engineering: A, 2015, 630(1): 116-124. |
| [19] | Zucchi F, Grassi V, Frignani A, et al. Electrochemical behaviour of a magnesium alloy containing rare earth elements[J]. Journal of Applied Electrochemistry, 2006, 36(2): 195-204. DOI:10.1007/s10800-005-9053-3 |
| [20] | Pebere N, Riera C, Dabosi F. Investigation of magnesium corrosion in aerated sodium sulfate solution by electrochemical impedance spectroscopy[J]. Electrochimica Acta, 1990, 35(2): 555-561. DOI:10.1016/0013-4686(90)87043-2 |
| [21] | 马政, 陆喜, 高明, 等. 缝隙腐蚀对Fe-30M-1C合金降解速率的影响[J]. 金属学报, 2018, 54(7): 1010-1018. (Ma Zheng, Lu Xi, Gao Ming, et al. Effect of crevice corrosion on the degradation rate of Fe-30Mn-1C alloy[J]. Acta Metallurgica Sinica, 2018, 54(7): 1010-1018.) |
| [22] | Hermawan H, Dubé D, Mantovani D. Development of degradable Fe-35Mn alloy for biomedical application[J]. Advanced Materials Research, 2006, 15(6): 107-112. |
