Ribonuclease(RNase)P是一类古老的核酸内切酶,它广泛的存在于所有生命体中。RNaseP通过切割pre-tRNA5’端序列促使tRNA成熟,该过程在蛋白质合成及维系细胞功能占据十分重要的地位。真核RNaseP是由一个单链RNA分子和十几个蛋白复合体组成的重要生物分子机器。
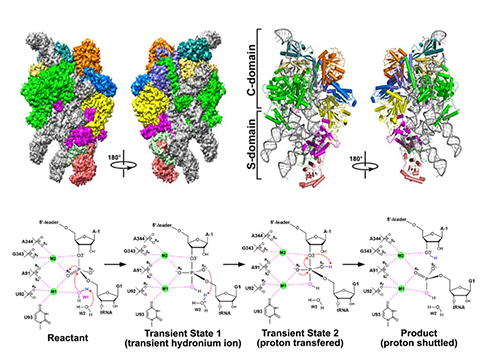
在本研究中,雷鸣团队成功解析了酵母内源RNaseP全酶及其与底物pre-tRNA的复合物结构,该结构揭示了真核生物中RNaseP各亚基在空间上原子分辨率的组织形式。李国辉团队通过分子动力学模拟揭示了不同组成蛋白对于核酶自身不同部位的稳定性具有不同的作用;并结合QM/MM/MD模拟及自由能计算分析了RNaseP催化反应机理,提出了水分子介导的的双镁离子催化的SN2反应模型,深入阐明了这一类古老核酶的催化微观机理。
该研究工作不仅清楚地理解了真核生物RNaseP催化底物tRNA前体切割成熟的分子机制,也为了解以RNA为基础的核糖核蛋白复合体的催化共性、底物tRNA的分子识别机理及RNA核酶的生物进化过程提供了新的认知。
该研究工作得到国家自然科学基金和中国科学院战略性先导科技专项项目资助。(文/图 张跃斌、李国辉)
