在当前的蛋白质研究中,ABC转运蛋白(ATP Binding Cassette Transporters)的作用得到了越来越多的重视。该蛋白是一个包含200多种蛋白的超家族,在一系列真核和原核生物中均有表达,其中B、C及G家族成员,即ABCBs(包括Mdr1与Bsep等)、ABCCs(如Mrps)及ABCGs(如Bcrp)参与了外源物的外排。这些蛋白主要分布于肝脏、肾脏以及血脑屏障等器官组织中,可在化学污染物与药物等存在的情况下被诱导表达,通过ATP水解供能,逆浓度将这些外源物及其代谢产物泵到细胞外,从而起到机体保护的作用。
那么,ABC转运蛋白对量子点是否起着同样的外排作用呢?苏州医工所蛋白质组学中心应用肝肾细胞及合成的CdTe量子点对这个问题进行了研究。研究发现ABC转运蛋白的表达水平在该量子点处理后显著提高,而ABC转运蛋白活性的改变也会显著影响该量子点在细胞中的积累量。从而表明作为一种细胞自我保护的形式,ABC转运蛋白介导了量子点的外排。
本研究的成果可作为量子点开发与应用的重要依据。该结论还可进一步推广用于其他结构量子点、纳米晶及纳米管等材料的细胞外排研究中,从而作为纳米材料开发的重要依据,保证其在生物学实验中更安全有效地应用。
相关成果已发表(Toxicol Appl Pharmacol, 2016, 303:11-20. IF= 3.705)。
以上工作得到了国家自然科学基金“应用斑马鱼模型研究ABC转运蛋白在多化学污染物抵御中的作用”(No. 21307154)及863项目“用于蛋白质相互作用研究的能量转移时间分辨荧光分子标记技术”(No. 2014AA020905)的支持。
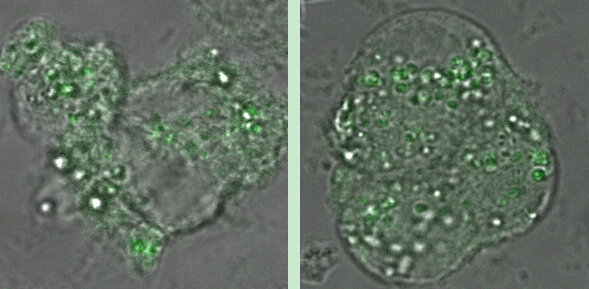
图1:CdTe量子点在细胞中的聚集情况:肝细胞系(左),肾细胞系(右)。
