张润峰,徐欣东,王清,陈山
(广西大学 轻工与食品工程学院,南宁 530004)
摘要:
近年来,氧化铁纳米粒子(Iron Oxide Nanoparticles,IONPs)由于具有超顺磁性、生物相容性、比表面积大、易分离等特点而备受科学界关注。然而,裸露的IONPs容易聚集和氧化而失去其应有的特性,采用多糖进行涂覆不仅能提高IONPs的稳定性和生物相容性,还能通过多糖与其他生物活性物质结合,赋予INOPs新的功能。多糖涂覆的IONPs充分结合了多糖的生化特性与磁芯的理化特性,在药物递送中展现出巨大的应用潜力。本文综述了多糖涂覆IONPs的合成方法、合成过程的影响因素、多糖与IONPs的结合机理及其在药物递送中的应用,最后对多糖涂覆的IONPs的合成及其在药物递送方面的应用进行了总结和展望。
关键词: 多糖 氧化铁 纳米粒子 合成 药物递送
DOI:10.11951/j.issn.1005-0299.20210061
分类号:TB333
文献标识码:A
基金项目:国家自然科学基金地区科学基金资助项目(21768001).
Research progress on synthesis of polysaccharide-coated iron oxide nanoparticles and their drug delivery applications
ZHANG Runfeng, XU Xindong, WANG Qing, CHEN Shan
(College of Light Industry and Food Engineering, Guangxi University, Nanning 530004, China)
Abstract:
In recent years, iron oxide nanoparticles (IONPs) have attracted much attentiondue to their unique properties, such as superparamagnetism, biocompatible, great specific surface area, and ease of separation. However,bare IONPs tend to lose their natural properties because of aggregation and oxidation. Polysaccharide coating not only improves the stability and biocompatible of IONPs, but also confers new functions on INOPs by combining with other bioactive substances.Polysaccharide-coated IONPs fully combine the biochemical properties of polysaccharides and the physical and chemical properties of magnetic cores, revealing great potential for drug delivery. This paper reviews the synthesis methods of polysaccharide-coated IONPs, the influencing factors of the synthesis process, the binding mechanism of polysaccharides and IONPs and its application in drug delivery.Finally, the synthesis of polysaccharide-coated IONPs and their application in drug delivery are summarized and prospected.
Key words: polysaccharide iron oxide nanoparticles synthesis drug delivery
张润峰, 徐欣东, 王清, 陈山. 多糖涂覆的氧化铁纳米粒子的合成及其药物递送应用研究进展[J]. 材料科学与工艺, 2021, 29(5): 9-22. DOI: 10.11951/j.issn.1005-0299.20210061.

ZHANG Runfeng, XU Xindong, WANG Qing, CHEN Shan. Research progress on synthesis of polysaccharide-coated iron oxide nanoparticles and their drug delivery applications[J]. Materials Science and Technology, 2021, 29(5): 9-22. DOI: 10.11951/j.issn.1005-0299.20210061.

基金项目 国家自然科学基金地区科学基金资助项目(21768001) 通信作者 陈山,E-mail:chenshan@gxu.edu.cn 作者简介 张润峰(1997—),男,硕士研究生 文章历史 收稿日期: 2021-04-02 网络出版日期: 2021-06-16
Contents Abstract Full text Figures/Tables PDF
多糖涂覆的氧化铁纳米粒子的合成及其药物递送应用研究进展
张润峰, 徐欣东, 王清, 陈山


广西大学 轻工与食品工程学院,南宁 530004
收稿日期: 2021-04-02; 网络出版日期: 2021-06-16
基金项目: 国家自然科学基金地区科学基金资助项目(21768001)
作者简介: 张润峰(1997—),男,硕士研究生.
通信作者: 陈山,E-mail:chenshan@gxu.edu.cn.
摘要: 近年来,氧化铁纳米粒子(Iron Oxide Nanoparticles,IONPs)由于具有超顺磁性、生物相容性、比表面积大、易分离等特点而备受科学界关注。然而,裸露的IONPs容易聚集和氧化而失去其应有的特性,采用多糖进行涂覆不仅能提高IONPs的稳定性和生物相容性,还能通过多糖与其他生物活性物质结合,赋予INOPs新的功能。多糖涂覆的IONPs充分结合了多糖的生化特性与磁芯的理化特性,在药物递送中展现出巨大的应用潜力。本文综述了多糖涂覆IONPs的合成方法、合成过程的影响因素、多糖与IONPs的结合机理及其在药物递送中的应用,最后对多糖涂覆的IONPs的合成及其在药物递送方面的应用进行了总结和展望。
关键词: 多糖 氧化铁 纳米粒子 合成 药物递送
Research progress on synthesis of polysaccharide-coated iron oxide nanoparticles and their drug delivery applications
ZHANG Runfeng, XU Xindong, WANG Qing, CHEN Shan


College of Light Industry and Food Engineering, Guangxi University, Nanning 530004, China
Abstract: In recent years, iron oxide nanoparticles (IONPs) have attracted much attentiondue to their unique properties, such as superparamagnetism, biocompatible, great specific surface area, and ease of separation. However, bare IONPs tend to lose their natural properties because of aggregation and oxidation. Polysaccharide coating not only improves the stability and biocompatible of IONPs, but also confers new functions on INOPs by combining with other bioactive substances.Polysaccharide-coated IONPs fully combine the biochemical properties of polysaccharides and the physical and chemical properties of magnetic cores, revealing great potential for drug delivery. This paper reviews the synthesis methods of polysaccharide-coated IONPs, the influencing factors of the synthesis process, the binding mechanism of polysaccharides and IONPs and its application in drug delivery.Finally, the synthesis of polysaccharide-coated IONPs and their application in drug delivery are summarized and prospected.
Keywords: polysaccharide iron oxide nanoparticles synthesis drug delivery
IONPs由铁磁性材料组成,当IONPs的尺寸小于25 nm时,能够在室温下表现出超顺磁性,而且其磁性只在外部磁场存在的情况下产生,从而可以通过改变外部磁场对其进行操控。具有超顺磁性的IONPs主要指Fe3O4和γ-Fe2O3,二者由于生物相容性、比表面积大、易分离等独特性能而使其在生物、医学、材料和环境等领域有着广泛的应用[1-3]。纳米粒子的生物活性在很大程度上取决于纳米粒子的大小、形状、组成和表面特性。当粒子的粒径>200 nm时,将其应用在生物体内时会被网状内皮系统(RES)清除并且可能对组织产生高浓度的毒害作用,且裸露的IONPs还容易被氧化导致失去磁性而难以应用,所以IONPs的稳定性、团聚和氧化失磁仍然是具有挑战性的问题[4-5]。解决方法之一是用生物相容性的聚合物(例如聚乙二醇、聚N-乙烯基-2-吡咯烷酮、多糖、聚丙烯酰胺和聚乙烯醇)来涂覆IONPs,以防止原始结构的改变、大聚集物的形成以及暴露于生物系统时的降解[6-8]。
涂层的选择会对IONPs的合成及应用产生重要的影响。多糖是一种由10个以上的单糖通过糖苷键结合在一起的天然高分子聚合物,广泛存在于自然界中,可以从动物、植物以及微生物中获取,是一种经济易得的可再生资源。此外,由于多糖具有生物相容性、无毒性、分子识别功能以及允许进一步功能化的化学基团而被认为是IONPs的理想涂覆材料。在合成的过程中加入多糖可以对IONPs的合成进行调控,而且多糖的涂覆可以增强IONPs生物相容性、靶向特异性以及降低毒性[9-13]。涂覆在IONPs上的多糖还易于与其他活性物质结合,从而赋予IONPs更多新的功能[14-16]。多糖涂覆的IONPs目前在核磁共振成像[17-18]、磁热疗[19-20]、药物递送[21-23]、酶的固定化[24-25]以及污染物的吸附[26-27]等方面已有广泛的研究与应用。其中,多糖涂覆的IONPs在药物递送中的应用充分结合了IONPs的理化特性以及多糖的生化特性,在药物递送中能够产生协同作用,实现药物在目标组织的释放,提高了药物的药效并减小了毒副作用,是多糖涂覆的IONPs功能的重要体现。将IONPs与多糖结合形成复合材料和纳米结构具有巨大的潜力,目前大多数文献仅仅综述了IONPs的合成方法,对关于多糖涂覆的IONPs的合成工艺却缺乏系统性的综述。因此,本文对多糖涂覆的IONPs的合成方法、合成过程的影响因素及二者的结合机理进行了综述。此外,综述了其在药物递送中的应用,最后进行了总结和展望,以期能够为多糖涂覆的IONPs的合成及其在药物递送中的应用提供有价值的参考。
1 多糖涂覆的IONPs的合成方法多糖涂覆的IONPs的合成是基于IONPs的合成方法进行的,主要包括共沉淀法[28]、微乳浊液法[29]、阴极电化沉积法[30]、声化学法[31]和微生物法[32],这些方法在一定条件下能够合成粒径小、粒径分布窄、结晶度好以及纯度高的IONPs。多糖可以在反应过程中或者反应完成后与IONPs结合,据此又可分为原位合成和两步合成。原位合成也叫“一锅法”,即将IONPs的前体和多糖溶解在相同的反应介质中,IONPs于多糖溶液中直接合成并被稳定化,此过程中多糖的存在可以控制IONPs的尺寸、形态以及防止IONPs的氧化;两步合成是指先单独合成IONPs,然后将分离后的IONPs重新悬浮于多糖溶液中进行涂覆,此法虽然比原位法复杂,但是二者结合过程不受IONPs合成因素的影响,适用范围更加广泛。
1.1 共沉淀法共沉淀工艺制备多糖涂覆的IONPs可以使用Fe2+与Fe3+的混合物作为前体也可以单独使用Fe2+作为前体。
1.1.1 以Fe2+和Fe3+为前体的共沉淀法由水介质中的Fe2+和Fe3+的混合物制备IONPs,是目前采用最多、最经典的一种方法。此法过程简单,不需要有机溶剂、表面活性剂和高温处理,具有良好的均质性、较低的生产成本以及高产品纯度等优点,而且得到的IONPs具有良好的亲水性,通过这种方法可以合成大多数市售的IONPs[33-34]。其反应方程式如式(1)所示:
${\rm{F}}{{\rm{e}}^{2 + }} + 2{\rm{F}}{{\rm{e}}^{3 + }} + 8{\rm{O}}{{\rm{H}}^ - } \to {\rm{F}}{{\rm{e}}_3}{{\rm{O}}_4} + 4{{\rm{H}}_2}{\rm{O}}$ (1)
控制Fe3+与Fe2+化学计量比为2 ∶1,调节pH至9~14,便可形成IONPs[35]。反应一般在N2氛围中进行,不仅可以防止Fe2+和Fe3O4的氧化,还能减小IONPs的粒径[36]。Fe3O4经过空气氧化后便可的到γ-Fe2O3,也可通过方程式(2)反应得到。
${\rm{F}}{{\rm{e}}_3}{{\rm{O}}_4} + 2{{\rm{H}}^ + } \to {\rm{ \mathsf{ γ} }} - {\rm{F}}{{\rm{e}}_2}{{\rm{O}}_3} + {\rm{F}}{{\rm{e}}^{2 + }} + {{\rm{H}}_{\rm{2}}}{\rm{O}}$ (2)
共沉淀法是被使用最多的方法,其具体的合成过程见图 1。此外,表 1列出了采用Fe3+与Fe2+共沉淀合成的各种多糖涂覆的IONPs及其特性。
图 Figure1(Fig.Figure1)
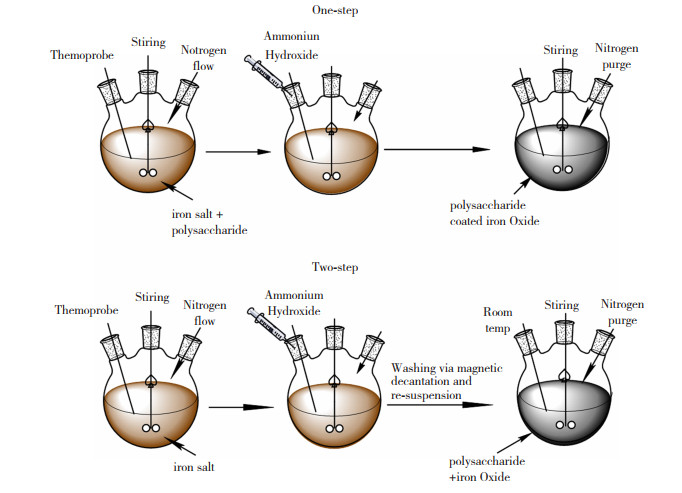 图 1 原位法以及两步法合成多糖涂覆的IONPs过程[37]Fig.1 Synthesis of polysaccharide-coated INOPs by one-step method and two-step method[37]
图 1 原位法以及两步法合成多糖涂覆的IONPs过程[37]Fig.1 Synthesis of polysaccharide-coated INOPs by one-step method and two-step method[37]表1(Table 1)
聚糖[38] 两步合成 10.7±0.1 70.00
壳聚糖[39] 原位合成 11.3~11.9 36.00~54.35 球形
右旋糖酐[40] 两步合成 7.0 14.00~26.00 球形
右旋糖酐[14] 原位合成 12.0±5.0 48.30
淀粉[15] 原位合成 15.0 15.00 球形
果胶[41] 两步合成 20.0 37.20 类球形
阿拉伯胶[42] 原位合成 < 20.0 44.20
纤维素[43] 原位合成 6.0~10.0 15.00 球形
海藻酸盐[44] 两步合成 10.0 12.00 近球形
普鲁兰多糖[45] 两步合成 3.4~8.4 0.29 球形
肝素[46] 两步合成 17.7 24.92
表 1 共沉淀法合成的各种多糖涂覆的IONPs及其特性Table 1 IONPs coated with various polysaccharides synthesized by co-precipitation method and their properties
1.1.2 以Fe2+为前体的共沉淀法只使用Fe2+作为前体的共沉淀法合成IONPs的反应机理如方程式(3)~(5)所示[47]:
${\rm{F}}{{\rm{e}}^{2 + }} + 2{\rm{O}}{{\rm{H}}^ - } \to {\rm{Fe}}{({\rm{OH}})_2}$ (3)
${\rm{3Fe}}{({\rm{OH}})_2} + 1/2{{\rm{O}}_{\rm{2}}} \to {\rm{Fe}}{({\rm{OH}})_2} + 2{\rm{FeOOH}} + {{\rm{H}}_{\rm{2}}}{\rm{O}}$ (4)
${\rm{Fe}}{({\rm{OH}})_2} + 2{\rm{FeOOH}} \to {\rm{F}}{{\rm{e}}_3}{{\rm{O}}_4} + 2{{\rm{H}}_{\rm{2}}}{\rm{O}}$ (5)
目前以Fe2+为前体的共沉淀法在合成多糖涂覆的IONPs时基本上都是原位合成。具体步骤是对多糖与亚铁盐的混合溶液进行碱处理,原位沉淀得到Fe(OH)2,然后用氧化剂(如O2或H2O2)氧化Fe(OH)2得到多糖涂覆的IONPs[48-49]。Robinson等[50]在N2氛围中,向淀粉与FeSO4的混合溶液中加入KOH和KNO3,在90 ℃下反应45 min,再将得到的混合物于空气中氧化得到了淀粉涂覆的Fe3O4纳米粒子。Adimoolam等[51]使用此法在室温下便原位合成了的壳聚糖涂覆的Fe3O4纳米粒子,并且成功的用于负载抗癌药物。虽然此法可能会产生非铁杂质以及过度的氧化,但是通过此法来原位合成多糖涂覆的IONPs的过程中只使用了一种铁盐,甚至在室温条件下便能成功合成多糖涂覆的IONPs,具有一定的应用潜力。
1.2 微乳液法油包水型微乳液已被广泛应用于合成均匀粒径的IONPs。纳米级水滴分散在油相中,在水和油界面上由表面活性剂分子稳定,以其作为限制IONPs成核、生长和团聚的微反应器来合成IONPs。Zhi等[52]用含有壳聚糖和亚铁盐的油包水微乳液作为微反应器,在微乳液中加入碱性沉淀剂NaOH,原位合成了壳聚糖涂覆的Fe3O4纳米粒子,其饱和磁化强度为11.15 emu/g,显示出了超顺磁性。Pham等[53]采用微乳液法两步合成了壳聚糖涂覆的Fe3O4纳米粒子,并负载上了抗癌药物,验证了药物的体外缓释性能,表明其具有作为药物载体的潜质。虽然此法合成的IONPs粒径分布窄、结晶性良好,但是微乳浊液法在水/油系统中进行,通常会涉及表面活性剂和乳化剂,这使得其在实际的应用特别是生物医学应用中受到了一定的限制。
1.3 声化学法声化学法是一种简便有效的合成IONPs的方法,可通过超声波辐射产生非常高的温度和压力,使无机铁前体分解(超声分解)从而合成IONPs[54]。在此过程中可以向溶液中加入多糖,原位合成多糖涂覆的IONPs。Balachandramohan等[55]以硫酸铁为前体,在室温和惰性气氛的条件下,向其水溶液中加入瓜尔胶和碱,在超声辐射的作用下成功合成了粒径约为48 nm的多糖涂覆的方形Fe3O4纳米粒子,该复合物显示出优异的催化性能。虽然此法合成的IONPs球形度低,但是可以用于合成具有不同形态和窄尺寸的单分散IONPs,而且此法不需要严格的实验条件或任何有毒试剂,是一种快速、高效和绿色的方法。
1.4 阴极电化学沉积法阴极电化学沉积法(Cathodic Electrochemical Deposition,CED)也可以用于合成IONPs,电流在位于电解质中的两个电极(阳极和阴极)之间通过,首先通过阳极氧化生成金属离子,然后金属离子在阴极被还原为金属[56]。近些年有很多采用此法来原位合成多糖涂覆的IONPs的报道,Karimzadeh等[57]以CED工艺为基础,在电解液中加入淀粉,原位合成了符合医学磁性标准的淀粉涂覆的Fe3O4纳米粒子。Aghazadeh等[58]以0.005 mol/L的Fe(NO3)3与1 g/L壳聚糖的混合溶液作为电解质溶液,原位合成了壳聚糖涂覆的Fe3O4纳米粒子。使用CED合成多糖涂覆的IONPs还能实现其他金属的掺入,进一步拓展IONPs的功能,如对含有FeCl2、Fe(NO3)3、Mn(NO3)2以及右旋糖酐的电解液进行电解,可原位合成右旋糖酐涂覆的掺杂锰的Fe3O4纳米粒子[59]。Ahmadi[60]也通过CED原位制备了右旋糖酐涂覆的掺杂锌的Fe3O4纳米粒子,其饱和磁化强度为51.75 emu/g,是适合于生物医学应用的候选材料。上述反应均采用无毒试剂,于室温条件下在低挥发性或无挥发性的反应介质中进行,是一种简便、高效、经济、绿色的合成多糖涂覆的IONPs的方法,具有良好的应用前景。
1.5 水热法水热法是指在密闭的容器中,在自生压力下高温加热溶液中的铁前体,通过水解、氧化或中和混合金属氢氧化物合成IONPs的方法,反应具有易于控制、环境友好、结晶性好和良好的产品形态等优点。Li等[61]在高压釜中,采用亚铁络合物为原料,以聚乙二醇作为溶剂,H2O2为氧化剂,于160 ℃下反应得到Fe3O4纳米粒子,再用壳聚糖进行涂覆,得到了粒径为22 nm的规则球形的多糖涂覆的IONPs。Mansur等[62]将FeCl3、乙酸钠以及聚合物在乙二醇中混合,然后将混合物在200 ℃下于聚四氟乙烯衬里的密闭不锈钢水热反应器中反应12 h,成功地原位合成了饱和磁化强度分别为42.3和66.4 emu/g的果胶和壳聚糖涂覆的IONPs。然而水热法在高温高压的条件下进行,实际应用过程中对设备的要求较高。
1.6 热分解法在稳定剂及表面活性剂的存在下,有机铁前体在高沸点有机溶剂中热分解,可制备出尺寸形状可控、粒径分布窄及结晶度好的IONPs。Hauksdottir等[63]以乙酰丙酮铁为前体,通过有机溶剂热分解得到IONPs,经过硅烷配体交换后用壳聚糖进行涂覆,得到了亲水性的IONPs。热分解法产生的纳米粒子带有疏水性表面配体,需经过配体交换使其具有亲水性,而且反应过程涉及有毒的化学物质以及需要苛刻的反应条件,在一定程度上限制了其应用。Rana等[64]在连续搅拌下将乙酰丙酮铁-乙醇溶液逐渐添加到果胶溶液中,然后加入NaBH4,在100~120 ℃的温度下合成了2~6 nm的果胶涂覆的γ-Fe2O3,此过程使用水作为溶剂,不需要调节pH值以及添加其他的表面活性剂,短时间内在相对较低的温度下原位合成了果胶涂覆的IONPs,是热分解法合成多糖涂覆IONPs的一个良好的改进。
1.7 微生物转化法微生物具有制造极其特殊的无机纳米结构的惊人能力,许多细菌菌株的生物质或细胞提取物已用于大规模合成各种类型的金属氧化物纳米颗粒[32]。微生物法合成IONPs具有环境友好,生物相容性强等特点,在大规模合成多糖涂覆的IONPs方面具有巨大的潜力。通过向铁还原菌的培养基中加入铁前体物质(可以是铁盐、铁金属络合物等),通过这些微生物的胞内外代谢物的作用,可以将铁盐转化为IONPs,同时代谢产物中的生物分子(如多糖)可以覆盖在IONPs上,得到聚合物涂覆的IONPs,其反应过程见图 2。
图 Figure2(Fig.Figure2)
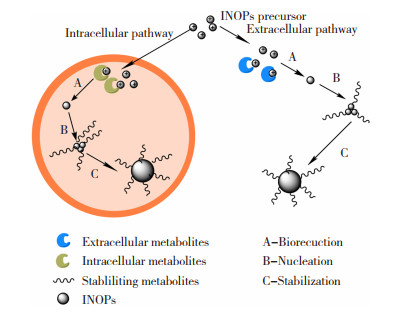 图 2 细胞内和细胞外通过铁离子生物合成多糖涂覆的IONPs的过程[65]Fig.2 Intracellular and extracellular biosynthesis of polysaccharide-coated IONPs by iron ions[65]
图 2 细胞内和细胞外通过铁离子生物合成多糖涂覆的IONPs的过程[65]Fig.2 Intracellular and extracellular biosynthesis of polysaccharide-coated IONPs by iron ions[65]Kianpour等[66]以柠檬酸铁作前体,通过从温泉中分离的瓦氏葡萄球菌成功的制备了粒径分布窄、尺寸细小、球形的多糖涂覆的IONPs。Ebrahiminezhad等[67]以柠檬酸铁作为铁源,经过黄单胞杆菌的转化,成功的在胞外合成了黄原胶涂覆的核-壳结构的IONPs。但是微生物胞内外代谢产物复杂,具体是哪种物质起转化作用目前尚未见相关文献报道,而且以此法合成多糖涂覆的IONPs还存在不易分离以及饱和磁化强度低等局限性,仍需进一步进行机理探索和条件优化。
通过上述方法合成多糖涂覆的IONPs具有各自的特点,得到的纳米粒子也存在一定的差异,其具体合成过程的特点及产物在各方面的差异见表 2。
表2(Table 2)
共沉淀法 简便、高效 低 宽 低 易 高
微乳液法 反应体系复杂,需要表面活性剂剂以及乳化剂 高 较窄 低 难 低
声化学法 简便、绿色、高效 低 窄 低 易 低
电化学沉积法 绿色、简便、高效 低 较窄 低 易 中
水热法 较简便,需要高温、高压条件 低 较宽 高 易 中
热分解法 反应体系复杂,需高温条件 高 窄 高 难 高
微生物转化法 绿色、简便、周期长 低 宽 低 难 高
表 2 多糖涂覆IONPs不同合成方法的特点及产物差异Table 2 Characteristics and product differences of IONPs coated with polysaccharides by different synthesis methods
2 多糖涂覆的IONPs合成的影响因素影响多糖涂覆的IONPs合成的因素有很多,包括IONPs本身合成因素的影响以及多糖方面的影响。目前关于IONPs合成过程的影响因素已经有很多的综述报道,因此本文仅讨论多糖方面的影响。主要的影响因素包括多糖加入反应体系的时间、多糖的理化特性以及合成体系中多糖与铁的比率。
2.1 多糖加入到合成体系中时间的影响如表 1所示,采用相同的多糖,原位合成与两步合成得到的IONPs会存在一定的差异,说明多糖加入反应体系的时间是影响多糖涂覆的IONPs合成的一个重要因素。Tancredi等[68]通过Fe2+的共沉淀法,在添加碱沉淀后分别在0、30、90、150和300 s的时间内加入淀粉,发现多糖涂覆的IONPs的磁芯粒径从12 nm增加到40 nm,而且流体力学直径也随着加入时间的延长而变大。所以在制备多糖涂覆的IONPs过程中,想要获得粒径较小的IONPs,多糖应当在成核时快速加入反应体系之中,使其迅速与IONPs结合从而控制其生长。Hauser等[37]在所有其他参数(例如pH、反应温度和多糖分子量)均保持恒定的条件下,在共沉淀过程中将右旋糖酐按4种不同的时间添加到反应体系中,具体操作步骤见图 3。可以将多糖涂覆的IONPs的流体力学直径、溶液稳定性、结晶度和热稳定性调节到不同的程度,最终结果表明将多糖与碱混合后加入铁盐溶液中的“同时半两步法”是最容易控制的方法,因为当初始成核发生时,溶液的黏度也是水的黏度,从而允许铁离子更有效地传输到成核位置。两步法以及“半两步法”则因为在成核后加入多糖导致获得的纳米粒子粒径较大,并且批次间差异也较大,这说明在粒径控制及重现性方面原位法较优。
图 Figure3(Fig.Figure3)
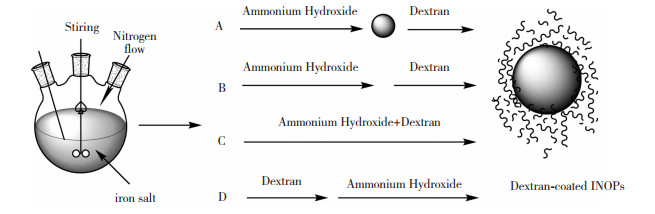 图 3 右旋糖酐涂覆IONPs的合成方法(A—两步法;B—半两步法;C—同时半两步法;D—原位法)Fig.3 Dextran-coated IONPs synthesis methods(A—two step; B—semi-two step method; C—simultaneous semi-two step method; D—one step method)
图 3 右旋糖酐涂覆IONPs的合成方法(A—两步法;B—半两步法;C—同时半两步法;D—原位法)Fig.3 Dextran-coated IONPs synthesis methods(A—two step; B—semi-two step method; C—simultaneous semi-two step method; D—one step method)但是,Hradil等[69]分别采用原位和两步共沉淀法合成右旋糖酐涂覆的IONPs时,发现在合适的多糖与铁的比率下,两步法得到的右旋糖酐涂覆的IONPs在储存过程中不会产生游离的右旋糖酐,其比一步法得到的产物更加适合医学应用。综上,在制备多糖涂覆的IONPs时多糖的加入时间至关重要,应当经过精心选择和控制,以获得特定应用所需的性能。
2.2 多糖理化特性的影响在相同的方法和条件下,采用不同的多糖涂覆IONPs会得到不同的结果,说明多糖本身的特性也是重要的影响因素,主要包括多糖的分子量和官能团。
2.2.1 多糖分子量的影响多糖的分子量是多糖与IONPs合成过程的重要影响因素。Horst等[42]采用原位共沉淀法来制备阿拉伯胶(GA)涂覆的IONPs,其中GA分别以固态和溶液的形式加入反应体系,结果表明前者得到的多糖涂覆的IONPs中多糖的比例占复合物39%,而后者为22%。作者认为造成这种现象的原因是由于后者在溶解过程中产生了部分低分子量GA组分的损失。Xu等[70]发现分子量为20 KDa的葡聚糖相比分子量为40 KDa的葡聚糖有较低的黏度和较高的分散速率,有利于葡聚糖吸附到IONPs表面,从而赋予了IONPs最佳的稳定性。说明在制备多糖涂覆的IONPs时宜采用分子量相对较低的多糖,高分子量和长支链的聚合物作为涂层还容易导致涂层厚度增加,这将大大增加颗粒尺寸并降低磁性能。但是分子量低于60 kDa的右旋糖酐可以很容易地滤过肾小球并引起渗透性肾病,从而导致慢性肾功能衰竭[71],所以在制备多糖涂覆的IONPs时多糖的分子量应当根据实际应用进行选择。
2.2.2 多糖官能团的影响多糖的官能团也是多糖与IONPs合成过程的重要影响因素。不同的官能团与前体铁离子以及合成的IONPs的亲和力不同,会对IONPs成核与生长产生巨大的影响。Stolyar等[49]采用共沉淀法在相同的条件下制备了阿拉伯半乳聚糖及壳聚糖涂覆的IONPs,二者由于官能团存在显著差异,最终产物也存在显著差异。Mansur等[62]的研究表明海藻酸盐和果胶中的羧基基团与壳聚糖中的氨基基团相比,前者对前体铁离子有更强的作用,能更加有效控制纳米微粒的成核与生长,获得较小粒径的IONPs。而且在生理pH值下,胺基被脱质子,可能会导致粒子之间的排斥力降低,从而产生大的流体力学尺寸。对多糖进行化学修饰,例如引入带电基团(例如氨基和羧基),也会对IONPs的特性产生深远的影响。Zhu等[72]分别使用壳聚糖、O—羧甲基壳聚糖和N—琥珀酰—O—羧甲基壳聚糖修饰Fe3O4纳米粒子,并负载上药物喜树碱(CPT),结果表明IONPs的粒径、粒径分布以及CPT的吸附效率、释放行为和牛血清白蛋白的非特异性结合能力与多糖的性质密切相关。说明多糖的官能团不仅会影响纳米粒子的粒径,而且会影响与活性物质结合的能力及其分子识别作用。根据特定的需求对多糖进行化学修饰,能够为多糖涂覆的IONPs在药物递送等生物医药等方面的应用赋予更多新的可能,具有重要的研究意义。
2.3 多糖与铁的比率的影响多糖与铁的比率也是影响多糖涂覆的IONPs合成的关键因素。Predesc等[40]通过两步法合成葡聚糖涂覆的IONPs,发现葡聚糖浓度越高,IONPs表面的多糖覆盖率越高,纳米粒子的分散性越好,IONPs的无定形特征越强。Robinson等[50]采用亚铁盐的共沉淀制备淀粉涂覆的IONPs,使淀粉与铁的质量比在0.05~10之间的范围内变化,随着淀粉量的增加,纳米粒子的尺寸从(66±5)nm减小到(12±4)nm。说明随着多糖与铁的比率增大,氧化铁成核前后与多糖接触的机会增大,更易于在多糖的控制下成核生长,从而形成粒径较小的纳米粒子,并且能够快速稳定化。但是在制备理想特性的IONPs时,多糖与铁的比率需要在一个合适的范围内。Li等[61]通过水热法合成了IONPs,再用壳聚糖进行涂覆,其中壳聚糖与IONPs的摩尔比在1 ∶0.5至1 ∶2之间变化,虽然产物的饱和磁化强度随摩尔比的增大而增大,但是当摩尔比为1 ∶1时IONPs的粒径最小。而且,当多糖与铁的比率太高时,可能会导致IONPs涂层的厚度增加,从而形成微米级的颗粒[73],这将使其不适于体内应用。Hradil等[69]发现初始葡聚糖与氧化铁的质量比是控制IONPs尺寸的有效参数,并且推荐使用的右旋糖酐/氧化铁质量比在0~0.16之间,因为此区间内合成的复合物中不含过量的右旋糖酐或氧化铁簇,更加适合医学应用。综上,在合成多糖涂覆的IONPs过程中,应当选择一个合适的多糖与铁的比率,以达到预期的要求。
3 多糖与IONPs结合机理由于多糖具有分子间和分子内氢键促进动态超分子缔合的特性,因此,它们可以充当IONPs的生长模板[74]。多糖中有羟基、羧基和氨基等较高含量的官能团,可以通过静电相互作用、配体交换(表面络合)、疏水相互作用、熵效应、氢键和阳离子桥接等吸附方式牢固地粘附在IONPs表面,并有效地抑制晶核的生长[40, 75-77]。多糖由于官能团的不同,其与IONPs结合机理也不相同。壳聚糖和IONPs之间的相互作用是通过静电力的复杂机理和极性基团之间发生的相互作用来解释的[78-79]。Can等[33]认为右旋糖酐的羟基与Fe3O4表面的氢键作用是最可能的结合机理:水位于右旋糖酐和氧化铁表面之间,形成分子间和分子内的氢键,其机理如图 4所示。Predescu等[40]则通过傅利叶红外光谱表明右旋糖酐由于范德华力、氢键和静电作用等多种相互作用的组合而结合在IONPs表面,说明多糖不止通过一种作用机制吸附在IONPs表面。
图 Figure4(Fig.Figure4)
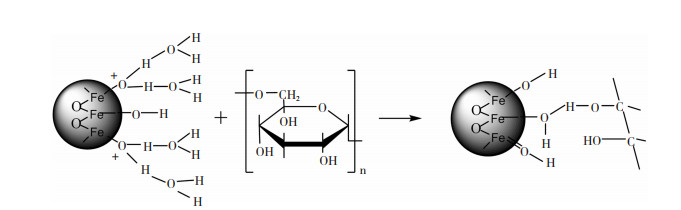 图 4 水位于氧化物表面和右旋糖酐之间形成氢桥网络[80]Fig.4 Water forms a network of hydrogen bridges between oxide surface and dextran[80]
图 4 水位于氧化物表面和右旋糖酐之间形成氢桥网络[80]Fig.4 Water forms a network of hydrogen bridges between oxide surface and dextran[80]多糖与IONPs的结合还与其所处的环境有关,因为有些多糖所带的电荷会随pH值发生变化,进而会出现不同的结合方式。Zhu等[81]采用两步共沉淀制备壳聚糖和羧甲基化壳聚糖涂覆的Fe3O4来探索其结合机理,认为壳聚糖和羧甲基化壳聚糖在IONPs上的吸附机理分别是静电吸引和配位相互作用。在pH值为4的壳聚糖/Fe3O4水溶液的系统中,氨基基团质子化为阳离子电荷(NH3+),可以通过静电力作用吸附到IONPs上;而在pH值为7.4的中性羧甲基化壳聚糖/Fe3O4系统中,部分羧酸基团将缔合为负电荷,而其他羧基基团保持分子形式,通过羧甲基化壳聚糖分子中羧基的“O”与Fe3O4的“Fe”的配位化学吸附而结合在IONPs的表面上。在共沉淀合成阿拉伯胶涂覆的IONPs过程中,NH4OH溶液的添加导致环境的pH值升高而开始成核,此时IONPs和阿拉伯胶呈现相反的表面电荷,二者发生静电相互作用而吸附,而且阿拉伯胶的羧基与IONPs之间还产生了氢键的相互作用[42]。说明当多糖带电荷较多时,多糖与IONPs主要通过静电作用相互结合,而不带电基团则会通过氢键、配位作用等方式与IONPs结合。此外,由于多糖表面的静电排斥作用,多糖中的氢键等作用会被大大抑制,有利于多糖涂覆的IONPs稳定存在。因此,根据多糖与IONPs结合机理的差异对合成环境进行调节,可以促进多糖与INOPs的结合及产物的稳定,从而获得理想的产物。
4 多糖涂覆的IONPs在药物递送中的应用多糖涂覆的IONPs充分结合了磁芯的理化特性以及涂层的生化特性,是药物递送的理想材料。根据磁芯的磁响应特性,通过施加外部和内部磁场可以帮助药物在目标位置积累(如图 5所示),实现药物的靶向递送。Peng等[82]通过在家兔的肿瘤部位植入永磁体,成功的将载有抗癌药物的右旋糖酐涂覆的Fe3O4靶向至肿瘤部位,使家兔在55天内的存活率从33.3%提高到了83.3%。IONPs的其他一些物理特性也被用于药物递送中。Wang等[83]采用琼脂涂覆的Fe3O4纳米粒子作为药物阿霉素的递送载体,在体外抑制癌细胞生长能力的测试中发现细胞活力在72 h内下降到66%,在结合磁热疗后癌细胞活力下降至(15.4±6.1)%。Karthik等[84]制备了壳聚糖作为涂层的还原氧化石墨烯-氧化铁的复合纳米系统,该系统在阿霉素的递送中不仅实现了药物的靶向递送,而且还利用了Fe3O4的成像特性,实现了化疗与光热联合的肿瘤治疗。此类能够实现化学与物理联合治疗的药物载体具有良好的效果,具有一定的开发前景。
图 Figure5(Fig.Figure5)
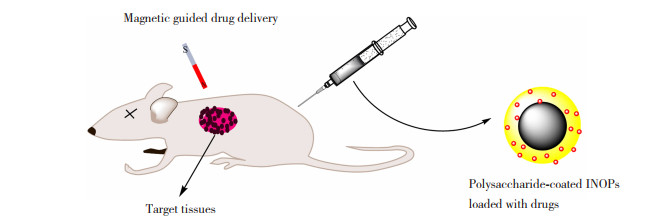 图 5 负载药物的多糖涂覆INOPs在磁场作用下于目标组织积累[3]Fig.5 Accumulation of drug-loaded polysaccharide coated INOPs in target tissues under magnetic field[3]
图 5 负载药物的多糖涂覆INOPs在磁场作用下于目标组织积累[3]Fig.5 Accumulation of drug-loaded polysaccharide coated INOPs in target tissues under magnetic field[3]通过IONPs表面涂层的分子识别作用,可以达到增强主动靶向递送药物的效果[85-86]。Soleymani等[87]以透明质酸作为Fe3O4生物相容性涂层,能够对过表达CD44受体的癌细胞产生靶向特异性,表明其具有作为药物递送载体的潜力。此外,多糖涂层可以直接或在修饰后配备与目标细胞相关的特定分子,如抗体、多肽、维生素和核酸等,实现特异性地靶向目标细胞的受体[88-90]。Angelopoulou等[91]使用叶酸对海藻酸盐涂层的IONPs进行功能化,在抗肿瘤测试中发现负载药物的叶酸功能化的纳米颗粒在乳腺癌细胞中表现出增加的摄取,并引起细胞凋亡和细胞毒性增加。Gholipour等[14]在Fe3O4表面的多糖涂层上缀合生物素作为肿瘤靶向剂,发现与未生物素化的纳米粒子相比,其与生物素受体阳性的癌细胞的亲和力显著提高。Amani等[92]甚至开发出了由叶酸、葡聚糖等聚合物结合的多靶点的磁性纳米粒子,可将siRNA和药物紫杉醇共同靶向递送至乳腺癌组织。通过生物配体与靶细胞表面上的特定受体结合,可以增加目标细胞对含药物纳米粒子的摄取,减小毒副作用,具有良好的治疗效果[93-94]。但是这些主动靶向的纳米颗粒仅在某些特定类型的细胞上表达,需要根据目标细胞上的受体进行选择设计,实际操作过程较为复杂与昂贵。
多糖涂覆的IONPs递药主要是通过静脉注射进行的,相比于传统的口服药物具有很多的优势。药物通过多糖进行稳定,不仅提高了药物在血液中的稳定性,而且具有缓释性和控释性,可以显著延长药物的作用时间[10, 16, 95]。能控制药物释放特性的药物载体也叫智能递送系统[96-97]。这种给药系统大大提高了药物的药效学和药代动力学,减少了患者的服药剂量,提高了药物利用率。Parsian等[7]将抗肿瘤药物装载到壳聚糖涂覆的Fe3O4上,药物释放研究表明,在pH=7.2时药物24 h内的累积释放百分比约为8%,而在pH=4.2时,药物释放高达65%。由于肿瘤组织的pH为酸性,而血液和健康组织为中性,该药物的释放特性较为理想。但是在最初的3 h内,药物在pH为4.2和5.2时的释放达到了25%和10%。考虑到大多数注射的纳米载体在血液循环中具有30 h的时长,其在药物缓释方面存在一定的不足。Hosseini等[23]将Fe3O4纳米颗粒封装在多糖的双层壳中,内壳多糖层通过化学修饰为抗癌药物阿霉素的结合提供了多个功能化位点。然后以聚乙二醇化羧甲基纤维素作为外壳包裹了载有药物的载体,用以增强其生物相容性并调节药物的释放。通过在pH为5.0和7.4时药物的释放研究发现,尽管72 h内释放的阿霉素与一层壳相比并没有得到很大改善,但是短时间内药物的释放差异显著,35 h内在pH为7.4时药物的释放量仅为16.8%,而在pH为5.0时则达到了54%以上,表明第二层外壳在调节阿霉素释放中的起关键作用。毒性与活性实验表明第二层壳的存在增强了生物相容性,并降低了纳米载体的细胞毒性。这种根据目标环境进行设计合成,能够控制药物释放的“智能”药物载体具有巨大的应用潜力。但是目前多糖涂覆的IONPs主要集中于抗癌药物的递送,基于其他环境响应的靶向递药的报道较少,开发此类的药物载体具有重要的意义。
尽管磁性纳米粒子是一种有效的药物载体,但是磁场强度随距离的增加而迅速降低,这使得在组织深处递药存在一定的挑战,仍需进一步研究[98]。此外,多糖涂覆IONPs用于靶向递药的生物安全性一直是人们关注的话题。虽然IONPs经过多糖的涂覆可以降低其毒性[99],但是部分研究发现多糖涂覆后的IONPs毒性仍然不可避免。Bakhtari等[9]在小鼠体外受精过程中研究右旋糖苷涂覆的IONPs对精子、卵母细胞和最终囊胚的毒性,发现精子线粒体和膜破坏,卵母细胞线粒体空泡化和嵴扭曲,粒层细胞核破坏和细胞膜紊乱,并且呈剂量依赖性。Pongrac等[100]发现D—甘露糖或聚—1—赖氨酸涂覆的IONPs显示了对微小视网膜的动态平衡的负面影响,聚合物涂覆没有避免它们在鼠神经干细胞中的毒性。所以多糖涂覆的IONPs在临床应用之前仍需对其潜在毒性进一步评估。
5 总结与展望本文综述了多糖涂覆的IONPs的合成方法,主要包括共沉淀法、微乳浊液法、电化学沉积法、声化学法、水热法、热分解法以及微生物转化法。根据多糖加入反应体系的时间又可分为原位合成和两步合成。合成过程中多糖方面的影响主要包括多糖加入反应体系的时间、多糖的分子量、多糖的官能团以及多糖与铁的比率。多糖与IONPs的结合机理与多糖的特性及其所处环境有关,二者之间存在多种结合机制。目前无论是采用原位法还是两步法来合成多糖涂覆的IONPs,共沉淀法都是目前使用最多的方法,但是通过这种方法合成的IONPs通常表现出较低的结晶度和相对较宽的粒径分布,仍需进一步完善。多糖涂覆IONPs的合成过程中应当尽量减少化学试剂的使用,朝着绿色经济的方向发展,如电化学法、声化学法、微生物法等,这些方法具有巨大的开发潜力。多糖涂覆IONPs在药物递送中的应用利用了多糖与IONPs的协同作用,可以顺利将药物递送至目标组织。根据目标组织的环境进行设计,合成能够在特定组织释放药物的智能系统具有重要的意义。此外,在多糖涂层上配备能够特异性地靶向目标细胞受体的特异性分子,能够增强递药系统的主动靶向性,具有重要的研究意义。虽然多糖涂覆的IONPs是药物递送的理想候选者,但是在临床应用之前其毒性仍需进一步评估。
参考文献
[1] HUANG Shiyu, HUANG Gangliang. Preparation and drug delivery of dextran-drug complex[J]. Drug Delivery, 2019, 26(1): 252-261. DOI:10.1080/10717544.2019.1580322
[2] LEE J W, KIM D K. Carboxymethyl group activation of dextran cross-linked superparamagnetic iron oxide nanoparticles[J]. Journal of the Korean Ceramic Society, 2021, 58: 106-115. DOI:10.1007/s43207-020-00077-2
[3] BEALER E J, KAVETSKY K, DUTKO S, et al. Protein and polysaccharide-based magnetic composite materials for medical applications[J]. International Journal of Molecular Sciences, 2020, 21(1): 186. DOI:10.3390/ijms21010186
[4] DO H D, LE T T H, PHAM H N, et al. Microwave-assisted dextran modification and nanoparticle synthesis for application in drug delivery system[J]. Advances in Natural Sciences: Nanoscience and Nanotechnology, 2019, 10(1): 015008. DOI:10.1088/2043-6254/ab0282
[5] GANAPATHE L S, MOHAMED M A, YUNUS R M, et al. Magnetite (Fe3O4) nanoparticles in biomedical application: from synthesis to surface functionalisation[J]. Magnetochemistry, 2020, 6(4): 68. DOI:10.3390/magnetochemistry6040068
[6] JIAO Mingxia, ZHANG Peisen, MENG Junli, et al. Recent advancements in biocompatible inorganic nanoparticles towards biomedical applications[J]. Biomaterials Science, 2018, 6(4): 726-745. DOI:10.1039/c7bm01020f
[7] PARSIAN M, UNSOY G, MUTLU P, et al. Loading of Gemcitabine on chitosan magnetic nanoparticles increases the anti-cancer efficacy of the drug[J]. European Journal Of Pharmacology, 2016, 784: 121-128. DOI:10.1016/j.ejphar.2016.05.016
[8] GARCíA-EMBID S, DI RENZO F, DE MATTEIS L, et al. Magnetic separation and high reusability of chloroperoxidase entrapped in multi polysaccharide micro-supports[J]. Applied Catalysis A: General, 2018, 560: 94-102. DOI:10.1016/j.apcata.2018.04.029
[9] BAKHTARI A, NAZARI S, ALAEE S, et al. Effects of Dextran-coated superparamagnetic iron oxide nanoparticles on mouse embryo development, antioxidant enzymes and apoptosis genes expression, and ultrastructure of sperm, oocytes and granulosa cells[J]. International Journal Of Fertility & Sterility, 2020, 14(3): 161-170. DOI:10.22074/ijfs.2020.6167
[10] HUANG Shiyu, HUANG Gangliang. The dextrans as vehicles for gene and drug delivery[J]. Future Medicinal Chemistry, 2019, 11(13): 1659-1667. DOI:10.4155/fmc-2018-0586
[11] LE T T, NGUYEN H D, NGUYEN T N L, et al. Biological durability, cytotoxicity and MRI image contrast effects of chitosan modified magnetic nanoparticles[J]. Journal of Nanoscience and Nanotechnology, 2020, 20(9): 5338-5348. DOI:10.1166/jnn.2020.17861
[12] ELKHENANY H, ABD ELKODOUS M, GHONEIM N I, et al. Comparison of different uncoated and starch-coated superparamagnetic iron oxide nanoparticles: Implications for stem cell tracking[J]. International Journal of Biological Macromolecules, 2020, 143: 763-774. DOI:10.1016/j.ijbiomac.2019.10.031
[13] SHAFIEE S, AHANGAR H A, SAFFAR A. Taguchi method optimization for synthesis of Fe3O4 @chitosan/tragacanth gum nanocomposite as a drug delivery system[J]. Carbohydrate Polymers, 2019, 222: 114982. DOI:10.1016/j.carbpol.2019.114982
[14] GHOLIPOUR N, AKHLAGHI M, MOKHTARI KHEIRABADI A, et al. Development of Ga-68 labeled, biotinylated thiosemicarbazone dextran-coated iron oxide nanoparticles as multimodal PET/MRI probe[J]. International Journal of Biological Macromolecules, 2020, 148: 932-941. DOI:10.1016/j.ijbiomac.2020.01.208
[15] ZIEGLER-BOROWSKA M. Magnetic nanoparticles coated with aminated starch for HSA immobilization-simple and fast polymer surface functionalization[J]. International Journal Of Biological Macromolecules, 2019, 136: 106-114. DOI:10.1016/j.ijbiomac.2019.06.044
[16] MOHAPATRA S, ASFER M, ANWAR M, et al. Doxorubicin loaded carboxymethyl Assam bora rice starch coated superparamagnetic iron oxide nanoparticles as potential antitumor cargo[J]. Heliyon, 2019, 5(6): e01955. DOI:10.1016/j.heliyon.2019.e01955
[17] KHMARA I, STRBAK O, ZAVISOVA V, et al. Chitosan-stabilized iron oxide nanoparticles for magnetic resonance imaging[J]. Journal of Magnetism and Magnetic Materials, 2019, 474: 319-325. DOI:10.1016/j.jmmm.2018.11.026
[18] XIE Manman, WANG Ziyang, LU Qian, et al. Ultracompact iron oxide nanoparticles with a monolayer coating of succinylated heparin: a new class of renal-clearable and nontoxic T-1 agents for high-field MRI[J]. Acs Applied Materials & Interfaces, 2020, 12(48): 53994-54004. DOI:10.1021/acsami.0c12454
[19] LACHOWICZ D, KACZYNSKA A, WIRECKA R, et al. A hybrid system for magnetic hyperthermia and drug delivery: spion functionalized by curcumin conjugate[J]. Materials, 2018, 11(12): 2388. DOI:10.3390/ma11122388
[20] SHATERABADI Z, NABIYOUNI G, SOLEYMANI M. Correlation between effects of the particle size and magnetic field strength on the magnetic hyperthermia efficiency of dextran-coated magnetite nanoparticles[J]. Materials Science & Engineering C-Materials for Biological Applications, 2020, 117: 111274. DOI:10.1016/j.msec.2020.111274
[21] HOSSEINI S H, ZOHREH N, KARIMI N, et al. Magnetic nanoparticles double wrapped into cross-linked salep/PEGylated carboxymethyl cellulose; a biocompatible nanocarrier for pH-triggered release of doxorubicin[J]. International Journal of Biological Macromolecules, 2020, 158: 994-1006. DOI:10.1016/j.ijbiomac.2020.05.040
[22] RAJESH T P, BALAJI R, CHEN Shenming, et al. The iron oxide/polymer nanocomposites for targeted drug delivery and toxicity investigation on zebra fish (Danio rerio)[J]. Inorganic Chemistry Communications, 2021, 125: 108447. DOI:10.1016/j.inoche.2021.108447
[23] FAHMY H M, ABD EL-DAIM T M, ALI O A, et al. Surface modifications affect iron oxide nanoparticles biodistribution after multiple-dose administration in rats[J]. Journal of Biochemical and Molecular Toxicology, 2021, 35(3): e22671. DOI:10.1002/jbt.22671
[24] NOURI M, KHODAIYAN F. Green synthesis of chitosan magnetic nanoparticles and their application with poly-aldehyde kefiran cross-linker to immobilize pectinase enzyme[J]. Biocatalysis and Agricultural Biotechnology, 2020, 29: 101681. DOI:10.1016/j.bcab.2020.101681
[25] VASIC K, KNEZ Z, LEITGEB M. Immobilization of alcohol dehydrogenase from Saccharomyces cerevisiae onto carboxymethyl dextran-coated magnetic nanoparticles: a novel route for biocatalyst improvement via epoxy activation[J]. Scientific Reports, 2020, 10(1): 19478. DOI:10.1038/s41598-020-76463-x
[26] AZIZI A. Green synthesis of iron oxide/cellulose magnetic recyclable nanocomposite and its evaluation in ciprofloxacin removal from aqueous solutions[J]. Journal of the Iranian Chemical Society, 2020, 18(2): 331-341. DOI:10.1007/s13738-020-02028-4
[27] BAHADOR F, FOROUTAN R, ESMAEILI H, et al. Enhancement of the chromium removal behavior of Moringa oleifera activated carbon by chitosan and iron oxide nanoparticles from water[J]. Carbohydrate Polymers, 2021, 251: 117085. DOI:10.1016/j.carbpol.2020.117085
[28] LOUREN?O I M, PELEGRINO M T, PIERETTI J C, et al. Synthesis, characterization and cytotoxicity of chitosan-coated Fe3O4 nanoparticles functionalized with ascorbic acid for biomedical applications[J]. Journal of Physics: Conference Series, 2019, 1323: 012015. DOI:10.1088/1742-6596/1323/1/012015
[29] JENJOB R, PHAKKEEREE T, SEIDI F, et al. Emulsion techniques for the production of pharmacological nanoparticles[J]. Macromolecular Bioscience, 2019, 19(6): 13. DOI:10.1002/mabi.201900063
[30] AGHAZADEH M, KARIMZADEH I. One-step cathodic electrochemical synthesis and characterization of dextran coated magnetite nanoparticles[J]. Journal of Nanoanalysis, 2017, 4(3): 228-238. DOI:10.22034/jna.2017.539366
[31] SHIN N, SARAVANAKUMAR K, WANG M-H. Sonochemical mediated synthesis of iron oxide (Fe3O4 and Fe2O3) nanoparticles and their characterization, cytotoxicity and antibacterial properties[J]. Journal of Cluster Science, 2019, 30(3): 669-675. DOI:10.1007/s10876-019-01526-7
[32] SALEM N F A, ABOUELKHEIR S S, YOUSIF A M, et al. Large scale production of superparamagnetic iron oxide nanoparticles by the haloarchaeon Halobiforma sp. N1 and their potential in localized hyperthermia cancer therapy[J]. Nanotechnology, 2021, 32(9): 09LT01. DOI:10.1088/1361-6528/abc851
[33] CAN H K, KAVLAK S, PARVIZIKHOSROSHAHI S, et al. Preparation, characterization and dynamical mechanical properties of dextran-coated iron oxide nanoparticles (DIONPs)[J]. Artificial Cells, Nanomedicine, and Biotechnology, 2017, 46(2): 421-431. DOI:10.1080/21691401.2017.1315428
[34] DADFAR S M, ROEMHILD K, DRUDE N I, et al. Iron oxide nanoparticles: diagnostic, therapeutic and theranostic applications[J]. Advanced Drug Delivery Reviews, 2019, 138: 302-325. DOI:10.1016/j.addr.2019.01.005
[35] WALLYN J, ANTON N, VANDAMME T F. Synthesis, principles, and properties of magnetite nanoparticles for in vivo imaging applications-a review[J]. Pharmaceutics, 2019, 11(11): 601. DOI:10.3390/pharmaceutics11110601
[36] SAXENA N, SINGH M. Efficient synthesis of superparamagnetic magnetite nanoparticles under air for biomedical applications[J]. Journal of Magnetism and Magnetic Materials, 2017, 429: 166-176. DOI:10.1016/j.jmmm.2017.01.031
[37] HAUSER A K, MATHIAS R, ANDERSON K W, et al. The effects of synthesis method on the physical and chemical properties of dextran coated iron oxide nanoparticles[J]. Materials Chemistry And Physics, 2015, 160: 177-186. DOI:10.1016/j.matchemphys.2015.04.022
[38] KHMARA I, MOLCAN M, ANTOSOVA A, et al. Bioactive properties of chitosan stabilized magnetic nanoparticles-Focus on hyperthermic and anti-amyloid activities[J]. Journal of Magnetism and Magnetic Materials, 2020, 513: 167056. DOI:10.1016/j.jmmm.2020.167056
[39] FREIRE T M, DUTRA L M U, QUEIROZ D C, et al. Fast ultrasound assisted synthesis of chitosan-based magnetite nanocomposites as a modified electrode sensor[J]. Carbohydrate Polymers, 2016, 151: 760-769. DOI:10.1016/j.carbpol.2016.05.095
[40] PREDESCU A M, MATEI E, BERBECARU A C, et al. Synthesis and characterization of dextran-coated iron oxide nanoparticles[J]. Royal Society Open Science, 2018, 5(3): 171525. DOI:10.1098/rsos.171525
[41] ZHANG Wei, VEISI H, SHARIFI R, et al. Fabrication of Pd NPs on pectin-modified Fe3O4 NPs: a magnetically retrievable nanocatalyst for efficient C-C and C-N cross coupling reactions and an investigation of its cardiovascular protective effects[J]. International Journal of Biological Macromolecules, 2020, 160: 1252-1262. DOI:10.1016/j.ijbiomac.2020.05.247
[42] HORST M F, CORAL D F, FERNANDEZ VAN RAAP M B, et al. Hybrid nanomaterials based on gum Arabic and magnetite for hyperthermia treatments[J]. Materials Science & Engineering C-Materials for Biological Applications, 2017, 74: 443-450. DOI:10.1016/j.msec.2016.12.035
[43] AZIZI A. Green synthesis of Fe3O4nanoparticles and its application in preparation of Fe3O4/cellulose magnetic nanocomposite: a suitable proposal for drug delivery systems[J]. Journal of Inorganic and Organometallic Polymers and Materials, 2020, 30(9): 3552-3561. DOI:10.1007/s10904-020-01500-1
[44] BEDE P M, DA SILVA M H P, FIGUEIREDO A B D, et al. Nanostructured magnetic alginate composites for biomedical applications[J]. Polimeros-Ciencia E Tecnologia, 2017, 27(4): 267-272. DOI:10.1590/0104-1428.2267
[45] COSERI S, SPATAREANU A, SACARESCU L, et al. Pullulan: a versatile coating agent for superparamagnetic iron oxide nanoparticles[J]. Journal of Applied Polymer Science, 2016, 133(5): 42926. DOI:10.1002/app.42926
[46] THI T T H, TRAN D H N, BACH L G, et al. Functional magnetic core-shell system-based iron oxide nanoparticle coated with biocompatible copolymer for anticancer drug delivery[J]. Pharmaceutics, 2019, 11(3): 120. DOI:10.3390/pharmaceutics11030120
[47] HUI Chao, SHEN Chengming, YANG Tianzhong, et al. Large-scale Fe3O4 nanoparticles soluble in water synthesized by a facile method[J]. Journal of Physical Chemistry C, 2008, 112(30): 11336-11339. DOI:10.1021/jp801632p
[48] LLANES F, RYAN D H, MARCHESSAULT R H. Magnetic nanostructured composites using alginates of different M/G ratios as polymeric matrix[J]. International Journal of Biological Macromolecules, 2000, 27(1): 35-40. DOI:10.1016/s0141-8130(99)00115-4
[49] STOLYAR S V, KRASITSKAYA V V, FRANK L A, et al. Polysaccharide-coated iron oxide nanoparticles: Synthesis, properties, surface modification[J]. Materials Letters, 2021, 284: 128920. DOI:10.1016/j.matlet.2020.128920
[50] RAKOTOMALALA ROBINSON M, ABDELMOULA M, MALLET M, et al. Starch functionalized magnetite nanoparticles: new insight into the structural and magnetic properties[J]. Journal of Solid State Chemistry, 2019, 277: 587-593. DOI:10.1016/j.jssc.2019.06.033
[51] ADIMOOLAM M G, AMREDDY N, NALAM M R, et al. A simple approach to design chitosan functionalized Fe3O4 nanoparticles for pH responsive delivery of doxorubicin for cancer therapy[J]. Journal of Magnetism and Magnetic Materials, 2018, 448: 199-207. DOI:10.1016/j.jmmm.2017.09.018
[52] ZHI Jia, WANG Yujun, LU Yangcheng, et al. In situ preparation of magnetic chitosan/Fe3O4 composite nanoparticles in tiny pools of water-in-oil microemulsion[J]. Reactive & Functional Polymers, 2006, 66(12): 1552-1558. DOI:10.1016/j.reactfunctpolym.2006.05.006
[53] PHAM X N, NGUYEN T P, PHAM T N, et al. Synthesis and characterization of chitosan-coated magnetite nanoparticles and their application in curcumin drug delivery[J]. Advances in Natural Sciences: Nanoscience and Nanotechnology, 2016, 7(4): 045010. DOI:10.1088/2043-6262/7/4/045010
[54] TALEBI M, BALASI Z M, AHADIAN M M, et al. Biocompatibility and hyperthermia efficiency of sonochemically synthesized magnetic nanoparticles[J]. Spin, 2019, 9(2): 1940006. DOI:10.1142/s201032471940006x
[55] BALACHANDRAMOHAN J, ANANDAN S, SIVASANKAR T. A simple approach for the sonochemical synthesis of Fe3O4-guargum nanocomposite and its catalytic reduction of p-nitroaniline[J]. Ultrasonics Sonochemistry, 2018, 40: 1-10. DOI:10.1016/j.ultsonch.2017.06.012
[56] HAJNOROUZI A, MODARESI N. Direct sono electrochemical method for synthesizing Fe3O4 nanoparticles[J]. Journal of Magnetism and Magnetic Materials, 2020, 505: 166732. DOI:10.1016/j.jmmm.2020.166732
[57] KARIMZADEH I, AGHAZADEH M, GANJALI M R, et al. Saccharide-coated superparamagnetic Fe3O4 nanoparticles (SPIONs) for biomedical applications: An efficient and scalable route for preparation and in situ surface coating through cathodic electrochemical deposition (CED)[J]. Materials Letters, 2017, 189: 290-294. DOI:10.1016/j.matlet.2016.12.010
[58] AGHAZADEH M, KARIMZADEH I. One-pot electro-synthesis and characterization of chitosan capped superparamagnetic iron oxide nanoparticles (SPIONs) from ethanol media[J]. Current Nanoscience, 2018, 14(1): 42-49. DOI:10.2174/1573413713666170825113906
[59] AGHAZADEH M. Electrochemical synthesis of dextran-and polyethyleneimine-coated superparamagnetic iron oxide nanoparticles and investigation of their physico-chemical characters[J]. Analytical & Bioanalytical Electrochemistry, 2019, 11(3): 362-372.
[60] AHMADI A. Facile electrosynthesis of zinc-doped superparamagnetic iron oxide nanoparticles and their surface capping with dextran layer for biomedical uses[J]. Analytical & Bioanalytical Electrochemistry, 2019, 11(5): 625-634.
[61] LI Guiyin, JIANG Yuren, HUANG Kelong, et al. Preparation and properties of magnetic Fe3O4-chitosan nanoparticles[J]. Journal of Alloys and Compounds, 2008, 466(1-2): 451-456. DOI:10.1016/j.jallcom.2007.11.100
[62] MANSUR S, RAI A, HOLLER R A, et al. Synthesis and characterization of iron oxide superparticles with various polymers[J]. Journal of Magnetism and Magnetic Materials, 2020, 515: 167265. DOI:10.1016/j.jmmm.2020.167265
[63] HAUKSDOTTIR H L, WEBSTER T J. Selenium and iron oxide nanocomposites for magnetically-targeted anti-cancer applications[J]. Journal of Biomedical Nanotechnology, 2018, 14(3): 510-525. DOI:10.1166/jbn.2018.2521
[64] RANA P, SHARMA S, SHARMA R, et al. Apple pectin supported superparamagnetic (γ-Fe2O3) maghemite nanoparticles with antimicrobial potency[J]. Materials Science for Energy Technologies, 2019, 2(1): 15-21. DOI:10.1016/j.mset.2018.09.001
[65] JACINTO M J, SILVA V C, VALLADAO D M S, et al. Biosynthesis of magnetic iron oxide nanoparticles: a review[J]. Biotechnology Letters, 2020, 43(1): 1-12. DOI:10.1007/s10529-020-03047-0
[66] KIANPOUR S, EBRAHIMINEZHAD A, DEYHIMI M, et al. Structural characterization of polysaccharide-coated iron oxide nanoparticles produced by staphylococcus warneri, isolated from a thermal spring[J]. Journal of Basic Microbiology, 2019, 59(6): 569-578. DOI:10.1002/jobm.201800684
[67] EBRAHIMINEZHAD A, ZARE M, KIYANPOUR S, et al. Biosynthesis of xanthan gum-coated INPs by using xanthomonas campestris[J]. IET Nanobiotechnology, 2018, 12(3): 254-258. DOI:10.1049/iet-nbt.2017.0199
[68] TANCREDI P, BOTASINI S, MOSCOSO-LONDONO O, et al. Polymer-assisted size control of water-dispersible iron oxide nanoparticles in range between 15 and 100 nm[J]. Colloids and Surfaces a-Physicochemical and Engineering Aspects, 2015, 464: 46-51. DOI:10.1016/j.colsurfa.2014.10.001
[69] HRADIL J, PISAREV A, BABI? M, et al. Dextran-modified iron oxide nanoparticles[J]. China Particuology, 2007, 5(1-2): 162-168. DOI:10.1016/j.cpart.2007.01.003
[70] XU X Q, SHEN H, XU J R, et al. Core-shell structure and magnetic properties of magnetite magnetic fluids stabilized with dextran[J]. Applied Surface Science, 2005, 252(2): 494-500. DOI:10.1016/j.apsusc.2005.01.027
[71] SARASWATHY A, NAZEER S S, NIMI N, et al. Synthesis and characterization of dextran stabilized superparamagnetic iron oxide nanoparticles for in vivo MR imaging of liver fibrosis[J]. Carbohydrate Polymers, 2014, 101: 760-768. DOI:10.1016/j.carbpol.2013.10.015
[72] ZHU Aiping, YUAN Lanhua, JIN Wenjie, et al. Polysaccharide surface modified Fe3O4 nanoparticles for camptothecin loading and release[J]. Acta Biomaterialia, 2009, 5(5): 1489-1498. DOI:10.1016/j.actbio.2008.10.022
[73] VASI ? K, KNEZ ?, KONSTANTINOVA E A, et al. Structural and magnetic characteristics of carboxymethyl dextran coated magnetic nanoparticles: From characterization to immobilization application[J]. Reactive and Functional Polymers, 2020, 148. DOI:10.1016/j.reactfunctpolym.2020.104481
[74] CHANG P R, YU Jiugao, MA Xiaofei, et al. Polysaccharides as stabilizers for the synthesis of magnetic nanoparticles[J]. Carbohydrate Polymers, 2011, 83(2): 640-644. DOI:10.1016/j.carbpol.2010.08.027
[75] DIAS A M, HUSSAIN A, MARCOS A S, et al. A biotechnological perspective on the application of iron oxide magnetic colloids modified with polysaccharides[J]. Biotechnology Advances, 2011, 29(1): 142-155. DOI:10.1016/j.biotechadv.2010.10.003
[76] SOUMIA A, ADEL M, AMINA S, et al. Fe3O4-alginate nanocomposite hydrogel beads material: One-pot preparation, release kinetics and antibacterial activity[J]. International Journal of Biological Macromolecules, 2020, 145: 466-475. DOI:10.1016/j.ijbiomac.2019.12.211
[77] MAHDAVINIA G R, ETEMADI H. Surface modification of iron oxide nanoparticles with kappa-carrageenan/carboxymethyl chitosan for effective adsorption of bovine serum albumin[J]. Arabian Journal of Chemistry, 2019, 12(8): 3692-3703. DOI:10.1016/j.arabjc.2015.12.002
[78] KLOSTER G A, MURACA D, MOSCOSO LONDO?O O, et al. Structural analysis of magnetic nanocomposites based on chitosan[J]. Polymer Testing, 2018, 72: 202-213. DOI:10.1016/j.polymertesting.2018.10.022
[79] CESANO F, FENOGLIO G, CARLOS L, et al. One-step synthesis of magnetic chitosan polymer composite films[J]. Applied Surface Science, 2015, 345: 175-181. DOI:10.1016/j.apsusc.2015.03.154
[80] CARMEN BAUTISTA M, BOMATI-MIGUEL O, DEL PUERTO MORALES M, et al. Surface characterisation of dextran-coated iron oxide nanoparticles prepared by laser pyrolysis and coprecipitation[J]. Journal of Magnetism and Magnetic Materials, 2005, 293(1): 20-27.
[81] ZHU Aiping, YUAN Lanhua, LIAO Tianqing. Suspension of Fe3O4 nanoparticles stabilized by chitosan and o-carboxymethylchitosan[J]. International Journal Of Pharmaceutics, 2008, 350(1-2): 361-368. DOI:10.1016/j.ijpharm.2007.09.004
[82] PENG Mingli, LI Houli, LUO Zhiyi, et al. Dextran-coated superparamagnetic nanoparticles as potential cancer drug carriers in vivo[J]. Nanoscale, 2015, 7(25): 11155-11162. DOI:10.1039/c5nr01382h
[83] WANG Yujyuan, LIN Peiying, HSIEH Shulin, et al. Utilizing edible agar as a carrier for dual functional doxorubicin-Fe3O4 nanotherapy drugs[J]. Materials, 2021, 14(8): 1824. DOI:10.3390/ma14081824
[84] KARTHIKA V, ALSALHI M S, DEVANESAN S, et al. Chitosan overlaid Fe3O4/rGO nanocomposite for targeted drug delivery, imaging, and biomedical applications[J]. Scientific Reports, 2020, 10(1): 18912. DOI:10.1038/s41598-020-76015-3
[85] KARPISHEH V, AFJADI J F, AFJADI M N, et al. Inhibition of HIF-1 alpha/EP4 axis by hyaluronate-trimethyl chitosan-SPION nanoparticles markedly suppresses the growth and development of cancer cells[J]. International Journal of Biological Macromolecules, 2021, 167: 1006-1019. DOI:10.1016/j.ijbiomac.2020.11.056
[86] AL-MUSAWI S, ALBUKHATY S, AL-KARAGOLY H, et al. Design and synthesis of multi-functional superparamagnetic core-gold shell nanoparticles coated with chitosan and folate for targeted antitumor therapy[J]. Nanomaterials, 2021, 11(1): 32. DOI:10.3390/nano11010032
[87] SOLEYMANI M, VELASHJERDI M, SHATERABADI Z, et al. One-pot preparation of hyaluronic acid-coated iron oxide nanoparticles for magnetic hyperthermia therapy and targeting CD44-overexpressing cancer cells[J]. Carbohydrate Polymers, 2020, 237: 116130. DOI:10.1016/j.carbpol.2020.116130
[88] YOO J, PARK C, YI G, et al. Active targeting strategies using biological ligands for nanoparticle drug delivery systems[J]. Cancers, 2019, 11(5): 640. DOI:10.3390/cancers11050640
[89] LI Zihou, MA Xuehua, XIA Yuanzhi, et al. A pH-sensitive polymer based precise tumor targeting strategy with reduced uptake of nanoparticles by non-cancerous cells[J]. Journal of Materials Chemistry B, 2019, 7(39): 5983-5991. DOI:10.1039/c9tb01202h
[90] ILYAS S, ULLAH N K, ILYAS M, et al. Mediating the fate of cancer cell uptake: dual-targeted magnetic nanovectors with biotin and folate surface ligands[J]. Acs Biomaterials Science & Engineering, 2020, 6(11): 6138-6147. DOI:10.1021/acsbiomaterials.0c00771
[91] ANGELOPOULOU A, KOLOKITHAS-NTOUKAS A, FYTAS C, et al. Folic acid-functionalized, condensed magnetic nanoparticles for targeted delivery of doxorubicin to tumor cancer cells overexpressing the folate receptor[J]. Acs Omega, 2019, 4(26): 22214-22227. DOI:10.1021/acsomega.9b03594
[92] AMANI A, ALIZADEH M R, YAGHOUBI H, et al. Novel multi-targeted nanoparticles for targeted co-delivery of nucleic acid and chemotherapeutic agents to breast cancer tissues[J]. Materials Science and Engineering C, 2021, 118: 111494. DOI:10.1016/j.msec.2020.111494
[93] MUHAMAD N, PLENGSURIYAKARN T, NA-BANGCHANG K. Application of active targeting nanoparticle delivery system for chemotherapeutic drugs and traditional/herbal medicines in cancer therapy: a systematic review[J]. International Journal of Nanomedicine, 2018, 13: 3921-3935. DOI:10.2147/IJN.S165210
[94] AL-MUSAWI S, ALBUKHATY S, AL-KARAGOLY H, et al. Dextran-coated superparamagnetic nanoparticles modified with folate for targeted drug delivery of camptothecin[J]. Advances in Natural Sciences-Nanoscience and Nanotechnology, 2020, 11(4): 3921-3935. DOI:10.1088/2043-6254/abc75b
[95] DHAVALE R P, DHAVALE R P, SAHOO S C, et al. Chitosan coated magnetic nanoparticles as carriers of anticancer drug Telmisartan: pH-responsive controlled drug release and cytotoxicity studies[J]. Journal of Physics and Chemistry of Solids, 2021, 148: 109749. DOI:10.1016/j.jpcs.2020.109749
[96] HUDA S, ALAM M A, SHARMA P K. Smart nanocarriers-based drug delivery for cancer therapy: an innovative and developing strategy[J]. Journal of Drug Delivery Science and Technology, 2020, 60: 102018. DOI:10.1016/j.jddst.2020.102018
[97] AL-MUSAWI S, IBRAHEEM S, ABDUL MAHDI S, et al. Smart nanoformulation based on polymeric magnetic nanoparticles and vincristine drug: a novel therapy for apoptotic gene expression in tumors[J]. Life, 2021, 11(1): 102018. DOI:10.3390/life11010071
[98] ZHOU Z, SUN T, JIANG C. Recent advances on drug delivery nanocarriers for cerebral disorders[J]. Biomedical Materials, 2021, 16(2): 024104. DOI:10.1088/1748-605X/abdc97
[99] ARIAS L S, PESSAN J P, VIEIRA A P M, et al. Iron oxide nanoparticles for biomedical applications: a perspective on synthesis, drugs, antimicrobial activity, and toxicity[J]. Antibiotics-Basel, 2018, 7(2): 46. DOI:10.3390/antibiotics7020046
[100] PONGRAC I M, PAVICIC I, MILIC M, et al. Oxidative stress response in neural stem cells exposed to different superparamagnetic iron oxide nanoparticles[J]. International Journal of Nanomedicine, 2016, 11: 1701-1715. DOI:10.2147/IJN.S102730
