郑威1,董学明1,何阳2,刘彦菊3,冷劲松2
(1.哈尔滨商业大学 药学院,哈尔滨 150076;2.哈尔滨工业大学 复合材料与结构研究所,哈尔滨 150080; 3.哈尔滨工业大学 航天工程与力学系,哈尔滨 150001)
摘要:
骨是世界上第二大需要移植的组织,每年至少有400万次手术使用骨移植物和骨代替材料。传统的治疗方法的局限性影响了当前的治疗选择,并且由于创伤、癌症、感染和关节炎引起的骨缺损现象不断增加,在临床治疗中对骨移植物的需求也持续上升。自体移植物和异体移植物是临床治疗骨缺损的常用方法,而慢性炎症、疾病传播和免疫排斥反应的发生阻碍了其发展。此外,金属材料支架也是最常用的植入物,然而同样存在着诸如应力屏蔽、感染和炎症等问题导致研究工作者期待新材料支架来代替它。因此,开发具有生物活性且能自适应展开填充的三维支架以促进骨骼再生已成为骨组织工程的重点关注领域。近年来,包括4D打印形状记忆材料的制造方法已被用于创造替代传统骨移植的新方法。本文主要综述了传统聚合物材料和新型形状记忆聚合物材料的种类、支架的主要制造方法、机械性能、生物相容性以及在骨组织工程领域中的最新用途,并总结了骨组织工程中4D打印技术的重要性、当前面临的挑战和未来的发展方向。
关键词: 生物活性材料 形状记忆聚合物 3D支架 骨组织工程 4D打印
DOI:10.11918/202007079
分类号:R318.08
文献标识码:A
基金项目:国家自然科学基金(5,6, 11802077); 国家自然科学基金委员会创新研究群体基金(11421091);黑龙江省普通本科高等学校青年创新人才培养计划(UNPYSCT-2017210)
Development of bioactive polymers and their composite materials in bone tissue engineering
ZHENG Wei1,DONG Xueming1,HE Yang2,LIU Yanju3,LENG Jinsong2
(1.School of Pharmacy, Harbin University of Commerce, Harbin 150076, China; 2.Center for Composite Materials and Structures, Harbin Institute of Technology, Harbin 150080, China; 3.Department of Astronautical Science and Mechanics, Harbin Institute of Technology, Harbin 150001, China)
Abstract:
Bone is the second most commonly transplanted tissue in the world, with at least four million surgical procedures using bone grafts and bone substitutes every year. However, the limitations of traditional treatments have affected current treatment options, and the clinical demand for bone grafts has continued to increase due to the high incidence of trauma, cancer, infection, and arthritis. Autografts and allografts are commonly used in the clinical treatment of bone defects, but chronic inflammation, disease transmission, and immune rejection have hindered their development. In addition, metal-based material scaffolds are the most widely used implants, while there are also problems such as stress shield, infection, and inflammation, leading researchers to find new material scaffolds to replace them. Therefore, developing bioactive three-dimensional (3D) scaffolds that can be adaptively expanded and filled to promote bone regeneration has become a key area of focus in bone tissue engineering (BTE). In recent years, manufacturing methods including 4D printing of shape memory materials have been used to create new methods to replace traditional bone grafts. This paper mainly reviews the classification of traditional polymer materials and new shape memory polymer materials, the main manufacturing methods, mechanical properties, biocompatibility, and the latest applications of polymer scaffolds in BTE. Furthermore, the importance, current challenges, and future development directions of 4D printing technology in BTE are summarized.
Key words: bioactive materials shape memory polymer 3D scaffold bone tissue engineering (BTE) 4D printing
郑威, 董学明, 何阳, 刘彦菊, 冷劲松. 生物活性聚合物及其复合材料在骨组织工程中的应用进展[J]. 哈尔滨工业大学学报, 2021, 53(8): 1-16. DOI: 10.11918/202007079.

ZHENG Wei, DONG Xueming, HE Yang, LIU Yanju, LENG Jinsong. Development of bioactive polymers and their composite materials in bone tissue engineering[J]. Journal of Harbin Institute of Technology, 2021, 53(8): 1-16. DOI: 10.11918/202007079.

基金项目 国家自然科学基金(11632005, 11672086, 11802077);国家自然科学基金委员会创新研究群体基金(11421091);黑龙江省普通本科高等学校青年创新人才培养计划(UNPYSCT-2017210) 作者简介 郑威(1983—),男,博士研究生 通信作者 冷劲松,lengjs@hit.edu.cn 文章历史 收稿日期: 2020-07-15
Abstract Full text Figures/Tables PDF
生物活性聚合物及其复合材料在骨组织工程中的应用进展
郑威1, 董学明1, 何阳2, 刘彦菊3, 冷劲松2


1. 哈尔滨商业大学 药学院,哈尔滨 150076;
2. 哈尔滨工业大学 复合材料与结构研究所,哈尔滨 150080;
3. 哈尔滨工业大学 航天工程与力学系,哈尔滨 150001
收稿日期: 2020-07-15
基金项目: 国家自然科学基金(11632005, 11672086, 11802077);国家自然科学基金委员会创新研究群体基金(11421091);黑龙江省普通本科高等学校青年创新人才培养计划(UNPYSCT-2017210)
作者简介: 郑威(1983—),男,博士研究生
通信作者: 冷劲松,lengjs@hit.edu.cn
摘要: 骨是世界上第二大需要移植的组织,每年至少有400万次手术使用骨移植物和骨代替材料。传统的治疗方法的局限性影响了当前的治疗选择,并且由于创伤、癌症、感染和关节炎引起的骨缺损现象不断增加,在临床治疗中对骨移植物的需求也持续上升。自体移植物和异体移植物是临床治疗骨缺损的常用方法,而慢性炎症、疾病传播和免疫排斥反应的发生阻碍了其发展。此外,金属材料支架也是最常用的植入物,然而同样存在着诸如应力屏蔽、感染和炎症等问题导致研究工作者期待新材料支架来代替它。因此,开发具有生物活性且能自适应展开填充的三维支架以促进骨骼再生已成为骨组织工程的重点关注领域。近年来,包括4D打印形状记忆材料的制造方法已被用于创造替代传统骨移植的新方法。本文主要综述了传统聚合物材料和新型形状记忆聚合物材料的种类、支架的主要制造方法、机械性能、生物相容性以及在骨组织工程领域中的最新用途, 并总结了骨组织工程中4D打印技术的重要性、当前面临的挑战和未来的发展方向。
关键词: 生物活性材料 形状记忆聚合物 3D支架 骨组织工程 4D打印
Development of bioactive polymers and their composite materials in bone tissue engineering
ZHENG Wei1, DONG Xueming1, HE Yang2, LIU Yanju3, LENG Jinsong2


1. School of Pharmacy, Harbin University of Commerce, Harbin 150076, China;
2. Center for Composite Materials and Structures, Harbin Institute of Technology, Harbin 150080, China;
3. Department of Astronautical Science and Mechanics, Harbin Institute of Technology, Harbin 150001, China
Abstract: Bone is the second most commonly transplanted tissue in the world, with at least four million surgical procedures using bone grafts and bone substitutes every year. However, the limitations of traditional treatments have affected current treatment options, and the clinical demand for bone grafts has continued to increase due to the high incidence of trauma, cancer, infection, and arthritis. Autografts and allografts are commonly used in the clinical treatment of bone defects, but chronic inflammation, disease transmission, and immune rejection have hindered their development. In addition, metal-based material scaffolds are the most widely used implants, while there are also problems such as stress shield, infection, and inflammation, leading researchers to find new material scaffolds to replace them. Therefore, developing bioactive three-dimensional (3D) scaffolds that can be adaptively expanded and filled to promote bone regeneration has become a key area of focus in bone tissue engineering (BTE). In recent years, manufacturing methods including 4D printing of shape memory materials have been used to create new methods to replace traditional bone grafts. This paper mainly reviews the classification of traditional polymer materials and new shape memory polymer materials, the main manufacturing methods, mechanical properties, biocompatibility, and the latest applications of polymer scaffolds in BTE. Furthermore, the importance, current challenges, and future development directions of 4D printing technology in BTE are summarized.
Keywords: bioactive materials shape memory polymer 3D scaffold bone tissue engineering (BTE) 4D printing
骨组织由两种不同的结构组成:松质骨和皮质骨(图 1)。松质骨的内部结构是海绵状的,具有50%~90%的孔隙率。皮质骨是致密的骨外层,孔隙率小于10%。两种类型骨形成都需要经历动态重塑、成熟、分化和再吸收的过程。这些过程通过骨细胞、成骨细胞和破骨细胞之间的相互作用来控制调节[1-2]。成骨细胞主要负责新骨形成,而破骨细胞负责老骨的再吸收。这种涉及破骨细胞和成骨细胞的动态过程称为骨重建,对于促进骨再生和维持组织结构的完整性具有重要意义。骨组织有良好的自我修复能力,尽管如此,包括创伤、感染、肿瘤和关节置换术后翻修在内的先天性和后天性病变仍然能够使患者的骨缺损超出身体无法治愈的临界尺寸[3-5]。这些患者需要通过外科手术将骨代替物移植到骨缺损部位,以帮助骨骼稳定和再生。在欧洲,预计从2010年到2025年骨折的增长率将达到28%[6]。美国与年龄有关的骨折人数预计将从2005年的210万增加到2025年的300多万[7]。骨骼是世界上第二大最常被移植的组织,每年至少有400万次手术使用骨移植物和骨替代材料[8-10]。
Fig. 1
 图 1 骨组织示意[1] Fig. 1 Schematic of bone tissue[1]
图 1 骨组织示意[1] Fig. 1 Schematic of bone tissue[1] 目前用于骨修复和再生的临床治疗方法包括使用自体骨移植物和同种异体骨移植物的自体移植和异体移植[11-12]。有大量的研究报告指出了这些疗法的局限性和并发症。自体骨移植物具有组织相容性和非免疫原性,因此成为了骨移植物的黄金标准,并且它们提供了骨移植物材料所需的所有必要性能。具体而言,自体骨移植物具有实现骨诱导(即骨形态发生蛋白(bone morphogenetic protein, BMP)和其他生长因子)、成骨作用(即骨祖细胞)和骨传导(即三维多孔基质)的基本成分。但是,自体骨移植需要从患者的其他部位骨骼中获得,因此需要在组织收集部位进行第二次手术[13]。自体骨移植是非常昂贵的手术,可能导致供体部位的严重损伤和发病率, 造成畸形、疤痕形成,并且还增加了相关的手术风险:包括出血、炎症、感染和慢性疼痛等[14-16]。此外,在缺损部位需要的骨量超过可行或可用量的情况下,自体骨移植可能是无效的治疗选择。同种异体移植是第二种最常见的骨移植技术,需要从供体者骨骼中获取所需骨组织。同种异体骨也具有一定的组织相容性,并且可以根据宿主缺损部位的需要通过多种形式获得,包括脱矿质骨基质(demineralized bone matrix, DBM)、皮质松质骨和皮质骨移植、骨软骨和全骨段等。与自体骨移植相比,同种异体移植具有免疫反应和增加感染传播的风险。它们具有相对较低的骨诱导特性,并且没有细胞成分,因为供体骨移植物往往需要经过辐射或冷冻干燥等过程,在此期间大部分的酶以及生长因子失活[17-19]。同种异体骨的来源依旧有限,并且手术费用同样很高。此外,骨移植市场正面临明显的供不应求和巨大需求[20]。目前同种异体骨移植材料出现严重短缺。其他常用的临床骨修复辅助技术包括牵拉骨生成、骨水泥填充剂和骨形态发生蛋白等,虽然上述临床干预措施已被证明可以改善骨修复,但没有一种具有所有理想的骨修复特性:较高的骨诱导性能和优异的血管生成潜力、生物相容性、低患者发病率、无尺寸限制、外科医生可随时获得、较长的保质期以及合理的成本。
近年来,组织工程的出现为骨缺损的治疗提供了新的方向。通过组织工程获得的骨代替物解决了自体移植物和同种异体移植物资源匮乏的问题。利用传统聚合物材料以及近几年新型的形状记忆聚合物材料制得的骨组织工程支架不仅能为新形成的骨组织提供结构完整性,而且互连多孔结构能够增强细胞渗透、新组织形成、营养物质运输以及新血管的形成。新型的形状记忆支架更能根据患者的不同缺损情况实现个性化“自适应”填充。此外,由于良好的生物相容性,可调节的化学组成和生物降解性,新型的形状记忆聚合物作为用于制造医疗产品和骨替代物的生物材料是非常有前途的。因此,本文主要综述了传统聚合物材料及新型的形状记忆聚合物材料近些年在骨修复中的应用情况。
1 传统聚合物材料传统聚合物由于其具有良好的延展性、生物相容性以及生物可降解性能等优点,被广泛使用在制备骨修复支架中。在传统聚合物支架表面上装载生物活性分子,可显著提高细胞在支架上的粘附、增殖和分化。传统的聚合物如胶原(collagen, Col)、壳聚糖(chitosan, CS)、透明质酸(hyaluronic acid, HA)、丝素蛋白(silk fibroin, SF)、甲壳质(chitin, CI)、明胶(凝胶)和藻酸盐(alginic acid sodium salt, Alg)及其复合物是资源丰富的生物材料,在骨组织工程中占据着主要地位。
1.1 胶原蛋白(Col)基复合支架Col是人体内最丰富,分布最广的蛋白质[21]。在骨组织工程中,从海洋海绵和反刍动物等各种来源获得的胶原被广泛地与各种其他材料结合使用,用于制造电纺纤维、支架基质和水凝胶,以帮助靶向输送生物因子、促进干细胞分化和成骨化[22-23]。利用细菌和酵母大规模合成的重组人样Col,有助于提高成纤维细胞的相容性和促进骨生长。生物相容性高、基质模拟和可生物降解等特性使其成为骨修复中最常应用的传统聚合物材料[24-25]。胶原的机械性能和降解特性可以通过交联过程来定制。然而,与其他传统聚合物一样,胶原蛋白的机械性能不足以作为承重支架使用,往往与骨组织工程(bone tissue engineering, BTE)中更坚固的材料结合以产生复合支架。例如,作为骨骼的主要无机成分,羟基磷灰石(hydroxyapatite, HAP)经常与胶原蛋白结合制备复合支架。
Zhang等[26]通过冷冻干燥后脱水热处理制备多孔和交联的Col/HAP复合支架。通过调节Col/HAP比率和脱水热时期,获得具有各种孔隙率、机械强度和稳定性的骨修复支架。细胞实验结果见图 2,成骨细胞在不同含量组成的Col/HAP支架中均有不同程度的粘附和增殖,说明该材料具有良好的生物相容性和可诱导细胞增殖的性能。
Villa等[27]通过共沉淀和冷冻浇铸法制备了胶原-羟基磷灰石(Col-HAP)复合支架。所形成的支架具有99%的孔隙率,高度的渗透性有利于细胞的浸润和附着。将在小鼠骨髓中获得的骨髓间充质干细胞(bone mesenchymal stem cells, BMSC)接种到支架上,在体外培养12 h后能观察到细胞在支架上良好附着。随后将支架植入小鼠颅骨缺损处,三周后放射影像和矿化分析发现颅骨缺损几乎完全填充。数周后,宿主的基质金属蛋白酶会逐渐分解胶原蛋白致使支架逐渐降解完全。为可降解生物支架提供了新的思路。相比之下,Marcacci等[28]发现,将纯HAP支架植入4例长骨缺损患者6 a后,存在支架无法降解的情况。Col-HAP支架的机械性能使其最适合于非承重应用,如面部修复[27],或者应用于辅助治疗复杂骨折,就像常用的骨替代品或骨移植一样,并可以结合机械固定来实现修复目的[29]。
Fig. 2
 图 2 在不同含量组成的Col/HAP支架上成骨细胞培养7 d的共聚焦荧光图像[26] Fig. 2 Confocal fluorescence images of osteoblasts cultured on Col/HAP scaffolds with different contents for 7 d[26]
图 2 在不同含量组成的Col/HAP支架上成骨细胞培养7 d的共聚焦荧光图像[26] Fig. 2 Confocal fluorescence images of osteoblasts cultured on Col/HAP scaffolds with different contents for 7 d[26] Ren等[30]研究了矿化胶原/糖胺聚糖(mineralized collagen-glycosaminoglycan, MC-GAG)支架。动物(兔)实验表明,与非矿化胶原/糖胺聚糖支架相比,MC-GAG植入物具有更好的支持骨修复颅骨缺损的能力。如图 3所示,在未重建和Col-GAG重建的缺陷中,在缺损的中心部分发现较小的矿化含量,而MC-GAG支架的中心部分含有更多的矿化骨。
Fig. 3
 图 3 体内组织学分析Col-GAG和MC-GAG支架植入临界大小的兔颅骨缺损中的骨修复情况[30] Fig. 3 Histologic analysis of in vivo bone healing in critical sized rabbit cranial defects implanted with Col-GAG and MC-GAG scaffolds[30]
图 3 体内组织学分析Col-GAG和MC-GAG支架植入临界大小的兔颅骨缺损中的骨修复情况[30] Fig. 3 Histologic analysis of in vivo bone healing in critical sized rabbit cranial defects implanted with Col-GAG and MC-GAG scaffolds[30] 1.2 壳聚糖(CS)基复合支架甲壳质(CI)是最丰富的天然氨基多糖,主要从甲壳类动物(虾、蟹、龙虾等)中提取。CI和CS被认为是一种多功能的生物材料。尽管CI具有各种工业应用,但由于其溶解性弱,在骨修复中的使用受到限制。另一方面,脱乙酰化的CI衍生物-CS是公认的天然聚合物。它主要包括的单元即(1-4)糖苷键连接的D-葡糖胺残基与随机定位的可变数目N-乙酰基-D-葡糖胺酶(N-acetyl-glucosaminidase, NAG) 基团。CS具有与糖胺聚糖(glycosaminoglycan, GAG)相似结构,GAG是细胞外基质(extracellular matrix, ECM)中与胶原纤维相互作用并在细胞-细胞粘附中起重要作用的成分之一。CS在骨修复支架制造领域非常重要,因为它具有良好的生物相容性、可生物降解性以及抗菌作用等[31-33]。为了增强CS的性能,聚合物如Alg、Gel、PCL和生物活性纳米陶瓷如HAP、SiO2、TiO2、ZrO2等已被用于增加CS生物复合材料的机械强度[34-36]。
Elkholy等[37]开发了一种β-CS/n-HAP复合材料。随着β-CS的增加力学性能逐渐增大,当重量比达到30∶ 70时β-CS/n-HAP复合材料获得了最佳力学性能(抗压强度为13.05 MP)。此外,研究发现β-CS/n-HAP复合材料在SBF溶液中浸泡8周后,壳聚糖逐渐减少并几乎消失,说明壳聚糖具有良好的生物可降解性能[38]。动物实验结果见图 4,复合β-CS/n-HAP作为可生物降解的骨替代物,不仅可以促进骨骼生成,还可以加速Haversian系统的形成。
Fig. 4
 图 4 对照组和植入组的显微图像[37] Fig. 4 Microscopic images of control group and implanted group[37]
图 4 对照组和植入组的显微图像[37] Fig. 4 Microscopic images of control group and implanted group[37] Wu等[39]通过粒子浸出法后压缩成型的方式制备了负载壳聚糖/纳米羟基磷灰石-阿伦磷酸盐(CH/nHAP-ALs)微球的多孔聚乳酸/纳米羟基磷灰石复合支架系统(CM-ALs)。并对载有0%、10%和20%的(CH/nHAP-ALs)微球的复合支架的表面形态、孔隙率、机械性能、药物体外释放和成骨分化性能等方面进行了测试。SEM观察到支架呈现均匀互相贯穿的多孔结构,孔径大约在150~250 μm之间。体外细胞实验表明与多孔聚乳酸/纳米羟基磷灰石支架相比,兔脂肪间充质干细胞(rabbit adipose-derived mesenchymal stem cells, ASCs)在负载壳聚糖载药微球的支架上培养5 d后发现快速增殖和细胞外基质的生成,碱性磷酸酶(alkaline phosphatase, ALP)活性和钙沉积显著增加。随后,将含有质量分数0%和10%的载药微球多孔复合支架植入兔骨缺损模型中进一步评估体内诱导骨生成性能。在植入4~8周期间,X射线分析发现骨缺损愈合,并伴有新骨形成。含有质量分数10%载药微球的支架组新骨形成率显著增高,这一效应随时间的延长而增强(图 5)。主要是因为阿伦磷酸盐的持续释放能长达30 d,提高骨的修复再生能力。这种可以持续释放药物并能支持干细胞增殖分化的多孔复合支架,在骨组织工程中具有巨大的应用前景。
Fig. 5
 图 5 X射线分析CM-ALs(0%)与CM-ALs(10%)植入组新骨形成情况[39] Fig. 5 X-ray analysis of new bone formation in CM-ALs (0%) and CM-ALs (10%) implanted groups[39]
图 5 X射线分析CM-ALs(0%)与CM-ALs(10%)植入组新骨形成情况[39] Fig. 5 X-ray analysis of new bone formation in CM-ALs (0%) and CM-ALs (10%) implanted groups[39] 1.3 透明质酸(HA)基复合支架透明质酸(HA)是一种线性高分子多糖,最常被称为乙酰透明质酸。它由α-1, 4-D-葡糖醛酸和β-1, 3-N-乙酰基-D-葡糖胺的交替二糖单元组成。HA作为一种天然糖胺聚糖,广泛存在于结缔组织、上皮和神经组织中。作为细胞外基质的主要成分之一,既能充当结构元素,也能与结合蛋白、蛋白聚糖和其他生物活性分子相互作用,有助于调节水平衡,而且HA能显著促进细胞增殖和迁移。它通常具有非常大的分子量(103~107),适用于硬组织和软组织工程。HA不仅具有机械性能可调性,同时具有天然的黏弹性,可生物降解性和生物相容性,使其成为骨组织工程的理想材料。此外,它可以通过与细胞表面受体的相互作用来直接影响组织结构,促进细胞迁移和细胞外基质的重塑。事实上,已知HA通过复杂信号通路中涉及各种表面受体与软骨细胞相互作用使得软骨细胞能够维持其原始表型。
Unnithan等[40]将多种材料的有利特性结合起来,制备了一种负载骨诱导药物辛伐他汀(simvastatin capsules, SV)的氧化石墨烯-壳聚糖-透明质酸(GO-CS-HA)基生物活性复合支架。SV能促使人脂肪干细胞(human adipose-derived stem cells, hADSCs)来源的成骨细胞分化,提高BMP的表达水平。在该研究中,通过将CS和HA混合溶解,连续搅拌加入GO以产生复合混合物,然后进行冷冻干燥并加入SV,最后将制得的复合支架与N, N-(3-二甲基氨基丙基)-N-乙基碳二亚胺交联。电子显微镜发现支架具有相互贯通的多孔结构,GO的加入减少溶胀性并有助于增强支架的结构完整性。如图 6所示,在接种第24和48 h后,从FESEM(field emission scanning electron microscope) 图像获得支架上MC3T3(成骨细胞)细胞的形态和扩散模式。细胞在复合支架上显示出良好的附着性和优异的铺展性。在载有SV的GO-CS-HA支架中通过48 h培养后细胞的细长形态证实成骨细胞迁移。此外,在支架上的细胞中观察到延伸的形态表明成纤维细胞发生迁移,这可以加快组织再生。在整个研究期间,在负载SV的GO-CS-HA支架上观察到更多细胞。体外矿化实验分析14 d后在负载了SV的支架中发现更高的矿化水平。总体而言,负载了SV的GO-CS-HA的复合支架为骨组织工程提供了一种新的选择,其中加入的骨诱导药物能显著提高生物活性从而诱导骨组织加速形成。
Fig. 6
 图 6 MC3T3细胞在CS-HA、GO-CS-HA和SV-GO-CS-HA支架上分别培养24 h和48 h附着和增殖的FESEM图像[40] Fig. 6 FESEM images of MC3T3 cell attachment and proliferation on CS-HA, GO-CS-HA, and SV-GO-CS-HA at 24 h and 48 h respectively[40]
图 6 MC3T3细胞在CS-HA、GO-CS-HA和SV-GO-CS-HA支架上分别培养24 h和48 h附着和增殖的FESEM图像[40] Fig. 6 FESEM images of MC3T3 cell attachment and proliferation on CS-HA, GO-CS-HA, and SV-GO-CS-HA at 24 h and 48 h respectively[40] HA还被用作骨替代材料中提高生物活性的传递剂。Chang等[41]研究了使用HA作为羟基磷灰石/β-磷酸三钙(HAP-βTCP)颗粒的水性粘合剂是否可以减少所需的骨移植量并在临床情况下对移植物处理得更为方便。将HAP/βTCP加载到交联的HA中形成新的HA/HAP-βTCP复合物,然后将其注入体内兔颅骨缺损。组织学和微CT(micro-CT)分析发现,即使HAP-βTCP颗粒数量减少,HA也能维持骨再生。事实上,与对照支架相比,HA/HAP-βTCP样品在2周后的骨形成量增加了1.7倍。总之,向骨移植物中添加HA不仅促进了骨传导,而且在临床情况下也改善了处理特性。这为在医疗应用中提供了便利,在组织工程中具有巨大的应用前景。
1.4 丝素蛋白(SF)基复合支架丝素蛋白是一种典型的纤维蛋白,可形成天然蚕丝的细丝,具有独特的物理和化学特性。几十年来,丝纤维一直被用作生物医学应用中的缝合线,它们是骨组织工程中有吸引力的生物材料。因为它们的性质符合生物材料支架的许多要求,例如缓慢的降解性、高强度和柔韧性,可调节的基因组成和顺序,对水和氧的良好渗透性。此外,它们可以在水溶液中加工成凝胶、海绵、粉末和薄膜,并且由于具有氨基和羧基侧链,因此易于表面修饰进行改性。由家蚕(Bombyx mori)生产的无纺布纤维蛋白网支持包括成骨细胞在内的各种人类细胞生长的能力。工程丝纤维基质已用于韧带工程,高度多孔的丝海绵已被证明增强了骨髓来源的骨髓间充质干细胞的成骨和软骨形成作用。
Roohaniesfahani等[42]比较了HAP涂层的SF支架和HAP涂层的胶原支架的性能,他们将两种支架变体植入大鼠胫骨中,在体内6周后对支架周围的骨形成进行组织学分析。他们发现用HAP涂覆的SF支架促进了骨再生以及骨组织与支架融合程度,与HAP涂覆的胶原支架相比,显示出优异的结果。
此外,在骨组织工程中,SF也经常被用于骨修复支架涂层。Kweon等[43]开发了新型复合陶瓷支架,把纳米纤维PCL-SF涂层与双向磷酸钙(biphasic calcium phosphate ceramics, BCP)结合形成复合支架,其结构模仿天然细胞外基质,利用PCL和SF的双重有益效果。评估了纳米纤维PCL-SF涂层在增强BCP支架的机械和生物学行为方面的功效。PCL和丝的组合改善了BCP支架的机械强度和生物活性,纳米纤维PCL-SF的添加改善了支架抗压强度(从BCP的0.07 MPa到0.42 MPa),弹性模量(BCP从5 MPa到25 MPa),同时还保留了支架的孔隙率(85%)以及孔的连通率(99%)。生物活性方面,与BCP/PCL和BCP支架相比,BCP/PCL-SF支架中的成骨细胞增殖和分化率均有显著提高。众所周知,尽管陶瓷支架具有优异的成骨诱导特性,但它们固有的脆性限制了临床应用。在研究中,已经证明纳米纤维PCL-SF涂层可以解决BCP陶瓷支架的脆性并且导致压缩强度和模量的显著改善。对于复合支架,双层改性使BCP支架的破坏应变从小于1%增加至约7%,表明从脆性行为转变为弹性行为。这些改进的机制基于PCL和SF与BCP的相互作用。SF作为聚合物具有出色的机械强度,而PCL以其优异的韧性而闻名。因此,SF和PCL的组合弥补了BCP支架的特定弱点。为陶瓷类支架的应用提供了一种新的方法,这对于骨组织工程的开发提供了新的道路。
2 新型形状记忆聚合物材料近年来,由于形状记忆聚合物(shape memory polymer, SMP)在医疗、电子、高科技行业以及日常生活中的特殊应用,引起了生物医药领域人士越来越多的关注。SMP是一类刺激响应聚合物,加热状态下通过对其施加一定外力固定成临时形状,再通过外界环境刺激(例如:热、水、pH、电、磁场、湿度等)从临时形态转变为原始形态(图 7),其中最常见的是温度响应。SMP由于其低密度、经济成本、可加工性、可观的形状恢复特性[44-45],被认为是开发新型智能骨组织支架的绝佳选择。
Fig. 7
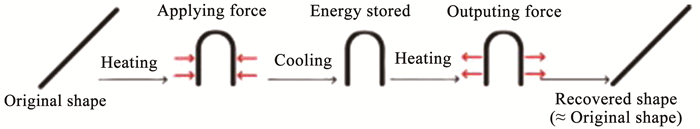 图 7 形状记忆过程示意[44] Fig. 7 Schematic of shape memory process[44]
图 7 形状记忆过程示意[44] Fig. 7 Schematic of shape memory process[44] SMP多年来已在医学应用中引起广泛关注,例如自紧缝合线[46],组织工程学[47-48]。对于其在微创手术中的潜力也已进行了深入研究,在此过程中,SMP在受到外部刺激后会从紧凑的结构扩展/恢复为原始形状[49-51]。除了微创植入的潜力外,具有形状恢复激活时产生的恢复力的SMP支架还可以在骨缺损中提供出色的自适配能力,较小的SMP支架能够在形状恢复(膨胀和扩展)后完全匹配骨缺损的边界[52]。通常,SMP支架的原始形状适度大于骨缺损的尺寸,从而导致从骨缺损朝向SMP支架的约束力。而骨缺损和支架之间的这种约束已被证明对骨骼向内生长有促进作用[53]。此外,可以通过调节交联密度或/和掺入纳米颗粒来满足骨再生的要求,从而控制SMP支架的孔互连性和力学性能[54-55]。
聚氨酯(polyurethane, PU)、聚乳酸(polylactic acid, PLA)、聚己内酯(polycaprolactone, PCL)等聚合物具有通过加热激活的形状记忆特性,在临床应用中,其独特的形状记忆性能能简化一些复杂的移植手术过程。此外,出色的化学稳定性,良好的生物相容性和生物降解性使其在骨组织工程中应用更加广泛。
2.1 形状记忆聚己内酯(PCL)基复合支架用于组织工程的具有可调节的转换温度(大约体温)的柔性可降解电活性形状记忆聚合物(electroactive shape memory polymer, ESMP)的开发仍然是一个挑战。Deng等[55]基于不同分子量的聚己内酯(PCL)和导电性氨基封端的苯胺三聚体,设计并合成了一系列具有电活性、超强可拉伸性和可调节恢复温度的形状记忆共聚物,并证明了它们具有增强成肌细胞(C2C12)分化能力的潜力。形状回复实验结果见图 8(a)~(c),不同分子量的PCL-AT(aniline trimer)共聚物在15 s内均能回复成原始形态。此外,为了研究PCL-AT共聚物的自展开能力,将PCL3000-5AT共聚物固定成一个螺旋形状(图 8(d))和圆环状(图 8(f)),然后在接近体温的温度下水浴加热,逐渐回复成原始的长方形(图 8(e)和(g))。这些结果表明,PCL-AT共聚物具有良好的形状记忆性能,并在自膨胀植入物的应用中具有巨大的潜力。此外,在电活性共聚物薄膜上研究了C2C12成肌细胞的增殖和分化,实验结果如图 9所示,与分子量为80 000的纯PCL相比,它们极大地增强了C2C12成肌细胞的增殖,肌管形成和相关的成肌分化基因的表达。这些具有电活性、可高度拉伸、可生物降解和具有接近体温附近的玻璃化转变温度的形状记忆聚合物,在骨骼肌组织工程应用中具有巨大潜力。此外,导电聚合物还可以调节细胞行为,例如细胞粘附、增殖、分化等。
Fig. 8
 图 8 PCL-AT膜的形状记忆过程[55] Fig. 8 Shape memory process of PCL-AT membrane[55]
图 8 PCL-AT膜的形状记忆过程[55] Fig. 8 Shape memory process of PCL-AT membrane[55] Fig. 9
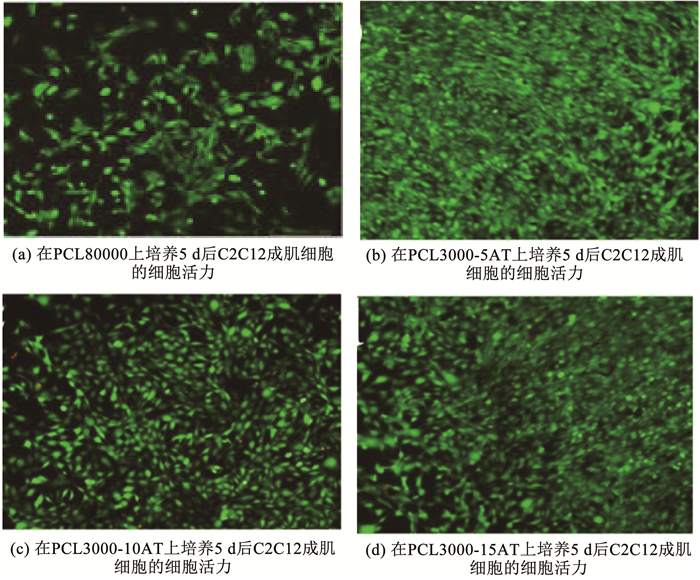 图 9 在PCL80000,PCL3000-5AT,PCL3000-10AT和PCL3000-15AT上培养5 d后C2C12成肌细胞的细胞活力[55] Fig. 9 Cell viability of C2C12 myoblasts after 5 d of cultivation on PCL80000, PCL3000-5AT, PCL3000-10AT, and PCL3000-15AT[55]
图 9 在PCL80000,PCL3000-5AT,PCL3000-10AT和PCL3000-15AT上培养5 d后C2C12成肌细胞的细胞活力[55] Fig. 9 Cell viability of C2C12 myoblasts after 5 d of cultivation on PCL80000, PCL3000-5AT, PCL3000-10AT, and PCL3000-15AT[55] 组织工程学是目前治疗临界尺寸颅颌面部骨缺损最有效的治疗方法,但在支架设计方面仍需改进,可以精确匹配骨缺损不规则边界、具有相互连通的多孔结构并且具有良好的生物活性, 是促进骨组织再生的理想要求。Zhang等[56]通过SCPL方法对聚(ε-己内酯)(PCL)二丙烯酸酯进行光交联制备了一种形状记忆PCL多孔支架。施加生物活性聚合物涂层以涂覆孔壁后,支架整体表现出优异的生物活性,明显促进成骨细胞的粘附、增殖以及成骨相关基因的表达量的提高。形状记忆实验结果见图 10,当外界温度大于PCL的熔融温度时,支架变软,延展性增大,施加外力制成不规则缺陷的临时形状,冷却后,支架在缺陷内固定并保持临时形状,实现个性化填充。为了评估SMP支架对成骨细胞粘附和增殖能力的影响,将成骨细胞均匀接种并培养在未涂覆的和聚多巴胺涂覆的SMP支架的表面上,培养72 h后,裂解贴壁细胞,并测量和比较DNA水平。结果表明,在聚多巴胺涂覆的SMP支架上的细胞DNA水平比未涂覆的SMP支架高5倍。细胞面积测量结果与粘附结果一致,成骨细胞相对于未涂覆的SMP支架,在聚多巴胺涂覆的SMP支架表面上扩散的程度更大。这种具有自适应形变,并具有高生物活性的多孔支架,在临床治疗中有着巨大的应用情景,为自适应骨组织植入物提供了新的方向。
Fig. 10
 图 10 聚多巴胺涂覆的形状记忆多孔PCL支架的自适应过程[56] Fig. 10 Self-adaptive process of polydopamine-coated shape memory porous PCL scaffolds[56]
图 10 聚多巴胺涂覆的形状记忆多孔PCL支架的自适应过程[56] Fig. 10 Self-adaptive process of polydopamine-coated shape memory porous PCL scaffolds[56] 迄今为止,已经有一些关于具有形状记忆功能的PCL多孔支架的报道。然而,这些研究主要研究了体外SMP的结构和功能。据我们所知,很少有研究报道在体内使用形状记忆多孔支架修复骨缺损。最近,Liu等[57]制备了一种由化学交联的聚ε-己内酯(c-PCL)和HAP纳米粒子组成的装载BMP-2形状记忆多孔纳米复合材料支架(SMP支架装载BMP-2)。HAP纳米颗粒的引入不仅可以增加支架的机械稳定性并提供良好的骨电导率[58-59],而且还可以在体内获得高质量的微CT支架图像。基于PCL的形状记忆支架由于其具有良好的生物相容性和生物可降解性从而备受关注。Liu等制备的具有可控药物释放和形状记忆行为的支架为骨修复组织工程支架的设计和制造提供基础。体外形状记忆结果显示,在37 ℃时,支架能从变形形状完全恢复至原始形状,具有优异的形状记忆效果。此外,Liu等还考察了形状记忆PCL多孔支架的体内展开过程,为了使动物在麻醉后保持温度,在42 ℃的温度/泵上进行植入操作,载有BMP的SMP纳米复合材料支架的体内形状记忆恢复过程见图 11。HAP纳米粒子的引入可以像造影剂一样改善支架的微CT图像质量,使用锥形束计算机地形学扫描了支架,发现支架在手术后10 min可以从压缩形状恢复到原始形状。与体外恢复过程不同,支架需要更多的时间才能在体内恢复其最终形状,这可能是由于空气中的传热低于水中的传热。然而,这种恢复需要的时间较多可能是有益的,可为临床治疗提供更多的植入时间。通过其与兔骨髓干细胞的相互作用来评估支架的体外细胞相容性,SEM图像表明,BMSC细胞大部分在支架多孔中生长繁殖,并且细胞附着良好,能在这些孔的壁表面上扩散生长,支架显示出良好的细胞相容性。骨缺损区域的三维显微CT图像和相应的骨形成定量分析用于确定SMP作为骨组织工程支架的可行性。CT结果如图 12所示,与对照组相比,SMP支架组显示出更多的骨形成。在对照组中,只有较少的新生骨沿缺损侧出现,而SMP支架组新生骨占缺损面积的1/3以上。BMP-2的支架组在植入后8周内显示出缺损区域中新生的骨骼最多,并且填充了一半以上的骨骼缺损区域。SMP智能支架在非常复杂且动态变化的体内环境中解决大体积支架植入方面具有巨大潜力。因此,该研究为设计用于治疗或修复患病的人体器官和组织的多功能组织工程支架植入提供了简便的工程策略。
Fig. 11
 图 11 锥束计算机断层扫描观察的BMP-2加载SMP支架的体内形状记忆恢复过程[57] Fig. 11 In vivo shape memory recovery process of BMP-2-loaded SMP scaffold observed using cone beam computed topography[57]
图 11 锥束计算机断层扫描观察的BMP-2加载SMP支架的体内形状记忆恢复过程[57] Fig. 11 In vivo shape memory recovery process of BMP-2-loaded SMP scaffold observed using cone beam computed topography[57] Fig. 12
 图 12 骨缺损区域的三维显微CT图像[57] Fig. 12 3D micro-CT images of bone defect area[57]
图 12 骨缺损区域的三维显微CT图像[57] Fig. 12 3D micro-CT images of bone defect area[57] 2.2 形状记忆聚氨酯(SMPU)基复合支架组织工程是治疗骨缺损的有前途的替代方法。但是,需要改进支架设计以精确匹配骨缺损的不规则边界并促进临床应用。最近的研究中,Yu等[58]通过二苯基甲烷4、4, -二异氰酸酯(diphenyl methane-4, 4′-diisocyanate, MDI),己二酸,乙二醇,环氧乙烷(ethylene oxide, EO),聚环氧丙烷(poly[oxy(methyl-1, 2-ethanediyl)], PO),1、4-丁二醇合成新型的形状记忆聚氨酯(shape memory polyurethane, SMPU)。并通过盐粒子浸出法制备了一种SMPU多孔支架,可通过调节盐粒子的粒径来得到不同孔径的支架,通过扫描电子显微镜(SEM)可观察到0~50, 50~110, 110~160, 160~450 μm不同大小的规则孔径。支架的孔隙率在77.13%到83.13%之间。通过压缩测试,热力学分析和骨肉瘤MG-63细胞实验分析了支架的机械性能和生物相容性。压缩测试表明,随着支架孔径的逐渐增大,压缩后支架的回复速率也逐渐加快。体外生物学评价中,Yu等[58]将支架分别剪成6 mm×2 mm大小,与MG-63细胞共混培养于96孔板中,分别培养1、3、5、7 d后通过MTT测定细胞增殖情况。并通过SEM可观察到细胞在支架中的生长图像,结果见图 13,与空白对照组相比,MG-63细胞有明显的增多。该支架不仅具有良好的骨修复机械性能、可调孔径大小和优异的形状记忆性能,还具有促进细胞增殖的能力。
Fig. 13
 图 13 不同孔径大小的SMPU支架的SEM图像[58] Fig. 13 SEM images of SMPU scaffold with different pore sizes[58]
图 13 不同孔径大小的SMPU支架的SEM图像[58] Fig. 13 SEM images of SMPU scaffold with different pore sizes[58] 在过去的几年中进行了大量的研究以检查SMP的自适应行为,但绝大多数研究主要集中在体外研究上。Baker及其同事[60]开发了一种基于丙烯酸酯的SMP移植物,该移植物在负重股骨节段缺损模型中用作合成骨替代物。然而,为了成功地将SMP应用于支架辅助的骨再生中,SMP支架在承重骨修复中的体内自适配功能和骨再生能力值得进一步研究。
最近,Xie等[59]通过气体发泡法制备了一种用于承重骨缺损治疗的新型聚氨酯/羟基磷灰石基SMP多孔泡沫。在此之前,SMPU已用于治疗脑动脉瘤栓塞。HAP是骨骼组织的主要矿质成分,Xie等充分将HAP的生物活性和SMPU在机械性能、生物相容性和形状记忆性能结合起来。如图 14所示,通过兔股骨缺损模型证明了SMP泡沫作为骨支架的微创递送和自适应功能的可行性,植入的SMP泡沫在热刺激后可能会从紧密的形状展开以填充骨缺损部位。micro-CT分析显示,与空白对照组相比,SMP泡沫能显著加快骨修复。组织学染色进一步表明,SMP泡沫促进了新血管形成和随后的骨重塑,在SMP泡沫中形成了大量的成熟骨。这项研究证明SMP泡沫由于其优越的性能而可潜在地作为骨支架治疗骨缺损。但是,仍需要更多地研究针对长期动物模型,以确定将SMP泡沫用于人骨再生的临床可行性。
Fig. 14
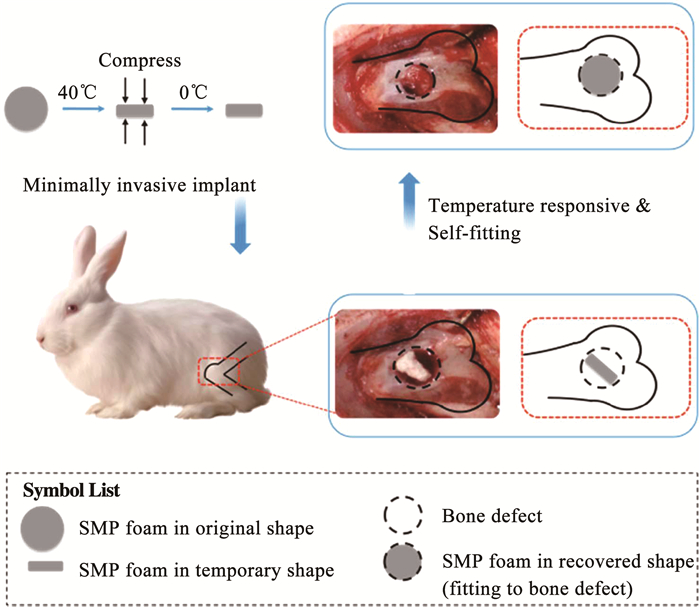 图 14 自适应SMP泡沫用于骨再生支架的示意[59] Fig. 14 Schematic of self-adaptive SMP foam as a bone scaffold for bone regeneration[59]
图 14 自适应SMP泡沫用于骨再生支架的示意[59] Fig. 14 Schematic of self-adaptive SMP foam as a bone scaffold for bone regeneration[59] 2.3 形状记忆聚乳酸(PLA)基复合支架聚乳酸(PLA)是一种热塑性SMP,由于其高弹性模量,相对较低的玻璃化转变温度Tg(55~65 ℃),良好的形状记忆性能使得其在3D打印中广泛使用。长PLA链通过物理缠结可以作为固定相,而缠结之间的聚合物链可以在变形过程中拉伸成临时形状。Lendlein等[46]详细研究了交联、化学改性、添加共聚物等可改善PLA形状记忆特性(例如恢复应力和应变)的方法。近些年来,形状记忆PLA在医学应用中受到越来越多的关注。
Senatov等[61]先将PLA和质量分数15%的HAP共混制备成可熔融丝线,再通过3D打印机打印了具有多孔结构的PLA/HAP骨修复支架。对3D打印支架的结构特性、机械性能和形状记忆效应进行了系统的评估。支架的平均孔径和孔隙率分别在700 μm和30%左右,能满足BMSc在支架中生长的结构需求。由于HAP的加入,导致热传导速度减慢, 材料的Tg也相应地从53 ℃提高到57 ℃。最大恢复应力可达到3.0 MPa。形状记忆实验表明,通过直接加热的方式来驱动形状记忆效应,PLA/HAP多孔支架能经受连续3次压缩-加热-压缩的循环过程并不会出现分层现象(图 15),形状恢复率可达到98%。在加热过程中形状记忆效应会使骨修复支架逐渐缩小骨骼裂缝而实现“自我修复”,为自体植入物用于小骨缺损治疗提供了新的方向。
Fig. 15
 图 15 通过压缩固定3D打印的PLA/HAP支架的临时形状,并在加热到玻璃化转变温度以上后演示形状记忆效果[61] Fig. 15 Fixing of a temporary shape of a 3D-printed PLA/HA scaffold through compression, and a demonstration of shape memory effect after heating above the glass transition temperature[61]
图 15 通过压缩固定3D打印的PLA/HAP支架的临时形状,并在加热到玻璃化转变温度以上后演示形状记忆效果[61] Fig. 15 Fixing of a temporary shape of a 3D-printed PLA/HA scaffold through compression, and a demonstration of shape memory effect after heating above the glass transition temperature[61] 随后,Senatov等[62]对3D打印的PLA/HAP多孔支架进行了体外生物学评价。通过流式细胞仪检测了MSCs是否存在特征性造血和内皮标记物。MSC通常表达抗原CD105和CD90:分别为69±17.4和71±23.9。这些细胞对白细胞CD45的典型标志物和早期造血细胞标志物CD34呈阴性。光学显微镜显示出成纤维细胞呈现纺锤体形态。细胞接种24 h后,将近30%的细胞固定在支架表面,表明在3D打印的多孔支架表面细胞能快速附着。图 16显示MSC细胞广泛分布并与支架表面形成强相互作用。此外,在支架的横截面中,显示出在支架的通道内部以及在表面上观察到聚集的MSC细胞,表明细胞以3D方式生长。通常,细胞需要牢固粘附到基质表面才能扩散、增殖和维持细胞功能。由于PLA/HAP纳米复合材料特殊的化学组成,3D打印过程中形成的表面额外微观结构,较大的表面积和支架的多孔结构为细胞粘附提供了基础。3D打印的多孔PLA/HAP支架对MSC细胞具有出色的粘合性能,这是其医疗应用的关键前提。
Fig. 16
 图 16 3D打印PLA/HAP多孔支架表面的MSC细胞:HE染色[62] Fig. 16 MSC colonization of 3D-printed porous PLA/HAP scaffold surface: HE stained[62]
图 16 3D打印PLA/HAP多孔支架表面的MSC细胞:HE染色[62] Fig. 16 MSC colonization of 3D-printed porous PLA/HAP scaffold surface: HE stained[62] 3 当前面临的挑战和发展方向被认为是下一代组织工程技术的4D生物打印,将“时间”作为第四维纳入3D生物打印中,有望构建具有按需动态控制的形状和功能的复杂结构[63]。在过去的几年中,随着刺激响应性生物材料的不断发展和对组织再生的理解逐渐深入,4D生物打印技术在生物医学领域和临床应用中引起了广泛关注[64]。例如,4D生物打印技术在个性化组织再生领域提供了巨大的应用前景,具有编程形状和尺寸的4D打印植入物将以精确的几何形状自适应填充缺损部位[65-66]。4D打印后的植入物表现出仿生物的功能特征,促进了组织重塑和再生[67-68]。与此同时,近年来计算模型系统的发展为组织工程的个性化设计提供了新的契机。4D生物打印的转化特征也可以通过构建自我生长结构来帮助治疗青少年患者。另外,刺激响应性材料细胞组装和组织重塑技术可用于药物递送和细胞疗法的临床应用[69-71]。一种有效的磁驱动干细胞输送系统已被应用于脊髓损伤修复中[72]。同样,这些刺激响应性细胞载体在体内可表现出定向迁移特征,可作为特殊部位损伤修复的临床适用载体[73]。综上所述,4D生物打印的形状和功能转换特征可以用来设计和控制具有特殊形状、尺寸、功能、工作部位的打印构建体随时间的变化,满足组织工程和临床应用的要求。这些4D生物打印技术可以为个性化治疗和精准医疗提供巨大的潜力,这已被视为组织工程领域的主要趋势。虽然已经开发了一系列刺激响应的生物材料和多种创新策略,但4D生物打印仍处于起步阶段,需要应对多种挑战。
首先,使现有的刺激响应性生物材料可打印并转化成生物“墨水”仍然是挑战。尽管对刺激响应敏感的生物材料的生产制造进行了深入的研究,并且SMP材料的细胞相容性和体内适应性也得到了验证,但它们直接应用于生物体内难以实现[74-77]。此外,还需要更多的研究来解决4D生物打印的多重挑战,如打印过程对细胞负载生物支架的负面影响,以及规模化和高通量生产的可能性。
其次,现有的4D打印结构的变形过程仍然是简单的变形,如折叠或组装,不能满足临床应用的复杂需求。在组织工程的广泛应用中,应进一步提高对形状转换和打印分辨率的精确时空控制。当形状发生变化时,刺激响应材料也需要精确控制内应力的产生或释放。在长期的应用过程中,应保持其对刺激的响应能力,而不丧失其独特的特性。Raviv等[78]报道反复折叠/展开会导致打印结构的力学性能明显下降。这些支架只有在有限的情况下才能完全恢复到原来的形状。另外,4D打印结构的机械强度通常不足以承受高压[79]。因此,有必要开发具有强大的形状转换特性的4D生物打印结构,尤其是在需要重复响应的情况下。
此外,在进一步应用于临床实践之前,还需要克服一些局限性。在刺激响应机制方面仍然有大量的限制,不可以用来触发变形过程。例如,剧烈变化的紫外线水平和pH值可能是不合适的,因为它们可能对细胞生存能力产生负面影响,而温度(4~40 ℃)和Ca2+浓度可以改变,但不会对活细胞产生有害影响[79-80]。期望提出相对温和的四维转化激发机制或刺激,使4D打印技术对宿主环境更加友好。同时,研究刺激响应材料与免疫系统之间的相互作用也很重要,以促进4D打印结构与受体部位微环境之间的整合。另外,人体组织的现实生理活动要复杂得多,并且细胞活动会受到多种刺激的影响,例如神经调节、体液调节和自我调节。4D打印的生物构建体通常在实现其全部功能之前经历多个转化过程[81]。因此,制造在多个刺激下同时经历复杂的形状转换过程和功能转变的4D打印构建体仍然具有挑战性。
为了实现组织工程中4D生物打印的精细程序控制,重要的是引入计算机设计技术和复杂的多重刺激响应程序以实现多功能自转换支架的制造。麻省理工学院设计的Project Cyborg软件平台,可提供模拟自组装和可编程材料以及优化设计结构的功能。然而,这些刺激响应性和可编程生物材料的成本是昂贵的,并且使用复杂的计算机设计系统来设计制造这种智能支架会更为困难。因此,在骨组织工程中如何深入地将4D打印技术与SMP智能材料有机的结合起来仍具有挑战性。
4 结论尽管针对传统聚合物在治疗骨缺损治疗的应用进行了大量新颖的研究,但临界尺寸的骨缺损的患病率却越来越高,临床治疗仍然存在巨大挑战,包括定制支架降解速度,结构仿生学不足,支架血管化不够充分和支架生产规模小。越来越多的研究使用具有生物活性的聚合物复合材料来制造三维支架,已经有效地实现了将材料理想的机械性能和细胞生物特性结合到组织工程的构造中,取得了巨大进展。
SMP具有形状记忆效应的独特属性,包括形状展开、形状恢复和形状自适应,因此SMP在生物医学领域中发挥着重要作用,以满足新型外科和医疗设备对材料特殊功能的需求。由于设计多样性高,可以通过改变其化学和物理结构来开发各种生物医学形状记忆材料,以满足各种应用的需求。此外,除了在温度的直接或间接驱动下,SMP还可通过pH、溶液、光甚至是多物理场来驱动。具有形状记忆效应(shape memory effect, SME)和双向SME的SMP在生物医学领域更具有巨大的发展潜力。结合其良好的生物相容性、生物降解性、简单有效的刺激方式和多种SME,SMP有望在生物医学领域得到广泛的应用。
4D生物打印技术同其他技术相比可对构造微体系结构提供越来越精确的控制。当与不断发展的生物活性材料、新型的形状记忆材料、生长因子、功能化4D打印技术和仿生支架设计相结合时,为患者制造个性化量身定制的复杂骨组织工程支架的潜力是巨大的。这也为治疗各种挑战性疾病提供了希望,包括骨质疏松症和严重的骨缺损。
但为了在将来能实现最大化的促进新骨形成,除了增加构建体的血管形成,还要保证细胞在支架表面以及内部更加紧密的增殖分化。这些往往需要通过对生物材料的进一步修饰、支架的制造方法的改进和模型设计精确程度来实现。还需要更有效的方法来简化细胞分离、培养和接种到骨支架中的过程。随着传统聚合物材料性能的不断改良,形状记忆聚合物的变形性能的自适应设计,制造方法的不断发展,希望将来能够以越来越具有低成本、无毒且高效的方式来实现个体患者的个性化治疗。
参考文献
[1] WUBNEH A, TSEKOURA E K, AYRANCI C, et al. Current state of fabrication technologies and materials for bone tissue engineering[J]. Acta Biomaterialia, 2018, 80: 1. DOI:10.1016/j.actbio.2018.09.031
[2] BOSE S, VAHABZADEH S, BANDYOPADHYAY A. Bone tissue engineering using 3D printing[J]. Materials Today, 2013, 16: 496. DOI:10.1016/j.mattod.2013.11.017
[3] MOURINO V, BOCCACCINI A R. Bone tissue engineering therapeutics: controlled drug delivery in three-dimensional scaffolds[J]. Journal of the Royal Society Interface, 2010, 7(43): 209. DOI:10.1098/rsif.2009.0379
[4] SEITZ H, RIEDER W, IRSEN S, et al. Three-dimensional printing of porous ceramic scaffolds for bone tissue engineering[J]. Journal of Biomedical Materials Research Part B, 2005, 74(2): 782. DOI:10.1002/jbm.b.30291
[5] JONES A C, ARNS C H, SHEPPARD A P, et al. Assessment of bone ingrowth into porous biomaterials using MICRO-CT[J]. Biomaterials, 2007, 28(15): 2491. DOI:10.1016/j.biomaterials.2007.01.046
[6] HERNLUND E, SVEDBOM A, IVERGRD M, et al. Osteoporosis in the European Union: medical management, epidemiology and economic burden[J]. Archives of Osteoporosis, 2013, 8(1): 136. DOI:10.1007/s11657-013-0136-1
[7] LOPES D L, MARTINS-CRUZ C, OLIVEIRA M B, et al. Bone physiology as inspiration for tissue regenerative therapies[J]. Biomaterials, 2018, 185: 240. DOI:10.1016/j.biomaterials.2018.09.028
[8] BRYDONE A S, MEEK D, MACLAINE S. Bone grafting, orthopaedic biomaterials, and the clinical need of bone engineering[J]. Proceedings of the Institution of Mechanical Engineers Part C—Journal of Mechanical Engineering Science, 2010, 224(12): 1329. DOI:10.1243/09544119JEIM770
[9] LOEBEL C, BURDICK J A. Engineering stem and stromal cell therapies for musculoskeletal tissue repair[J]. Cell Stem Cell, 2018, 22(3): 325. DOI:10.1016/j.stem.2018.01.014
[10] LAURENCIN C T, KHAN Y, EL-AMIN S F. Bone graft substitutes[J]. Expert Review of Medical Devices, 2006, 3(1): 49. DOI:10.1586/17434440.3.1.49
[11] BAROLI B. From natural bone grafts to tissue engineering therapeutics: brainstorming on pharmaceutical formulative requirements and challenges[J]. International Journal of Pharmaceutics, 2009, 98(4): 1317. DOI:10.1002/jps.21528
[12] DIMITRIOU R, JONES E, MCGONAGLE D, et al. Bone regeneration: current concepts and future directions[J]. BMC Medicine, 2011, 9: 66. DOI:10.1186/1741-7015-9-66
[13] YOUNGER E M, CHAPMAN M W. Morbidity at bone graft donor sites[J]. Journal of Orthopaedic Trauma, 1989, 3(3): 192. DOI:10.1097/00005131-198909000-00002
[14] BANWART J C, ASHER M A, HASSANEIN R S. Iliac crest bone graft harvest donor site morbidity. A statistical evaluation[J]. Spine, 1995, 20(9): 1055. DOI:10.1097/00007632-199505000-00012
[15] EBRAHEIM N A, ELGAFY H, XU R. Bone-graft harvesting from iliac and fibular donor sites: techniques and complications[J]. Journal of the American Academy of Orthopaedic Surgeons, 2001, 9(3): 210. DOI:10.5435/00124635-200105000-00007
[16] ST JOHN T A, VACCARO A R, SAH A P, et al. Physical and monetary costs associated with autogenous bone graft harvesting[J]. American Journal of Orthopedics, 2003, 32(1): 18.
[17] DELLOYE C, CORNU O, DRUEZ V, et al. Bone allografts: what they can offer and what they cannot[J]. Journal of Bone and Joint Surgery. British Volume, 2007, 89(5): 574. DOI:10.1302/0301-620X.89B5.19039
[18] LORD C F, GEBHARDT M C, TOMFORD W W, et al. Infection in bone allografts. Incidence, nature, and treatment[J]. Journal of Bone and Joint Surgery-American Volume, 1988, 70(3): 369. DOI:10.1016/0020-1383(88)90094-0
[19] TOMFORD W W, STARKWEATHER R J, GOLDMAN M H. A study of the clinical incidence of infection in the use of banked allograft bone[J]. Journal of Bone and Joint Surgery—American Volume, 1981, 63(2): 244. DOI:10.1007/BF00267846
[20] LIN Cheng, LIU Liwu, LIU Yanju, et al. The compatibility of polylactic acid and polybutylene succinate blends by molecular and mesoscopic dynamics[J]. International Journal of Smart and Nano Materials, 2020, 11(1): 24. DOI:10.1080/19475411.2020.1729274
[21] FERREIRA A M, GENTILE P, CHIONO V, et al. Collagen for bone tissue regeneration[J]. Acta Biomaterialia, 2012, 8(9): 3191. DOI:10.1016/j.actbio.2012.06.014
[22] QUINLAN E, ADOLFO L N, THOMPSON E, et al. Development of collagen-hydroxyapatite scaffolds incorporating PLGA and alginate microparticles for the controlled delivery of rhBMP-2 for bone tissue engineering[J]. Journal of Controlled Release, 2014, 198: 71. DOI:10.1016/j.jconrel.2014.11.021
[23] THITISET T, DAMRONGSAKKUL S, BUNAPRASERT T, et al. Development of collagen/demineralized bone powder scaffolds and periosteum-derived cells for bone tissue engineering application[J]. International Journal of Molecular Sciences, 2013, 14(1): 2056. DOI:10.3390/ijms14012056
[24] WU Bin, ZHENG Qixin, GUO Xiaodong, et al. Preparation and ectopic osteogenesis in vivo of scaffold based on mineralized recombinant human-like collagen loaded with synthetic BMP-2-derived peptide[J]. Biomedical Materials, 2008, 3(4): 044111. DOI:10.1088/1748-6041/3/4/044111
[25] HU Kun, CUI Fuzai, LV Qiang, et al. Preparation of fibroin/recombinant human-like collagen scaffold to promote fibroblasts compatibility[J]. Journal of Biomedical Materials Research Part A, 2008, 84A(2): 483. DOI:10.1002/jbm.a.31440
[26] ZHANG Ziqiang, MA Zequn, ZHANG Yihe, et al. Dehydrothermally crosslinked collagen/hydroxyapatite composite for enhanced in vivo bone repair[J]. Colloids and Surfaces B, 2018, 163: 394. DOI:10.1016/j.colsurfb.2018.01.011
[27] VILLA M M, WANG Liping, HUANG Jianping, et al. Bone tissue engineering with a collagen-hydroxyapatite scaffold and culture expanded bone marrow stromal cells[J]. Journal of Biomedical Materials Research Part B, 2015, 103(2): 243. DOI:10.1002/jbm.b.33225
[28] MARCACCI M, KON E, MOUKHACHEV V, et al. Stem cells associated with macroporous bioceramics for long bone repair: 6- to 7-year outcome of a pilot clinical study[J]. Tissue Engineering, 2007, 13(5): 947. DOI:10.1089/ten.2006.0271
[29] BABIKER H. Bone graft materials in fixation of orthopaedic implants in sheep[J]. Danish Medical Journal, 2013, 60(7): B4680. DOI:10.1111/eci.12103
[30] REN Xiaoyan, TU V, BISCHOFF D, et al. Nanoparticulate mineralized collagen scaffolds induce in vivo bone regeneration independent of progenitor cell loading or exogenous growth factor stimulation[J]. Biomaterials, 2016, 89: 67. DOI:10.1016/j.biomaterials.2016.02.020
[31] BALAGANGADHARAN K, DHIVYA S, SELVAMURUGAN N. Chitosan based nanofibers in bone tissue engineering[J]. International Journal of Biological Macromolecules, 2016, 104: 1372. DOI:10.1016/j.ijbiomac.2016.12.046
[32] LOGITHKUMAR R, KESHAVNARAYAN A, DHIVYA S. A review of chitosan and its derivatives in bone tissue engineering[J]. Carbohydrate Polymers, 2016, 151: 172. DOI:10.1016/j.carbpol.2016.05.049
[33] VENKATESAN J, KIM S K. Chitosan composites for bone tissue engineering—an overview[J]. Marine Drugs, 2010, 8(8): 2252. DOI:10.3390/md8082252
[34] LEENA R S, VAIRAMANI M, SELVAMURUGAN N. Alginate/gelatin scaffolds incorporated with silibinin-loaded chitosan nanoparticles for bone formation in vitro[J]. Colloids and Surfaces B, 2017, 158: 308. DOI:10.1016/j.colsurfb.2017.06.048
[35] DEEPTHI S, VENKATESAN J, KIM S K, et al. An overview of chitin or chitosan/nano ceramic composite scaffolds for bone tissue engineering[J]. International Journal of Biological Macromolecules, 2018, 93: 1338. DOI:10.1016/j.ijbiomac.2016.03.041
[36] KAVYA K C, JAYAKUMAR R, NAIR S, et al. Fabrication and characterization of chitosan/gelatin/nSiO2 composite scaffold for bone tissue engineering[J]. International Journal of Biological Macromolecules, 2013, 59: 255. DOI:10.1016/j.ijbiomac.2013.04.023
[37] ELKHOLY S, YAHIA S, AWAD M, et al. In vivo evaluation of β-CS/n-HA with different physical properties as a new bone graft material[J]. Clinical Implant Dentistry and Related Research, 2018, 20(3): 416. DOI:10.1111/cid.12599
[38] LI Zhang, LI Yunbo, YANG Aiping, et al. Preparation and in vitro investigation of chitosan/nano-hydroxyapatite composite used as bone substitute materials[J]. Journal of Materials Science: Materials in Medicine, 2005, 16(3): 213. DOI:10.1007/s10856-005-6682-3
[39] WU Hongwei, LEI Pengfei, LIU Gengyan, et al. Reconstruction of large-scale defects with a novel hybrid scaffold made from poly(L-lactic acid)/nanohydroxyapatite/alendronate-loaded chitosan microsphere: in vitro and in vivo studies[J]. Scientific Reports, 2017, 7(1): 359. DOI:10.1038/s41598-017-00506-z
[40] UNNITHAN A R, SASIKALA A R K, PARK C H, et al. A unique scaffold for bone tissue engineering: an osteogenic combination of graphene oxide-hyaluronic acid-chitosan with simvastatin[J]. Journal of Industrial and Engineering Chemistry, 2017, 46: 182. DOI:10.1016/j.jiec.2016.10.029
[41] CHANG Y L, LO Y J, FENG S W, et al. Bone healing improvements using hyaluronic acid and hydroxyapatite/beta-tricalcium phosphate in combination: an animal study[J]. Biomed Research International, 2016, 2016: 1. DOI:10.1155/2016/8301624
[42] ROOHANIESFAHANI S, LU Zhengfeng, LI Jiaojiao, et al. Effect of self-assembled nanofibrous silk/polycaprolactone layer on the osteoconductivity and mechanical properties of biphasic calcium phosphate scaffolds[J]. Acta Biomaterialia, 2012, 8(1): 302. DOI:10.1016/j.actbio.2011.10.009
[43] KWEON H Y, LEE S W, HAHN B D, et al. Hydroxyapatite and silk combination-coated dental implants result in superior bone formation in the peri-implant area compared with hydroxyapatite and collagen combination-coated implants[J]. Journal of Oral and Maxillofacial Surgery, 2014, 72(10): 1928. DOI:10.1016/j.joms.2014.06.455
[44] 郑威, 王亚立, 张风华, 等. 形状记忆聚合物微纳米纤维膜在生物医学中的应用进展[J]. 中国科学: 技术科学, 2018, 48(8): 811.
ZHENG Wei, WANG Yali, ZHANG Fenghua, et al. Development of shape memory polymers micro/nanofiber membranes in biomedical applications[J]. Scientia Sinica Technologica, 2018, 48(8): 811.
[45] REZWAN K, CHEN Q Z, BLAKER J J, et al. Biodegradable and bioactive porous polymer/inorganic composite scaffolds for bone tissue engineering[J]. Biomaterials, 2006, 27(18): 3413. DOI:10.1016/j.biomaterials.2006.01.039
[46] LENDLEIN A, LANGER R. Biodegradable, elastic shape-memory polymers for potential biomedical applications[J]. Science, 2002, 296(5573): 1673. DOI:10.1126/science.1066102
[47] YAKACKI C M, GALL K. Shape-memory polymers for biomedical applications[J]. Shape memory Polymers, 2009, 226: 147. DOI:10.1007/12_2009_23
[48] LANGER R, TIRRELL D A. Designing materials for biology and medicine[J]. Nature, 2004, 428(6982): 487. DOI:10.1038/nature02388
[49] HU Jinlian, ZHU Yong, HUANG Huahua, et al. Recent advances in shape-memory polymers: structure, mechanism, functionality, modeling and applications[J]. Progress in Polymer Science, 2012, 37: 1720. DOI:10.1016/j.progpolymsci.2012.06.001
[50] ZHU Yong, HU Jinlian, YEUNG K W, et al. Influence of ionic groups on the crystallization and melting behavior of segmented polyurethane ionomers[J]. Journal of Applied Polymer Science, 2006, 100: 4603. DOI:10.1002/app.23009
[51] LI Guoqiang, MENG H, HU Jinlian. Healable thermoset polymer composite embedded with stimuli-responsive fibres[J]. Journal of the Royal Society Interface, 2012, 9(77): 3279. DOI:10.1098/rsif.2012.0409
[52] ZHANG Dawei, BURKES W L, SCHOENER C A, et al. Porous inorganic-organic shape memory polymers[J]. Polymer, 2012, 53(14): 2935. DOI:10.1016/j.polymer.2012.04.053
[53] BAO Min, WANG Xianliu, YUAN Huihua, et al. HAp incorporated ultrafine polymeric fibers with shape memory effect for potential use in bone screw hole healing[J]. Journal of Materials Chemistry B, 2016, 4(31): 5308. DOI:10.1039/C6TB01305H
[54] KINGHAM E, OREFFO R O C. Embryonic and induced pluripotent stem cells: understanding, creating, and exploiting the nano-niche for regenerative medicine[J]. ACS Nano, 2013, 7(3): 1867. DOI:10.1021/nn3037094
[55] DENG Zexing, GUO Yi, ZHAO Xin, et al. Stretchable degradable and electroactive shape memory copolymers with tunable recovery temperature enhancing myogenic differentiation[J]. Acta Biomaterialia, 2016, 46: 234. DOI:10.1016/j.actbio.2016.09.019
[56] ZHANG Dawei, GEORGE O J, PETERSEN K M, et al. A bioactive "self-fitting" shape memory polymer scaffold with potential to treat cranio-maxillo facial bone defects[J]. Acta Biomaterialia, 2014, 10(11): 4597. DOI:10.1016/j.actbio.2014.07.020
[57] LIU Xian, ZHAO Kun, GONG Tao, et al. Delivery of growth factors using a smart porous nanocomposite scaffold to repair a mandibular bone defect[J]. Biomacromolecules, 2014, 15(3): 1019. DOI:10.1021/bm401911p
[58] YU Juhong, XIA Hong, TERAMOTO A, et al. Fabrication and characterization of shape memory polyurethane porous scaffold for bone tissue engineering[J]. Journal of Biomedical Materials Research Part A, 2017, 105(4): 1132. DOI:10.1002/jbm.a.36009
[59] XIE Ruiqi, HU Jinlian, NG F, et al. High performance shape memory foams with isocyanate-modified hydroxyapatite nanoparticles for minimally invasive bone regeneration[J]. Ceramics International, 2017, 43: 4794. DOI:10.1016/j.ceramint.2016.11.216
[60] BAKER R M, TSENG L F, IANNOLO M T, et al. Self-deploying shape memory polymer scaffolds for grafting and stabilizing complex bone defects: a mouse femoral segmental defect study[J]. Biomaterials, 2016, 76: 388. DOI:10.1016/j.biomaterials.2015.10.064
[61] SENATOV F S, NIAZA K V, ZADOROZHNYY M Y, et al. Mechanical properties and shape memory effect of 3D-printed PLA-based porous scaffolds[J]. Journal of the Mechanical Behavior of Biomedical Materials, 2016, 57: 139. DOI:10.1016/j.jmbbm.2015.11.036
[62] SENATOV F S, ZADOROZHNYY M Y, NIAZA K V, et al. Shape memory effect in 3D-printed scaffolds for self-fitting implants[J]. European Polymer Journal, 2017, 93: 222. DOI:10.1016/j.eurpolymj.2017.06.011
[63] LI Yichen, ZHANG Y S, AKPEK A, et al. 4D bioprinting: the next-generation technology for biofabrication enabled by stimuli-responsive materials[J]. Biofabrication, 2016, 9(1): 012001. DOI:10.1088/1758-5090/9/1/012001
[64] HSIAO S H, HSU S H. Synthesis and characterization of dual stimuli-sensitive biodegradable polyurethane soft hydrogels for 3D cell-laden bioprinting[J]. ACS Applied Materials & Interfaces, 2018, 10(35): 29273. DOI:10.1021/acsami.8b08362
[65] SU J W, GAO Wenxin, TRINH K, et al. 4D printing of polyurethane paint-based composites[J]. International Journal of Smart and Nano Materials, 2019, 10(3): 237. DOI:10.1080/19475411.2019.1618409
[66] WU Linxiao, VIRDEE J, MAUGHAN E, et al. Stiffness memory nanohybrid scaffolds generated by indirect 3D printing for biologically responsive soft implants[J]. Acta Biomaterialia, 2018, 80: 188. DOI:10.1016/j.actbio.2018.09.016
[67] WANG Yong. Programmable hydrogels[J]. Biomaterials, 2018, 178: 663. DOI:10.1016/j.biomaterials.2018.03.008
[68] INVERNIZZI M, TURRI S, LEVI M, et al. Processability of 4D printable modified polycaprolactone with self-healing abilities[J]. Materials Today, 2019, 7: 508. DOI:10.1016/j.matpr.2018.12.001
[69] ZHAO Xu, YANG Chengxiong, CHEN Ligong, et al. Dual-stimuli responsive and reversibly activatable theranostic nanoprobe for precision tumor-targeting and fluorescence-guided photothermal therapy[J]. Nature Communications, 2017, 8: 14998. DOI:10.1038/ncomms14998
[70] ZHANG Fang, ZHANG Ning, MENG Hongxu, et al. Easy applied gelatin-based hydrogel system for long-term functional cardiomyocyte culture and myocardium formation[J]. ACS Biomaterials Science & Engineering, 2019, 5(6): 3022. DOI:10.1021/acsbiomaterials.9b00515
[71] TANG Qian, PLANK T N, ZHU Tong, et al. Self-assembly of metallo-nucleoside hydrogels for injectable materials that promote wound closure[J]. ACS Applied Materials & Interfaces, 2019, 11(22): 19743. DOI:10.1021/acsami.9b02265
[72] TUKMACHEV D, LUNOV O, ZABLOTSKII V, et al. An effective strategy of magnetic stem cell delivery for spinal cord injury therapy[J]. Nanoscale, 2015, 7(9): 3954. DOI:10.1039/c4nr05791k
[73] GOMES M E, RODRIGUES M T, DOMINGUES R M A, et al. Tissue engineering and regenerative medicine: new trends and directions—A year in review[J]. Tissue Engineering Part B: Reviews, 2017, 23(3): 211. DOI:10.1089/ten.TEB.2017.0081
[74] RYCHTER P, PAMULA E, ORCHEL A, et al. Scaffolds with shape memory behavior for the treatment of large bone defects[J]. Journal of Biomedical Materials Research Part A, 2015, 103(11): 3503. DOI:10.1002/jbm.a.35500
[75] TSENG L F, WANG Jing, BAKER R M, et al. Osteogenic capacity of human adipose-derived stem cells is preserved following triggering of shape memory scaffolds[J]. Tissue Engineering Part A, 2016, 22(15/16): 1026. DOI:10.1089/ten.TEA.2016.0095
[76] WAN Zhuqing, ZHANG Ping, LIU Yunsong, et al. Four-dimensional bioprinting: current developments and applications in bone tissue engineering[J]. Acta Biomaterialia, 2020, 101: 26. DOI:10.2139/ssrn.3423498
[77] LIU Xian, ZHAO Kun, GONG Tao, et al. Delivery of growth factors using a smart porous nanocomposite scaffold to repair a mandibular bone defect[J]. Biomacromolecules, 2014, 15(3): 1019. DOI:10.1021/bm401911p
[78] RAVIV D, ZHAO Wei, MCKNELLY C, et al. Active printed materials for complex self-evolving deformations[J]. Scientific Reports, 2014, 4: 7422. DOI:10.1038/srep07422
[79] IONOV L. 4D biofabrication: materials, methods, and applications[J]. Advanced Healthcare Materials, 2018, 7(17). DOI:10.1002/adhm.201800412
[80] KRUSE C R, SINGH M, TARGOSINSKI S, et al. The effect of pH on cell viability, cell migration, cell proliferation, wound closure, and wound reepithelialization: in vitro and in vivo study[J]. Wound Repair and Regeneration, 2017, 25(2): 260. DOI:10.1111/wrr.12526
[81] WU Shuying, ZHANG Jin, LADANI R B, et al. Novel electrically conductive porous PDMS/Carbon nanofiber composites for deformable strain sensors and conductors[J]. ACS Applied Materials & Interfaces, 2017, 9(16): 14207. DOI:10.1021/acsami.7b00847
