张莉丽1,薛慧2,邸维3,张功圣1,刘宁1,韩雪3
(1.东北农业大学 食品学院,哈尔滨 150030;2.黑龙江中医药大学 佳木斯学院, 黑龙江 佳木斯 154007;3.哈尔滨工业大学 化工与化学学院,哈尔滨 150090)
摘要:
前期研究表明,MgCl2胁迫不但可以提高TGase的产量,还会影响微生物次级代谢产物合成的一个重要调节因子LuxR家族蛋白的表达.为了研究LuxR家族蛋白对茂原链霉菌(Streptomyces mobaraensis) TGase生物合成以及菌体生长的调控作用,利用pKC1139为载体,构建luxR基因阻断质粒,通过PEG介导的质粒转化将其转入S. mobaraensis原生质体中,利用单交换同源重组法将整个重组质粒插入到茂原链霉菌基因组中构建S. mobaraensis luxR家族蛋白基因阻断突变菌.利用菌体干重法对比突变菌和野生菌菌体生长变化,利用比色法研究两株菌TGase生物合成的变化,找到LuxR家族蛋白基因表达与TGase生物合成之间的关系.结果发现,本研究采用单交换同源重组的方法可以成功地构建出S. mobaraensis luxR基因阻断突变菌株.通过对比野生菌与阻断菌株生长和TGase活力的变化发现阻断luxR基因会导致菌体生长受阻,TGase合成延迟,并且表达量显著下降.这些研究结果表明本文研究的luxR基因可能是S. mobaraensis合成TGase必不可少的正向调控因子.
关键词: 茂原链霉菌 谷氨酰胺转氨酶 luxR基因 生物合成
DOI:10.11918/j.issn.0367-6234.201611051
分类号:TS214.2
文献标识码:A
基金项目:国家自然科学基金(31301545/C200207);中国博士后基金(2014M560244);黑龙江省博士后基金(LBH-Z13042);中国博士后基金国际交流项目(20150082)
Effects of luxR gene in the biosynthesis of transglutaminase in Streptomyces mobaraensis
ZHANG Lili1,XUE Hui2,DI Wei3,ZHANG Gongsheng1,LIU Ning1,HAN Xue3
(1.College of Food Science, Northeast Agricultural University, Harbin 150030,China; 2.Jiamusi College, Heilongjiang University of Chinese Medicine,Jiamusi 154007,Heilongjiang,China; 3.School of Chemistry and Chemical Engineering, Harbin Institute of Technology, Harbin 150090, China)
Abstract:
Our previous studies indicated that MgCl2 stress could not only increase the yield of TGase, but also affect the expression of LuxR family protein, which is an important regulator of microbial metabolism. In order to study the effects of LuxR family protein on the biosynthesis of TGase, the luxR gene disruption plasmid was constructed with the vector of pKC1139. The plasmid was transferred into the protoplasts of Streptomyces mobaraensis by PEG mediated transformation. The recombinant plasmid was inserted into the genome of Streptomyces by a single exchange of homologous recombination. The cell growth and TGase activity of luxR gene disruption mutant of S. mobaraensis were compared with the wild stain. The results showed that the luxR gene disruption mutant was successfully constructed, and that the block of the luxR gene leads to a decrease of the biomass, a synthesis delaying and expression decrease of TGase. These results showed that luxR gene might be an important positive factor on TGase production.
Key words: Streptomyces mobaraensis transglutaminase luxR gene biosynthesis
张莉丽, 薛慧, 邸维, 张功圣, 刘宁, 韩雪. 茂原链霉菌luxR基因对TGase生物合成的作用[J]. 哈尔滨工业大学学报, 2018, 50(2): 173-177. DOI: 10.11918/j.issn.0367-6234.201611051.

ZHANG Lili, XUE Hui, DI Wei, ZHANG Gongsheng, LIU Ning, HAN Xue. Effects of luxR gene in the biosynthesis of transglutaminase in Streptomyces mobaraensis[J]. Journal of Harbin Institute of Technology, 2018, 50(2): 173-177. DOI: 10.11918/j.issn.0367-6234.201611051.

基金项目 国家自然科学基金(31301545/C200207);中国博士后基金(2014M560244);黑龙江省博士后基金(LBH-Z13042);中国博士后基金国际交流项目(20150082) 作者简介 张莉丽(1981—),女,博士,副教授;
刘宁(1960—),男,教授,博士生导师;
韩雪(1978—),女,副教授,博士生导师 通信作者 刘宁, ningliuneau@outlook.com
韩雪, xhan@hit.edu.cn 文章历史 收稿日期: 2016-11-18
Contents -->Abstract Full text Figures/Tables PDF
茂原链霉菌luxR基因对TGase生物合成的作用
张莉丽1, 薛慧2, 邸维3, 张功圣1, 刘宁1

 , 韩雪3
, 韩雪3

1. 东北农业大学 食品学院,哈尔滨 150030;
2. 黑龙江中医药大学 佳木斯学院,黑龙江 佳木斯 154007;
3. 哈尔滨工业大学 化工与化学学院,哈尔滨 150090
收稿日期: 2016-11-18
基金项目: 国家自然科学基金(31301545/C200207);中国博士后基金(2014M560244);黑龙江省博士后基金(LBH-Z13042);中国博士后基金国际交流项目(20150082)
作者简介: 张莉丽(1981—),女,博士,副教授;
刘宁(1960—),男,教授,博士生导师;
韩雪(1978—),女,副教授,博士生导师
通信作者: 刘宁, ningliuneau@outlook.com
韩雪, xhan@hit.edu.cn
摘要: 前期研究表明,MgCl2胁迫不但可以提高TGase的产量,还会影响微生物次级代谢产物合成的一个重要调节因子LuxR家族蛋白的表达.为了研究LuxR家族蛋白对茂原链霉菌(Streptomyces mobaraensis) TGase生物合成以及菌体生长的调控作用,利用pKC1139为载体,构建luxR基因阻断质粒,通过PEG介导的质粒转化将其转入S. mobaraensis原生质体中,利用单交换同源重组法将整个重组质粒插入到茂原链霉菌基因组中构建S. mobaraensis luxR家族蛋白基因阻断突变菌.利用菌体干重法对比突变菌和野生菌菌体生长变化,利用比色法研究两株菌TGase生物合成的变化,找到LuxR家族蛋白基因表达与TGase生物合成之间的关系.结果发现,本研究采用单交换同源重组的方法可以成功地构建出S. mobaraensis luxR基因阻断突变菌株.通过对比野生菌与阻断菌株生长和TGase活力的变化发现阻断luxR基因会导致菌体生长受阻,TGase合成延迟,并且表达量显著下降.这些研究结果表明本文研究的luxR基因可能是S. mobaraensis合成TGase必不可少的正向调控因子.
关键词: 茂原链霉菌 谷氨酰胺转氨酶 luxR基因 生物合成
Effects of luxR gene in the biosynthesis of transglutaminase in Streptomyces mobaraensis
ZHANG Lili1, XUE Hui2, DI Wei3, ZHANG Gongsheng1, LIU Ning1

 , HAN Xue3
, HAN Xue3

1. College of Food Science, Northeast Agricultural University, Harbin 150030, China;
2. Jiamusi College, Heilongjiang University of Chinese Medicine, Jiamusi 154007, Heilongjiang, China;
3. School of Chemistry and Chemical Engineering, Harbin Institute of Technology, Harbin 150090, China
Abstract: Our previous studies indicated that MgCl2 stress could not only increase the yield of TGase, but also affect the expression of LuxR family protein, which is an important regulator of microbial metabolism. In order to study the effects of LuxR family protein on the biosynthesis of TGase, the luxR gene disruption plasmid was constructed with the vector of pKC1139. The plasmid was transferred into the protoplasts of Streptomyces mobaraensis by PEG mediated transformation. The recombinant plasmid was inserted into the genome of Streptomyces by a single exchange of homologous recombination. The cell growth and TGase activity of luxR gene disruption mutant of S. mobaraensis were compared with the wild stain. The results showed that the luxR gene disruption mutant was successfully constructed, and that the block of the luxR gene leads to a decrease of the biomass, a synthesis delaying and expression decrease of TGase. These results showed that luxR gene might be an important positive factor on TGase production.
Key words: Streptomyces mobaraensis transglutaminase luxR gene biosynthesis
谷氨酰胺转氨酶(Transglutaminase,TGase)是食品加工领域中重要的蛋白酶,它能够催化酰基转移反应、脱酰胺基反应和蛋白质分子内或分子间谷氨酰胺与赖氨酸残基间的交联反应[1].这些催化反应能够使食品基质中蛋白质发生深刻的变化,改善其结构,提高热稳定性、凝胶性、持水性等,甚至能够引入必需氨基酸来提高食物的营养价值[2-4],因此,在食品工业中应用广泛,在纺织业、组织工程等领域具有良好的发展前景[5-6].目前TGase的主要来源是通过链霉菌发酵生产,为了获得理想的TGase产量,国内外研究者们不断投身于高产菌株筛选、培养基及发酵条件优化、诱变育种等研究中[7-9],但TGase产量低、酶活力不足仍然是发酵生产TGase面临的主要问题,单纯通过外界因素诱导TGase合成不能从根本上解决产量问题.现代生物技术的飞速发展为研究微生物发酵开辟了新的思路.借助该技术可以从基因水平分析目的产物的合成机制,以及合成过程中的调控机制,再通过基因工程技术对菌体基因组进行合理改造,从而有针对性地提高目标产物的合成量.
前期研究发现,在MgCl2胁迫条件下,S. mobaraensis提前合成TGase,并且产量提高,同时MgCl2胁迫会影响LuxR家族蛋白的合成[10].LuxR家族蛋白作为一类转录调控蛋白,与多种微生物的次级代谢产物合成密切相关[11-13].但是目前没有关于LuxR家族蛋白对S. mobaraensis的生长以及其TGase合成作用的研究.为了探索LuxR家族蛋白与S. mobaraensis TGase合成之间的关系,本研究通过基因重组技术阻断S. mobaraensis luxR基因,构建突变菌.通过分析突变菌与野生菌株在MgCl2培养条件和普通培养条件下的TGase活力和菌体合成情况,初步探讨LuxR家族蛋白对TGase合成的调控作用,为其实际应用奠定理论基础.
1 实验 1.1 菌种与质粒TGase生产菌S. mobaraensis购于日本NBRC公司;Escherichia coli DH5α购自TIANGEN公司,大肠杆菌-链霉菌穿梭质粒pKC1139、E. coli ET12567(pUZ8002)系本实验室保存.
1.2 试剂KOD-Plus-Neo PCR反应试剂盒购自TOYOBO;T4 DNA连接酶、200 bp DNA Ladder、1 kb DNA Ladder、DNA纯化回收试剂盒购自TIANGEN;限制性内切酶Hind Ⅲ、Eco RI购自Thermo Fisher;阿泊拉霉素(Apramycin,Am)购自Sigma-Aldrich;上海生工提供引物合成及测序技术支持.
1.3 培养基LB培养基用于E. coli液态培养;麦康凯培养基用于大肠杆菌转化子筛选;YEME培养基用于液态培养S. mobaraensis以制备原生质体;R2YE培养基用于S. mobaraensis原生质体再生;高氏一号培养基用于S. mobaraensis固态培养,当用于S. mobaraensis转化子筛选时需加入相应的抗生素;种子培养基、普通发酵培养基和MgCl2发酵培养基[10]用于S. mobaraensis发酵生产TGase.
1.4 获取luxR基因片段根据链霉菌属luxR基因保守序列设计正向测序引物P1:5’-TTCCTCCTGGACGACCACGAA-3’和反向引物P2:5’-CCGGTTGGTGAGCCCCTCAC-3’.以S. mobaraensis总DNA为模板进行基因扩增,然后对扩增产物进行测序和比对分析,验证是否为luxR基因.验证准确后,根据该基因序列设计正、反引物P3和P4,并分别引入Hind Ⅲ、Eco RI酶切位点,该扩增产物将作为同源臂与质粒连接,命名为ΔluxR.所有的PCR反应均在50 μL反应体系中进行,其中含模板DNA 200 ng和正、反引物各10 μmol/L.PCR反应条件为:94 ℃,2 min;98 ℃,10 s;57 ℃,30 s;68 ℃,30 s/kb;68 ℃,10 min;25~45个循环.
1.5 构建基因阻断质粒将回收纯化的ΔluxR与质粒pKC1139分别经Hind Ⅲ、Eco RI双酶切处理后,进行酶连反应,然后转化E. coli DH5α,麦康凯培养基抗性(50 μg/mL Am)筛选出单菌落,经PCR和质粒双酶切验证后,得到重组质粒.将重组质粒转化E. coli ET12567(pUZ8002),再提取获得去甲基化基因阻断质粒,命名为pKC1139-ΔluxR.
1.6 转化与鉴定参照文献[14]制备S. mobaraensis原生质体并采用PEG介导的方式进行质粒转化.将转化反应液涂布R2YE培养基经再生培养后,利用抗性高氏一号培养基(30 μg/mL Am)培养,筛选出转化子并进行PCR验证.由于野生型S. mobaraensis基因组中不含Apramycin抗性基因aac(3)Ⅳ,当重组质粒上的ΔluxR与其发生同源单交换时,质粒基因也会随之整合到S. mobaraensis基因组上,使其携带aac(3)Ⅳ基因.因此,根据aac(3)Ⅳ基因设计引物P5:5’-TGCAATACGAATGGCGAAAAG-3’,P6:5’-TCGGCCCAGTTGACCCAGGG-3’用来鉴定转化子.
此外,重组质粒所携带的为luxR基因的部分片段,5’端缺少240 bp片段.以luxR基因5’端引物P1为正向引物,aac(3)Ⅳ基因3’端引物P6为反向引物,以阳性转化子DNA为模板进行PCR扩增,PCR产物则应包括luxR上游基因、质粒中的luxR基因片段及Apramycin抗性基因,该方法用于鉴定转化子的整合方式.
1.7 luxR基因阻断对S. mobaraensis生长的影响将S. mobaraensis野生菌和luxR基因阻断突变菌分别进行斜面固体培养,得到新鲜孢子后接种到种子培养基中,48 h后取种子培养物分别接种到普通发酵培养基和MgCl2发酵培养基中继续培养,其间每24 h取一次样测定菌体生物量,绘制细胞生长曲线.菌体生物量(DCW)测定参见文献[9].
1.8 luxR基因阻断对S. mobaraensis TGase产量的影响按1.7方法培养S. mobaraensis野生菌和luxR基因阻断突变菌,其间每24 h取一次样测定发酵液中TGase活力,绘制酶活力变化曲线.TGase活力测定采用分光光度法[15].
2 结果与讨论 2.1 构建基因阻断质粒按照1.3的方法利用引物P1和P2对S. mobaraensis基因组进行PCR反应,得到500 bp产物,测序后经比对与Streptomyces rimosus来源的LuxR family transcriptional regulator的氨基酸序列匹配度高,证明为luxR基因.根据该基因序列设计正向引物P3:5’-TTT AAGCTTCGGGGCCTCGGGTTATGT-3’ (下划线为Hind Ⅲ位点)和反向引物P4:5’-AAA GAATTCGATCCGCCGTTCCTGCTC-3’ (下划线为Eco RI位点),以S. mobaraensis DNA为模板进行基因扩增,得到200 bp luxR基因片段ΔluxR.然后按照1.5的方法将ΔluxR与质粒载体pKC1139连接,构建重组质粒pKC1139-ΔluxR,见图 1(a)所示.重组质粒经双酶切后能够得到6.5 kb载体片段和200 bp的同源臂片段,如图 1(b)所示,证明基因阻断质粒构建成功.
Figure 1
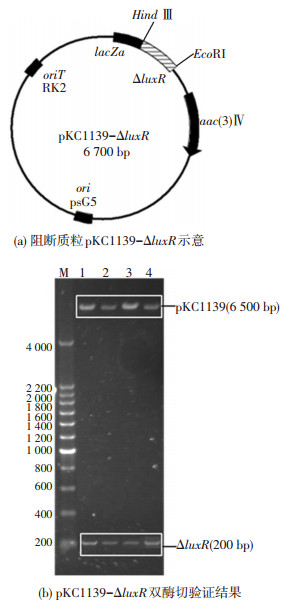 图 1 阻断质粒pKC1139-ΔluxR Figure 1 Recombinant plasmids pKC1139-ΔluxR
图 1 阻断质粒pKC1139-ΔluxR Figure 1 Recombinant plasmids pKC1139-ΔluxR 2.2 重组菌的构建、筛选与验证按照1.6的方法将重组质粒转化到S. mobaraensis原生质体,然后利用R2YE培养基30 ℃条件下进行再生培养,得到的单菌落接种抗性高氏一号培养基(30 μg/mL Am)30 ℃条件下连续传代4次.由于pKC1139-ΔluxR带有温敏型启动子,当培养温度超过37 ℃时,该游离质粒不能自我复制,该重组质粒的luxR基因片段与链霉菌染色体上的同源区段发生同源重组时,整个质粒可通过单交换的方式插入到染色体上的luxR基因中,质粒上所携带的aac(3)Ⅳ抗性基因也就能够表达,取第四代转化子继续接种抗性高氏一号培养基(30 μg/mL)中,39 ℃条件下培养.
提取转化子DNA,按照1.6的方法进行PCR验证.以luxR基因5’端引物P1为正向引物,以阿泊拉霉素抗性基因3’端引物P6为反向引物,以转化子DNA为模板进行PCR扩增,PCR产物则包括了luxR基因上游、质粒中的luxR基因片段及阿泊拉霉素抗性基因的核苷酸序列,理论大小为2.4 kb左右.结果如图 2(b)所示,转化子S1既扩增出了700 bp的aac(3)Ⅳ基因(泳道1),又扩增出一条2.4 kb产物,且验证整合方式的PCR产物与理论大小(图 2(a))一致(泳道2).而转化子S2只扩增出700 bp的aac(3)Ⅳ基因(泳道1.将转化子S1的2.4 kb扩增产物进行测序比对,证明pKC1139-luxR2已经整合到S. mobaraensis基因组中,luxR基因阻断菌构建成功.
Figure 2
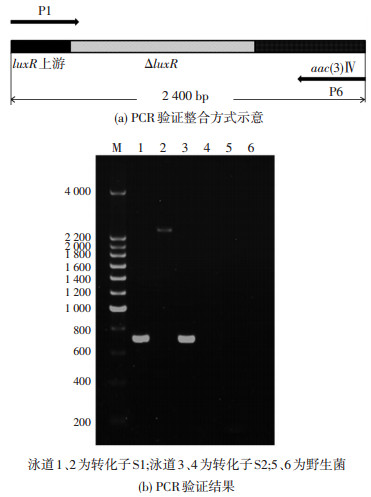 图 2 突变菌PCR验证 Figure 2 PCR identification of recombinant
图 2 突变菌PCR验证 Figure 2 PCR identification of recombinant 2.3 luxR基因阻断对S. mobaraensis生长的影响菌体生长曲线结果显示(图 3),普通发酵培养中的野生菌和重组菌生长周期一致,24~96 h菌体迅速生长处于对数期,96 h后生长趋于平缓进入稳定期.虽然野生菌和重组菌生长趋势相似,但在同一时间点的野生菌生物量显著高于突变菌(P<0.05),发酵到96 h时野生菌生物量达到最大(10.89 g/L),重组菌生长到120 h生物量最大也仅为8.04 g/L.将野生菌和重组菌接种到MgCl2发酵培养基中后,对菌体生长周期没有影响,相同菌株其生物量也没有显著差异(P>0.05).这些结果表明,阻断luxR基因会抑制S. mobaraensis生长.
Figure 3
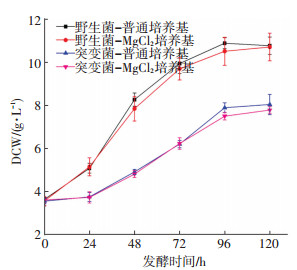 图 3 野生菌及重组菌在不同发酵培养基中的生长曲线 Figure 3 Growth curves of wild strain and luxR gene disruption mutant in the different fermentation media
图 3 野生菌及重组菌在不同发酵培养基中的生长曲线 Figure 3 Growth curves of wild strain and luxR gene disruption mutant in the different fermentation media 2.4 luxR基因阻断对S. mobaraensis发酵生产TGase的影响S.mobaraensis发酵生产TGase酶活力变化曲线(图 4)显示,生长在普通发酵培养基中的野生菌在对数生长期TGase活力逐渐增加,96 h发酵液中TGase活力达到最大(0.9 U/mL),96 h后随着菌体生长进入稳定期,TGase活力不再升高.相比普通培养基,生长在MgCl2发酵培养基中的野生菌在24~96 h期间TGase活力增长速度更快,96 h后增长速度放缓,发酵结束时TGase活力达到最高(2.8 U/mL),相对普通发酵培养基其TGase活力提高了211%.然而重组菌在普通发酵培养基和MgCl2培养基中几乎没有酶活产生.这些结果表明,luxR基因阻断显著影响TGase合成,并且MgCl2胁迫不能提高重组菌TGase产量.
Figure 4
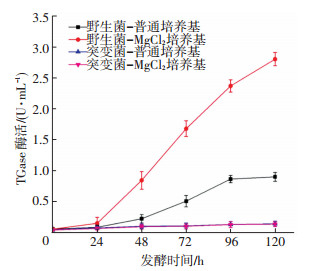 图 4 野生菌及重组菌在不同发酵培养基中的TGase产量变化 Figure 4 Changes of TGase production of wild strain and luxR gene disruption mutant in the different fermentation media
图 4 野生菌及重组菌在不同发酵培养基中的TGase产量变化 Figure 4 Changes of TGase production of wild strain and luxR gene disruption mutant in the different fermentation media LuxR家族蛋白是一类在细菌群体感应机制中起重要作用的调控蛋白,它影响着微生物的生长繁殖、毒性因子、次级代谢产物和生物膜的形成以及胞外蛋白的合成[12].研究表明,在链霉菌发酵过程中,LuxR家族蛋白可以作为抗生素产量的调控因子,在基因水平上对次级代谢产物进行调控.He等[16]研究发现LuxR家族蛋白对格尔德霉素的产生具有正调控的作用.Yu等[17]研究发现阻断LuxR家族蛋白调控因子的表达降低了S. avermitilis合成寡霉素(oligomycin)的能力,然而阿维菌素(avermectin)的产量却升高了4倍.这些结果表明,luxR基因对于链霉菌的产物合成可以是一种双向调节因子,对于S. mobaraensis生产TGase来说可能是一种正向调控因子.
3 结语以pKC1139为载体构建luxR基因阻断质粒,通过PEG介导的质粒转化将其转入S. mobaraensis原生质体中,单交换同源重组法将整个重组质粒插入到链霉菌基因组中以阻断luxR基因的表达,可以成功构建出S. mobaraensis luxR基因阻断突变菌.通过对比野生菌和阻断菌株在两种不同培养基中生长和产酶情况,发现阻断luxR基因会抑制S. mobaraensis菌体的生长,并且TGase合成受到抑制.这些结果表明,本文研究的luxR基因可能是S. mobaraensis合成TGase必不可少的正向调控因子.
参考文献
[1]ANDO H, ADACHI M, UMEDA K, et al. Purification and characteristics of a novel transglutaminase derived from microorganisms[J].Agricultural and Biological Chemistry, 1989, 53(10): 2613-2617.
[2]ZHU Y, TRAMPER J. Novel applications for microbial transglutaminase beyond food processing[J].Trends in Biotechnology, 2008, 26(10): 559-565.DOI: 10.1016/j.tibtech.2008.06.006
[3]DEJONG G A H, KOPPELMAN S J. Transglutaminase catalyzed reactions: Impact on food applications[J].Journal of Food Science, 2002, 67(8): 2798-2806.DOI: 10.1111/j.1365-2621.2002.tb08819.x
[4]GASPAR A L C, GOES-FAVONI DE S P. Action of microbial transglutaminase (MTGase) in the modification of food proteins: A review[J].Food Chemistry, 2015, 171: 315-322.DOI: 10.1016/j.foodchem.2014.09.019
[5]GEMBEH S V, FARRELL H M, TAYLOR M M, et al. Application of transglutaminase to derivatize proteins: 1. Studies on soluble proteins and preliminary results on wool[J].Journal of the Science of Food and Agriculture, 2005, 85(3): 418-424.DOI: 10.1002/jsfa.1999
[6]DU G, CUI L, ZHU Y, et al. Improvement of shrink-resistance and tensile strength of wool fabric treated with a novel microbial transglutaminase from Streptomyces hygroscopicus[J].Enzyme and Microbial Technology, 2007, 40(7): 1753-1757.DOI: 10.1016/j.enzmictec.2006.12.001
[7]ZHANG L, ZHANG L, HAN X, et al. Enhancement of transglutaminase production in Streptomyces mobaraensis as achieved by treatment with excessive MgCl2[J].Applied Microbiology and Biotechnology, 2012, 93(6): 2335-2343.DOI: 10.1007/s00253-011-3790-5
[8]ZHU Y, RINZEMA A, TRAMPER J, et al. Fed-batch fermentation dealing with nitrogen limitation in microbial transglutaminase production by Streptoverticillium mobaraense[J].Applied Microbiology and Biotechnology, 1998, 49(3): 251-257.DOI: 10.1007/s002530051165
[9]ZHU Y, RINZEMA A, TRAMPER J, et al. Medium design based on stoichiometric analysis of microbial transglutaminase production by Streptoverticillium mobaraense[J].Biotechnology and Bioengineering, 1996, 50(3): 291-298.3.0.CO;2-B" target="_blank" title="点击浏览原文">DOI: 10.1002/(SICI)1097-0290(19960505)50:3<291::AID-BIT8>3.0.CO;2-B
[10]ZHANG L, ZHANG L, YI H, et al. Enhancement of transglutaminase production in Streptomyces mobaraensis dsm 40587 by non-nutritional stress conditions: Effects of heat shock, alcohols, and salt treatments[J].Korean Journal of Chemical Engineering, 2012, 29(7): 913-917.DOI: 10.1007/s11814-011-0274-3
[11]CHEN J, XIE J. Role and regulation of bacterial LuxR-like regulators[J].Journal of Cellular Biochemistry, 2011, 112(10): 2694-2702.DOI: 10.1002/jcb.23219
[12]SANTOS C L, CORREIA-NEVES M, MORADAS-FERREIRA P, et al. A walk into the luxr regulators of actinobacteria: Phylogenomic distribution and functional diversity[J].PLoS ONE, 2012, 7(10): e46758.DOI: 10.1371/journal.pone.0046758
[13]YU Q, BAI L, ZHOU X, et al. Inactivation of the positive luxr-type oligomycin biosynthesis regulators olmri and olmrii increases avermectin production in Streptomyces avermitilis[J].Chinese Science Bulletin, 2012, 57(8): 869-876.DOI: 10.1007/s11434-011-4865-5
[14]侯孝仑, 刘雅清, 郭玮婷, 等. 原生质体融合提高产谷氨酰胺转氨酶菌株产量[J].食品科学, 2016(3): 145-150.
HOU Xiaolun, LIU Yaqing, GUO Weiting, et al. Strain improvement by protoplast fusion for enhanced transglutaminase production[J].Food Science, 2016(3): 145-150.DOI: 10.7506/spkx1002-6630-201603027
[15]FOLK J E, COLE P W. Structural requirements of specific substrates for guinea pig liver transglutaminase[J].Jounal of Biological Chemistry, 1965, 240(7): 2951-2960.
[16]HE W Q, LEI J, LIU Y Y, et al. The luxr family members gdmri and gdmrii are positive regulators of geldanamycin biosynthesis in Streptomyces hygroscopicus 17997[J].Archives of Microbiology, 2008, 189(5): 501-510.DOI: 10.1007/s00203-007-0346-2
[17]YU Q, BAI L Q, ZHOU X F, et al. Inactivation of the positive luxr-type oligomycin biosynthesis regulators olmri and olmrii increases avermectin production in Streptomyces avermitilis[J].Chinese Science Bulletin, 2012, 57(8): 869-876.DOI: 10.1007/s11434-011-4865-5
