

1. 湖北医药学院附属东风医院 医学实验中心,湖北 十堰 442008;
2. 湖北医药学院 药学院,湖北 十堰 442000;
3. 深圳市宝安纯中医治疗医院 药学部,广东 深圳 518102;
4. 武汉工程大学 化学与环境工程学院,湖北 武汉 430205
收稿日期:2020-06-24;接收日期:2020-10-21;网络出版时间:2020-11-09
基金项目:国家自然科学基金(No. 81872509),湖北省卫生健康委员会面上项目(No. WJ2019M054),湖北医药学院自由探索基金(No. FDFR201804),十堰市科技局引导性科研项目(No. 19Y93),湖北医药学院研究生科技创新项目(No. YC2019021) 资助
摘要:为了开发一种用于人体血浆中外泌体的高效快速提取和分离的新型微流控芯片,文中收集健康人体外周血液样本,自主设计并制备基于纳米多孔薄膜和琼脂糖凝胶电泳的微流芯片。提取的外泌体使用透射电镜、Nanosight和Western blotting等技术进行表征,鉴定并分析其形态、浓度和粒径分布。同时将超速离心法和微流芯片所提取的外泌体进行粒径和浓度的分析比较,探讨两种方法各自的提取效率。最后,利用RT-PCR技术分析外泌体中miRNA-21的相对表达量。凝胶电泳微流芯片可在1 h内快速的从血浆中高效率地提取出纯度高、大小完整、尺寸分布在30–200 nm之间的外泌体,满足后续下游分析的要求。通过与现有最普遍的超速离心法进行对比分析,当血浆样本量小于100 μL时,凝胶电泳微流芯片提取外泌体的效率为超速离心法的3.80倍。凝胶电泳微流芯片提取外泌体的优化参数是:电场电压:100 V;琼脂糖凝胶浓度:1.0%;注射泵流速:0.1 mL/h。凝胶电泳微流芯片可快速高效地提取出外泌体,对外泌体与癌症生物标记物的相关研究具有潜在的巨大优势,也为基于外泌体的即时诊断技术提供了可能。
关键词:外泌体微流控芯片癌症纳米多孔薄膜凝胶电泳
Extraction of exosome by gel electrophoresis microfluidic chip and determination of miRNA-21 in exosome of human plasma
Dan Luo1,2, Fengying Ran1, Lun Wu1, Juan Zhang4, Fangling Ren1,2, Jingjian Liu1,2, Binqiang Zhang1, Qinhua Chen1,3


1. Department of Medical Experimental Center, Affiliated Dongfeng Hospital of Hubei University of Medicine, Shiyan 442008, Hubei, China;
2. College of Pharmacy, Hubei University of Medicine, Shiyan 442000, Hubei, China;
3. Department of Pharmacy, Shenzhen Baoan Authentic TCM Therapy Hospital, Shenzhen 518102, Guangdong, China;
4. College of Chemistry and Environmental Engineering, Wuhan Institute of Technology, Wuhan 430205, Hubei, China
Received: June 24, 2020; Accepted: October 21, 2020; Published: November 9, 2020
Supported by: National Natural Science Foundation of China (No. 81872509), Hubei Province Health and Family Planning Scientific Research Project (No. WJ2019M054), the Free Exploration Project of Hubei University of Medicine (No. FDFR201804), the Scientific and Technology Project of Shiyan City of Hubei Province (No. 19Y93), the Innovative Research Program for Graduates of Hubei University of Medicine (No. YC2019021)
Corresponding author: Qinhua Chen. Tel: +86-719-8272534; E-mail: cqh77@163.com.
Abstract: We developed a high-efficiency microfluidic chip for extracting exosomes from human plasma. We collected peripheral blood from normal human, designed and fabricated a microfluidic chip based on nanoporous membrane and agarose gel electrophoresis to isolate exosomes. The extracted exosomes were characterized by transmission electron microscopy, nanosight and Western blotting, the morphology, concentration and particle size of exosomes were identified and analyzed. Meanwhile, we used ultracentrifugation and microfluidic chip to isolate exosomes separately. The particle size and concentration of the exosomes extracted by two methods were compared and analyzed, and their respective extraction efficiency was discussed. Finally, the expression level of miRNA-21 in exosomes was analyzed by RT-PCR. The microfluidic chip isolated (in 1 hour) high-purity exosomes with size ranging from 30–200 nm directly from human plasma, allowing downstream exosomal miRNA analysis. By comparing with ultracentrifugation, the isolation yield of microfluidic chip was 3.80 times higher than ultracentrifugation when the volume of plasma sample less than 100 μL. The optimized parameters for exosome isolation by gel electrophoresis microfluidic chip were: voltage: 100 V; concentration of agarose gel: 1.0%; flow rate of injection pump: 0.1 mL/h. The gel electrophoresis microfluidic chips could rapidly and efficiently isolate the exosomes, showing great potential in the research of exosomes and cancer biomarkers.
Keywords: exosomesmicrofluidic chipcancernanoporous membranegel electrophoresis
随着癌症发病率和死亡率的逐年增加,癌症已成为严重威胁国民健康与生命安全的一种疾病,癌症的早期发现是降低人类癌症死亡率的最有效途径[1]。近年来,液体活检作为一种临床诊断癌症的新方法,获得国内外越来越多专家****的关注。液体活检主要利用癌症患者血液、尿液、乳汁等体液中的循环生物标记物,如循环肿瘤细胞(Circulating tumor cells,CTCs)、游离的DNA、RNA和外泌体(Exosomes),获取肿瘤相关的生物学信息[2]。其中,外泌体作为最具代表性的肿瘤生物标记物[3],近年来逐渐成为一个研究热点。
外泌体是一种大小均一、直径约为30-200 nm的脂质双分子层结构小囊泡[4],它们由大多数类型的细胞主动分泌至细胞外,广泛存在于许多生物液体中[5]。当外泌体在体液中循环时,它们作为肿瘤细胞与正常细胞间通讯的重要介质,可能促进肿瘤的恶性过程,与肿瘤的发生发展有着密切的关系[6]。由于外泌体大小均一,存在于大量生物液体中且其内容物丰富(包括RNAs、DNAs、脂质和蛋白质等),含有更多的特异性标记物,外泌体被视为新一代的生物标志物[7]。
作为细胞间通讯信息交换的载体,外泌体的实际价值如同血浆、淋巴液等,但其提取分离的方法及效率却是一个影响其应用的重要问题。由于外泌体纳米级别的尺寸大小,其高效快速的提取与分离方法一直以来是一个尚未彻底解决的难题。当前常用的外泌体提取方法有:超速离心沉淀法(Ultracentrifugation,UC)、超滤法、商业试剂盒法(Exo QuickTM法,qEV技术)、新型免疫亲和捕获法和微流控技术等[8-9]。这些方法各有其优缺点,近年来利用微流控技术提取外泌体较为广泛,微流控技术可以较高产量地从生物流体中分离出高纯度的外泌体,且该技术易用、高通量、可自动化[10],可作为外泌体提取相关研究的新方向。
本研究旨在设计开发一种性能优越且便携小巧的凝胶电泳微流芯片用于人体血浆中外泌体的提取分离,高效、快速地提取人体原始血浆样品中的外泌体,使外泌体产量较高且所需成本较低,拟解决外泌体提取费时费力、成本较高等问题,也为基于外泌体的即时诊断技术提供可能性。
1 材料与方法1.1 材料与试剂正常人体外周血液样本来自湖北医药学院附属国药东风总医院。50×TAE缓冲液购自Solarbio公司,货号T1060 (2 mol/L Tris-乙酸、0.1 mol/L Na2EDTA·2H2O,pH 8.5);1×TAE缓冲液(50×TAE缓冲液用蒸馏水稀释50倍,4 ℃保存);琼脂糖购自Biowest公司,货号YZQZT;聚对苯二甲酸乙二醇酯(Polyethylene terephthalate,PET) 纳米孔薄膜购自Whatman公司,货号110602;兔单克隆抗体CD63、TSG101、Anti-apolipoprotein A1 (Apo-A1) 均购自Abcam公司,货号分别为ARG57952、EPR7130B、EP1368Y;二抗山羊抗兔抗体购自Antgene公司,货号ANT020s;miRNeasy Serum/Plasma Kit试剂盒、miScript SYBR Green PCR Kit试剂盒和逆转录miScript Ⅱ RT Kit试剂盒均购自QIAGEN公司,货号分别为217184、218073、218160。荧光定量PCR仪(美国Corbett Research公司,Rotor gene 6000);超速离心机(日本Hitachi INC公司,CP100MX);凝胶成像系统(上海Gene公司,UPV INC);微量注射泵(兰格恒流泵有限公司,LSP01-1A)。本研究的所有实验均严格按照相关法律和制度规定(中华人民共和国国家卫生健康委员会《涉及人的生物医学研究伦理审查办法》[11]) 进行。本研究得到了国药东风总医院伦理委员会(中国,十堰) 的批准,健康受试者均获得知情同意。
1.2 芯片的设计与制备本研究所开发的凝胶电泳微流芯片是以一个尺寸约为100 mm×40 mm×2 mm的聚甲基丙烯酸甲酯片材(Polymethyl methacrylate,PMMA) 作为微通道基板,与聚碳酸酯片材(Polycarbonate,PC) 逐层搭建而成。芯片的微通道设计如图 1A所示,在Adobe Illustrator中经过设计由计算机控制的铣床(Roland,SRM-20) 直接研磨而成。如图 1A所示,微通道由一条尺寸为55 mm×5 mm的水平通道和两条尺寸分别为28 mm×1.5 mm、28 mm×2 mm的垂直通道构成,中间穿插了两个尺寸为15 mm×4.5 mm的卡槽(防止电泳时凝胶滑动)。聚碳酸酯片材用作芯片的上盖、下盖和底盖,厚度约300 μm,布局通过绘图仪Graphtec 7000切割而成。连接微通道基板、上盖、下盖、底盖与纳米孔薄膜5部分的是3层聚酰亚胺胶带(Kapton tape),布局通过绘图仪Graphtec 7000切割而成。在2层聚酰亚胺胶带之间留出一个5 mm×2 mm的小口,将纳米孔薄膜夹载在其中并暴露出来。上盖留出2个用于进样、出液的小孔(与28 mm× 1.5 mm垂直通道两端对应),2个用于回收外泌体的小孔(与28 mm×2 mm垂直通道两端对应),2个注入琼脂糖凝胶的小孔(与水平通道两端对应)和1个尺寸为5 mm×2 mm的放置纳米孔薄膜的小口。下盖留出与微通道两条垂直通道完全重合的窗口,底盖密封。这样包括上盖、纳米孔薄膜、微通道基板、下盖和底盖在内的5层芯片结构便可以在胶带的作用下密封贴合在一起,构成芯片的主体。在2个注入琼脂糖凝胶的小孔和纳米孔薄膜的上方分别放置一段直径为15 mm的塑料管,将其与芯片主体粘合在一起,作为电泳液的储液槽。
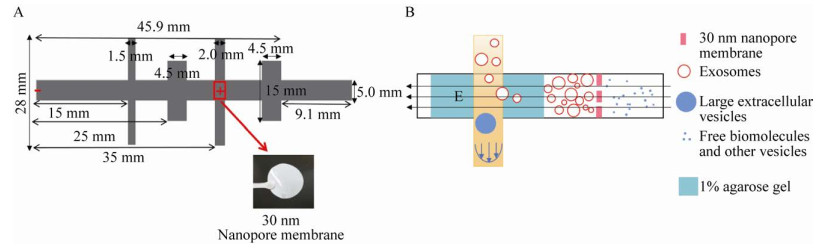 |
| 图 1 凝胶电泳微流芯片设计原理图 Fig. 1 Schematic diagram of gel electrophoresis microfluidic chip. (A) Design diagram of microfluidic chip. (B) Schematic diagram of microfluidic chip to isolate exosomes. |
| 图选项 |
1.3 外泌体的提取打开芯片的底盖,于下盖的两条垂直通道窗口处贴入2条与之完全匹配的普通胶带,用底盖密封。精确称取0.1 g琼脂糖凝胶于锥形瓶中,加入10 mL 1×TAE缓冲液,置于微波炉中加热溶解,配制浓度为1.0%的琼脂糖凝胶。迅速将琼脂糖凝胶从塑料管内小孔处注入芯片,使之完全充满芯片微通道,再将芯片在4 ℃条件下放置20 min左右,待凝胶完全凝固后取出。20 min后将芯片底盖打开,取出粘贴在垂直通道的胶带,此时垂直通道中的琼脂糖凝胶也会随之掉落,形成一条用于进样的垂直通道和一条用于富集外泌体的富集腔通道,再用底盖密封芯片。取50 μL左右的PBS缓冲液(pH 7.3) 从回收外泌体的小孔处注入芯片,使其位于纳米孔薄膜下端的富集腔处,用于收集外泌体。将正常人外周血在3 000 r/min条件下离心5 min,取上清液即为血浆。取80 μL左右血浆至1 mL注射器中,将注射器加载至微量注射泵上,调整注射泵流速为0.1 mL/h,用小管将注射器连接至芯片入口处,使注射器中的血浆能够顺利注入芯片内。将芯片两端的电泳储液槽灌满1×TAE缓冲液,分别插入电极(纳米孔薄膜上端电泳槽为正极),调整电压为100 V。施加电压的同时打开注射泵,使血浆中的外泌体在电场的作用下发生定向移动,穿过琼脂糖凝胶被纳米孔薄膜所捕获,从而完成外泌体的提取。
1.4 外泌体的表征与鉴定1.4.1 TEM用透射电子显微镜(Transmission electron microscope,TEM) 分析所提取的外泌体样本,观察其形态特征。将400目碳涂层铜网格(碳侧朝下) 漂浮在20 μL外泌体悬浮液滴上,避光静置5 min。然后用2%戊二醛(Sigma-Aldrich) 将外泌体样品固定在铜网上20 min,室温下静置干燥,再将铜网浸入2%磷钨酸中进行染色。用PBS冲洗样品并在室温下干燥,在透射电子显微镜(Hitachi H-7000 NAR) 中获得图像。
1.4.2 Nanosight用Nanosight分析所提取外泌体的浓度和粒径大小。取外泌体样品,用PBS进行稀释(1︰1 000)至800-1 000 mL,用旋涡混合器混合均匀。再取稀释好的外泌体样本上机(马尔文Nanosight NS300),分别进样3次,每次30 s。使用NTA2.3分析软件进行数据分析,使用手动快门和增益调整对样本进行分析,得出快门速度为15 ms或30 ms,相机增益在280-560之间。
1.4.3 Western blotting使用Western blotting鉴定外泌体的标志蛋白CD63和TSG101。提取的外泌体样本直接与上样缓冲液(99 ℃,5 min) 混合,再用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(Sodium dodecyl sulfate- polyacrylamide gel electrophoresis,SDS-PAGE) 分离蛋白质。外泌体蛋白电泳至SDS-PAGE凝胶底层后,暂停电泳,将SDS-PAGE凝胶中的蛋白质转移到聚偏二氟乙烯(Polyvinylidene difluoride,PVDF) 膜上。然后用牛奶孵育1 h,再加入CD63和TSG101抗体,在4 ℃条件下缓慢摇晃过夜。过夜后加入二抗山羊抗兔抗体,室温下孵育2 h。最后,使用显影剂在凝胶成像系统分析图像。
1.5 超速离心法提取外泌体用PBS溶液将待提取的100 μL血浆样品稀释至20 mL,在300×g、4 ℃条件下离心10 min,弃管底沉淀,取上清液备用。再将上清液置于2 000×g、4 ℃条件下离心10 min,弃管底沉淀(即死细胞),取上清液备用。将上清液置于10 000×g、4 ℃条件下继续离心30 min,弃管底沉淀(即细胞碎片),取上清液。继续将上清液置于100 000×g、4 ℃条件下离心70 min,结束后弃上清液,取管底沉淀(外泌体和蛋白)。将管底沉淀使用PBS溶液稀释至20 mL,置于100 000×g、4 ℃条件下继续离心70 min,弃上清液,管底沉淀即外泌体。最后用200 μL PBS溶液清洗管底沉淀,所得溶液即外泌体。
1.6 RT-PCR分析取凝胶电泳微流芯片与超速离心法所提取的血浆(100 μL) 中的外泌体样本,使用miRNeasy Serum/Plasma Kit试剂盒提取外泌体的总RNA。按照miScript Ⅱ RT Kit试剂盒说明书将RNA逆转录成cDNA,然后用miScript SYBR Green PCR Kit试剂盒行RT-PCR检测。扩增程序为:95 ℃ 15 min;94 ℃ 15 s,55 ℃ 30 s,70 ℃ 30 s,45个循环。实验均设5个复孔,RT-PCR实验数据采用2-ΔΔCt法(Ct为荧光达到阈值时所需PCR的循环数),以试剂盒自带的spike-in control (miRNA-39) 作为内参基因,分析两种方法所提取的血浆外泌体样本中miRNA-21的表达水平。
2 结果与分析2.1 外泌体的提取原理图 1B展示了凝胶电泳微流芯片提取外泌体的原理机制。由于外泌体等生物分子的表面带有负电荷[12],在电场的存在下可以发生定向移动,所以设计了该芯片用于提取人体血浆中的外泌体。本实验利用微量注射泵从芯片的垂直通道入口处注入血浆样品,当血浆流经存在电场(100 V)的水平通道时,带有负电荷的外泌体可在电场的作用下发生定向移动从而进入充满琼脂糖凝胶的水平通道。1.0%琼脂糖凝胶内部孔径为200-300 nm[13],可以保证目标外泌体顺利穿过琼脂糖凝胶,血浆中尺寸较大的细胞外囊泡由于不能穿过1.0%琼脂糖凝胶而从垂直通道的出口处流出。在电场的作用下,血浆中尺寸为30-200 nm的外泌体被驱动到30 nm纳米孔薄膜处被捕获,而游离的生物小分子和其他小囊泡则穿过纳米孔薄膜,从而实现外泌体的分离和纯化。电泳结束后使用移液器从回收外泌体的小孔处取出外泌体,从而完成外泌体的提取工作。
2.2 外泌体的表征与鉴定使用TEM、Nanosight和Western blotting等技术对所提外泌体进行表征与鉴定,结果如图 2所示。首先,使用TEM分析所提取的外泌体样本,观察其形态特征。如图 2A所示,透射电子显微镜下的外泌体为圆形或椭圆形的囊泡结构,大小均匀完整,直径多在30-200 nm之间。Nanosight分析测量所提外泌体的浓度与粒径分布,图 2B显示粒径分布在30-200 nm范围内的外泌体占比80.10%,外泌体浓度约为(1.64±0.456)×109 /mL,其中每微升血浆大约可提取(10.25±0.521)×108个外泌体。Western blotting结果如图 2C所示,在图中40 kDa和45 kDa处可见2条信号较强的条带,分别代表外泌体标志性蛋白CD63和TSG101的表达,说明凝胶电泳微流芯片可成功从人体血浆中提取出外泌体。Apo-A1是一种载脂蛋白,由于血浆中混有脂质-蛋白复合物,其形状也为小球型,外层同样为磷脂,有蛋白结合。所以我们使用Western blotting检测所提取的外泌体中是否含有载脂蛋白Apo-A1,结果如图 2C所示,图中31 kDa处并未看到Apo-A1的表达。说明所提取的外泌体样品纯度较高,可排除脂蛋白的相关影响。上述鉴定结果表明,根据我们设计的凝胶电泳微流芯片可以提取出大量浓度适宜、纯度较高且大小完整的外泌体。
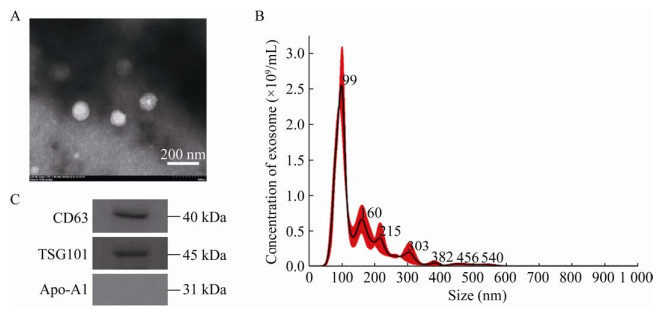 |
| 图 2 外泌体的表征 Fig. 2 Characterization of exosome. (A) The TEM imagine of exosome. (B) The nanosight analysis of exosome. (C) The Western blotting of exosome. |
| 图选项 |
2.3 条件优化为了获得凝胶电泳微流芯片提取外泌体的最佳效率,我们将外泌体提取过程中的关键参数进行了优化考察,包括电场电压大小、琼脂糖凝胶浓度和注射泵流速等参数。选择外泌体浓度来评估上述实验参数对凝胶电泳微流芯片提取性能的影响,每次优化实验重复3次(n=3),结果为3次外泌体浓度的平均数±标准差(x±s)优化结果见图 3。基于上述,经优化后的凝胶电泳微流芯片提取外泌体的实验参数分别是:电场电压:100 V;琼脂糖凝胶浓度:1.0%;注射泵流速:0.1 mL/h。具体参数优化过程见讨论部分。
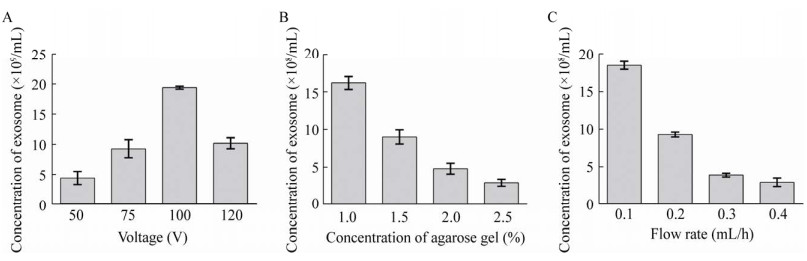 |
| 图 3 实验参数的优化 Fig. 3 Optimization of experimental parameters. (A) Effects of voltage on the concentration of exosome extracted by microfluidic chip. (B) Effects of the concentration of agarose gel on the concentration of exosome extracted by microfluidic chip. (C) Effects of the flow rate on the concentration of exosome extracted by microfluidic chip. Error bars: s, n=3. |
| 图选项 |
2.4 凝胶电泳微流芯片的提取效率为了评价凝胶电泳微流芯片提取外泌体的整体效率,我们将该芯片与超速离心法(外泌体提取金标准) 进行比较分析,结果如图 4所示。首先,使用凝胶电泳微流芯片提取80 μL血浆中的外泌体,按照上述提取步骤可获得50 μL的外泌体样品。使用Nanosight技术分析该外泌体样品(取20 μL) 的浓度和粒径分布,如图 4A所示,结果显示粒径分布在30-200 nm范围内的外泌体占比86.57%,外泌体浓度为(19.00±0.585)×108/mL,对应于每微升血浆可提取(11.88±0.631)×108个外泌体。然后,使用超速离心法提取100 μL血浆中的外泌体,同样使用Nanosight技术对该外泌体样品(取50 μL) 进行浓度和粒径分布分析,结果如图 4B所示。结果显示粒径分布在30-200 nm范围内的外泌体只占比41.17%,外泌体浓度为(1.57±0.187)×108/mL,对应于每微升血浆可提取(3.14±0.238)×108个外泌体。最后,将两种方法提取每微升血浆中外泌体的数量进行比较,发现两种方法所提取的外泌体产量差异明显(P=0.003)。当血浆样本量小于100 μL时,凝胶电泳微流芯片所提取外泌体的产量为超速离心法的3.80倍(图 4C)。该凝胶电泳微流芯片提取外泌体的效率受到血浆样品量的影响,当处理的血浆量大于100 μL时,外泌体的提取效率和纯度都会出现明显下降。凝胶电泳微流芯片分离性能的下降主要是由于分离外泌体浓度过高后会堵塞纳米孔薄膜从而使得分离特性失效,同时纳米孔的堵塞也会进一步降低微流沟道中的电场强度使得外泌体的电泳捕获效率下降。所以在本实验中我们选取的最大样品处理量小于100 μL。该凝胶电泳微流芯片的样品处理量可以通过设计多个并行的微流沟道和增加纳米孔膜的面积进一步提升。
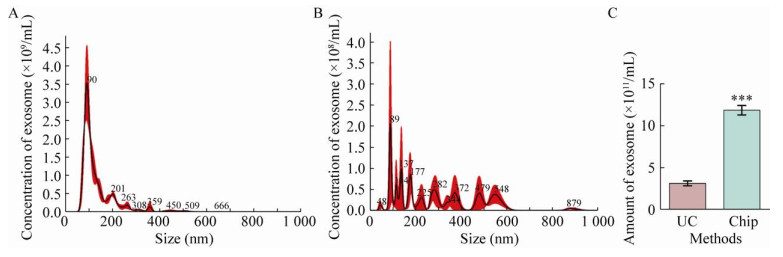 |
| 图 4 凝胶电泳微流芯片与超速离心法提取外泌体的比较分析 Fig. 4 Comparison between gel electrophoresis microfluidic chip and ultracentrifugation. (A) Nanosight analysis of exosome extracted by gel electrophoresis microfluidic chip. (B) Nanosight analysis of exosome extracted by ultracentrifugation. (C) The isolation yield of two methods. Error bars: s, n=3. |
| 图选项 |
2.5 外泌体miRNA-21检测为了验证凝胶电泳微流芯片所提取的外泌体样本可满足后续下游分析对于外泌体miRNA的需求和实验可行性,我们分别使用凝胶电泳微流芯片和超速离心法提取10份健康人血浆(各100 μL) 中的外泌体,将其进行RT-PCR,以超速离心法所提取的外泌体作为对照组,分析外泌体miRNA-21的表达情况,结果如图 5所示。我们在10份血浆外泌体中都检测到了miRNA-21表达,其中9份凝胶电泳微流芯片所提取的外泌体相对于超速离心法可检测到miRNA-21的显著表达,差异具有统计学意义(P < 0.05)。结果表明凝胶电泳微流芯片所提取的外泌体样本具有后续下游分析(miRNA分析) 的可行性,这也为外泌体的进一步研究和分析提供了可能性。由于本研究所采用的样本量较少,后续还需扩大样本量进行全面分析,深入研究外泌体miRNA在肿瘤发生发展过程中所发挥的具体作用。
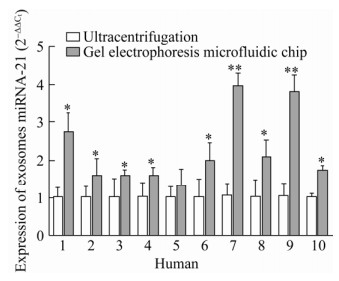 |
| 图 5 外泌体miRNA-21的表达水平分析 Fig. 5 The expression level of miRNA-21 in exosomes. *: P < 0.05; **: P < 0.01; Error bars: s, n=5. |
| 图选项 |
3 讨论近年来,关于外泌体提取方法的研究越来越多。超速离心沉淀法被认为是提取与分离外泌体的金标准[8],大部分外泌体研究中所使用的提取方法都是超速离心沉淀法。使用超速离心法提取外泌体时,要将待提取样品以至少100 000×g的转速进行多次超速离心使外泌体沉淀,离心管管底产生的沉淀即外泌体[14]。这种外泌体提取的方法不仅需要大量的资金(超速离心机价格> 10万美元),其提取还是一个劳动密集且耗时(一般需4-6 h) 的过程[14]。为了获得满足实验要求的外泌体,需要收集大量的生物样品,但最后提取到的外泌体仍然会受到其他蛋白质的污染,导致外泌体纯度较低[15]。另外,超速离心沉淀法的多轮离心过程也会造成外泌体的损失,该方法并不适用于微量样品中外泌体的提取。超滤法可快速简便地提取出外泌体,并且不需要特殊的设备,但容易形成堵塞现象,外泌体也会因此吸附在膜上,使产量降低[8]。商业试剂盒(Exo QuickTM技术,qEV技术) 可高效快捷地提取出外泌体,产量较高,外泌体生物活性较好[16],但这种方法仍然会造成其他蛋白质对外泌体的污染。目前商业试剂盒价格昂贵、成本较高[17],很难在临床研究中实现大规模的应用。免疫亲和法主要是利用磁珠标记抗体与外泌体表面的蛋白进行特异性结合,可高特异性地捕获到目标外泌体,但该方法只能捕获表面表达特定蛋白的部分外泌体而不能捕获所有外泌体[18],产量较低。并且外泌体与磁珠的分离过程非常耗时,需要超过一天的时间才能达到最佳分离效果[19]。利用微流控技术提取外泌体是近年来研究的新方向,微流控技术可提取微量生物样本中的外泌体,这可大大减少样本的取样量,受试者的可接受程度较高。并且微流控技术可对外泌体样本进行富集,产生较高浓度和纯度的外泌体,弥补了传统提取方法的不足之处。
在本研究中,凝胶电泳微流芯片提取外泌体的效率取决于外部施加电压大小,过高或者过低的电压都会影响外泌体进入水平通道,从而降低纳米孔薄膜的捕获效率,使芯片提取外泌体的性能降低。因此,我们首先研究了50-120 V外加电压对芯片提取性能的影响。如图 3A所示,外泌体浓度随着电压从50 V增加至100 V而逐渐增大,此后逐渐减小。当电压为100 V时,外泌体浓度达到最大值(19.40±0.190)×108 /mL,此时外泌体能够以相对较高的效率发生定向移动进入琼脂糖凝胶,以获得最佳的捕获效率。随着电压增至120 V,外泌体浓度逐渐降低,这是由于过高的电压可能产生焦耳热使琼脂糖凝胶内部孔径结构改变,这对于外泌体的提取是不利的。因此,100 V的电压被评估为提取外泌体的最佳电压,其余的条件都按照电压为100 V进行优化。琼脂糖凝胶的浓度对外泌体的提取也有重要影响,凝胶浓度决定其内部孔径大小,从而影响外泌体在电场作用下穿过琼脂糖凝胶被纳米孔薄膜所捕获的效率。如图 3B所示,外泌体浓度随着琼脂糖凝胶浓度的增加而逐渐降低。当琼脂糖凝胶浓度为1.0%时,外泌体浓度最大,达到(16.20±0.864)×108/mL,说明浓度为1.0%的琼脂糖凝胶有利于外泌体被纳米孔薄膜捕获。随着琼脂糖凝胶浓度的逐渐增加(1.5%-2.5%),外泌体浓度逐渐降低至(2.97±0.457)×108/mL。这可能是由于琼脂糖凝胶浓度的增加,其内部孔径逐渐变小,大部分外泌体无法穿过凝胶而从出口处流出,使外泌体提取效率降低。所以,我们认为琼脂糖凝胶的最佳浓度为1.0%,此参数也被用于后续的研究。
最后,微量注射泵流速(即血浆进入芯片的流速) 也是影响本芯片提取效率的重要因素之一。流速过高会使血浆中的外泌体直接从入口处流向出口处,使其无法穿过琼脂糖凝胶而被纳米孔薄膜所捕获;流速过低则直接影响血浆中外泌体进入芯片的时间,使整个提取过程耗时过长,影响提取效率。如图 3C所示,我们研究了注射泵流速对本实验的影响,从图 3C可看出外泌体浓度随着流速的增加(0.1-0.4 mL/h) 而逐步降低。当流速为0.1 mL/h时,外泌体浓度达到最大值(18.50±0.521)×108/mL。当流速达到0.3 mL/h或0.4 mL/h时,外泌体浓度变化可忽略不计(外泌体浓度分别为(3.94±0.192)×108/mL、(2.96±0.635)× 108/mL),因此我们认为能够带来最大提取效率的注射泵流速是0.1 mL/h。
综上所述,本研究提供了一种基于凝胶电泳微流芯片提取外泌体的新方法。经实验优化与验证,该芯片可成功从人体血浆中提取出大量浓度适宜、尺寸均匀的外泌体,满足后续下游分析的要求。通过与超速离心法进行对比分析,当血浆样本量小于100 μL时,该芯片提取外泌体的效率约为超速离心法的3.80倍,优势较大。通过调整纳米孔薄膜的孔径大小和琼脂糖凝胶的浓度等实验参数,该芯片有望用于分离分选不同尺寸的外泌体。所以,凝胶电泳微流芯片为外泌体的提取与分离工作提供了一种新思路和新途径,可进一步推动外泌体与肿瘤相关研究的发展,具有重要的基础研究价值和潜在应用价值。
参考文献
| [1] | Phallen J, Sausen M, Adleff V, et al. Direct detection of early-stage cancers using circulating tumor DNA. Sci Transl Med, 2017, 9(403): eaan2415. DOI:10.1126/scitranslmed.aan2415 |
| [2] | Heitzer E, Perakis S, Geigl JB, et al. The potential of liquid biopsies for the early detection of cancer. NPJ Precis Oncol, 2017, 1: 36. DOI:10.1038/s41698-017-0039-5 |
| [3] | 刘艳, 戴鹏, 朱运峰. 外泌体作为肿瘤标志物的研究进展. 中国生物工程杂志, 2019, 39(8): 74-79. Liu Y, Dai P, Zhu YF. Research progress of exosome as tumor marker. China Biotechnol, 2019, 39(8): 74-79 (in Chinese). |
| [4] | Denzer K, Kleijmeer MJ, Heijnen HF, et al. Exosome: from internal vesicle of the multivesicular body to intercellular signaling device. J Cell Sci, 2000, 113(Pt 19): 3365-3374. |
| [5] | Kim J, Tan ZL, Lubman DM. Exosome enrichment of human serum using multiple cycles of centrifugation. Electrophoresis, 2015, 36(17): 2017-2026. DOI:10.1002/elps.201500131 |
| [6] | Kahlert C, Kalluri R. Exosomes in tumor microenvironment influence cancer progression and metastasis. J Mol Med, 2013, 91(4): 431-437. DOI:10.1007/s00109-013-1020-6 |
| [7] | Frydrychowicz M, Kolecka-Bednarczyk A, Madejczyk M, et al. Exosomes-structure, biogenesis and biological role in non-small-cell lung cancer. Scandin J Immunol, 2015, 81(1): 2-10. DOI:10.1111/sji.12247 |
| [8] | Li P, Kaslan M, Lee SH, et al. Progress in exosome isolation techniques. Theranostics, 2017, 7(3): 789-804. DOI:10.7150/thno.18133 |
| [9] | Greening DW, Xu R, Ji H, et al. A protocol for exosome isolation and characterization: evaluation of ultracentrifugation, density-gradient separation, and immunoaffinity capture methods//Posch A, Ed. Methods in Molecular Biology. New York, NY: Humana Press, 2015, 1295: 179-209. |
| [10] | Liu F, Vermesh O, Mani V, et al. The exosome total isolation chip. ACS Nano, 2017, 11(11): 10712-10723. DOI:10.1021/acsnano.7b04878 |
| [11] | 涉及人的生物医学研究伦理审查办法. [2020-10-21]. http://www.nhc.gov.cn/xxgk/pages/viewdocument.jsp?dispatchDate=&staticUrl=/fzs/s3576/201610/84b33b81d8e747eaaf048f68b174f829.shtml&wenhao=第11号委令&utitle=涉及人的生物医学研究伦理审查办法&topictype=&topic=&publishedOrg=法制司&index Num=000013610/2016-00224&manuscriptId=84b33b81d8e747eaaf048f68b174f829. |
| [12] | Marczak S, Richards K, Ramshani Z, et al. Simultaneous isolation and preconcentration of exosomes by ion concentration polarization. Electrophoresis, 2018, 39(15): 2029-2038. DOI:10.1002/elps.201700491 |
| [13] | Pernodet N, Maaloum M, Tinland B. Pore size of agarose gels by atomic force microscopy. Electrophoresis, 2010, 18(1): 55-58. DOI:10.1002/elps.1150180111 |
| [14] | Muller L, Hong CS, Stolz DB, et al. Isolation of biologically-active exosomes from human plasma. J Immunol Methods, 2014, 411: 55-65. DOI:10.1016/j.jim.2014.06.007 |
| [15] | Baranyai T, Herczeg K, Onódi Z, et al. Isolation of exosomes from blood plasma: qualitative and quantitative comparison of ultracentrifugation and size exclusion chromatography methods. PLoS ONE, 2015, 10(12): e145686. DOI:10.1371/journal.pone.0145686 |
| [16] | B?ing AN, Van Der Pol E, Grootemaat AE, et al. Single-step isolation of extracellular vesicles by size-exclusion chromatography. J Extracell Vesicles, 2014, 3(1): 23430. DOI:10.3402/jev.v3.23430 |
| [17] | Peterson MF, Otoc N, Sethi JK, et al. Integrated systems for exosome investigation. Methods, 2015, 87: 31-45. DOI:10.1016/j.ymeth.2015.04.015 |
| [18] | Zarovni N, Corrado A, Guazzi P, et al. Integrated isolation and quantitative analysis of exosome shuttled proteins and nucleic acids using immunocapture approaches. Methods, 2015, 87: 46-58. DOI:10.1016/j.ymeth.2015.05.028 |
| [19] | Oksvold MP, Neurauter A, Pedersen KW. Magnetic bead-based isolation of exosomes//Sioud M, Ed. RNA Interference. New York, NY: Humana Press, 2015, 1218: 465-481. |
