

1. 江南大学 食品科学与技术国家重点实验室,江苏 无锡 214122;
2. 江南大学 食品安全国际合作联合实验室,江苏 无锡 214122
收稿日期:2020-04-22;接收日期:2020-08-02;网络出版时间:2020-08-13
基金项目:国家自然科学基金(Nos. 31922073,31801583),江苏省自然科学基金(No. BK20181343)资助
摘要:菊糖作为益生元和膳食纤维,具有许多重要的生理功能,广泛应用于食品、医药等领域。微生物菊糖蔗糖酶可以以蔗糖为底物合成较植物菊糖具有更高分子量的菊糖。文中通过基因数据库筛选获得一段拟表达菊糖蔗糖酶的基因。通过N-端和C-端截断的方式,保留中间催化域,构建重组质粒。将重组质粒在大肠杆菌表达系统中表达,粗酶液经Ni2+亲和层析纯化,获得分子量约为65 kDa的重组酶。以蔗糖为唯一底物时,重组酶的最适pH和温度分别为5.5和45 ℃。金属离子在不同程度上抑制酶的活性。产物多糖分离纯化后,使用核磁共振鉴定产物多糖为β-(2, 1)糖苷键连接的菊糖。最后对菊糖合成的条件进行优化,结果表明:以700 g/L的蔗糖为底物,加酶量4 U/mL时,7 h后菊糖产量达到最大,约为287 g/L,蔗糖到菊糖的转化率约为41%。
关键词:菊糖蔗糖酶酶学性质菊糖酶法合成
Characterization of inulosucrase and the enzymatic synthesis of inulin
Dawei Ni1, Wei Xu1, Ziwei Chen1, Wenli Zhang1,2, Wanmeng Mu1,2


1. State Key Laboratory of Food Science and Technology, Jiangnan University, Wuxi 214122, Jiangsu, China;
2. International Joint Laboratory on Food Safety, Jiangnan University, Wuxi 214122, Jiangsu, China
Received: April 22, 2020; Accepted: August 2, 2020; Published: August 13, 2020
Supported by: National Natural Science Foundation of China (Nos. 31922073, 31801583), Natural Science Foundation of Jiangsu Province, China (No. BK20181343)
Corresponding author: Wanmeng Mu. Tel/Fax: +86-510-85919161; E-mail: wmmu@jiangnan.edu.cn.
Abstract: As a type of prebiotics and dietary fiber, inulin performs plenty of significant physiological functions and is applied in food and pharmaceutical fields. Inulosucrase from microorganisms can use sucrose as the substrate to synthesize inulin possessing higher molecular weight than that from plants. In this work, a hypothetical gene coding inulosucrase was selected from the GenBank database. The catalytic domain was remained by N- and C- truncation strategies, constructing the recombinant plasmid. The recombinant plasmid was expressed in E. coli expression system, and after purifying the crude enzyme by Ni2+ affinity chromatography, a recombinant enzyme with a molecular weight of approximately 65 kDa was obtained. The optimal pH and temperature of the recombinant enzyme were 5.5 and 45 ℃, respectively, when sucrose was used as the sole substrate. The activity of this enzyme was inhibited by various metal ions at different degrees. After purifying the produced polysaccharide, nuclear magnetic resonance analysis was used to determine that the polysaccharide was inulin connected by β-(2, 1) linkages. Finally, the conditions for the production of inulin were optimized. The results showed that the inulin production reached the maximum, approximately 287 g/L after 7 h, when sucrose concentration and enzyme dosage were 700 g/L and 4 U/mL, respectively. The conversion rate from sucrose to inulin was approximately 41%.
Keywords: inulosucraseenzymatic propertiesinulinenzymatic synthesis
微生物多糖是一类重要的微生物多聚物[1],其中微生物胞外多糖在食品领域中的研究和应用较为广泛。果聚糖和葡聚糖是两种重要的同多糖。按照果糖基之间的糖苷键型分类,果聚糖可分为β-(2, 1)糖苷键连接的菊糖和β-(2, 6)糖苷键连接的levan型果聚糖[2]。菊糖在植物中,尤其是菊科植物中含量丰富。目前,工业化生产和应用的菊糖均来自植物提取,主要原料为菊苣和菊芋等[3]。相反,levan型果聚糖(以下简称levan)在植物中含量极少,因此,levan的生产和应用主要通过微生物酶法合成[4]。
微生物中存在一类以蔗糖为底物,经一步反应合成多糖的酶,统称为“蔗糖类酶”[5]。合成levan的levan型果聚糖蔗糖酶(Levansucrase,LS)和合成菊糖的菊糖蔗糖酶(Inulosucrase,IS)是其中的典型代表,分别可以以蔗糖为唯一底物,合成levan和菊糖。菊糖具有良好的理化性质,如水溶性、增稠性和凝胶性等,常被作为低能量甜味剂、增稠剂、脂肪替代品和质构修饰剂等,应用于食品领域[6-8]。菊糖的β-(2, 1)糖苷键不能被人体的消化酶水解,能到达盲肠,被乳酸菌和双歧杆菌发酵,从而促进肠道有益菌的生长[9]。一直以来,菊糖被视为一种可溶性膳食纤维和益生元,具有许多重要的生理功能,如:促进钙离子吸收、缓解炎症反应、减少肿瘤发生风险和抗氧化等[10]。微生物菊糖与植物菊糖相比,最大的区别在于微生物菊糖的分子量较高,一般可达106–108 g/mol,而植物菊糖一般不超过104 g/mol[11]。
近年来,由于高分子量菊糖的合成能力,IS受到关注。目前,已鉴定的具有IS生产能力的微生物有15种,其中只有7个IS被鉴定出了酶学性质,1个IS被解析出了晶体结构[11]。IS生产的高分子量菊糖比植物菊糖在凝胶性能和稳定性等方面有着较大优势[12]。IS在菊糖纳米材料的制备和应用方面的研究也不断增多[13]。IS和LS同属于糖苷水解酶GH68家族(http://www.cazy.org/GH68.html),亲缘关系密切。二者已报道的酶学性质、结构功能和催化机理等方面具有很多的相似之处,故常被一起研究和讨论[2, 14]。本研究利用NCBI (https://www.ncbi.nlm.nih.gov/)数据库中鹦鹉热乳杆菌Lactobacillus psittaci DSM 15354的假定编码IS的基因序列为基础,通过N-端截断和C-端截断的方式,构建重组质粒。将重组质粒在大肠杆菌Escherichia coli表达系统中异源表达,经分离纯化后,进行酶学性质鉴定及产物结构鉴定。之后对酶法合成菊糖的条件进行优化。该研究为菊糖的酶法合成提供理论基础,对促进高分子量菊糖的研究有一定意义。
1 材料与方法1.1 材料与试剂大肠杆菌Escherichia coli BL21 (DE3)、氨苄青霉素钠(Amp)、异丙基-β-D-硫代半乳糖苷(IPTG)、果糖、葡萄糖、蔗糖、酵母提取物、蛋白胨、琼脂粉等购自生工生物工程(上海)股份有限公司;基因合成及质粒构建委托上海捷瑞生物工程有限公司完成;标准蛋白Marker、染色和脱色相关试剂购自上海雅酶生物科技有限公司;其余试剂均为国产分析纯。
1.2 仪器与设备pH计(FE22,梅特勒-托利多)、高压灭菌锅(GI54DWS,美国Zealway)、紫外检测器(HD-3,上海沪西分析仪器厂有限公司)、超声波细胞破碎仪(SCIENTZ-1200E,宁波新芝生物科技股份有限公司)、Ni2+亲和层析填料(Ni2+ Sepharose 6 Fast Flow,GE Healthcare)、核磁共振波谱仪(AVANCE Ⅲ 400 MHz,德国布鲁克AXS有限公司)、高效液相色谱仪(e2695)、示差折光检测器(2414)、柱温箱(WAT038040)、色谱柱(Sugar- PakTM)为美国沃特世公司(Waters)产品。
1.3 方法1.3.1 重组酶的克隆、表达及纯化通过NCBI数据库检索,发现来源于L. psittaci DSM 15354的一段基因序列,登录号:AZFB01000009.1,标注为LS的编码序列。将其5′-端和3′-端分别截断273 bp和324 bp,保留中间1 701 bp的序列。在目的基因的5′-端和3′-端分别加上限制性酶切位点NdeⅠ和XhoⅠ,并在3′-端加上6个组氨酸标签序列。将重组序列连接到载体pET-22b(+)上,构建重组质粒:Laps- pET-22b(+)。将其转化到E. coli BL21(DE3)中进行蛋白表达。
重组E. coli 在LB液体培养基(5 g/L酵母提取物,10 g/L蛋白胨、10 g/L NaCl)中表达蛋白。LB液体培养基中含有100 μg/mL的Amp,在37 ℃条件下,当培养物OD600达到0.6时,向培养基中加入终浓度为1 mmol/L的IPTG。将培养基置于28 ℃下,诱导重组酶的过量表达。7 h后离心收集菌体。
将由200 mL培养基中收集的菌体,用细胞裂解液(50 mmol/L磷酸盐缓冲液,100 mmol/L NaCl,pH 7.0)充分悬浮。置于冰上,利用超声波细胞破碎机进行破碎(工作1 s、停2 s、总时长20 min、30%功率)。将细胞破碎液于4 ℃、8 000 r/min离心10 min,上清液用0.45 μm的水系膜过滤,收集滤液。利用Ni2+亲和层析柱纯化目的蛋白。首先利用上样缓冲液(50 mmol/L磷酸盐缓冲液,500 mmol/L NaCl,pH 6.5)平衡Ni2+柱,之后将过膜粗酶液泵入柱中,再用上样缓冲液洗脱未结合的蛋白。然后用去杂蛋白缓冲液(50 mmol/L磷酸盐缓冲液,50 mmol/L咪唑,500 mmol/L NaCl,pH 6.5)洗脱弱结合的杂蛋白。最后用洗脱缓冲液(50 mmol/L磷酸盐缓冲液、500 mmol/L咪唑,500 mmol/L NaCl,pH 6.5)收集目的蛋白,收集时间根据紫外检测器的出峰时间而定,整个过程恒流泵的流速控制在3 mL/min。收集的酶液于50 mmol/L的磷酸盐缓冲液(pH 6.5)中透析3次。收集透析后的酶液于4 ℃保存。
十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)测定蛋白分子量,上层胶浓度为4.5%,下层胶浓度为12.5%。染色1 h,脱色至背景透明。使用Bradford法测量纯化后蛋白浓度[15]。使用ExPASy在线服务器预测(https://web.expasy.org/compute_pi/)蛋白理论分子量。
1.3.2 酶活分析1 mL的反应体系中,含300 g/L的蔗糖和50 mmol/L的醋酸盐缓冲液(pH 5.5)。反应体系在45 ℃下预热2 min,加入10 μg重组酶,反应20 min。反应结束后,加入终浓度为100 mmol/L的NaOH,冰浴20 min使酶失活,加入等量HCl中和反应体系。以蔗糖为唯一底物时,定义总酶活、水解酶活和转糖基酶活3种酶活力。其中反应体系中葡萄糖的量代表总酶活;果糖的量代表水解酶活;二者之差代表转糖基酶活。酶活的定义为:以300 g/L蔗糖为唯一底物时,每分钟释放1 μmol的单糖(葡糖糖或果糖)所需要的酶量。
反应体系中糖含量检测使用高效液相色谱(HPLC)和示差折光检测器进行。色谱柱型号为Sugar-PakⅠ(6.5 mm×300 mm)。流动相为超纯水,流速0.4 mL/min,柱温85 ℃。
1.3.3 pH对酶活的影响使用50 mmol/L的3种不同的缓冲液,测定酶活的变化。分别为醋酸盐缓冲液(pH 4.0–6.5)、磷酸盐缓冲液(pH 6.5–7.5)和Tris-HCl缓冲液(pH 7.5–9.0)。反应温度为45 ℃,反应时间为20 min。其余条件如1.3.2所述。
1.3.4 温度对酶活的影响将反应体系置于不同的温度下进行反应,研究温度对酶活的影响。温度设为25–60 ℃,间隔5 ℃。缓冲液为pH 5.5的醋酸缓冲液,反应时间为20 min。其余条件如1.3.2所述。
1.3.5 金属离子对酶活的影响向反应体系中加入终浓度为1 mmol/L的CoCl2、CaCl2、MgSO4、NiSO4、MnSO4、CuSO4、FeSO4、ZnSO4、Fe2(SO4)3、Al2(SO4)3和EDTA,于pH 5.5和45 ℃条件下反应20 min。其余条件如1.3.2所述。未加金属离子的对照组酶活定义为100%。
1.3.6 产物多糖的分离纯化扩大反应体系至100 mL,其中蔗糖浓度700 g/L,加酶量4 U/mL,在pH 5.5和45 ℃条件下反应7 h。反应结束后,利用Sevag法除蛋白。向去除蛋白后的溶液中,加入4倍体积的无水乙醇,4 ℃沉淀,离心取沉淀。用水复溶后重复该步骤,直至HPLC的图谱中显示无蔗糖、葡萄糖和果糖残留。将沉淀冷冻干燥24 h,储存于干燥器中。
1.3.7 核磁共振(NMR)将35 mg冷冻干燥的样品,放进核磁管,加入550 μL的重水(D2O),放在70 ℃水浴锅中溶解。待完全溶解后,进行NMR检测,记录碳谱(NMR-13C)和氢谱(NMR-1H)。
1.3.8 酶法合成菊糖的条件优化为探究底物浓度对菊糖产量的影响,100、200、300、400、500、600、700、800 g/L的蔗糖作为底物,加酶量控制在4 U/mL,于pH 5.5和45 ℃条件下反应20 min。
为探究加酶量对菊糖产量的影响,向700 g/L的蔗糖中分别加入0.2、0.6、1、2、3、4、5 U/mL的重组酶,于pH 5.5和45 ℃条件下反应20 min。
为探究菊糖产量随时间的变化,向700 g/L的蔗糖中加入4 U/mL的重组酶,分别在反应0.33、1、2、3、4、5、6、7、8、9 h后取样检测菊糖含量。
1.3.9 数据分析本研究中,酶学性质部分和菊糖合成条件的优化部分,平行实验3次,数据取平均值,采用Orgin 8.5作图。氨基酸序列比对使用ESPript在线服务器完成(http://espript.ibcp.fr/ESPript/ESPript/)。NMR-13C和NMR-1H的图谱分析,使用MestReNova软件进行。
2 结果与分析2.1 重组酶的构建、表达及纯化NCBI数据库中有一段可利用的DNA序列(GenBank登录号:AZFB01000009.1),其编码的蛋白序列登录号为:KRL62549.1。蛋白全长765个氨基酸,N-端前32个氨基酸为该酶信号肽,C-端有一段细胞壁结合序列LPQTG,它们的存在影响蛋白的表达纯化。信号肽和细胞壁结合序列在IS中是常见的[16]。通过氨基酸序列比对分析(图 1),该蛋白与已知晶体结构的约氏乳杆菌Lactobacillus johnsonii NCC533来源的IS (Lajo-IS)序列一致性达62.9%,因此,推测该蛋白可能是IS。研究表明IS的氨基酸序列可分为3部分,其一:N-端不保守区域;其二:C-端不保守区域;其三:保守催化区域[17-19]。因此,本研究采用同时截断N-端和C-端部分序列的方式,构建重组酶。
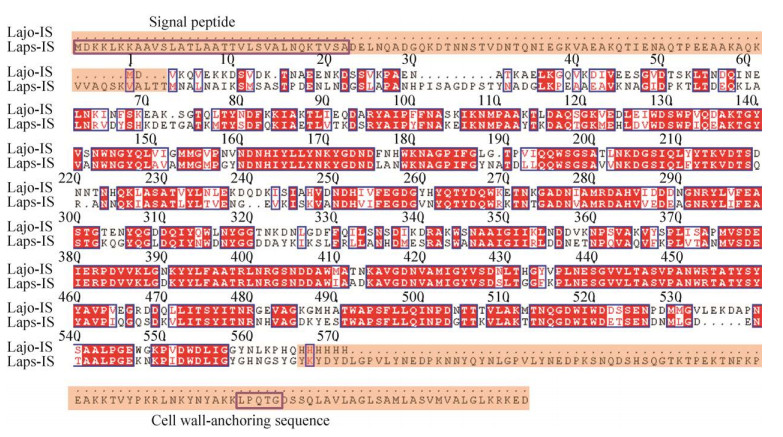 |
| 图 1 Lajo-IS和Laps-IS的氨基酸序列比对(红色部分为保守区域,浅橙色阴影部分为截去的序列) Fig. 1 Multiple sequence alignment of Lajo-IS and Laps-IS. Red parts are conserved regions and the light orange parts are truncated sequences. |
| 图选项 |
通过将已知蛋白序列与Lajo-IS进行氨基酸比对,将野生酶N-端和C-端多余的93个和108个氨基酸截断,相当于在DNA序列5′-端和3′-端分别截去273 bp和324 bp。将保留的中间1 701 bp的3′-端加上6个组氨酸标签后插入到载体pET-22b(+)中。构建的重组质粒经表达、分离、纯化后,进行SDS-PAGE检测。如图 2所示,重组酶的条带单一,分子量在65 kDa左右,与蛋白的理论预测值63.4 kDa相符,表明蛋白成功表达。纯化后无杂蛋白残留,可用于后续酶学性质的鉴定研究。
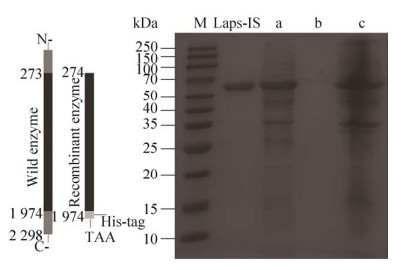 |
| 图 2 重组酶的构建方式及SDS-PAGE分析 Fig. 2 The constructed process of the recombinant enzyme and SDS-PAGE analysis. M: standard protein marker; Laps-IS: the purified recombinant enzyme; a: the supernatant of broken cells; b: the supernatant cultivating the cells for 6 h; c: the broken cell fragments. |
| 图选项 |
2.2 pH和温度对酶活的影响IS催化蔗糖的反应过程分为3步。第1步:在酶的作用下,蔗糖被裂解为葡萄糖和酶-果糖基复合体。第2步:若水分子作为果糖基受体,则发生水解反应,蔗糖被水解为葡萄糖和果糖;若另一分子蔗糖作为果糖基受体,则发生转糖基反应,果糖基通过β-(2, 1)糖苷键连接到蔗糖的果糖基端,产生蔗果三糖。第3步:蔗果三糖再次作为受体,生产蔗果四糖,反应不断进行,最终产生长链菊糖[11]。因此,由反应过程定义了3种酶活:总酶活、水解酶活和转糖基酶活,分别用反应体系中葡萄糖的量、果糖的量和二者之差表示。
pH对酶活的影响如图 3A所示。在弱酸性环境下,酶活处于较高水平,在pH 5.5的醋酸盐缓冲液中总酶活和转糖基酶活达到最大,水解酶活在pH 5.0的醋酸盐缓冲液中最大。碱性环境对酶活的影响大,3种酶活均比较低。因此,重组酶的最适pH为5.5。目前已报到的IS,除芽孢杆菌Bacillus sp. 217C-11来源的以外[20],最适pH均在弱酸性条件下。与格氏乳杆菌Lactobacillus gasseri DSM 20604来源的IS相比[21],Laps-IS的酶活受pH的影响更加显著。
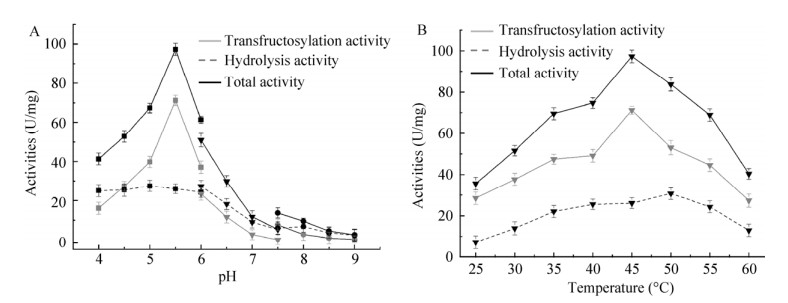 |
| 图 3 pH (A)和温度(B)对Laps-IS酶活的影响 Fig. 3 The effects of pH and temperature on activities of Laps-IS. (A) The effects of pH on total, hydrolysis and transfructosylation activities.□: acetate buffer; ▽: sodium phosphate buffer; ○: Tris-HCl. (B) The effects of temperature on total, hydrolysis and transfructosylation activities. |
| 图选项 |
温度对酶活的影响如图 3B所示。在25–45 ℃,酶活随着温度的升高而增加,且转糖基酶活的增加幅度比水解酶活大。在45 ℃时总酶活和转糖基酶活达到最大,而水解酶活在50 ℃时达到最大。因此,确定45 ℃为重组酶的最适温度。值得注意的是,在25 ℃时,转糖基酶活与水解酶活之比(T/H)为4.0,随着温度的提高,这一比例逐渐降低,45 ℃时T/H为1.7。45–60 ℃,T/H变化不大。这一现象说明,低温条件更有利于发生转糖基反应,高温条件下则促进水解反应发生。黏琼脂芽孢杆菌Bacillus agaradhaerens WDG185来源的IS的最适温度是目前鉴定的同类酶中最高的,为60 ℃[22]。其次是L. johnsonii NCC 533来源的IS,最适温度为55 ℃[16]。
2.3 金属离子对酶活的影响金属离子对酶活的影响如图 4所示。在添加终浓度为1 mmol/L的各种金属离子后,重组酶的酶活均受到不同程度影响。尤其是Cu2+,1 mmol/L Cu2+即可使酶失活。金属离子对转糖基酶活的影响较水解酶活大,使得T/H都减小。因此,可以判定Laps-IS为金属离子抑制型酶。这一结果与目前已报道的不同。例如,Ca2+可以在不同程度上促进罗伊氏乳杆菌Lactobacillus reuteri 121[17]和L. gasseri[18]来源的IS的酶活,Mn2+可以将L. gasseri DSM 20604来源的IS酶活提高57%[21]。B. agaradhaerens WDG185来源的IS酶活不受金属离子的影响,因为该酶没有金属离子结合位点[22]。而通过序列比对可以发现Laje-IS与Lajo-IS一致,存在Ca2+结合残基。导致金属离子不仅不促进Laje-IS酶活,反而抑制其酶活的原因,可能是金属离子结合位点附近的微环境的变化对底物结合口袋产生影响。其分子机制有待进一步研究。
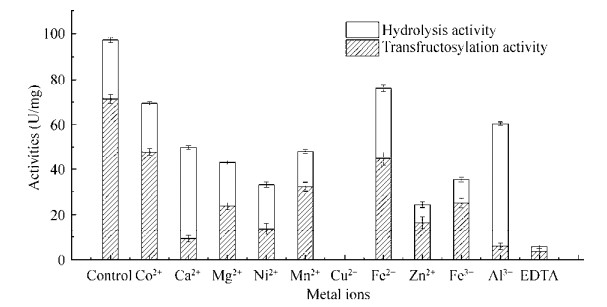 |
| 图 4 金属离子对Laps-IS酶活的影响 Fig. 4 The effect of metal ions on the activities of Laps-IS. |
| 图选项 |
2.4 产物结构鉴定由于IS和LS在反应进程,酶分子结构及催化机理等方面存在很多相似性。甚至Lactobacillus来源的两种酶,在氨基酸序列上都表现出很高的相似性。本课题组曾研究过L. reuteri LTH5448来源的LS,它的氨基酸序列一致性与IS更接近,而产物却是levan型果聚糖[23]。因此,仅从序列上无法判断酶的种类。通过产物果聚糖的糖苷键型,判断产物果聚糖的种类,进而确定酶的种类,是区分IS和LS最直接的方法。酶法合成的果聚糖分子内糖苷键单一,可通过NMR进行鉴定。
NMR结果如图 5所示。5A为NMR-13C图谱,可以看到6个明显的单峰,无杂峰,分别代表果糖基上处于不同化学环境的6个碳原子。化学位移分别为62.39 ppm (C-1)、104.56 ppm (C-2)、78.52 ppm (C-3)、75.83 ppm (C-4)、82.47 ppm (C-5)和62.39 ppm (C-6)。NMR-1H图谱如图 5B,氢原子的化学位移和裂分状态,与levan果聚糖的氢谱不同,与菊糖的氢谱一致。因此,将峰型和相对位置与目前已报道的微生物酶法合成果聚糖的结果进行比对(表 1),可以确定本研究L. psittaci DSM 15354来源重组酶为IS。
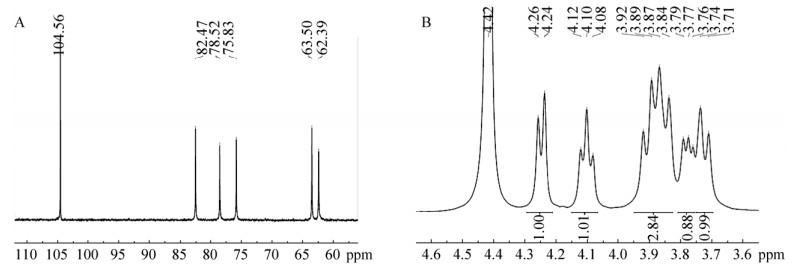 |
| 图 5 Laps-IS产物多糖的NMR图谱(A:NMR-13C图谱;B:NMR-1H图谱) Fig. 5 The NMR spectra of produced polysaccharide. (A) The spectrum of NMR-13C. (B) The spectrum of NMR-1H. |
| 图选项 |
表 1 已报到的酶法合成果聚糖产物的13 C原子化学位移Table 1 13C chemical shifts of reported fructans biosynthesized enzymatically
| Microorganisms | Products | Carbon atom number | |||||
| C-1 | C-2 | C-3 | C-4 | C-5 | C-6 | ||
| L. gasseri DSM20604[21] | Inulin | 62.15 | 104.25 | 78.31 | 75.62 | 82.2 | 63.21 |
| L. johnsonii NCC 533[16] | Inulin | 62.2 | 104.2 | 78.3 | 75.6 | 82.2 | 63.1 |
| L. citreum CW28[24] | Inulin | 61.4 | 103.6 | 77.5 | 74.9 | 81.8 | 62.7 |
| L. psittaci DSM 15354 | Inulin | 62.39 | 104.56 | 78.52 | 75.83 | 82.47 | 62.39 |
| B. goodwinii[25] | Levan | 60.95 | 104.57 | 77.27 | 75.91 | 80.67 | 63.83 |
| L. reuteri LTH5448[23] | Levan | 60.93 | 104.55 | 77.25 | 75.90 | 80.66 | 63.81 |
表选项
2.5 蔗糖浓度的优化研究表明L. reuteri 121来源的IS的总酶活和转糖基酶活的反应动力学参数,不遵循米氏方程底物饱和的典型特征,因为这两种酶活不能被蔗糖饱和[26]。因此,蔗糖浓度可能对菊糖的产量产生重要影响。如图 6所示,为酶活和菊糖产量随蔗糖浓度的变化。可以看出,在蔗糖浓度从100 g/L增加到700 g/L时,转糖基酶活不断增加,使得总酶活也不断增加。这说明了Laps-IS总酶活和转糖基酶活的底物不饱和现象。相反,水解酶活在不同的蔗糖浓度下,变化不大,说明水解酶活被底物饱和。高的蔗糖浓度有利于促进转糖基反应的发生,这一现象在一些研究中也有报道[27-29]。当蔗糖浓度从700 g/L增加到800 g/L时,菊糖产量降低了13.5%。这可能是由于生成的菊糖部分水解造成的。因此,将蔗糖浓度定为700 g/L,进行加酶量的影响研究。
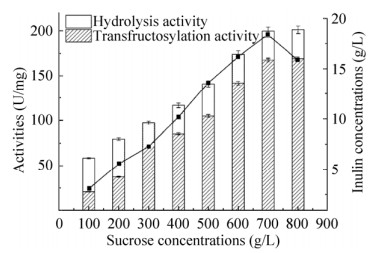 |
| 图 6 蔗糖浓度对Laps-IS酶活和菊糖产量的影响 Fig. 6 The effect of sucrose concentration on activities and inulin production. |
| 图选项 |
2.6 加酶量浓度的优化加酶量是影响菊糖产量的另一个重要因素。在700 g/L的蔗糖中,分别加入不同量的蔗糖,结果如图 7所示。随着加酶量的增加,转糖基酶活和总酶活都总体呈现下降趋势,这是由二者底物不饱和造成的。菊糖的产量随着加酶量的增加而提高,当加酶量增加到4 U/mL时达到最大。之后再提高加酶量,菊糖产量略微降低。同样的现象在LS中也被观察到。Brenneria goodwinii来源的LS,当每克蔗糖加入6 U的酶时,levan产量最大,之后略有降低[25]。因此,在确定蔗糖浓度等的条件下,Laps-IS产菊糖的最适加酶量为4 U/mL。
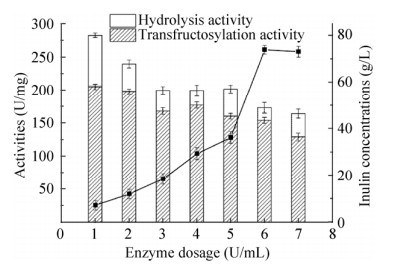 |
| 图 7 加酶量对Laps-IS酶活和菊糖产量的影响 Fig. 7 The effect of enzyme dosage on activities and inulin production. |
| 图选项 |
2.7 菊糖生产的反应进程以700 g/L的蔗糖为底物,加酶量4 U/mL,在pH 5.5和45 ℃条件下进行反应。反应体系中菊糖的浓度随时间的变化如图 8所示。随着反应的进行,蔗糖不断被转化为菊糖,7 h时产量达到最大,约为287 g/L,蔗糖到菊糖的转化率为41%。B. goodwinii来源的LS在优化条件下,levan型果聚糖的产量为185 g/L[25]。L. gasseri DSM 20604来源的IS在优化条件下,菊糖的产量为53 g/L[21]。本研究所得到的重组酶Laps-IS是目前报道的菊糖产量和蔗糖到菊糖转化率最高的IS。这可能与Laps-IS高的转糖基能力有关。通过利用IS的转糖基能力,可以以蔗糖为供体、某些其他糖类为受体,进行受体反应,生产新型低聚糖[30-31]。因此,Laps-IS进行受体反应的转糖基能力,值得进一步研究。
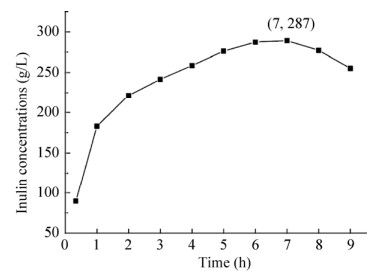 |
| 图 8 Laps-IS菊糖产量的反应进程 Fig. 8 Reaction process of inulin production. |
| 图选项 |
3 结论本研究通过基因数据库筛选获得来源于L. psittaci DSM 15354的基因片段。通过截断的方式构建重组质粒。经重组表达、分离纯化,获得分子量为65 kDa的纯酶。通过对酶学性质进行鉴定,获得以蔗糖为唯一底物时的最适反应条件。产物鉴定表明产物多糖为菊糖,进而判定该重组酶为菊糖生产酶IS。最后,对菊糖生产条件进行优化,使菊糖的最大产量为287 g/L。目前国内对IS的研究较少,本研究鉴定的IS具有高的转糖基能力,蔗糖到菊糖的转化率高,有工业应用的前景。此外,本研究有利于促进对该类酶的认识,为IS和微生物菊糖的进一步研究提供基础。
参考文献
| [1] | Moradali MF, Rehm BH. Bacterial biopolymers: from pathogenesis to advanced materials. Nat Rev Microbiol, 2020, 18(4): 195-210. DOI:10.1038/s41579-019-0313-3 |
| [2] | Xu W, Ni DW, Zhang WL, et al. Recent advances in levansucrase and inulosucrase: evolution, characteristics, and application. Crit Rev Food Sci Nutr, 2019, 59(22): 3630-3647. DOI:10.1080/10408398.2018.1506421 |
| [3] | Ahmed W, Rashid S. Functional and therapeutic potential of inulin: A comprehensive review. Crit Rev Food Sci Nutr, 2019, 59(1): 1-13. DOI:10.1080/10408398.2017.1355775 |
| [4] | ?ner ET, Hernández L, Combie J. Review of levan polysaccharide: from a century of past experiences to future prospects. Biotechnol Adv, 2016, 34(5): 827-844. DOI:10.1016/j.biotechadv.2016.05.002 |
| [5] | Shoda SI, Uyama H, Kadokawa JI, et al. Enzymes as green catalysts for precision macromolecular synthesis. Chem Rev, 2016, 116(4): 2307-2413. DOI:10.1021/acs.chemrev.5b00472 |
| [6] | Shoaib M, Shehzad A, Omar M, et al. Inulin: properties, health benefits and food applications. Carbohydr Polym, 2016, 147: 444-454. DOI:10.1016/j.carbpol.2016.04.020 |
| [7] | Karimi R, Azizi MH, Ghasemlou M, et al. Application of inulin in cheese as prebiotic, fat replacer and texturizer: A review. Carbohydr Polym, 2015, 119: 85-100. DOI:10.1016/j.carbpol.2014.11.029 |
| [8] | Meyer D, Bayarri S, Tárrega A, et al. Inulin as texture modifier in dairy products. Food Hydrocolloids, 2011, 25(8): 1881-1890. DOI:10.1016/j.foodhyd.2011.04.012 |
| [9] | Vogt L, Meyer D, Pullens G, et al. Immunological properties of inulin-type fructans. Crit Rev Food Sci Nutr, 2015, 55(3): 414-436. DOI:10.1080/10408398.2012.656772 |
| [10] | Gupta N, Jangid AK, Pooja D, et al. Inulin: a novel and stretchy polysaccharide tool for biomedical and nutritional applications. Int J Biol Macromol, 2019, 132: 852-863. DOI:10.1016/j.ijbiomac.2019.03.188 |
| [11] | Ni DW, Xu W, Zhu YY, et al. Inulin and its enzymatic production by inulosucrase: Characteristics, structural features, molecular modifications and applications. Biotechnol Adv, 2019, 37(2): 306-318. DOI:10.1016/j.biotechadv.2019.01.002 |
| [12] | Ni DW, Zhu YY, Xu W, et al. Production and physicochemical properties of food-grade high-molecular-weight Lactobacillus inulin. J Agric Food Chem, 2020, 68(21): 5854-5862. DOI:10.1021/acs.jafc.9b07894 |
| [13] | Ni DW, Xu W, Zhang WL, et al. Research progress on microbial inulosucrase and its applications in food. Food Sci. (2020-05-14). http://kns.cnki.net/kcms/detail/11.2206.TS.20200514.0938.014.html (in Chinese). 倪大伟, 徐炜, 张文立, 等.微生物菊糖蔗糖酶及在食品中的应用研究进展.食品科学, (2020-05-14). http://kns.cnki.net/kcms/detail/11.2206.TS.20200514.0938.014.html. |
| [14] | Anwar MA, Leemhuis H, Pijning T, et al. The role of conserved inulosucrase residues in the reaction and product specificity of Lactobacillus reuteri inulosucrase. FEBS J, 2012, 279(19): 3612-3621. DOI:10.1111/j.1742-4658.2012.08721.x |
| [15] | Bradford MM. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem, 1976, 72(1/2): 248-254. |
| [16] | Anwar MA, Kralj S, Van Der Maarel MJEC, et al. The probiotic Lactobacillus johnsonii NCC 533 produces high-molecular-mass inulin from sucrose by using an inulosucrase enzyme. Appl Environ Microbiol, 2008, 74(11): 3426-3433. DOI:10.1128/AEM.00377-08 |
| [17] | Van Hijum SAFT, Van Geel-Schutten GH, Rahaoui H, et al. Characterization of a novel fructosyltransferase from Lactobacillus reuteri that synthesizes high-molecular-weight inulin and inulin oligosaccharides. Appl Environ Microbiol, 2002, 68(9): 4390-4398. DOI:10.1128/AEM.68.9.4390-4398.2002 |
| [18] | Anwar MA, Kralj S, Piqué AV, et al. Inulin and levan synthesis by probiotic Lactobacillus gasseri strains: characterization of three novel fructansucrase enzymes and their fructan products. Microbiology, 2010, 156(4): 1264-1274. DOI:10.1099/mic.0.036616-0 |
| [19] | Del Moral S, Olvera C, Rodriguez ME, et al. Functional role of the additional domains in inulosucrase (IslA) from Leuconostoc citreum CW28. BMC Biochem, 2008, 9: 6. DOI:10.1186/1471-2091-9-6 |
| [20] | Wada T, Ohguchi M, Iwai Y. A novel enzyme of Bacillus sp. 217C-11 that produces inulin from sucrose. Biosci Biotechnol Biochem, 2003, 67(6): 1327-1334. DOI:10.1271/bbb.67.1327 |
| [21] | Ni DW, Zhu YY, Xu W, et al. Biosynthesis of inulin from sucrose using inulosucrase from Lactobacillus gasseri DSM 20604. Int J Biol Macromol, 2018, 109: 1209-1218. DOI:10.1016/j.ijbiomac.2017.11.120 |
| [22] | Kralj S, Leeflang C, Sierra EI, et al. Synthesis of fructooligosaccharides (FosA) and inulin (InuO) by GH68 fructosyltransferases from Bacillus agaradhaerens strain WDG185. Carbohydr Polymers, 2018, 179: 350-359. DOI:10.1016/j.carbpol.2017.09.069 |
| [23] | Ni DW, Xu W, Bai YX, et al. Biosynthesis of levan from sucrose using a thermostable levansucrase from Lactobacillus reuteri LTH5448. Int J Biol Macromol, 2018, 113: 29-37. DOI:10.1016/j.ijbiomac.2018.01.187 |
| [24] | Olivares-Illana V, Wacher-Rodarte C, Le Borgne S, et al. Characterization of a cell-associated inulosucrase from a novel source: A Leuconostoc citreum strain isolated from Pozol, a fermented corn beverage of Mayan origin. J Ind Microbiol Biotechnol, 2002, 28(2): 112-117. DOI:10.1038/sj/jim/7000224 |
| [25] | Liu Q, Yu SH, Zhang T, et al. Efficient biosynthesis of levan from sucrose by a novel levansucrase from Brenneria goodwinii. Carbohydr Polymers, 2017, 157: 1732-1740. DOI:10.1016/j.carbpol.2016.11.057 |
| [26] | Van Hijum SAFT, Van Der Maarel MJEC, Dijkhuizen L. Kinetic properties of an inulosucrase from Lactobacillus reuteri 121. FEBS Lett, 2003, 534(1/3): 207-210. |
| [27] | Pe?a-Carde?a A, Rodríguez-Alegría ME, Olvera C, et al. Synthesis of fructooligosaccharides by IslA4, a truncated inulosucrase from Leuconostoc citreum. BMC Biotechnol, 2015, 15: 2. DOI:10.1186/s12896-015-0116-1 |
| [28] | Ozimek LK, Kralj S, Kaper T, et al. Single amino acid residue changes in subsite -1 of inulosucrase from Lactobacillus reuteri 121 strongly influence the size of products synthesized. FEBS J, 2006, 273(17): 4104-4113. DOI:10.1111/j.1742-4658.2006.05411.x |
| [29] | González-Garcinu?o á, Tabernero A, Sánchez-álvarez JM, et al. Effect of bacteria type and sucrose concentration on levan yield and its molecular weight. Microb Cell Factor, 2017, 16: 91. DOI:10.1186/s12934-017-0703-z |
| [30] | Díez-Municio M, Herrero M, De Las Rivas B, et al. Synthesis and structural characterization of raffinosyl-oligofructosides upon transfructosylation by Lactobacillus gasseri DSM 20604 inulosucrase. Appl Microbiol Biotechnol, 2016, 100(14): 6251-6263. DOI:10.1007/s00253-016-7405-z |
| [31] | Díez-Municio M, De Las Rivas B, Jimeno ML, et al. Enzymatic synthesis and characterization of fructooligosaccharides and novel maltosylfructosides by inulosucrase from Lactobacillus gasseri DSM 20604. Appl Environ Microbiol, 2013, 79(13): 4129-4140. DOI:10.1128/AEM.00854-13 |
