
 , 刘洪涛1
, 刘洪涛1

1. 湖北中医药大学 基础医学院,湖北 武汉 430065;
2. 湖北中医药大学 药学院,湖北 武汉 430065
收稿日期:2020-04-09;接收日期:2020-08-02;网络出版时间:2020-10-13
基金项目:国家自然科学基金(No. 81903946),国家重点研发计划应急专项(No. 2020YFC0845800),湖北省教育厅中青年项目(No. Q20192004)资助
摘要:胆汁酸不仅促进脂质吸收,还可调节肠道菌群结构,影响多种疾病的发生。胆汁酸代谢过程涉及肝脏、肠道、血液等重要组织。胆汁酸组成复杂、同分异构体多、生物活性相差巨大,这给胆汁酸检测分析技术带来较大挑战,同时也限制了胆汁酸与多种疾病的关系研究,因此,对多种不同胆汁酸进行特异性检测可为生物研究、临床诊断、疾病预防提供有利条件。基于不同检测方法分析多种来源胆汁酸样品已获得较大进展,现有技术包括分光光度法、薄层色谱、色谱法、色谱质谱联用分析,但均存在较大限制。文中介绍了胆汁酸传统检测技术的研究情况,突出生物传感器的研究进展,并对其在胆汁酸检测方面的发展进行了展望。
关键词:胆汁酸特异性检测生物传感器疾病诊断
Bile acid detection by biosensors—a review
Enpeng Dong1,2, Junping Zheng1

 , Hongtao Liu1
, Hongtao Liu1

1. School of Basic Medicine, Hubei University of Chinese Medicine, Wuhan 430065, Hubei, China;
2. School of Pharmacy, Hubei University of Chinese Medicine, Wuhan 430065, Hubei, China
Received: April 9, 2020; Accepted: August 2, 2020; Published: October 13, 2020
Supported by: National Natural Science Foundation of China (No. 81903946), Emergency Special Project of National Key Research and Development Program of China (No. 2020YFC0845800), Hubei Provincial Department of Education (No. Q20192004)
Corresponding author: Junping Zheng. E-mail: junpingzheng2013@163.com;
Hongtao Liu. Tel/Fax: +86-27-68891387; E-mail: hongtaoliu@hbtcm.edu.cn.
Abstract: Bile acids facilitate the absorption of lipids, and affect the development of various diseases by regulating intestinal flora structure and modulating immunity and metabolism. It is therefore important to quantitatively detect bile acids. Current analytical methods are still immature due to constituent complexity, structural heterogeneity and bioactive variability of bile acids. Detection of individual bile acids is of significance for pharmacological research, clinical diagnosis and disease prevention. Advances have been made in bile acid analysis from multiple sources including serum, bile, urine and feces, although several limitations still exist for bile acid quantification. Here we review research progress in conventional bile acid assays, including spectrophotometry, thin-layer chromatography, liquid/gas chromatography and liquid/gas chromatography-mass spectrometry. Moreover, we emphasize the development of bile acid biosensors that may have promising prospects.
Keywords: bile acidsspecific sensingbiosensordisease diagnosis
胆汁酸是胆固醇代谢终产物,亦是胆汁的重要组分,可促进动物肠道中胆固醇、脂质和维生素的吸收,胆汁酸代谢紊乱可引起多种疾病[1-3]。胆汁酸在肝胆丰度最高但基质复杂,而在血液、粪便、尿液中含量很少。人体内各种胆汁酸化学结构相似、同分异构体多、且不同胆汁酸生理活性迥异。因此,对体内每种胆汁酸进行定性定量检测意义重大但也颇具挑战[4]。目前胆汁酸检测方法主要包括分光光度法、薄层色谱法、高效液相法、气相色谱法、色谱质谱联用等[5]。上述方法均不同程度存在分析成本高、操作繁琐、样品前处理复杂等问题,难以实现日常化检测。生物传感器具有结构简单、操作简便、检测灵敏性高、检测限低、样品用量少等优点,特别适用于样品量少、日常化需求、检测目标明确的样品,是极具潜力的实用检测技术[6-7]。
1 胆汁酸代谢及其作用1.1 胆汁酸的合成与循环胆汁酸(Bile acid,BA)是由肝脏合成,储存于胆囊,在摄食时经胆道释放到小肠,促进脂质和脂溶性维生素的吸收。胆汁酸组分复杂,分为游离型胆汁酸以及结合型胆汁酸两大类。在人体中,胆汁酸主要包括胆酸(Cholic acid,CA)、鹅去氧胆酸(Chenodeoxycholic acid,CDCA)、脱氧胆酸(Deoxycholic acid,DCA)、熊去氧胆酸(Ursodeoxycholic acid,UDCA)和石胆酸(Lithocholic acid,LCA)等,它们以游离或与甘氨酸/牛磺酸结合的形式存在。肝脏内的胆固醇在多种酶的作用下,经过还原、羟化、侧链修饰和加辅酶A等反应转化为初级胆汁酸,即CA和CDCA。在肝细胞内,绝大部分初级胆汁酸与甘氨酸或牛磺酸结合形成结合型胆汁酸,贮存于胆囊中。部分初级结合型胆汁酸在肠道发生脱蛋白反应,形成非结合型初级胆汁酸,在肠道微生物的作用下转化为次级胆汁酸,如DCA和LCA等[8-9]。进入肠道的胆汁酸,大部分胆汁酸在回肠末端以主动转运的方式被重吸收,少部分胆汁酸则以被动扩散的形式在大肠各部位被吸收,仅有5%左右随粪便排出(以LCA为主)。重吸收的胆汁酸通过门静脉重新入肝,游离胆汁酸在肝脏再衍生形成结合胆汁酸,与重吸收的和新合成的结合胆汁酸一起汇入胆汁,随胆汁再次排入肠道,完成胆汁酸的肝肠循环[10]。其合成及代谢过程如图 1所示。
 |
| 图 1 胆汁酸体内代谢[11] Fig. 1 In vivo metabolism of bile acids[11]. |
| 图选项 |
1.2 胆汁酸的生物活性胆汁酸不仅影响饮食中脂质物质吸收,亦可调控肠道菌群组成,还能作为信号分子激活特异性受体。胆汁酸激活受体后可进一步改变胆汁酸组成,对维持机体脂质代谢、葡萄糖代谢等能量代谢起着至关重要的作用[12]。不同的胆汁酸在调节肠道菌群、激活信号受体等生物活性方面相距甚远。大部分胆汁酸具有抑制细菌增长作用,因小肠中胆汁酸浓度高,故小肠细菌密度仅为大肠的百分之一。不同胆汁酸的抑菌活性并不相同,虽CA和DCA均可破坏细胞膜抑制细菌增长,但DCA抑菌效率是CA的10倍以上[13]。研究发现,肠道内胆汁酸组成变化可导致肠道细菌改变,CDCA与肠杆菌科Enterobacteriaceae呈正相关,而DCA与瘤胃菌科Ruminococcaceae呈正相关[14]。胆汁酸可调节G蛋白偶联胆汁酸受体(Takeda G protein receptor 5,TGR5)和法尼酯X受体(Farnesoid X receptor,FXR)通路影响糖脂代谢,但不同胆汁酸对受体的结合能力不尽相同,其激活TGR5的优先顺序是LCA > DCA > CDCA > CA,激活FXR能力按CDCA > DCA > CA > LCA依次递减[15]。Wang等[16]发现牛磺熊去氧胆酸(Tauroursodeoxycholic acid,TUDCA)抑制高脂饮食小鼠肠道炎症和脂肪转运,减轻改善非酒精性脂肪肝症状。除影响肥胖、糖尿病、非酒精性脂肪肝病等糖脂代谢紊乱疾病外[17],胆汁酸代谢紊乱还与炎性肠病[18]、心血管疾病[19]、病毒性感染[20]等密切相关。上述证据表明,胆汁酸代谢紊乱会导致胆汁酸浓度以及信号通路的异常从而引起多种疾病。而不同胆汁酸的生物活性不尽相同,因此对每种胆汁酸进行特异性检测,可为阐释其具体作用机制提供良好的基础。
2 胆汁酸现有检测技术人体内各种游离型以及结合型胆汁酸化学结构相似、同分异构体较多、极性相差不大(图 2)。
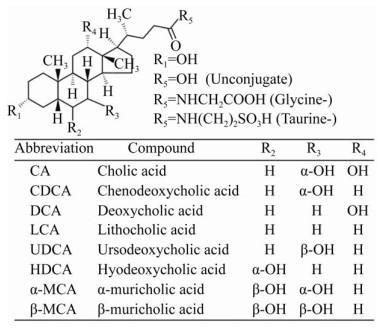 |
| 图 2 胆汁酸分子结构[21] Fig. 2 Molecular structure of bile acids[21]. |
| 图选项 |
大部分胆汁酸均处在肝肠循环状态,血清及粪便中胆汁酸含量较少,因此对血清或粪便中胆汁酸的定量检测相对困难[4]。现有胆汁酸检测方法包括分光光度法、薄层色谱法、高效液相法、色谱质谱技术联用等[5, 21]。
2.1 分光光度法胆汁酸属于甾体类化合物,不存在共轭结构和发色基团,本身在紫外-可见分光区无明显特征吸收,不能直接进行分光光度计检测,需借助显色反应进行分析。对于牛黄中胆酸的含量测定,目前行业标准主要采用糠醛比色法检测,糠醛比色法采用糠醛溶液作显色剂,在硫酸溶液作用下,糠醛与胆汁酸分子中羟基缩合形成共价化合物,形成颜色物质,可比色检测胆汁酸含量。但该方法在实际操作中实验条件较难控制,干扰因素较多,对反应温度、时间、显色剂用量等因素敏感,结果不准确[22]。样品胆汁酸与硫酸溶液发生脱水反应后形成共轭双键而产生紫外特征吸收峰,使得紫外分光光度法可用于胆汁酸测定,由于仅需加入硫酸,其方法简便性和灵敏性均高于糠醛比色法。基于此原理,Liu[23]用60%冰醋酸提取样品,然后在70 ℃硫酸溶液中加热20 min,在385 nm波长处测紫外吸收,发现该方法线性范围为20–160 μg/mL (R2=0.999 9),平均回收率为98.97%,标准平均偏差(Relative standard deviation,RSD)为0.24%。Yan等[24]以胆酸和熊去氧胆酸为对照品,加入49%硫酸为显色剂,在75 ℃水浴加热18 min反应显色,于388 nm波长处测定熊、猪、牛、鸡等动物胆粉中总胆酸的含量,在5.7–34.3 μg/mL范围内有良好的线性关系。
Ikeda等[25]将样品盐酸酸化和乙酸乙酯萃取等前处理,然后再加入乙酸酐、吡啶和磷酸混合,所得产物在429或456 nm有较强吸收,可用于甘氨酸共轭胆汁酸的定量检测,且游离胆汁酸或牛磺共轭胆汁酸不发生颜色反应。酚酞-β环糊精包涵体复合物结构本呈无色,但DCA和UDCA竞争性结合β-环糊精后,酚酞处于游离状态,显出pH对应颜色,可对DCA和UDCA进行定量分析, 检出限分别为15.5 μg/mL和16.0 μg/mL[26]。Kafrawy等[27]利用2-硝基苯肼衍生法可实现药物制剂中的UDCA的定量检测,碳二亚胺和吡啶条件下UDCA与2-硝基苯肼盐酸盐反应生成酰肼衍生物,该产物在水溶液中呈紫罗兰色,可在553 nm处有最大吸收峰,检出限低至3.37 μg/mL。利用酶法偶联显色反应已有报道,Rani等[28]偶联硫辛酰胺脱氢酶和3α-羟基类固醇脱氢酶(3α-hydroxysteroid dehydrogenase,3α-HSD)反应,利用NAD+作为电子受体,将胆汁酸脱氢过程的电子传递给NAD+,再利用硝基蓝四唑对还原性NADH的显色反应最终定量胆汁酸含量,该方法可达到19.63 μg/mL以下的检出限,检测准确率90%以上。通过外加显色反应,使得无颜色的胆汁酸呈现紫外-可见光波段的特征吸收峰,具有较好可行性,操作相对简单、对大型设备的依赖程度小,但该方法只能检测总胆汁酸或某一类胆汁酸,且检出限不低,很难实现某种胆汁酸的精准定量分析,仅适用于初步定性或简单定量分析。
2.2 薄层色谱法薄层色谱法(Thin-layer chromatography,TLC)是一种可靠、简单、省时、专属性较强的胆汁酸检测方法。Kindel等[29]开发了基于薄层色谱-直接扫描荧光测定法针对人粪便游离胆汁酸的定量分析方法,经分离、纯化、萃取等步骤获取纯度较高的胆汁酸溶液,再经薄层色谱展开,然后经二氯荧光素染色后进行荧光光谱定量分析,该方法可检测粪便中5种胆汁酸含量,回收率为91%–106%。Ye等[30]以铝基薄层板为展板,用单波长扫描法测定了人工牛黄中的主要胆汁酸类成分中胆酸及猪去氧胆酸的含量,该方法以环己烷-乙醚-冰醋酸(2:1:1)为展开剂,以10%磷钼酸乙醇溶液为显色剂,平均回收率分别为101.3% (RSD=2.6%)和101.6% (RSD=2.5%)。Dolowy等[31]比较硅胶、硫酸盐硅藻土-硅胶等薄层材料,选择不同配比的正己烷-乙酸乙酯-乙酸混合液作为展开剂,确定最优条件,实现5种胆汁酸(CA、DCA、CDCA、LCA、UDCA)的分离分析,其检出限可达到每个分离斑点0.119–2.085 μg水平。薄层色谱技术检测胆汁酸需较为复杂的样品前处理,该法对薄层色谱实验条件要求较高,受薄层板、展开剂、展开环境、显色等因素影响较大,且较高浓度样品可导致不同胆汁酸的分离效果变差。
2.3 高效液相色谱法高效液相色谱法(High-performance liquid chromatography,HPLC)具有灵敏度高、分析时间短、实验过程相对简单等特点,适于分析高沸点、不易挥发、分子量大、不同极性的有机化合物。该方法普遍用于胆汁酸的分析检测过程,Deng等[32]就不同的液相条件及分析效能进行了部分总结。Sardella等[33]将胆汁酸进行酰化处理,然后利用HPLC分析了12种胆汁酸的含量,包含多种异构体,该方法检测的检出限为1–27 ng/mL,线性范围10–320 μg/mL之间。Kakiyama等[34]开发了一种简便、准确的测定粪便胆汁酸的高效液相色谱法,以甲醇(82%)作为流动相,在254 nm处检测胆汁酸(CA、CDCA、DCA、LCA、UDCA)线性关系良好(R2 > 0.999 6),且可用于肝硬化患者粪便胆汁酸的测定。Zhao等[35]使用高效液相色谱技术,利用固相萃取技术纯化样品,鉴定了人体血液和胆囊中8种共轭胆汁酸,线性范围为3.91–500 μg/mL (R2 > 0.995)。液相色谱技术定量检测胆汁酸局限于标准品及色谱柱寿命、检测条件等情况。一般情况下,该检测方法必须配套使用繁琐的前处理操作,同时仪器操作难度较大、仪器昂贵、分析成本也较高。
2.4 液相色谱-质谱联用液相色谱-质谱联用(High-performance liquid chromatography with mass spectrometry,HPLC-MS)将液相色谱的高分离效能与质谱的强大结构测定功能组合起来,实现了对复杂混合物更准确的定量和定性分析,简化了样品的前处理过程。Qu等[36]利用高效液相色谱法串联质谱法(High-performance liquid chromatography-tandem mass spectrometry,HPLC-MS/MS)测得人体内的15种胆汁酸,用Symmetry C18色谱柱分离,采用电喷雾离子源负离子模式检测,耗时50 min,12种胆汁酸线性范围为0.001–3 μg/mL,浓度与峰面积呈良好的线性关系(R2 > 0.985)。Liu等[37]利用HPLC-MS/MS测得大鼠体内26种胆汁酸,采用Xterra RP18 (4.6 mm×150 mm,5 μm)色谱柱,以乙腈-10 mmol/L醋酸铵溶液为流动相进行梯度洗脱,采用电喷雾离子源-三重四极杆质谱仪于负离子模式下进行多反应监测。结果显示26种胆汁酸线性关系良好且色谱峰互不干扰,定量下限为4–80 ng/mL,RSD为2.0%–13.3%,满足正常生理浓度检测需求(7.8–1 156.6 ng/mL)。Ulaszewska等[38]利用HPLC-MS/MS建立了测定生物体液中8个胆汁酸异构体的方法。该方法灵敏度高,检出限为0.081–12.26?ng/mL,定量限为0.286–44.95?ng/mL,线性度好(R2 > 0.99),RSD≤16%。Fu等[39]建立了测定血清中21种初级和次级胆汁酸的胆汁酸分析方法,并通过LC-MS/MS进行了验证。结果该方法在一定范围内,对所有被测物均表现出良好的线性和高回归系数(R2 > 0.99)。本研究团队通过HPLC-MS/MS分析小鼠喂食高脂饮食后胆汁和粪便胆汁酸变化,实现10种胆汁酸同时检测,检出限低至0.5 ng/mL (数据未发表)。液相色谱与质谱联用技术准确度高、检出限更低,但该检测方法的前处理方法仍然复杂、操作难度较大、仪器更加昂贵、分析成本高。
2.5 气相色谱-质谱联用气相色谱-质谱联用(Gas chromatography- mass spectrometry,GC-MS)可以对胆汁酸进行准确定量以及最大限度去除其他组分干扰。Keller等[40]介绍了一种利用GC-MS方法定量测定人粪便中胆汁酸,气化程序为:150 ℃保持5 min,以40 ℃/min升至240 ℃,再以1 ℃/min加热至280 ℃,恒定10 min,采用单离子监测模式,实现了对粪便样品中选择性、特异性、高灵敏度的胆汁酸测定。Tadano等[41]使用GC-MS同时分析血清和粪便胆汁酸,用于分析健康人及结肠癌患者的胆汁酸的动力学规律。Bhowmik等[42]利用气-质联用技术可同时测定尿中氧甾醇和胆汁酸。GC-MS需要进行繁琐的胆汁酸样品衍生化处理,样品损失量大且检测过程耗时长,成本相对较高,不利于小体积样品的检测。
3 生物传感器对于胆汁酸检测的应用现状3.1 生物传感器检测原理生物传感器是利用生物特异结合分子作为识别元件(酶、微生物、适体等),再进行适当放大,将生物信号转化为电信号从而进行定性定量的检测技术。其原理为待测物质扩散进入固定化生物敏感膜层,经分子识别,待测样品信息继而被换能器转变成可定量处理的电信号,经过放大并输出,即可知待测物的浓度。该方法具有多样性、操作快速简便、易于联机、重复使用、灵敏度高、成本低、对待检测物特异性高等特点,在食品工业、环境监测、发酵工业、生物学等领域有着广泛的应用前景[43-45]。根据分子识别元件可分为酶传感器、免疫传感器、组织传感器、细胞传感器、微生物传感器、核酸传感器等,而根据生物传感器信号转化元件的不同,则可以分为电化学生物传感器、半导体生物传感器、光学生物传感器、热敏生物传感器等[43]。
 |
| 图 3 生物传感器结构框图[43] Fig. 3 Structure of biosensor fabrication[43]. |
| 图选项 |
3.2 胆汁酸生物传感器研究现状近些年胆汁酸检测领域迅速发展,在临床样品中进行总胆汁酸的现场检测有很大的应用前景。Koide等[46]利用戊二醛将胆酸硫酸酯酶(Bile acid sulfate sulfatase,BSS)、β-羟基类固醇脱氢酶(β-hydroxysteroid dehydrogenase,β-HSD)、NADH氧化酶3种酶固定于包覆Nafion薄膜微平板电极上,可检测尿中磺化胆汁酸的含量。该传感器制备简单、灵敏度高、稳定性好、重现性好且检测快速,磺酸化胆汁酸浓度与其电流响应值在0.82–40.86 μg/mL范围内呈线性相关。该生物传感器的表面包覆了Nafion薄膜,因此受尿中其他干扰物影响小。Li等[47]在此基础上提出了一种固定化酶促荧光毛细管生物传感器测定硫酸化胆汁酸(Sulfated bile acids,SBAs)。该生物传感器方案与Koide的基本相同,在BSS、β-HSD作用下,SBAs脱硫生成3-羟基胆汁酸,3-羟基胆汁酸与NAD+反应,生成3-酮甾体。与此同时,NAD+被转化为NADH,NADH与1-甲氧基-5-甲基酚嗪硫酸甲酯盐(1-methoxy-5-methylphenazinium methyl sulfate,1-MPMS)反应转化为NAD+和1-MPMSH2。最后1-MPMSH2将刃天青还原为试卤灵,所得试卤灵的荧光强度与硫酸化胆汁酸成正比,相对标准偏差小于3.4%,检出限为64 ng/mL,回收率在95.5%–106%之间。该方法实现了微量体积样品的定量分析,适用于临床诊断。Zhang等[48]使用3α-HSD作为敏感元件,该酶可将不同胆汁酸共有的3α-羟基转化为羰基,反应过程将NAD+还原为NADH,NADH在电极表面上被氧化为NAD+,电极捕获电子信号,该间接电化学传感器可用于人体血清中胆汁酸检测,抗干扰能力较强,检测的线性范围为2–163 μg/mL (R2=0.997 2)。Zhang等[49]进一步开发了基于酶促反应以及双氧化循环扩增技术超敏检测总胆汁酸的方法。该方法以丝网印刷电极为载体,利用3α-HSD对胆汁酸脱氢反应偶联NAD+还原成NADH,NADH与Ru(bpy)33+发生电子介质反应生成Ru(bpy)32+,最后在一定的电压下将Ru(bpy)32+进一步氧化为Ru(bpy)33+,因此构成了一个完整的双氧化放大循环。该方法操作简便、灵敏度高、成本低,无需样品制备,检测限为0.16 pg/mL,在2–16 pg/mL呈线性关系(R2=0.998),或可适用于临床上婴幼儿等样本量少的胆汁酸检测。
Hyeong等[50]设计并实现了一个利用液晶检测胆汁酸的毛细管传感平台。在微细毛细管中的液晶液滴在表面活性剂填充的液晶/水界面上呈垂直液面排列。然而,胆汁酸的竞争性吸附可破坏该界面上的表面活性剂填料,并触发了液晶液滴在界面上从垂直方向转变到平行于界面方向,利用偏振光显微镜可捕捉到对应的光学图像变化。该传感系统成功地检测出CA、DCA、CDCA三种主要类型的胆汁酸,其中DCA、CDCA的检出限为0.39 μg/mL,CA检出限为2.04 μg/mL,且具有一定抗干扰能力,此种基于液晶微液滴的阵列改变的思路新颖,不需要复杂的过程和昂贵的设备。
Wiel等[51]描述了一种基因编码胆汁酸传感器,其由两个荧光团融合到法氏体X受体配体结合区域组成,胆汁酸结合后导致FXR荧光基团的发光能力被遮蔽,该传感器可以定位检测局部的胆汁酸浓度,可用于实验生物样本的在线实时监测,不需要另外标记荧光或放射性核素。
3.3 胆汁酸生物传感器开发展望据表 1所示,比色法虽然快捷但灵敏度低;色谱法的灵敏度高、可同时检测多种胆汁酸,但样品前处理繁琐,且依赖大型设备,检测耗时相对较长。胆汁酸生物传感器结构简单、检测速度快、灵敏度高、样品量小、操作简单、样品前处理少。虽然目前检测胆汁酸的生物传感器已经制备成功,但仅能检测体内的总胆汁酸,且大多数都是基于酶的催化生成某种代谢产物进行检测,尚不能检测特定胆汁酸水平。胆汁酸属于甾体类化合物,其骨架相同,仅为取代基位置、数目或者种类不同。现阶段,构建特异性检测特定胆汁酸生物传感器较困难,无法实现DCA、CDCA、LCA等特定胆汁酸的检测,而且识别元件的半衰期短、易降低催化活性,检测方法难以实际应用。因此,结合大量与此相关的研究,笔者认为胆汁酸传感器的开发可从以下方面进行探讨。
表 1 不同胆汁酸检测方法性能比较Table 1 Performance comparison of different bile acid analytical methods
| Method | Reference | Source | Pretreatment | LOD | Linearity range | Specificity | Time spent (h) | Advantages/disadvantages |
| UV-Vis | [23] | Calculus bovis tablets | Extraction with acetic acid | – | 20–160 μg/mL | Low | 0.6–1.0 | Advantages: 1. Less equipment dependence 2. Simple operation procedure 3. Short testing time Disadvantages: 1. Large sample volume 2. High LOD 3. Low specificity |
| UV-Vis | [25] | Liver homogenate, bile, duodenal aspirate | 1. Acidification with HCl 2. Extraction with ethyl acetate | 14 μg/mL | 14.0–233.5 μg/mL | Medium | 2–3 | Advantages: 1. Simple operation procedure 2. Less equipment dependence Disadvantages: 1. Long testing time 2.Need pretreatment steps 3. Low sensitivity |
| UV-Vis | [26] | Standards | Diluted in acid | 15.5 μg/mL | 2.4–1 252.0 μg/mL | Medium | 0.3–0.5 | Advantages 1. Obvious color reaction 2. Simple operation procedure 3. Short testing time Disadvantages: 1. No validated specificity 2. Need pretreatment steps |
| UV-Vis | [27] | Medical reagents | Extraction with methanol | 3.37 μg/mL | 32–192 μg/mL | Medium | 1 | Advantages: 1. Good sensitivity 2. Discriminative color Disadvantages: 1. Long pretreatment time 2. Large sample volume |
| Enzyme- aided UV-Vis | [28] | Serum, bile | No | 19.6 μg/mL | 2.5–60.0 μg/mL | High | 0.3–0.5 | Advantages: 1. Good specificity 2. High repeatability 3. No pretreatment Disadvantages: 1. Cannot identify specific BA 2. Relative low sensitivity |
| TLC | [29] | Feces | 1. Fecal homogenate 2. Centrifugal separation 3. Organic extraction 4. SPE Column purification | – | 2–20 μg/mg | Medium | 4–5 | Advantages: 1. Available to multiple BAs 2. High sensitivity Disadvantages: 1. Complex sampling procedure 2. Long testing time 3. Limited kinds of BAs |
| HPLC | [34] | Feces | 1. Freeze and crush 2. Ultrasonic dissolving 3. Organic extraction 4. Enzymatic hydrolysis 5. SPE Column purification | 0.49 pg/mL | – | High | 17–18 | Advantages: 1. Ultra-high sensitivity 2. Available to multiple BAs 3. High repeatability Disadvantages: 1. Tedious operation procedure 2. Very long testing time 3. Need standards |
| HPLC | [35] | Serum, bile | 1. Dilution 2. SPE extraction | 3.91 μg/mL | 3.91–500.00 μg/mL | High | 1–2 | Advantages: 1. Available to multiple BAs 2. Good sensitivity 3. High repeatability Disadvantages: 1. Need standards 2. Long pretreatment time |
| HPLC- MS/MS | [37] | Bile | 1. Protein deposition 2. Concentration and dry | 4–80 ng/mL | 4–4 800 ng/mL | High | 1–2 | Advantages: 1. High sensitivity 2. High repeatability 3. Available to multiple BAs Disadvantages: 1. Long pretreatment time 2. Rely on massive equipment |
| HPLC- MS/MS | [38] | Biological fluids | 1. SPE Extraction 2. Nitrogen blow dry | 0.08–12.00 ng/mL | 7.2–900.0 ng/mL | High | 1–2 | Advantages: 1. Available to multiple BAs 2. Ultra-high sensitivity 3. High repeatability Disadvantages: 1. Long pretreatment time 2. Rely on massive equipment |
| GC-MS | [40] | Feces | 1. Dilution 2. Extraction and Wash 3. Nitrogen blow dry 4. Silylation derivatization | 0.16 μg/mL | 5–500 μg/mL | High | 6–8 | Advantages: 1. High sensitivity 2. High repeatability Disadvantages: 1. Tedious operation procedure 2. Rely on massive equipment 3. Very long testing time |
| GC-MS | [42] | Urine | 1. Enzymatic hydrolysis 2. Liquid-liquid extraction 3. Nitrogen blow dry 4. Derivations | 2.0 ng/mL | 0.2–1 000.0 ng/mL | High | 6–8 | Advantages: 1. High repeatability 2. High sensitivity Disadvantages: 1. Tedious operation procedure 2. Rely on massive equipment 3. Very long testing time |
| Fluorescent biosensor | [47] | Urine | No | 64 ng/mL | 20–2 000 ng/mL | High | 0.1–0.3 | Advantages: 1. Simple operations 2. High sensitivity 3. Low-cost 4. No pretreatment 5. Short testing time Disadvantages: 1. Cannot identify specific BA |
| SPCE biosensor | [49] | Serum | Dilution | 0.16 pg/mL | 2–60 pg/mL | High | 0.1–0.3 | Advantages: 1. Simple operations 2. High sensitivity 3. Low-cost 4. No pretreatment 5. Short testing time Disadvantages: 1. Cannot identify specific BA 2. Narrow linearity range |
表选项
(1) 开发特异性结合胆汁酸识别分子
① 利用指数富集的配基系统进化(Systematic evolution of ligands by exponential enrichment,SELEX)技术筛选胆汁酸特异性核酸适体。以不同胆汁酸标品作为配体,用SELEX技术可筛选出大量特异性胆汁酸结合适体。可利用该适体与胆汁酸结合前后结构不同,在适体末端修饰电化学敏感元件如二茂铁、亚甲基蓝等,从而实现胆汁酸的定量检测。亦或者利用核酸剪切、核酸互补配对等方式设计信号放大元件,将适体与胆汁酸结合的影响进一步放大,从而提高灵敏度。不仅如此,酶催化、新型纳米材料、荧光染料等元件均可与适体有机组合,使得胆汁酸传感器的灵敏度和选择性均大幅提高。
② 筛选细菌来源胆汁酸代谢酶。胆汁酸进入小肠后,具有较强抑菌效果,但仍有大量细菌(约104–107每克食糜)存在,说明细菌中可能存在丰富的胆汁酸代谢酶类。因此,通过以不同胆汁酸为单一碳源体外培养细菌,进一步优化实验设计可筛选得到对不同胆汁酸有特异性催化的酶类,进而可通过借助NADH或FAD等电子介质,利用信号放大的电极捕获催化过程中的电子传递,可得到电化学生物传感器,或利用电子敏感的荧光剂,可制得荧光生物传感器。
③ 将分子印迹技术应用至生物传感器。分子印迹技术可将胆汁酸与单体共聚合形成模板,然后通过物理手段去除结合的胆汁酸,形成能与待测物中胆汁酸特异识别的模板。可以在电极表面形成分子印迹聚合物,加入胆汁酸样品后,利用带有信号标记的胆汁酸特异性抗体进一步结合,构成三明治型生物传感器,也可实现不同胆汁酸的特异性检测。
(2) 提高胆汁酸传感器的性能
① 优化敏感元件识别胆汁酸条件,选择合适电解液、pH、离子强度、温度等参数,既要保持高灵敏度,又要保证敏感元件的相对稳定,避免识别元件的活性降低或者失活。
② 提高相应识别组件的稳定性,从而提高生物传感器的检测效果。选用核酸适体为敏感元件,则要求储存条件无核酸酶,在检测时核酸处于相对稳定状态。若选用蛋白酶类作为敏感元件,则需选择合适交联剂或聚合剂,以提高敏感酶在修饰电极表面的酶活稳定性。
③ 应用新型纳米材料,放大检测信号。利用石墨烯、碳量子点、金属纳米颗粒等作为电子传递放大或荧光放大元件,可进一步提高胆汁酸传感器的灵敏度。开发具有胆汁酸结合功能或催化功能的纳米材料,则更具竞争力。
(3) 胆汁酸传感器的应用
① 结合快速化前处理方法,可短时间内富集样品中胆汁酸。如利用β-环糊精与胆汁酸的特异吸附作用[52]、胆汁酸超分子自组装、分子印迹聚合物、核酸适体修饰磁珠等方法,在10 min内富集样品中所有胆汁酸,再利用特异性传感器进行检测,从而进一步降低检测过程的干扰因素。
② 应对便携式的快速检测的市场化需求,结合生物电子学、化工、人工智能等学科技术,逐步实现产品的微型化、集成化、智能化。
③ 开发实时、在线、可穿戴式的检测设备,用于研究不同疾病的胆汁酸含量变化,进一步用于诊断和防控相关疾病。
4 总结胆汁酸重要性不亚于葡萄糖,在多种疾病发生发展过程中扮演重要角色。目前较多使用的胆汁酸检测技术主要为分光光度法、薄层色谱法、高效液相色谱-质谱法、气相色谱-质谱法、生物传感器等。其中高效液相色谱-质谱法和气相色谱-质谱法重复性较好、测量准确,但存在样品处理复杂、操作复杂、仪器昂贵、分析成本高、分析时间较长等问题。生物传感器具有灵敏度高、检测速度快、分析成本低、样品处理简单等优点,但现有生物传感器对胆汁酸没有实现特异性检测,检测性能低、检测仪器尚未实现简单化。胆汁酸生物传感器的开发方向,在于构建特异性检测的生物传感器,通过提高识别元件的稳定性或者降低分析时间等途径从而提高检测性能,实现胆汁酸传感器的简化,从而更好服务于胆汁酸与代谢疾病的研究,用于日常疾病预防及诊断,最终使广大人群受益。相信随着相应技术的成熟和研究的深入,胆汁酸生物传感器将会有更大的市场。
参考文献
| [1] | Shapiro H, Kolodziejczyk AA, Halstuch D, et al. Bile acids in glucose metabolism in health and disease. J Exp Med, 2018, 215(2): 383-396. DOI:10.1084/jem.20171965 |
| [2] | Ahmad TR, Haeusler RA. Bile acids in glucose metabolism and insulin signalling—mechanisms and research needs. Nat Rev Endocrinol, 2019, 15(12): 701-712. DOI:10.1038/s41574-019-0266-7 |
| [3] | Marchionatti A, Rivoira M, Rodriguez V, et al. Molecular mechanisms triggered by bile acids on intestinal Ca2+ absorption. Curr Med Chem, 2018, 25(18): 2122-2132. DOI:10.2174/0929867324666171116125131 |
| [4] | Griffiths WJ, Sj?vall J. Bile acids: analysis in biological fluids and tissues. J Lipid Res, 2010, 51(1): 23-41. DOI:10.1194/jlr.R001941 |
| [5] | Liu YN, Rong ZH, Xiang D, et al. Detection technologies and metabolic profiling of bile acids: a comprehensive review. Lipids Health Dis, 2018, 17(1): 121. DOI:10.1186/s12944-018-0774-9 |
| [6] | Carneiro P, Morais S, Do Carmo Pereira M. Biosensors on the road to early diagnostic and surveillance of Alzheimer's disease. Talanta, 2020, 211: 120700. DOI:10.1016/j.talanta.2019.120700 |
| [7] | Sabu C, Henna TK, Raphey VR, et al. Advanced biosensors for glucose and insulin. Biosens Bioelectron, 2019, 141: 111201. DOI:10.1016/j.bios.2019.03.034 |
| [8] | Dawson PA, Karpen SJ. Intestinal transport and metabolism of bile acids. J Lipid Res, 2015, 56(6): 1085-1099. DOI:10.1194/jlr.R054114 |
| [9] | Jia ET, Liu ZY, Pan M, et al. Regulation of bile acid metabolism-related signaling pathways by gut microbiota in diseases. J Zhejiang Univ Sci B, 2019, 20(10): 781-792. DOI:10.1631/jzus.B1900073 |
| [10] | Di Ciaula A, Garruti G, Baccetto RL, et al. Bile acid physiology. Ann Hepatol, 2017, 16(S1): S4-S14. |
| [11] | Baier V, Cordes H, Thiel C, et al. A physiology-based model of human bile acid metabolism for predicting bile acid tissue levels after drug administration in healthy subjects and BRIC Type 2 patients. Front Physiol, 2019, 10: 1192. DOI:10.3389/fphys.2019.01192 |
| [12] | Molinaro A, Wahlstr?m A, Marschall HU. Role of bile acids in metabolic control. Trends Endocrinol Metab, 2018, 29(1): 31-41. DOI:10.1016/j.tem.2017.11.002 |
| [13] | Ridlon JM, Kang DJ, Hylemon PB, et al. Bile acids and the gut microbiome. Curr Opin Gastroenterol, 2014, 30(3): 332-338. DOI:10.1097/MOG.0000000000000057 |
| [14] | Just S, Mondot S, Ecker J, et al. The gut microbiota drives the impact of bile acids and fat source in diet on mouse metabolism. Microbiome, 2018, 6(1): 134. DOI:10.1186/s40168-018-0510-8 |
| [15] | Chávez-Talavera O, Tailleux A, Lefebvre P, et al. Bile acid control of metabolism and inflammation in obesity, type 2 diabetes, dyslipidemia, and nonalcoholic fatty liver disease. Gastroenterology, 2017, 152(7): 1679-1694. DOI:10.1053/j.gastro.2017.01.055 |
| [16] | Wang WJ, Zhao JF, Gui WF, et al. Tauroursodeoxycholic acid inhibits intestinal inflammation and barrier disruption in mice with non-alcoholic fatty liver disease. Br J Pharmacol, 2018, 175(3): 469-484. |
| [17] | Wahlstr?m A, Sayin SI, Marschall HU, et al. Intestinal crosstalk between bile acids and microbiota and its impact on host metabolism. Cell Metab, 2016, 24(1): 41-50. |
| [18] | Gadaleta RM, Van Erpecum KJ, Oldenburg B, et al. Farnesoid X receptor activation inhibits inflammation and preserves the intestinal barrier in inflammatory bowel disease. Gut, 2011, 60(4): 463-472. DOI:10.1136/gut.2010.212159 |
| [19] | Li WY, Shu S, Cheng LL, et al. Fasting serum total bile acid level is associated with coronary artery disease, myocardial infarction and severity of coronary lesions. Atherosclerosis, 2019, 292: 193-200. |
| [20] | Goh B, Choi J, Kang JA, et al. Development of a mass spectrometric screening assay for hepatitis B virus entry inhibitors. J Pharm Biomed Anal, 2020, 178: 112959. DOI:10.1016/j.jpba.2019.112959 |
| [21] | Dutta M, Cai JW, Gui W, et al. A review of analytical platforms for accurate bile acid measurement. Anal Bioanal Chem, 2019, 411(19): 4541-4549. DOI:10.1007/s00216-019-01890-3 |
| [22] | Zhang YJ, Xia J, Qiu JS, et al. Research progress in pharmacological effects and quantitative methods for biles acids in Calculus bovis. J Int Pharm Res, 2016, 43(2): 268-274 (in Chinese). 张宇静, 夏晶, 仇佳思, 等. 牛黄中胆汁酸的药理作用及定量分析方法研究进展. 国际药学研究杂志, 2016, 43(2): 268-274. |
| [23] | Liu LF. The content of bile acid in taurine Niuhuang Xiaoyan tablets detected by ultraviolet spectrophotometry. Guide Chin Med, 2010, 8(23): 6-7 (in Chinese). 刘力丰. 紫外分光光度法测定牛黄消炎片中胆酸的含量. 中国医药指南, 2010, 8(23): 6-7. |
| [24] | Yan HY, Zou CC. Determination of total cholic acid in bear bile powder, porcine gal powder, ox bile powder and chicken bile powder and study on the bacteriostatic action of these bile powder. Chin Hosp Pharm J, 2012, 32(3): 175-179 (in Chinese). 鄢海燕, 邹纯才. 熊胆粉、猪胆粉、牛胆粉及鸡胆粉中总胆酸的含量测定及其抑菌作用. 中国医院药学杂志, 2012, 32(3): 175-179. |
| [25] | Ikeda M, Nanba S, Hayakawa S, et al. Colorimetric determination of glycine conjugates of bile acids. J Clin Chem Clin Biochem, 1980, 18(7): 407-411. |
| [26] | Cadena PG, Oliveira EC, Araújo AN, et al. Simple determination of deoxycholic and ursodeoxycholic acids by phenolphthalein-β-cyclodextrin inclusion complex. Lipids, 2009, 44(11): 1063-1070. DOI:10.1007/s11745-009-3353-z |
| [27] | El-Kafrawy DS, Belal TS, Mahrous MS, et al. Validated spectrophotometric and RP-HPLC-DAD methods for the determination of ursodeoxycholic acid based on derivatization with 2-nitrophenylhydrazine. J AOAC Int, 2017, 100(3): 677-685. DOI:10.5740/jaoacint.16-0286 |
| [28] | Rani K, Garg P, Pundir CS. Measurement of bile acid in serum and bile with arylamine-glass-bound 3α-hydroxysteroid dehydrogenase and diaphorase. Anal Biochem, 2004, 332(1): 32-37. |
| [29] | Kindel M, Ludwig-Koehn H, Lembcke B. New and versatile method for the determination of raecal bile acids by thin-layer chromatography with direct scanning fluorimetry. J Chromatogr B, 1989, 497: 139-146. DOI:10.1016/0378-4347(89)80013-1 |
| [30] | Ye BB, Pan L, Wang D, et al. Simultaneous TLC-scanning determination of cholic acid and hyodeoxycholic acid in artificial Calculus bovis. Chin J Pharm Anal, 2010, 30(4): 706-709 (in Chinese). 叶蓓蓓, 潘莉, 王栋, 等. 薄层扫描法同时测定人工牛黄中胆酸及猪去氧胆酸的含量. 药物分析杂志, 2010, 30(4): 706-709. |
| [31] | Do?owy M. Application of selected topological indices to predict retention parameters of selected bile acids separated on modified TLC plates. Acta Pol Pharm, 2008, 65(1): 51-57. |
| [32] | Deng Y, Qu L, Yan M, et al. Advances in the determination methods of bile acids. Hunan J Tradit Chin Med, 2013, 29(12): 169-171 (in Chinese). 邓阳, 屈玲, 颜苗, 等. 多种胆汁酸测定方法研究进展. 湖南中医杂志, 2013, 29(12): 169-171. |
| [33] | Sardella R, Gioiello A, Ianni F, et al. HPLC/ELSD analysis of amidated bile acids: an effective and rapid way to assist continuous flow chemistry processes. Talanta, 2012, 100: 364-371. DOI:10.1016/j.talanta.2012.07.092 |
| [34] | Kakiyama G, Muto A, Takei H, et al. A simple and accurate HPLC method for fecal bile acid profile in healthy and cirrhotic subjects: validation by GC-MS and LC-MS. J Lipid Res, 2014, 55(5): 978-990. DOI:10.1194/jlr.D047506 |
| [35] | Zhao MF, Huang P, Ge CL, et al. Conjugated bile acids in gallbladder bile and serum as potential biomarkers for cholesterol polyps and adenomatous polyps. Int J Biol Markers, 2016, 31(1): 73-79. DOI:10.5301/jbm.5000173 |
| [36] | Qu YC, Yu YL, Wang MM, et al. Determination of 15 bile acids concentration in human plasma by HPLC-MS/MS method and comparative analysis of different anticoagulants on detection results. Chin J Pharm Anal, 2019, 39(7): 1185-1193 (in Chinese). 屈昱晨, 俞蕴莉, 王猛猛, 等. HPLC-MS/MS法测定人血中15种胆汁酸浓度及不同抗凝剂对检测结果的对比分析. 药物分析杂志, 2019, 39(7): 1185-1193. |
| [37] | Liu YN, Lei K, Xiang D, et al. HPLC-MS/MS simultaneous analysis of 26 bile acids in rat plasma. Chin J Pharm Anal, 2018, 38(10): 1767-1774 (in Chinese). 刘雅楠, 雷凯, 向东, 等. HPLC-MS/MS法同时测定大鼠血浆中26种胆汁酸. 药物分析杂志, 2018, 38(10): 1767-1774. |
| [38] | Ulaszewska MM, Mancini A, Garcia-Aloy M, et al. Isotopic dilution method for bile acid profiling reveals new sulfate glycine-conjugated dihydroxy bile acids and glucuronide bile acids in serum. J Pharm Biomed Anal, 2019, 173: 1-17. |
| [39] | Fu XW, Xiao Y, Golden J, et al. Serum bile acids profiling by liquid chromatography-tandem mass spectrometry (LC-MS/MS) and its application on pediatric liver and intestinal diseases. Clin Chem Lab Med, 2020, 58(5): 787-797. |
| [40] | Keller S, Jahreis G. Determination of underivatised sterols and bile acid trimethyl silyl ether methyl esters by gas chromatography-mass spectrometry-single ion monitoring in faeces. J Chromatogr B, 2004, 813(1/2): 199-207. |
| [41] | Tadano T, Kanoh M, Matsumoto M, et al. Studies of serum and feces bile acids determination by gas chromatography-mass spectrometry. Rinsho Byori, 2006, 54(2): 103-110. |
| [42] | Kumar BS, Chung BC, Lee YJ, et al. Gas chromatography-mass spectrometry-based simultaneous quantitative analytical method for urinary oxysterols and bile acids in rats. Anal Biochem, 2011, 408(2): 242-252. |
| [43] | Bhalla N, Jolly P, Formisano N, et al. Introduction to biosensors. Essays Biochem, 2016, 60(1): 1-8. |
| [44] | Neethirajan S, Ragavan V, Weng X, et al. Biosensors for sustainable food engineering: challenges and perspectives. Biosensors, 2018, 8(1): 23. |
| [45] | Rapini R, Marrazza G. Electrochemical aptasensors for contaminants detection in food and environment: Recent advances. Bioelectrochemistry, 2017, 118: 47-61. |
| [46] | Koide S, Ito N, Karube I. Development of a micro-planar amperometric bile acid biosensor for urinalysis. Biosens Bioelectron, 2007, 22(9/10): 2079-2085. |
| [47] | Li YS, Liu WP, Gao XF, et al. Immobilized enzymatic fluorescence capillary biosensor for determination of sulfated bile acid in urine. Biosens Bioelectron, 2008, 24(4): 538-544. |
| [48] | Zhang XQ, Zhu MS, Xu B, et al. Indirect electrochemical detection for total bile acids in human serum. Biosens Bioelectron, 2016, 85: 563-567. |
| [49] | Tian G, Ding M, Xu B, et al. A novel electrochemical biosensor for ultrasensitive detection of serum total bile acids based on enzymatic reaction combined with the double oxidation circular amplification strategy. Biosens Bioelectron, 2018, 118: 31-35. |
| [50] | Kim HJ, Jang CH. Liquid crystal-based capillary sensory platform for the detection of bile acids. Chem Phys Lipids, 2017, 204: 10-14. |
| [51] | van de Wiel S, Merkx M, van de Graaf S. Real time monitoring of intracellular bile acid dynamics using a genetically encoded FRET-based bile acid sensor. J Vis Ex https://research.tue.nl/en/publications/real-time-monitoring-of-intracellular-bile-acid-dynamics-using-a- |
| [52] | p, 2016, (107): 53659. |
| [53] | Huang SY, Zheng JT, Yang Q, et al. High-efficiency, matrix interference-free, general applicable probes for bile acids extraction and detection. Adv Sci, 2018, 5(12): 1800774. |
