

江南大学 粮食发酵工艺与技术国家工程实验室 工业生物技术教育部重点实验室 糖化学与生物技术教育部重点实验室,江苏 无锡 214122
收稿日期:2018-08-20;接收日期:2018-10-18
基金项目:国家自然科学基金(No.31570034), 111计划(No.111-2-06), 国家轻工技术与工程一流学科自主课题(No.LITE2018-24), 江苏省自然科学基金(No.BK20150148)资助
摘要:以来自于谷氨酸棒杆菌内源AH6启动子和5′ UTR及其前38 bp结合合适的Shine-Dalgarno (SD)序列,构建双顺反子表达载体对木聚糖酶进行表达。为了能够实现分泌表达,选取了来自谷氨酸棒杆菌的两种分泌途径的信号肽,分别为Tat型的CgR0949及Sec型的CspB信号肽。在实现分泌表达之后,对其进行5 L发酵罐的扩大培养以提高分泌量。并对纯化的木聚糖酶进行了部分酶学性质的研究,包括最适催化pH及酸碱耐受性;最适催化温度及热稳定性。结果表明:在上述表达体系中,以CgR0949为信号肽木聚糖酶不能分泌到胞外;木聚糖酶能在CspB信号肽的引导下分泌到胞外,分泌表达量为486.2 U/mL。木聚糖酶的分泌量在5 L发酵罐水平上达到1 648.7 U/mL,是摇瓶培养的3.4倍。该木聚糖酶的最适反应pH为4.5,最适温度为45 ℃;在pH 4–11范围内4 ℃处理24 h酶活保持在80%以上;在50 ℃前处理15 min酶活保持在95%以上,超过60 ℃则酶活迅速下降至20%及其以下。上述结果表明,谷氨酸棒杆菌内源元件能有效用于木聚糖酶的分泌表达,扩大培养能进一步提升木聚糖酶的分泌量。该双顺反子表达体系能为外源蛋白在谷氨酸棒杆菌中的分泌表达提供一种可用的工具。此外,通过酶学性质的研究可进一步提高木聚糖酶的催化效率。
关键词:谷氨酸棒杆菌木聚糖酶双顺反子分泌表达
Secretory production of xylanase in Corynebacterium glutamicum using its endogenous elements
Wei Zhang, Xiuxia Liu, Yankun Yang, Zhonghu Bai


Key Laboratory of Carbohydrate Chemistry and Biotechnology, Ministry of Education, Key Laboratory of Industrial Biotechnology, Ministry of Education, National Engineering Laboratory of Cereal Fermentation Technology, Jiangnan University, Wuxi 214122, Jiangsu, China
Received: August 20, 2018; Accepted: October 18, 2018
Supported by: National Natural Science Foundation of China (No. 31570034), the 111 Project (No. 111-2-06), National First-class Discipline Program of Light Industry Technology and Engineering (No. LITE2018-24), Natural Science Foundation of Jiangsu Province (No. BK20150148)
Corresponding author: Zhonghu Bai. Tel: +86-510-85329306; E-mail: baizhonghu@jiangnan.edu.cn.
Abstract: We constructed bicistronic expression system containing AH6 promoter, 5′ UTR and its fore 38 bp sequence from Corynebacterium glutamicum, followed by a conserved Shine-Dalgarno (SD) sequence for xylanase expression. The two major secretory pathways signal peptide in C. glutamicum, Tat (CgR0949) and Sec (CspB) dependent signal peptide were added before xylanase for its secretion. Fed-batch cultivation was done in a 5 L jar for high-level xylanase secretion. The enzyme properties of the purified xylanase were then studied, including the effect of temperature and pH on its activity. The xylanase could be secreted into the culture supernatant when the Sec-dependent signal peptide CspB was used, but none was detected when CgR0949 was used. The secretory production level of xylanase in a flask was 486.2 U/mL and become 1 648.7 U/mL when in a 5 L jar, which was 3.4 fold as in the flask. The optimal pH and temperature of xylanase were pH 4.5 and 45 ℃, respectively. Its activity was 80% of initial activity after pretreatment at 4 ℃ for 24 h at pH 4–11, 95% after incubation below 50 ℃ for 15 min, and 20% when the temperature above 60 ℃. The xylanase could be efficiently secreted into the culture medium by C. glutamicum using its own genetic elements, and the secretion level could be improved through large-scale fed-batch cultivation. This bicistronic expression system can provide a useful tool for heterologous proteins secretion in C. glutamicum. In addition, the catalyze activity of xylanase could be further improved by enzyme properties study.
Keywords: Corynebacterium glutamicumxylanasebicistronicsecretory production
木聚糖酶(XynA)是一种可将木聚糖催化成低聚木糖或木寡糖的一类酶的总称,其切割部位为底物的β-1, 4糖苷键,广泛存在于细菌和真菌中,是一种重要的工业酶类,在饲料工业、造纸业和食品行业等具有较大的应用价值[1]。木聚糖酶的生产与应用已由Juturu等[1]和Paes等[2]作过相关综述,并介绍了木聚糖酶的来源、结构和相关酶学性质等。
目前,最常用于外源蛋白表达的宿主为大肠杆菌Escherichia coli,表达量高以及便于遗传操作等使其成为蛋白表达的明星菌株。由于该宿主缺乏有效的分泌元件以及双层细胞膜,使其主要用于胞内表达外源蛋白。Chen等通过对普鲁兰酶分子的CBM41和X25区简化,得到的精简普鲁兰酶能在PelB信号肽引导之下分泌到周质空间,实现了普鲁兰酶在大肠杆菌中的分泌表达[3]。为了克服大肠杆菌作为表达宿主的缺点,如含有内毒素、易形成包涵体及双层细胞膜不利于蛋白分泌,人们开发了利用革兰氏阳性菌为宿主的较为安全的表达体系来代替,如枯草芽孢杆菌和谷氨酸棒杆菌Corynebacterium glutamicum表达体系等。作为表达宿主,枯草芽孢杆菌具有易于培养、安全和可分泌表达等[4]优点,但部分情况下在表达蛋白过程中的错误折叠导致表达出的蛋白无活性,而利用谷氨酸棒杆菌则能正确地折叠蛋白并且具有活性[5]。谷氨酸棒杆菌自首次被分离出后就广泛用于氨基酸的生产,如谷氨酸、赖氨酸、丝氨酸和异亮氨酸等[6-8]。除作为氨基酸和有机酸的生产菌株外,谷氨酸棒杆菌还是一种很有潜力的外源蛋白表达宿主。相对于大肠杆菌表达体系,谷氨酸棒杆菌表达体系有如下优势:可溶性表达外源蛋白,不易形成包涵体;细胞为单层膜,外源蛋白易于分泌到胞外,不需要破碎,纯化较胞内表达容易;不含内毒素,比较安全[9]。在用谷氨酸棒杆菌进行氨基酸生产过程中,积累了大量的有关该菌的大规模发酵技术和经验,可以利用这些技术和经验实现外源蛋白的工业化生产。随着谷氨酸棒杆菌的基因组序列测定完毕[10],对其进行改造和构建工程菌株更为容易。
目前,关于谷氨酸棒杆菌分泌表达外源蛋白的研究主要集中于载体元件的构建和宿主的改造等。载体元件的选择和构建是进行外源蛋白表达的重要过程。启动子是表达系统的关键元件之一,通过控制转录影响外源蛋白的表达。启动子的来源可从宿主中进行筛选,包括原有启动子的突变和人工合成突变等。宿主中筛选如赵子豪等以egfp为报告基因,通过Golden Gate法从谷氨酸棒杆菌转录组数据筛选到了与强启动子Pgro接近的AH6和Ptuf启动子[11-12],来自谷氨酸棒杆菌中的Psod等也属于较强的启动子并用于ScFv等的表达[13],Zou等在谷氨酸棒杆菌中过表达GlyA时发现用强启动子Ptuf能降低5-氨基乙酰丙酸的产量[14],同添加过量丝氨酸结果相同;原有启动子的突变如Zhang等通过构建启动子突变库,以绿色荧光蛋白为报告基因,筛选到了P69启动子,是tac启动子的1.9倍[15];Liu等利用tac-M启动子结合CgR-S0949信号肽在谷氨酸棒杆菌中成功分泌表达了来自茂源链霉菌Streptomyces mobaraense CICC 11018的转谷氨酰胺酶[16];人工突变合成启动子库如Rytter等基于谷氨酸棒杆菌?10区的序列(gngnTA (c/t) aaTgg)及大肠杆菌的?35区序列通过PCR突变法构建了适用于谷氨酸棒杆菌的组成型启动子库,并基于大肠杆菌的lac启动子的?10区和?35区之间序列的突变,构建了诱导型的启动子库并用于β-半乳糖苷酶的诱导表达[17];Yim等以gfp为报告基因,结合流式分选技术,通过随机突变筛选了启动子PH36,并用于ScFv的表达[18]。除启动子外,核糖体结合位点(Ribosome binding site,RBS)序列通过核糖体与mRNA的结合效率而影响着目的基因的表达[19],并且RBS序列的改变还会影响转录效率间接引起翻译水平的变化;Shi等通过合适的启动子和RBS序列组合使γ-氨基丁酸(GABA)在谷氨酸棒杆菌中的产量超过25 g/L[20]。若进行分泌表达,信号肽是必不可少的元件,信号肽通过引导蛋白跨膜从而分泌到胞外,形成分泌表达,有利于下游的分离纯化,这也是相对于大肠杆菌胞内表达的优势所在。目前在谷氨酸棒杆菌中的信号肽主要有两种途径,分别为Sec依赖型和Tat依赖型,其中Sec依赖型信号肽转运非折叠蛋白[13],而Tat型信号肽转运折叠蛋白[21]。蛋白如GFP仅能通过Tat型信号肽分泌到胞外,通过Sec途径不能分泌或分泌出极少量的无活性的蛋白[5];淀粉酶等既能通过Sec信号肽分泌,又能通过Tat型信号肽分泌[22-23]。在分泌表达外源蛋白时,需要根据蛋白特性选择合适的信号肽。
目前在谷氨酸棒杆菌中所用的表达载体大都为单顺反子形式,即启动子-5′UTR-目的基因;本研究中我们通过构建双顺反子分泌表达载体用于外源蛋白的分泌表达。相对于单顺反子载体而言多了第一顺反子后续的38 bp碱基以利于核糖体沿着mRNA进行翻译,在遇到第二个SD序列以后,核糖体重新起始第二个顺反子即目的基因的翻译。利用此双顺反子载体以及合适的信号肽,成功分泌表达了来自天蓝色链霉菌Streptomyces coelicolor A3(2)的木聚糖酶蛋白并在5 L发酵罐上进行了扩大培养,并对其部分酶学性质进行初步研究。为谷氨酸棒杆菌分泌表达外源蛋白提供了一种可用的工具,为进一步发掘谷氨酸棒杆菌基因组中基因功能、利用谷氨酸棒杆菌内源元件进行外源蛋白的表达奠定了基础。
1 材料与方法1.1 材料1.1.1 菌株和质粒大肠杆菌E. coli DH5α用于载体的构建和扩增;谷氨酸棒杆菌C. glutamicum CGMCC1.15647用于目的基因的表达。质粒pxmj19和PUC-xynA由本实验室保存。
1.1.2 主要试剂和仪器质粒提取试剂盒和胶回收试剂盒购自Axygen公司;限制性内切酶XhoⅠ和EcoRⅠ及T4 DNA连接酶购自Thermo公司;Q5超保真聚合酶购自NEB公司;氯霉素购自生工生物工程(上海)股份有限公司;Endo-Xylanase Assay Procedure购自Megazyme公司;HRP-conjugated anti-His购自Proteintech公司,显色液购自Thermo公司;其余试剂为国产或进口分析纯。
电转化仪和凝胶成像系统为Bio-Rad公司;高速冷冻离心机为Thermo公司;核酸和蛋白电泳仪,北京六一仪器厂。
1.1.3 培养基和培养条件大肠杆菌:37 ℃在LB培养基中培养;谷氨酸棒杆菌:30 ℃在BHI培养基中培养。在需要氯霉素抗性筛选时,在大肠杆菌中终浓度为15 mg/L,在谷氨酸棒杆菌中为10 mg/L。
1.1.4 引物合成和基因合成实验中所用引物及分泌表达的载体AH6-PS2和AH6-0949由苏州鸿讯生物科技有限公司构建合成。上述两个载体以pxmj19载体为基础,带有除木聚糖酶(XynA)以外的序列,包括AH6启动子[11]、5′ UTR及其前38 bp的序列(Gene ID:NCgl1316)、SD2 (AAAGGAGGACAAC)和信号肽。其余载体为实验室保存,载体结构如图 1所示。
 |
| 图 1 木聚糖酶分泌表达载体结构简图 Fig. 1 Brief architecture of vectors for XynA secretion. |
| 图选项 |
1.2 方法1.2.1 分泌表达载体的构建AH6-09X和AH6-PSX的构建:以xynAF (5′-C CGCTCGAGGCCGAGAGCACGCTCGGCG-3′)和xynA (5′-CCGGAATTCTCAGTGGTGGTGGTGGTG GTGGGTGCGGGTCCAGCGTTGGTTG-3′)为引物(在C末端添加了6×His标签便于后续纯化),以PUC-xynA质粒为模板扩增木聚糖酶基因xynA序列。反应体系为:5×缓冲液10 μL、dNTPs (各10 mmol/L) 1 μL、上下游引物各2 μL、Q5 DNA聚合酶0.5 μL、模板1 μL,补足ddH2O至50 μL。扩增条件为:95 ℃ 4 min;95 ℃ 30 s,60 ℃ 30 s,72 ℃ 1 min,35个循环;72 ℃ 3 min。PCR产物纯化后经XhoⅠ和EcoRⅠ酶切,用T4 DNA连接酶分别连接到同样经过XhoⅠ和EcoRⅠ酶切之后的AH6-0949和AH6-PS2载体上,分别得到AH6-09X和AH6-PSX,结构如图 1所示。
1.2.2 谷氨酸棒杆菌的转化上述的AH6-09X和AH6-PSX载体通过电转化法转入谷氨酸棒杆菌中[24]。
1.2.3 木聚糖酶在5 L发酵罐中的分泌表达将含有AH6-PSX载体的谷氨酸棒杆菌在培养12 h后,取200 mL培养物接种到含有1.8 L发酵培养基的5 L Applikon Ez-control发酵罐中。培养基成分为(g/L):葡萄糖30,BHI 30,(NH4)2SO4 20,MgSO4 1,KH2PO4 1。发酵过程中,pH值控制在7.0,通过氨水及10%的磷酸调节pH;温度控制在30 ℃,溶氧控制在30%。在12 h开始补料(300 g/L的葡萄糖),在取样之后用循环泵迅速补料32 mL。每隔4 h取一次样,测定其OD600和发酵液上清的木聚糖酶活性,用DNS法测定葡萄糖含量。
1.2.4 分泌蛋白的检测、纯化及SDS-PAGE木聚糖酶的检测:按照Endo-Xylanase Assay Procedure试剂盒操作说明书进行。酶活定义:在试剂盒标准测定条件下,每分钟催化底物释放20 nmol的4-硝基酚所需酶量为一个酶活单位。
木聚糖酶的纯化:使用AKTA Purifier System (GE Healthcare)进行目的蛋白纯化。带有目的基因载体的谷氨酸棒杆菌在培养结束后,4 ℃、12 000×g离心5 min收集培养物上清。取25 mL经0.22 μm滤膜过滤的样品上样到经过A液(20 mmol/L Tris,300 mmol/L NaCl,pH 8.0)平衡过的镍柱上,然后用A液继续平衡5个柱体积以洗下未与镍柱结合的杂蛋白。平衡完毕后,用50%的B液(20 mmol/L Tris,300 mmol/L NaCl,250 mmol/L咪唑,pH 8.0)洗脱,收集带有蛋白峰洗脱液。
蛋白的纯度分析通过SDS-PAGE进行,分离胶的浓度为12%,浓缩胶的浓度为4%。电泳电压为100 V,结束后用考马斯亮蓝染液进行染色,脱色后置于凝胶成像仪拍照。Western blotting操作按照之前报道[25]进行,以HRP-conjugated anti-His为抗体进行检测。
1.2.5 最适pH及酸碱稳定性最适pH测定:分别在不同pH值的缓冲液配制木聚糖酶催化底物和稀释酶液,测定木聚糖酶的活性。酸碱稳定性测定:选用不同pH值的缓冲液稀释酶液,于4 ℃冰箱存放24 h后测定木聚糖酶活性。以其中的最高酶活为100%,其余条件下测定的酶活以相对百分比与之相比较。pH的范围为3.0–12.0,其中pH 3.0–6.0所用的缓冲液为100 mmol/L乙酸-乙酸钠,pH 7.0–8.0为100 mmol/L的Tris-HCl缓冲液,pH 9.0–10.0为100 mmol/L的Gly-NaOH缓冲液,pH 11.0–12.0为Na2HPO4-NaOH缓冲液。
1.2.6 最适温度及热稳定性最适温度测定:分别在20–80 ℃条件下测定木聚糖酶的活性,其余参数同标准条件。温度稳定性测定:分别将木聚糖酶在20–80 ℃条件下处理15 min,然后在40 ℃条件下测定木聚糖酶的活性。以酶活最高的一组定为100%,其余条件下测定的酶活以相对百分比与之相比较。
2 结果与分析2.1 载体的构建载体AH6-09X和AH6-PSX的主要结构如图 1所示,除一般载体所共有的复制起始位点、抗性基因等之外,上述两个载体都是双顺反子形式的载体。含有AH6启动子,AH6启动子为本实验室前期在谷氨酸棒杆菌中筛选到的表达EGFP效果较好的内源启动子[11],以AH6基因的前38 bp为第一顺反子,第二个SD序列来自16S rRNA中出现较高频率的序列[26],信号肽基因cgR0949和cspB来自谷氨酸棒杆菌自身,分别为Tat和Sec依赖型,为谷氨酸棒杆菌的两种主要的分泌途径。构建双顺反子载体的原因是:双顺反子形式能通过第一顺反子(38 bp)的翻译使核糖体能够结合到mRNA上,以及改变mRNA的二级结构更有利于翻译进行,在核糖体遇到第二个SD序列之后,可以重新起始下一个顺反子的翻译,从而表达第二顺反子即目的基因。在目的基因前加上信号肽能引导目的蛋白分泌到胞外,形成分泌表达。在大肠杆菌中,双顺反子结构表达较单顺反子稳定[27],在谷氨酸棒杆菌中,双顺反子形式的表达往往优于单顺反子表达[11, 19]。
2.2 木聚糖酶的表达及其分泌将构建好的载体分别转入谷氨酸棒杆菌中进行表达。胞内表达的木聚糖酶酶活通过超声破碎后检测,分泌表达的木聚糖酶酶活取发酵液上清进行检测。检测结果如图 2所示,在带有AH6-PSX载体的谷氨酸棒杆菌发酵液上清中检测到木聚糖酶活性为486.2 U/mL,说明木聚糖酶能够由本载体中的启动子和SD等原件启动表达,并且在CspB信号肽的引导下能够分泌到胞外,上清经过镍柱一步纯化即可得到较为单一的条带(图 2);在带有AH6-09X载体的谷氨酸棒杆菌发酵液上清中检测不到木聚糖酶活性,说明在此表达体系中,木聚糖酶不能通过CgR0949信号肽分泌到胞外。在胞内,木聚糖酶在AH6-09X中的表达量为69.8 U/mL,稍高于在AH6-PSX中的表达量48 U/mL,可能是由于木聚糖酶在AH6-PSX中能分泌到胞外,而在AH6-09X中不能分泌到胞外,在胞内积累,因此高于在AH6-PSX中含量。但由于表达量都低于在AH6-PSX中的分泌表达量,因此,分泌表达是较优的选择。
 |
| 图 2 木聚糖酶在谷氨酸棒杆菌中的分泌表达 Fig. 2 Secretion of XynA in C. glutamicum. (A) SDS-PAGE gel (lanes 1–5) of XynA production. Lane M: protein molecular mass marker; lane 1: sample from wild type C. glutamicum; lane 2: sample from C. glutamicum harboring pxmj19; lane 3: sample from C. glutamicum harboring AH6-09X; lane 4: sample from C. glutamicum harboring AH6-PSX; lane 5: purified XynA. (B) Western blotting analysis (lanes 1–3) of XynA production. Lane 1: sample from C. glutamicum harboring AH6-09X; lane 2: sample from C. glutamicum harboring AH6-PSX; lane 3: purified XynA. |
| 图选项 |
上述结果说明,木聚糖酶在谷氨酸棒杆菌中的分泌表达优于胞内表达,并对信号肽具有选择性,适合于通过Sec型的信号肽分泌而不适于通过Tat型的信号肽分泌。蛋白分泌到胞外可不经过菌体破碎而直接纯化,简化了纯化过程,在工业化生产上能有效节约成本。同时谷氨酸棒杆菌为食品级安全菌,结合分泌表达,使得谷氨酸棒杆菌成为极具潜力的外源蛋白表达宿主。
2.3 木聚糖酶在5 L发酵罐的分泌表达为了进一步提高本表达体系中木聚糖酶分泌表达能力,我们在5 L发酵罐对重组菌进行了扩大培养实验。结果如图 3所示,接种之后,葡萄糖浓度维持在20–30 g/L,菌体的浓度随着培养时间的延长而增加,在第8小时时木聚糖酶的分泌表达量即接近了摇瓶水平(481.8 U/mL),第12 h时分泌量首次超过摇瓶水平(702.8 U/mL),到第36 h菌体浓度达到最大,而后开始下降。SDS-PAGE图上也可以看到在接种后培养4 h后即出现分泌的木聚糖酶蛋白条带,并且随着培养时间延长而增大浓度。经过酶活检测,木聚糖酶的活性在第36 h即达到最大,为1 648.7 U/mL,分泌量是摇瓶水平的3.4倍。同时由图 3A可知,木聚糖酶的分泌和菌体的生长有一定的关系,木聚糖酶的分泌量紧随菌体的总量,可通过培养基和培养条件的优化进一步利于菌体的生长及提高蛋白的分泌量。除此之外,强启动子能够提高目的基因的转录水平,目的基因密码子优化能够使原有的稀有密码子减少,对应氨基酸的tRNA相对增加,从而提高蛋白翻译效率[13];在分泌表达时,信号肽效率的提高和目的蛋白在跨膜转运过程中障碍的减少如宿主细胞壁的改造能有效提高蛋白的转运效率而提高蛋白分泌水平[28]。
 |
| 图 3 5 L发酵罐发酵生产木聚糖酶过程图 Fig. 3 Fed-batch cultivation of C. glutamicum (AH6-PSX) for XynA production in a 5 L fermentor. (A) Profiles of cell growth (●), glucose concentration (?) and activity of XynA (■). (B) SDS-PAGE of culture supernatant during cultivation. Lane M: protein molecular mass marker; lane 1–13: supernatant samples taken at 4 h, 8 h, 12 h, 16 h, 20 h, 24 h, 28 h, 32 h, 36 h, 40 h, 44 h, 48 h, 52 h after inoculation. Arrow indicates XynA. |
| 图选项 |
2.4 木聚糖酶最适pH和酸碱稳定性最适pH:如图 4A所示,在pH 3–12之间测定木聚糖酶活性时,在pH 5–7之间相对酶活保持在90%以上;pH值小于4或大于9时,酶活发挥不足最高酶活的54%,说明该木聚糖酶在此pH条件下不利于催化底物降解。为进一步确定最适催化pH,在pH 5上下分别选择pH 4.5和pH 5.5进行酶活测定。结果表明,在pH 4.5时的酶活为pH 5时的1.02倍,说明该木聚糖酶的最适催化pH在4.5左右。
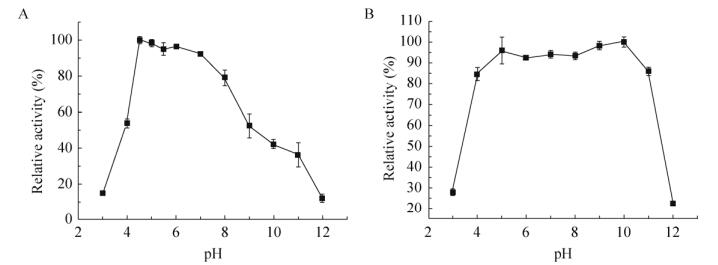 |
| 图 4 木聚糖酶的最适pH和酸碱稳定性 Fig. 4 The optimal pH and pH stability of XynA. (A) Optimal pH. (B) pH stability. |
| 图选项 |
酸碱稳定性:如图 4B所示,pH稳定性测试结果表明该酶在pH 3–11时较为稳定,处理后残余酶活能保持在84%以上,在此较宽的pH范围内较为稳定。在pH低于3或高于12,处理后残余酶活降至30%以下,可能是因为过酸或是过碱都会对酶本身造成损害,从而导致酶活的降低。
2.5 木聚糖酶最适温度和热稳定性最适温度:如图 5A所示,在20–80 ℃测该木聚糖酶的最适催化温度时,催化效率最高为40 ℃;酶活在30–60 ℃都能发挥60%以上活力;低于20 ℃酶活效力低于40%,而高于70 ℃酶活效率低于20%,说明此温度范围内不适于发挥酶活。为进一步精确该酶最适催化温度,在40 ℃上下分别选择35 ℃和45 ℃进行酶活测定。结果表明,在45 ℃时木聚糖酶的催化活性是40 ℃时的1.07倍,说明该木聚糖酶的最适催化温度在45 ℃左右。
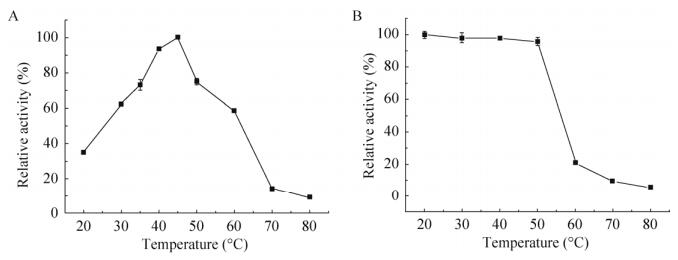 |
| 图 5 木聚糖酶的最适温度和热稳定性 Fig. 5 The optimal temperature and thermostability of XynA. (A) Optimal temperature. (B) Thermostability. |
| 图选项 |
热稳定性:如图 5B所示,热稳定性测试结果表明该木聚糖酶在50 ℃前处理后残余酶活能保持在95%以上,在此温度范围内较为稳定。超过60 ℃,处理后残余酶活降低至20%及其以下,说明温度对该木聚糖酶影响明显。在20 ℃时木聚糖酶虽能保持稳定,但由于温度不适于催化,因此不能有效发挥酶活;而超过60 ℃时,酶活较低的原因除催化温度不适外,高温对酶本身有一定的损害,二者共同作用所致。
3 讨论谷氨酸棒杆菌作为氨基酸和有机酸的生产菌,是一种GRAS (Generally regarded as safe)菌,同时也是一种有潜力的外源蛋白表达宿主。利用谷氨酸棒杆菌作为宿主进行外源蛋白表达所需的表达元件来源广泛,本实验所用的表达载体中的关键元件均来自谷氨酸棒杆菌自身。第一顺反子的启动子AH6来自谷氨酸棒杆菌转录组中筛选到转录效果较强的内源启动子,结合合适的SD序列已经成功用于EGFP的表达。为了进一步验证该表达框能否用于其他外源蛋白的表达及能否结合信号肽进行分泌表达,我们用木聚糖酶作为测试蛋白,木聚糖酶在内源的AH6启动子和SD序列等元件作用下在谷氨酸棒杆菌表达之后,在内源的Sec依赖型信号肽CspB的引导下,成功分泌到胞外,说明谷氨酸棒杆菌内源元件组合能够用于木聚糖酶的分泌表达,并且分泌表达量高于胞内表达量。进一步验证了木聚糖酶适合于通过Sec途径进行分泌,和文献报道利用Sec型信号肽PorB分泌木聚糖酶一致[29]。木聚糖酶的分泌表达量在5 L发酵罐水平是摇瓶培养的3.4倍,说明扩大培养能有效提高木聚糖酶的生产,因为在培养过程中有补料添加和通氧等利于菌体生长的因素,这有利于木聚糖酶分泌和积累。而木聚糖酶的积累随着宿主生长变化而变化,可通过进一步的优化培养条件提高菌体的生长状况以进一步提高蛋白的分泌量。木聚糖酶种类多样,有酸性和碱性之分,本实验用的木聚糖酶属于酸性,等电点(pI)为酸性,最适pH为4.5在酸性范围内;在45 ℃时酶能发挥最大催化效率,并且在此温度下稳定性较好,有利于持续的酶活发挥。Liu等报道在法夫驹形氏酵母Komagataella phaffii中表达的来自黑曲霉Aspergillus niger的木聚糖酶产量为1 827.19 U/mL,该木聚糖酶的最适温度和最适pH分别为55 ℃和5.0[30],和本实验中的木聚糖酶有一定差异,可能是酶的来源及结构不同所致。不同木聚糖酶之间酶学性质差异较大,不同来源的木聚糖酶其分子量、pI、最适催化pH和最适催化温度等已在Paes等综述中作了介绍[2]。
本研究提供了一种利用谷氨酸棒杆菌的内源元件构建双顺反子表达载体,用于木聚糖酶的分泌表达,验证了AH6启动子能够用于除EGFP之外的蛋白的表达,并且能够在合适的信号肽引导下进行分泌表达。至于本表达体系能否用于其他蛋白的分泌表达,有待于进一步的研究;并且AH6启动子并非是最强启动子,若要进一步提高蛋白的表达量,可以通过更换较强的启动子进行调节。此外,密码子的优化、合适的SD序列、强信号肽的选择、宿主的改造如分泌过程中障碍的减少都能有助于蛋白的分泌。
参考文献
| [1] | Juturu V, Wu JC. Microbial xylanases: engineering, production and industrial applications.Biotechnol Adv, 2012, 30(6): 1219–1227.DOI: 10.1016/j.biotechadv.2011.11.006 |
| [2] | Pa?s G, Berrin JG, Beaugrand J. GH11 xylanases: structure/function/properties relationships and applications.Biotechnol Adv, 2012, 30(3): 564–592.DOI: 10.1016/j.biotechadv.2011.10.003 |
| [3] | Chen AN, Sun Y, Zhang W, et al. Downsizing a pullulanase to a small molecule with improved soluble expression and secretion efficiency in Escherichia coli.Microb Cell Fact, 2016, 15(1): 9.DOI: 10.1186/s12934-015-0403-5 |
| [4] | Guan CR, Cui WJ, Cheng JT, et al. Construction and development of an auto-regulatory gene expression system in Bacillus subtilis.Microb Cell Fact, 2015, 14(1): 150.DOI: 10.1186/s12934-015-0341-2 |
| [5] | Meissner D, Vollstedt A, van Dijl JM, et al. Comparative analysis of twin-arginine (Tat)-dependent protein secretion of a heterologous model protein (GFP) in three different Gram-positive bacteria.Appl Microbiol Biotechnol, 2007, 76(3): 633–642. |
| [6] | Hermann T. Industrial production of amino acids by coryneform bacteria.J Biotechnol, 2003, 104(1/3): 155–172. |
| [7] | Zhang XM, Dou WF, Xu HY, et al. Metabolic flux analysis L-serine synthesis by Corynebacterium glutamicum SYPS-062.Chin J Biotech, 2010, 26(10): 1363–1371.(in Chinese). 张晓梅, 窦文芳, 许泓瑜, 等. 谷氨酸棒杆菌SYPS-062合成L-丝氨酸的代谢通量分析.生物工程学报, 2010, 26(10): 1363-1371. |
| [8] | Huan XJ, Li K, Shi F, et al. Overexpression of Corynebacterium glutamicum NAD kinase improves the L-isoleucine biosynthesis.Chin J Biotech, 2012, 28(9): 1038–1047.(in Chinese). 还晓静, 李坤, 史锋, 等. 谷氨酸棒杆菌NAD激酶的过表达对L-异亮氨酸合成的促进作用.生物工程学报, 2012, 28(9): 1038-1047. |
| [9] | Liu XX, Zhang W, Zhao ZH, et al. Protein secretion in Corynebacterium glutamicum.Crit Rev Biotechnol, 2017, 37(4): 541–551.DOI: 10.1080/07388551.2016.1206059 |
| [10] | Kalinowski J, Bathe B, Bartels D, et al. The complete Corynebacterium glutamicum ATCC 13032 genome sequence and its impact on the production of L-aspartate-derived amino acids and vitamins.J Biotechnol, 2003, 104(1/3): 5–25. |
| [11] | Zhao ZH, Liu XX, Zhang W, et al. Construction of genetic parts from the Corynebacterium glutamicum genome with high expression activities.Biotechnol Lett, 2016, 38(12): 2119–2126.DOI: 10.1007/s10529-016-2196-y |
| [12] | Liu XX, Zhao ZH, Sun Y, et al. Selection of endogenous expression elements from Corynebactrium glutamicum.Microbiol China, 2016, 43(8): 1671–1678.(in Chinese). 刘秀霞, 赵子豪, 孙杨, 等. 谷氨酸棒杆菌内源表达元件的筛选.微生物学通报, 2016, 43(8): 1671-1678. |
| [13] | Yim SS, An SJ, Choi JW, et al. High-level secretory production of recombinant single-chain variable fragment (scFv) in Corynebacterium glutamicum.Appl Microbiol Biotechnol, 2014, 98(1): 273–284. |
| [14] | Zou YL, Chen T, Feng LL, et al. Enhancement of 5-aminolevulinic acid production by metabolic engineering of the glycine biosynthesis pathway in Corynebacterium glutamicum.Biotechnol Lett, 2017, 39(9): 1369–1374.DOI: 10.1007/s10529-017-2362-x |
| [15] | Zhang SH, Liu DY, Mao ZT, et al. Model-based reconstruction of synthetic promoter library in Corynebacterium glutamicum.Biotechnol Lett, 2018, 40(5): 819–827.DOI: 10.1007/s10529-018-2539-y |
| [16] | Liu YH, Lin S, Liu K, et al. High-level expression of the Streptomyces mobaraense CICC 11018 transglutaminase in Corynebacterium glutamicum ATCC 13032.Appl Biochem Microbiol, 2014, 50(5): 456–462.DOI: 10.1134/S0003683814050068 |
| [17] | Rytter JV, Helmark S, Chen J, et al. Synthetic promoter libraries for Corynebacterium glutamicum.Appl Microbiol Biotechnol, 2014, 98(6): 2617–2623.DOI: 10.1007/s00253-013-5481-x |
| [18] | Yim SS, An SJ, Kang M, et al. Isolation of fully synthetic promoters for high-level gene expression in Corynebacterium glutamicum.Biotechnol Bioeng, 2013, 110(11): 2959–2969.DOI: 10.1002/bit.24954 |
| [19] | Zhang W, Zhao ZH, Yang YK, et al. Construction of an expression vector that uses the aph promoter for protein expression in Corynebacterium glutamicum.Plasmid, 2017, 94: 1–6.DOI: 10.1016/j.plasmid.2017.09.001 |
| [20] | Shi F, Luan MY, Li YF. Ribosomal binding site sequences and promoters for expressing glutamate decarboxylase and producingγ-aminobutyrate in Corynebacterium glutamicum.AMB Express, 2018, 8(1): 61.DOI: 10.1186/s13568-018-0595-2 |
| [21] | Kikuchi Y, Date M, Itaya H, et al. Functional analysis of the twin-arginine translocation pathway in Corynebacterium glutamicum ATCC 13869.Appl Environ Microbiol, 2006, 72(11): 7183–7192.DOI: 10.1128/AEM.01528-06 |
| [22] | Suzuki N, Watanabe K, Okibe N, et al. Identification of new secreted proteins and secretion of heterologous amylase by C. glutamicum.Appl Microbiol Biotechnol, 2009, 82(3): 491–500.DOI: 10.1007/s00253-008-1786-6 |
| [23] | Watanabe K, Tsuchida Y, Okibe N, et al. Scanning the Corynebacterium glutamicum R genome for high-efficiency secretion signal sequences.Microbiology, 2009, 155: 741–750.DOI: 10.1099/mic.0.024075-0 |
| [24] | van der Rest ME, Lange C, Molenaar D. A heat shock following electroporation induces highly efficient transformation of Corynebacterium glutamicum with xenogeneic plasmid DNA.Appl Microbiol Biotechnol, 1999, 52(4): 541–545.DOI: 10.1007/s002530051557 |
| [25] | Liu XX, Zhao ZH, Zhang W, et al. Bicistronic expression strategy for high-level expression of recombinant proteins in Corynebacterium glutamicum.Eng Life Sci, 2017, 17(10): 1118–1125.DOI: 10.1002/elsc.201700087 |
| [26] | Mart??n JF, Barreiro C, González-Lavado E, et al. Ribosomal RNA and ribosomal proteins in corynebacteria.J Biotechnol, 2003, 104(1/3): 41–53. |
| [27] | Mutalik VK, Guimaraes JC, Cambray G, et al. Precise and reliable gene expression via standard transcription and translation initiation elements.Nat Methods, 2013, 10(4): 354–360.DOI: 10.1038/nmeth.2404 |
| [28] | Matsuda Y, Itaya H, Kitahara Y, et al. Double mutation of cell wall proteins CspB and PBP1a increases secretion of the antibody Fab fragment from Corynebacterium glutamicum.Microb Cell Fact, 2014, 13(1): 56.DOI: 10.1186/1475-2859-13-56 |
| [29] | An SJ, Yim SS, Jeong KJ. Development of a secretion system for the production of heterologous proteins in Corynebacterium glutamicum using the Porin B signal peptide.Protein Expr Purif, 2013, 89(2): 251–257.DOI: 10.1016/j.pep.2013.04.003 |
| [30] | Liu TY, Zhang JG. High-level expression and characterization of Aspergillus niger ATCC 1015 xylanase B in Komagataella phaffii.Appl Biolog Chem, 2018, 61(4): 373–381.DOI: 10.1007/s13765-018-0368-2 |
