高红1, 盛剑2, 白旭2, 康宝铃2, 孙欢欢2, 孙海峰2

 , 曹秋芬3
, 曹秋芬3

1. 山西大学黄土高原研究所, 山西 太原 030006;
2. 山西大学化学化工学院, 山西 太原 030006;
3. 山西农业大学生命科学学院, 山西 太原 030031
收稿日期:2019-10-30;修回日期:2020-02-12;网络出版日期:2020-02-23
基金项目:山西省黄芪资源产业化及产业国际化协同创新中心项目(HQXTCXZX2016-002,HQXTCXZX2016-003);国家重点研发技术项目(2019YFC1710800)
*通信作者:孙海峰, Tel:+86-351-7010588;E-mail:haifeng@sxu.edu.cn;
曹秋芬, E-mail:qiufengcao@163.com.
摘要:[目的] 分离、鉴定浑源黄芪内生细菌,筛选潜在促生菌,并研究绿叶挥发物对其生长的影响。[方法] 以山西浑源7年生传统采收期黄芪为材料,采用平板培养法分离内生菌,16S rRNA基因序列进行菌株鉴定;通过培养基中添加1-氨基环丙烷-1-羧酸(1-aminocyclopropane-1-carboxylate,ACC)、色氨酸及缺氮素培养的方式进行含ACC脱氨酶、吲哚乙酸产生及固氮菌初筛;通过培养基中添加Ca3(PO4)2、钾长石的方式进行解磷、解钾菌初筛;电感耦合等离子体质谱等方法进行定量;通过液体培养基中添加绿叶挥发物的方式,研究其对含ACC脱氨酶菌株的影响;利用顶空气相色谱-质谱法测定黄芪绿叶挥发物含量。[结果] 从浑源黄芪根中分离得85株代表性内生菌株,分别属于变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)和拟杆菌门(Bacteroidetes)的13个属,其中假单胞菌属(Pseudomonas)、泛菌属(Pantoea)和葡萄球菌属(Staphylococcus)菌株数量较高,占分离菌株总数的80.00%。筛选获得的促生菌中,具有吲哚乙酸合成能力的菌株所占比例最高(69.41%),其次为含ACC脱氨酶和具有固氮活性的菌株,分别占分离菌株的40.00%和31.76%,而解磷、解钾菌株所占比例较低(分别为14.12%、7.06%);双重促生效应菌株中,兼具吲哚乙酸合成与含ACC脱氨酶菌株所占比例最高(37.65%),其次为兼具吲哚乙酸合成和固氮活性、兼具含ACC脱氨酶和固氮活性的菌株,分别占分离菌株的28.24%和24.71%,兼具含ACC脱氨酶和解钾活性的菌株占比最低(1.18%)。2-50 μmol/L正己醛和Z-3-己烯醛、5-125 μmol/L正己醇具有促进部分含ACC脱氨酶内生菌株生长的作用。[结论] 吲哚乙酸产生和含ACC脱氨酶的内生菌株占比高、绿叶挥发物促生菌的存在很可能是浑源黄芪内生菌群适应栖息地独特生境的产物,绿叶挥发物很可能是影响浑源黄芪内生菌群组成与功能的重要因素之一。
关键词:黄芪内生菌群促生菌筛选绿叶挥发物
Composition and function of endophytic bacteria residing the root tissue of Astragalus mongholicus in Hunyuan
Hong Gao1, Jian Sheng2, Xu Bai2, Baoling Kang2, Huanhuan Sun2, Haifeng Sun2

 , Qiufen Cao3
, Qiufen Cao3

1. Institute of Loess Plateau, Shanxi University, Taiyuan 030006, Shanxi Province, China;
2. College of Chemistry and Chemical Engineering, Shanxi University, Taiyuan 030006, Shanxi Province, China;
3. College of Life Science, Shanxi Agricultural University, Taiyuan 030031, Shanxi Province, China
Received: 30 October 2019; Revised: 12 February 2020; Published online: 23 February 2020
*Corresponding author: Haifeng Sun, Tel:+86-351-7010588;E-mail:haifeng@sxu.edu.cn;
Qiufen Cao, E-mail:qiufengcao@163.com.
Foundation item: Supported by the Collaborative Innovation Center of Astragali Radix Resource Industrialization and Internationalization (HQXTCXZX2016-002, HQXTCXZX2016-003) and by the National Key R&D Program of China (2019YFC1710800)
Abstract: [Objective] This study aimed to isolate and screen bacterial endophytes with potential plant growth-promoting activities from Astragali Radix, and to explore effects of green leaf volatiles (GLVs) on the endophytes. [Methods] Plate culture method was used to isolate bacterial endophytes from the root tissue of 7-year old plants of A. mongholicus in Hunyuan, Shanxi, China and 16S rRNA gene sequencing was used to identify the isolates. The screening for plant growth-promoting endophytes was performed by adding exogenous 1-aminocycline-1-carboxylic acid (ACC), tryptophan, calcium phosphate and feldspar into the medium and by incubation in the medium lacking nitrogen source, further quantification was carried out by inductively coupled plasma mass spectrometry (ICP-MS) and spectrophotometry. Effect of the main GLVs in Astragali Radix on the isolates was investigated by adding synthetic chemicals into the liquid medium and the ten isolates containing ACC deaminase were used as representative strains. Headspace GC-MS was performed to determine the contents of the main GLVs in Astragali Radix. [Results] A total of 85 bacterial strains were obtained and classified into the follow phyla:Proteobacteria, Firmicutes, actinobacteria and Bacteroides. At the genus level, they were categorized into 13 genera and the stains of Pseudomonas, Pantoea and Staphylococcus were more abundant (80.00%) than the ones of the others. Among candidate plant growth-promoting isolates, these that can synthesize indoleacetic acid (IAA) shared the biggest proportion (69.41%), followed by these with ACC deaminase (40.00%) and nitrogen fixation activity (31.76%), and these that can solubilize phosphorus and potassium shared relatively lower proportions (i.e., 14.12% and 7.06%). Among the isolates with double plant growth-promoting activities, the IAA-producing strains containing ACC deaminase shared the biggest proportion (37.65%), followed by the IAA-producing strains with nitrogen fixation activity and the strains with ACC deaminase and nitrogen fixation activity, accounting for 28.24% and 24.71%, respectively, while these that not only contain ACC deaminase but can solubilize potassium bearing minerals shared the smallest part (1.18%). Besides, low concentrations of GLVs (i.e., 2-50 μmol/L of hexanal and Z-3-hexenal, and 5-125 μmol/L hexanol) exerted positive effects on the growth of a few strains with ACC deaminase. [Conclusion] There were bigger proportions of the isolates that can produce IAA and/or contain ACC deaminase and GLV growth-promoting strains in the bacterial community residing the root tissue of A. mongholicus in Hunyuan, which might be resulted from the local adaptation. GLVs might be involved in the shaping of the composition and function of endophytic communities in Astragali Radix in Hunyuan.
Keywords: Astragali Radixendophytic bacteriaplant growth-promotionscreeninggreen leaf volatiles
内生菌是栖居在植物组织内部、以宿主植物代谢物为营养物质的一类微生物。通过增加植物养分获取、改善土壤结构、诱导植物防御应答、合成抗生素和植物生长类激素物质或酶等方式,内生菌在植物生长、防御应答等过程中发挥着积极作用[1-2]。此外,内生菌还具有促进药用植物活性成分合成积累的作用。如Li等发现,从黄花蒿分离的一株内生细菌具有促进青蒿素积累的作用[3];Zhou等发现,内生荧光假单胞菌(Pseudomonas fluorescens ALEB7B)通过触发活性氧产生的方式,具有增加苍术(Atractylodes lancea)氧化性倍半萜种类和含量的作用[4]。挖掘药用植物内生菌资源,发现其有益功能,对于中药材活性成分合成积累机制研究、中药材生态种植具有重要意义。
已有研究表明,植物微生物装配驱动不仅受环境、土壤因素影响,还与植物因素如水分、营养素的释放及次生代谢物的产生有关。通过对比两种百里香植物叶片、根及根际土壤可培养细菌组成,Checcucci等发现叶腺挥发油是影响内生菌群组成的重要因素之一,富含挥发油的叶片菌群多样性指数高[5]。众所周知,中药材品质与产地息息相关,产自道地产区的药材即道地药材除品质佳、临床疗效好外,有的还含有较高水平的挥发性有机化合物,其影响是否会在药用植物内生菌群组成及功能上有所体现?
黄芪为豆科植物蒙古黄芪Astragalus membranaceus (Fisch.) Bge. var. mongholicus (Bge.) Hsiao或膜荚黄芪Astragalus membranaceus (Fisch.) Bge的干燥根,是一味临床使用率极高的中药,产于我国北方各地。其中,产自山西浑源、应县等恒山山脉周边的黄芪,属道地药材,不仅药材品质佳,也含有较高水平的绿叶挥发物[6]。基于16S rRNA高通量测序技术的前期研究已揭示,浑源黄芪根细菌菌群多样性较高,产地独特的细菌分类单元(operational taxonomic units,OTUs)数较高[7]。但是,浑源黄芪可培养内生菌群组成与功能如何?绿叶挥发物影响如何?目前还不清楚。
本研究以7年生浑源黄芪为研究材料,首先采用平板培养法进行内生菌的分离及潜在促生菌的筛选,再以含ACC脱氨酶的内生菌株为代表,分析浑源黄芪主要绿叶挥发物对内生菌生长的影响;最后,通过基于根解剖学结构的黄芪绿叶挥发物含量数据,佐证黄芪内源绿叶挥发物促进其内生菌生长的作用。研究结果表明,中药材挥发物很可能是影响药用植物微生物招募及其功能的重要因素,中药材种植与田间管理应重视与挥发物具协同作用的内生菌资源挖掘与利用。
1 材料和方法 1.1 植物样品 山西浑源7年生黄芪,经山西医科大学高建平教授鉴定为蒙古黄芪。田间采集时,挑取健康、无病害症状的根,将其装入无菌塑料袋中,低温运至实验室(24 h内)。在实验室中,用自来水冲洗干净根表面附着的土后,将样本分成2份,一份立即用于内生菌分离;另一份置于冰上,按其解剖学结构,剥离为周皮、次生韧皮部和次生木质部,-80 ℃保存,用于绿叶挥发物的定量分析。
1.2 试剂 1-氨基环丙烷-1-羧酸(ACC)、正己醛、Z-3-己烯醛和正己醇购自Sigma-Aldrich(德国);Taq?酶等分子生物学用试剂购自大连宝生物。
1.3 内生菌株分离与纯化 参照文献报道方法[8],进行黄芪根表面消毒及内生菌分离。根据菌落长出时间及菌落特征,挑选代表性单菌落,转接于新的LB固体培养基上,进行纯化培养,直至获得菌落特征完全一致的单菌落,视为已纯化内生菌株。确定菌株编号并接种于LB液体培养基中,30 ℃、180 r/min摇床培养至对数生长后期(OD600=1.8-2.0),-80 ℃保存(内含20%甘油)。
1.4 内生菌株鉴定 利用16S rRNA基因序列进行菌株鉴定。无菌牙签沾取细菌培养物少许,混悬于50 μL无菌水中,100 ℃裂解5 min,作为PCR扩增用模板;利用1492R和27F引物对,进行PCR扩增。PCR反应体系组成、反应条件及引物序列见文献[8]。PCR产物经1.0%琼脂糖凝胶电泳检测确认后,委托中美泰和进行双向测序,获得的序列经BLAST软件在线比对(https://blast.ncbi.nlm.nih.gov),获得序列相似度数据,鉴定菌株至属或种。
1.5 潜在促生菌筛选 参照文献报道方法[9],进行含ACC脱氨酶菌株筛选。鉴于固氮菌在含/不含ACC的DF培养基上均可生长,筛选时,设置不含ACC和(NH4)2SO4的DF盐培养基对照。连续传代5次后,在含ACC和不含氮源的DF培养基上均可生长者,具有固氮活性;仅在含ACC的培养基上生长者,含ACC脱氨酶。
参照文献报道方法[10],进行产吲哚乙酸(IAA)菌株初筛以及IAA合成量的定量分析。利用Pikovskaya固体培养基进行解磷菌初筛,钼蓝法定量分析解磷活性[11]。参照Anjanadevi等报道方法[12],进行解钾菌初筛,电感耦合等离子体质谱法定量分析解钾活性。
1.6 黄芪主要绿叶挥发物对含ACC脱氨酶内生菌生长的影响 以50%乙醇(V/V)为溶剂,配制绿叶挥发物储备液,-20 ℃保存。按1‰ (V/V)的量添加于DF盐液体培养基中,再接种1‰ (V/V)液体培养物(处于对数生长期后期),28 ℃、180 r/min摇床培养至对数生长期后期,测定OD600。以正常培养物为正常对照,添加1‰ (V/V) 50%乙醇者为溶剂对照,每组生物学重复3次。以正常对照组OD600为参照,计算溶剂对照(vehicle control,VC)和绿叶挥发物处理组菌株相对生长率,即相对生长率=OD600,VC/处理组/ OD600,正常对照。
鉴于醛类挥发物抑菌活性强于醇类[13],醛类挥发物浓度梯度设置如下:2、10、50、250、1250和6250 μmol/L,醇类挥发物为:5、25、125、625、3125和6250 μmol/L。
1.7 黄芪主要绿叶挥发物定量分析 液氮研磨样品呈粉末,精密称定0.20 g,转移至20 mL顶空瓶中,密封,置于TriPlus 300顶空进样器(Thermo Fisher)中25 ℃平衡20 min,顶空进样于TRACETM 1300气相色谱-ISQTM质谱仪。进样量:1 mL;色谱柱:TR-5(0.25 μm×0.25 mm× 30 m)。
色谱条件:进样口温度:230 ℃;载气:氦气;流速:1.1 mL/min;升温程序:30 ℃ 2 min,1 ℃/min升至38 ℃,20 ℃/min升至250 ℃,250 ℃ 5 min。
质谱条件:汽化室温度:250 ℃;电子能量:70 eV;离子源温度:230 ℃;四极杆温度:150 ℃;m/z扫描范围:30-500;进样模式:非分流模式。选择性离子监测模式进行定量分析,扫描时间:0.20 s;定量离子信息:Z-3-己烯醛为83,正己醛为72,正己醇为69。
1.8 数据处理 菌株活性定量分析数据、相对生长率及绿叶挥发物含量以平均值±标准偏差形式表示。采用GraphPad Prism 7.01进行制图,利用IBM SPSS Statistics(v25)进行单因素方差分析,阈值设定为P≤0.05。
2 结果和分析 2.1 浑源黄芪内生细菌菌群组成分析 从黄芪根部共分离得85株内生细菌。基于16S rRNA基因序列分析表明,所有菌株的序列同源性与现有数据库相似度均大于99%,鉴定为已知种属,分属4个门和13个属。在门水平,67株属变形菌门(Proteobacteria),在分离菌株中所占比例最高,为78.82%;8株属厚壁菌门(Firmicutes)、7株属放线菌门(Actinobacteria),分别占分离菌株总数的9.41%和8.24%;3株属拟杆菌门(Bacteroidetes),所占比例最小(3.53%)。相关序列已提交GenBank,登录号分别为KY633768、KY633769、KY634236、KY634241、KY634419、KY634431、KY636436、KY636441-KY636443、MN954231-MN954287。
属水平的分离菌株分布见图 1。从该图可以看出,泛菌属(Pantoea)菌株占比最高,达45.88%,有39株;其次为假单胞菌属(Pseudomonas)菌株,占分离菌株总数的25.88%(22株);再次为葡萄球菌属(Staphylococcus)菌株(7株),占分离菌株的8.24%。节杆菌属(Arthrobacter)、不动杆菌属(Acinetobacter)和黄杆菌属(Flavobacterium)菌株所占比例较低,分别为3.53%、3.53%和2.35%。此外,还包括欧文氏菌属(Erwinia)、寡养单胞菌属(Stenotrophomonas)、贪噬菌属(Variovorax)、色杆菌属(Chryseobacterium)、微杆菌属(Microbacterium)和植物杆菌属(Plantibacter)菌株各1株(1.18%)。
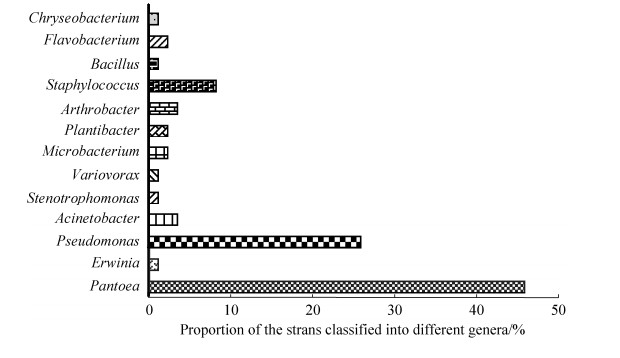 |
| 图 1 属水平上的浑源黄芪内生细菌菌株分布 Figure 1 Distribution of the bacterial isolates from Astragali Radix in Hunyuan, Shanxi, China at the genus level. |
| 图选项 |
2.2 潜在促生菌筛选及其组成分析 筛选结果表明,59株可以合成植物生长类激素吲哚乙酸,占分离菌株的69.41%;根据Salkowski试剂显色结果,选取其中36株进行吲哚乙酸合成量的定量分析,进一步筛选得6株合成量高于20 mg/L的菌株;其中菌株H61吲哚乙酸合成量最高,为32.09±1.25 mg/L。含ACC脱氨酶的内生菌株34株,占分离菌株的40.00%;具有固氮活性的菌株27株,占分离菌株的31.76%。相对而言,具有解磷和解钾活性的内生菌株所占比例较小,分别为14.12% (12株)和7.06% (6株);定量分析表明,菌株H78解磷活性最高,培养至对数生长后期,培养液中可溶性磷含量为126.36±9.79 mg/L;菌株H17解钾活性最高,培养至对数生长后期,培养液中可溶性钾含量为14.23±0.23 mg/L。
属水平的促生分离菌株的分布特征见图 2。就筛选涉及的5种促生效应而言,泛菌属促生菌株所占比例均为最高,其中含ACC脱氨酶的分离菌株占比最高,达70.58%,占比最低的解钾菌所占比例亦高达33.33%;其次为假单胞菌属促生菌,其中解钾菌占比最高,为33.33%,含ACC脱氨酶的菌株占比最低,为14.71%。此外,本实验分离获得的芽孢杆菌属和黄杆菌属细菌菌株中,未筛选得到具潜在促生效应的菌株。
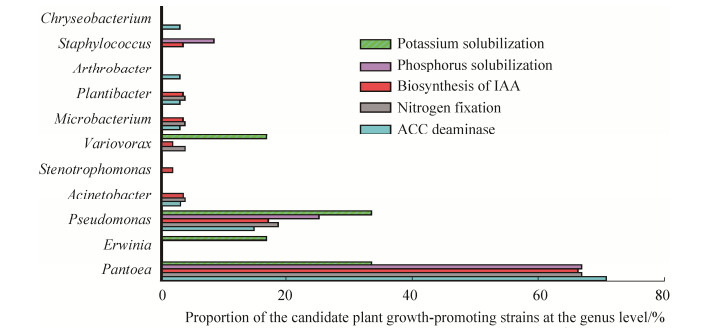 |
| 图 2 属水平的植物生长促进分离菌株分布 Figure 2 Distribution of the candidate plant growth-promoting isolates at the genus level. |
| 图选项 |
在上述分析的基础上,我们进一步统计了兼具吲哚乙酸产生、含ACC脱氨酶及其他促生活性的菌株。结果表明,兼具吲哚乙酸产生和含ACC脱氨酶的菌株数量最高(32株),占分离菌株的37.65%;其次为兼具吲哚乙酸产生和固氮活性的菌株(24株),占分离菌株的28.24%;兼具含ACC脱氨酶和固氮活性的菌株数量也比较高(21株),占分离菌株的24.71%;兼具含ACC脱氨酶和解钾活性的菌株数量最少,仅1株。
2.3 绿叶挥发物对含ACC脱氨酶菌株生长的影响 在植物-内生菌共生体系中,含ACC脱氨酶的内生菌可以利用乙烯合成前体ACC作为营养源,阻断植物体内乙烯的合成,在缓解宿主植物环境胁迫中发挥作用[10]。绿叶挥发物是植物在受到昆虫啃食、辐射等环境胁迫时,细胞膜损伤产生的游离不饱和脂肪酸,在脂肪氧合酶、脂肪酸氢过氧化物裂解酶催化作用下形成的C6挥发醛、醇及其酯化产物,不仅与植物特有气味如“青草味”、“豆腥味”形成有关,更是植物化学防御体系的重要信号分子[14]。基于顶空GC-MS技术的挥发性有机化合物谱表征表明,浑源黄芪中主要含有的绿叶挥发物有正己醛、正己醇和Z-3-己烯醛,属黄芪主要挥发物(未发表数据)。基于此,选取10株含ACC脱氨酶的内生菌株为代表,研究绿叶挥发物对黄芪根内生菌生长的影响,结果见图 3。
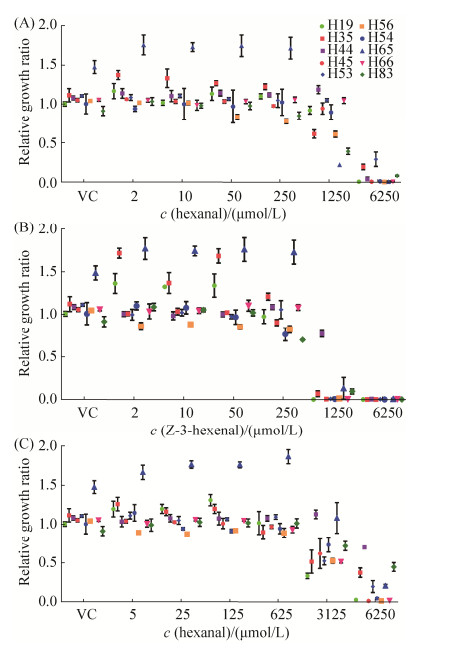 |
| 图 3 浑源黄芪主要绿叶挥发物对含ACC脱氨酶的10株内生菌株生长的影响 Figure 3 Effects of main green leaf volatiles in Astragali Radix in Hunyuan on the growth of the ten strains with ACC deaminase. Relative growth ratios of the strains in the vehicle control (VC) and treated groups with different concentrations of green leaf volatiles were calculated using the average OD600 of the normal control as reference. The icons in the rectangle frame correspond to the different strains examined. VC: vehicle control; A: hexanal; B: Z-3-hexenal; C: hexanol. |
| 图选项 |
就最高浓度处理组(6250 μmol//L)而言,正己醛处理组生长的菌株数量为3,分别是H35、H53和H82;正己醇处理组生长的菌株包括H35、H44、H53、H65和H82,共5株;而Z-3-己烯醛处理组无菌株生长。就1250 μmol//L处理组而言,10株菌在含正己醛的培养液中均有不同程度的生长,且菌株H44相对生长率明显高于溶剂对照;而Z-3-己烯醛处理组中,仅有3株菌(H35、H65和H82)生长。该结果提示,较高浓度的Z-3-己烯醛抑菌作用较正己醛强,正己醇抑菌作用最弱,与文献报道一致[13]。当培养液中正己醛和Z-3-己烯醛浓度较低(2、10、50 μmol/L)时,二者对菌株H19、H35、H65生长表现出明显的促进作用。此外,低、中浓度的正己醇(5、25、125 μmol/L)对上述3菌株生长亦具有明显的促进作用,培养液中正己醇浓度高达625 μmol/L时,对菌株H65生长还具有明显的促进作用。
2.4 浑源黄芪主要绿叶挥发物含量分析 已有研究表明,植物根微生物装配不仅与土壤、生物地理因素有关,亦与其解剖学部位有关[15]。分析不同解剖学部位中的挥发物组成和含量变化,将有助于阐释该问题。传统采收期早、晚两时间点浑源黄芪周皮、次生韧皮部、次生木质部中3种绿叶挥发物含量测定结果见表 1。从表中数据可以看出,9月28日采集的样本中均可以检测到正己醛,且周皮中含量最高(155.36±43.79 μmol/kg,鲜重),次生韧皮部含量最低(95.94±10.20 μmol/kg),次生木质部含量介于二者之间(116.03±17.42 μmol/kg),而10月17日采集的样本中均未检测到该挥发物。
表 1. 浑源黄芪主要绿叶挥发物含量(μmol/kg,鲜重) Table 1. The contents of main green leaf volatiles (μmol/kg, fresh weight) in different parts of Astragali Radix in Hunyuan
| Anatomical parts | Date of sampling | Hexanal | Z-3-hexenal | Hexanol |
| Periderm | 2018.09.28 | 155.36±43.79a | 69.88±8.36b | 21.60±2.08b |
| 2018.10.17 | — | 39.93±3.46 | 25.28±4.37b | |
| Secondary phloem | 2018.09.28 | 95.94±10.20b | 204.61±50.37a | 23.14±4.31b |
| 2018.10.17 | — | 38.41±1.60 | 22.50±1.10b | |
| Secondary xylem | 2018.09.28 | 116.03±17.42ab | 198.52±49.89a | 31.59±2.10a |
| 2018.10.17 | — | 40.70±5.12 | 76.35±15.99a |
表选项
与正己醛不同的是,两个取样时间点样本中均可以检测到Z-3-己烯醛和正己醇。9月28日采集的样本中,次生韧皮部和木质部中Z-3-己烯醛含量较高,分别为204.61±50.37 μmol/kg和198.52±49.89 μmol/kg,周皮中的含量较低,为69.88±8.36 μmol/kg。10月17日采集的样本中,虽然都可以检测到Z-3-己烯醛,但与9月28日采集的样本对应部位相比,含量显著降低。正己醇含量数据分析表明,两个取样点样本中均可以检测到该挥发物,且在次生木质部的含量显著高于其他部位;10月17日采集样本中木质部正己醇含量(76.35±15.99 μmol/kg)明显高于9月28日对应部位(31.59±2.10 μmol/kg)。由此可以看出,黄芪绿叶挥发物含量受具体的采收时间点、根解剖学结构影响,存在含量减少、增加或检测不到的情况;浑源黄芪绿叶挥发物含量普遍低于250 μmol/kg,在本研究涉及的10株内生菌株可生长浓度范围内,也在具促生效应的绿叶挥发物浓度范围。
3 讨论 普遍的观点认为,中药材的道地性是在遗传因素、环境变化和人文因素的共同作用下产生的。除遗传因素外,特定地域的独特生境在道地药材品质形成中发挥着重要作用。通过综述内生菌与宿主植物关系,马昭等提出“不同产地独特的内生菌种群和群落结构特征很可能赋予了不同产地一些中药材独有的品质特点,在影响中药材道地性的诸多因素中,内生菌可能发挥着独特作用”[16]。本研究采用传统培养法,从7年生浑源黄芪中分离得85株内生菌中,59株可以合成吲哚乙酸,32株含ACC脱氨酶,27株具有固氮活性,兼具吲哚乙酸产生和含ACC脱氨酶或固氮活性的菌株数量亦较高,分别为30株和26株,兼具固氮活性和含ACC脱氨酶的菌株数量也比较高(22株);促生内生菌株所占比例较高,很可能与浑源黄芪内生细菌适应道地产区独特生境有关。
通过比较8种绿叶挥发物对临床致病菌生长的影响,Nakamura和Hatanaka发现,醛类挥发物杀菌效应强于醇,0.1 μg/mL和1 μg/mL (1-10 μmol/L) Z-3-己烯醛抑制金黄色葡萄球菌(Staphylococcus aureus) IFO 12732和大肠杆菌(E. coli) IFO 3301效应最佳[17]。Demirtas等发现,绿叶挥发物对牛瘤胃革兰氏阳性菌的抑菌效果优于革兰氏阴性菌,其中Z-3-己烯醛抑菌效应最佳,最小抑菌浓度为500 μg/mL (~5 mmol/L);187.5、375、750 mg/d的添加量,处理瘤胃14 d,Butyrivibrio fibrisolvens和Streptecoccus bovis数量明显增加,Ruminococcus albus和Ruminococcus flavefaciens数量较为稳定,提示Z-3-己烯醛具有选择性促进牛瘤胃微生物生长的作用[18]。在本研究中,我们分析了浑源黄芪主要绿叶挥发物对含ACC脱氨酶内生菌生长的影响,发现内生菌对低浓度绿叶挥发物响应有所不同,存在相对生长率明显增加的菌株。鉴于浑源黄芪在其自然生境中,根释放的绿叶挥发物浓度应低于其含量数据,我们推测浑源黄芪根中栖居着可以代谢、转化绿叶挥发物的内生菌株。通过对比盆栽拟南芥局部受损叶片中,损伤及完好无损部位绿叶挥发物谱,Matsui等提出,在无损伤部位Z-3-己烯醛还原为Z-3-己烯醇及其乙酸酯,有助于降低Z-3-己烯醛的毒性,利于健康细胞的生存[19]。因此,除植物自身的酶系统外,栖居的微生物亦可能参与绿叶挥发物特别是醛类挥发物的代谢转化,基于微生物-宿主植物互作的药用植物次生代谢物质合成积累研究中应重视挥发性有机化合物的潜在有益作用挖掘。
References
| [1] | Pańka D, Piesik D, Jeske M, Baturo-Cie?niewska A. Production of phenolics and the emission of volatile organic compounds by perennial ryegrass (Lolium perenne L.)/Neotyphodium lolii association as a response to infection by Fusarium poae. Journal of Plant Physiology, 2013, 170(11): 1010-1019. DOI:10.1016/j.jplph.2013.02.009 |
| [2] | Santhanam R, Luu VT, Weinhold A, Goldberg J, Oh Y, Baldwin IT. Native root-associated bacteria rescue a plant from a sudden-wilt disease that emerged during continuous cropping. Proceedings of the National Academy of Sciences of the United States of America, 2015, 112(36): E5013-E5020. DOI:10.1073/pnas.1505765112 |
| [3] | Li J, Zhao GZ, Varma A, Qin S, Xiong Z, Huang HY, Zhu WY, Zhao LX, Xu LH, Zhang S, Li WJ. An endophytic Pseudonocardia species induces the production of artemisinin in Artemisia annua. PLoS ONE, 2012, 7(12): e51410. DOI:10.1371/journal.pone.0051410 |
| [4] | Zhou JY, Yuan J, Li X, Ning YF, Dai CC. Endophytic bacterium-triggered reactive oxygen species directly increase oxygenous sesquiterpenoid content and diversity in Atractylodes lancea. Applied and Environmental Microbiology, 2016, 82(5): 1577-1585. DOI:10.1128/AEM.03434-15 |
| [5] | Checcucci A, Maida I, Bacci G, Ninno C, Bilia AR, Biffi S, Firenzuoli F, Flamini G, Fani R, Mengoni A. Is the plant-associated microbiota of Thymus spp. adapted to plant essential oil? Research in Microbiology, 2017, 168(3): 276-282. |
| [6] | Sun HF, Kang BL, Chai Z, Sun HH, Du HZ, Gao JP, Feng QJ, Zhang CF, Cao QF, Guo LP. Characterization of root-associated microbiota in medicinal plants Astragalus membranaceus and Astragalus mongholicus. Annals of Microbiology, 2017, 67(9): 587-599. DOI:10.1007/s13213-017-1285-z |
| [7] | Sun HF, Kang BL, Kang LP, Guo LP, Sun HH, Gao JP. Involvement of C6-volatiles in quality formation of herbal medicine: a case study in Astragalus membranaceus var. mongholicus. Journal of Applied Botany and Food Quality, 2017, 90: 214-223. |
| [8] | 康宝玲.山西黄芪根际及根微生物组初探.山西大学硕士学位论文, 2017. |
| [9] | Tian L, Jiang Y, Chen CQ, Zhang GJ, Li T, Tong B, Xu P. Screening and identification of an endophytic bacterium with 1-aminocyclopropane-1-carboxylate deaminase activity from Panax ginseng and its effect on host growth. Acta Microbiologica Sinica, 2014, 54(7): 760-769. (in Chinese) 田磊, 姜云, 陈长卿, 张冠军, 李桐, 佟斌, 许朋. 一株人参内生1-氨基环丙烷-1-1羧酸(ACC)脱氨酶活性细菌的筛选、鉴定及其对宿主生长的影响. 微生物学报, 2014, 54(7): 760-769. |
| [10] | Feng WW, Wu MX, Si YT, Xing K, Qin S, Jiang JH, Peng X. Screening and biodiversity of endophytic and rhizosphere bacteria containing ACC deaminase from halophyte Limonium sinense (Girard) Kuntze. Acta Microbiologica Sinica, 2016, 56(4): 719-728. (in Chinese) 冯维维, 武美贤, 司雨婷, 邢珂, 秦盛, 蒋继宏, 彭学. 中华补血草内生与根际具ACC脱氨酶活性细菌的筛选及其生物多样性. 微生物学报, 2016, 56(4): 719-728. |
| [11] | Murphy J, Riley JP. A modified single solution method for the determination of phosphate in natural waters. Analytica Chimica Acta, 1962, 27: 31-36. DOI:10.1016/S0003-2670(00)88444-5 |
| [12] | Anjanadevi IP, John NS, John KS, Jeeva ML, Misra RS. Rock inhabiting potassium solubilizing bacteria from Kerala, India: characterization and possibility in chemical K fertilizer substitution. Journal of Basic Microbiology, 2016, 56(1): 67-77. DOI:10.1002/jobm.201500139 |
| [13] | Gardner HW, Dornbos Jr DL, Desjardins AE. Hexanal, trans-2-Hexenal, and trans-2-nonenal inhibit soybean, Glycine max, seed germination. Journal of Agricultural and Food Chemistry, 1990, 38(6): 1316-1320. DOI:10.1021/jf00096a005 |
| [14] | Sun HF, Li ZY, Wu B, Qin XM. Review of recent advances on the production and eco-physiological roles of green leaf volatiles. Chinese Journal of Plant Ecology, 2013, 37(3): 268-275. (in Chinese) 孙海峰, 李震宇, 武滨, 秦雪梅. 绿叶挥发物产生特征及其生态生理作用研究进展. 植物生态学报, 2013, 37(3): 268-275. |
| [15] | Fitzpatrick CR, Copeland J, Wang PW, Guttman DS, Kotanen PM, Johnson MTJ. Assembly and ecological function of the root microbiome across angiosperm plant species. Proceedings of the National Academy of Sciences of the United States of America, 2018, 115(6): E1157-E1165. DOI:10.1073/pnas.1717617115 |
| [16] | Ma Z, Tang CC, Zhang C, Hu ZB, Wang LL, Li WK. The relationship between endophytes and host plants: implications for research on geoherbalism. Acta Universitatis Traditionis Medicalis Sinensis Pharmacologiaeque Shanghai, 2015, 29(6): 4-11. (in Chinese) 马昭, 唐承晨, 张纯, 胡之璧, 王莉莉, 黎万奎. 内生菌与宿主植物关系对中药材道地性研究的启示. 上海中医药大学学报, 2015, 29(6): 4-11. |
| [17] | Nakamura S, Hatanaka A. Green-leaf-derived C6-aroma compounds with potent antibacterial action that act on both Gram-negative and Gram-positive bacteria. Journal of Agricultural and Food Chemistry, 2002, 50(26): 7639-7644. DOI:10.1021/jf025808c |
| [18] | Demirtas A, Ozturk H, Sudagidan M, Keyvan E, Yavuz O, Gulay OY, Musa SAA. Effects of commercial aldehydes from green leaf volatiles (green odour) on rumen microbial population and fermentation profile in an artificial rumen (Rusitec). Anaerobe, 2019, 55: 83-92. DOI:10.1016/j.anaerobe.2018.11.001 |
| [19] | Matsui K, Sugimoto K, Mano J, Ozawa R, Takabayashi J. Differential metabolisms of green leaf volatiles in injured and intact parts of a wounded leaf meet distinct ecophysiological requirements. PLoS ONE, 2012, 7(4): e36433. DOI:10.1371/journal.pone.0036433 |
