王一成, 李燕, 张晶, 魏长龙


上海立龙生物科技有限公司, 上海 200030
收稿日期:2017-08-23;修回日期:2017-09-22;网络出版日期:2017-10-10
基金项目:科技型中小企业创新基金(上海市科委2016第63814号)
*通信作者:魏长龙, Tel/Fax: +86-21-34771044, E-mail: changlongwei@126.com
摘要:[目的]基于肠道微生物与宿主代谢的相互关系,研究不同配方的益生菌对小鼠肥胖的影响。[方法]50只C57BL/6J雄性小鼠随机平均分成10组,分别给予正常饲料、高脂饲料以及高脂饲料加8种不同配方的益生菌产品(50亿CFU/只),所有动物连续喂养9周,每周测量小鼠体重1次。最后一周测定空腹血糖、葡萄糖耐量试验(glucose tolerance test,GTT)、血脂相关指标,称取内脏重量,并留取小鼠盲肠内容物,提取小鼠肠道菌群总DNA,利用16S rDNA测序检测相关细菌含量。[结果]部分益生菌可引起小鼠体重增速加快,而部分益生菌可减缓小鼠肥胖和降低内脏脂肪重量,同时缓解高血脂症。丹尼斯克品牌益生菌配方组小鼠肠道中厚壁菌/拟杆菌比例(F/B)是正常饮食组的22.8倍,Akkermansia muciniphila(Akkermansia)细菌含量几乎为0;而菌拉丁品牌益生菌配方组小鼠F/B比例与正常饲料饮食组类似,Akkermansia含量为0.5%,为正常饮食对照组小鼠的一半左右。[结论]益生菌可影响小鼠体重和代谢,但不同配方的益生菌效果截然相反。特定的益生菌配方对肥胖和高血脂的改善可能是由于其选用的菌株本身的特性以及菌株之间的相互配比能够降低小鼠肠道中F/B比例以及升高Akkermansia的含量所带来的。此研究为进一步开发可改善代谢的益生菌产品提供了参考。
关键词: 肥胖 糖尿病 高脂血症 益生菌 肠道菌群 16S rDNA测序
Effects of different probiotics on mice obesity induced by high-fat diet
Wang Yicheng, Li Yan, Zhang Jing, Wei Changlong


Shanghai Lilong Biotechnology Co., Ltd., Shanghai 200030, China
Received 23 August 2017; Revised 22 September 2017; Published online 10 October 2017
*Corresponding author: Changlong Wei, Tel/Fax: +86-21-34771044, E-mail: changlongwei@126.com
Supported by Innovation Fund for Technology Based Firms (63814)
Abstract: [Objective]To study the effects of different probiotics on mice obesity based on the interaction between microbiota and host metabolism.[Methods]In total 50 C57BL/6J male mice were equally divided into 10 groups and fed with normal feed, high-fat feed and high-fat feed with eight different probiotics compositions (5 billion CFU/mice). All mice were continuously fed for nine weeks and weighted weekly. Fasting blood glucose, GTT, blood fat indexes and organ weight were measured at last week. Microbiota total DNA was extracted from cecum contents and sequenced by 16S rDNA sequencing.[Results]Some probiotic compositions accelerated mice body weight accumulation, whereas some probiotic compositions reduced obesity, decreased visceral fat and relieved hyperlipemia. Compared to the normal feed group, Firmicutes/Bacteroidetes (F/B) ratio was 22.8-fold in accelerated body weight group fed with Danisco probiotic, and none Akkermansia muciniphila (Akkermansia) was detected, while F/B ratio was similar and the Akkermansia content was 0.5% (half of normal feed group) in reduced obesity group fed with Junlading probiotic.[Conclusion]Some probiotics influence mice body weight and metabolism, but different compositions may lead to opposite effects. Specific probiotic composition improves obesity and hyperlipemia possibly by its selected strain characteristics and relative ratio through decreasing F/B ratio and increasing Akkermansia level in gut microbiota. This study contributes to developing metabolism-improving probiotic product in the future.
Key words: obesity diabetes hyperlipidemia probiotics gut microbiota 16S rDNA sequencing
随着社会的发展和人们生活水平提高,肥胖和糖尿病等与能量代谢相关的疾病发病率急剧提高。据世界卫生组织报道,从1980年以来,世界肥胖人数已经翻了一倍以上,截止2014年,18岁以上成年人中逾19亿人超重,其中超过6亿人肥胖[1]。肥胖是由于能量摄入超标以及代谢紊乱等因素造成的,其与心血管病,糖尿病,癌症等疾病的发生密切相关[2-3],心血管病是目前世界上导致死亡人数最多的疾病,而目前全球糖尿病人数也达到了4.22亿,这些慢性病及其并发症严重影响了人们的生活质量,给社会和家庭带来了沉重的负担,已经成为全球突出的社会问题。目前有大量的报道指出,肠道菌群和肥胖存在着很强的关联性。美国华盛顿大学医学院的Gordon等发现,普通小鼠和肠道内无菌小鼠(germ-free)同时喂养相同的食物(含57%的碳水化合物和5%的脂肪),2周后,普通小鼠比无菌小鼠多42%总脂肪含量和47%附睾脂肪含量,而能量摄入却比无菌小鼠低29%;随后研究者将普通小鼠肠道细菌接种到了无菌小鼠体内,喂食同样的食物,2周之后该组小鼠总脂肪含量增加了57%,附睾脂肪含量增加了61%,最终这两种小鼠的体重和甘油三酯等指标均没有差异[4]。该实验表明,肠道菌群可以帮助宿主消化食物,获得更多的热量。肠道菌群通过调节能量代谢来影响肥胖,在这一过程中菌群的组成结构也会产生变化,Ruth等研究发现,通过对5088份从小鼠肠道粪便中提取的细菌16S sDNA测序分析,发现肥胖小鼠(ob/ob)与瘦小鼠(ob/+)相比,拟杆菌门下降了50%,而厚壁菌门细菌含量却有很明显的提高[5]。同样Turnbaugh等发现肥胖人群肠道中的厚壁菌门比例明显高于正常人群,而拟杆菌门细菌比例却低于正常人群。在一年时间内对肥胖志愿者给予低脂肪低碳水化合物的食物,随着志愿者体重的减少,肠道里的厚壁菌门细菌比例减少,而拟杆菌门细菌比例得到了相应的增加[6]。
除此之外,有种叫Akkermansia muciniphila的细菌在肥胖人群肠道中的含量极低,研究者发现,ob/ob遗传性肥胖小鼠肠道中Akkermansia菌含量仅为正常小鼠的1/3300,高脂饮食诱导的肥胖小鼠肠道内Akkermansia菌仅为正常饮食小鼠的1/100。通过给予高脂饮食小鼠喂食活Akkermansia菌后其肠道中该菌的水平恢复正常。与对照组相比,喂食该菌后小鼠体重减轻、肠道屏障功能改善、胰岛素抵抗减轻。研究者得出结论,Akkermansia菌可逆转由高脂饮食导致的代谢紊乱[7],并且其改善血糖的作用是其自身合成一种蛋白质[8],通过反向调控人体的IFN-来实现的[9]。
以上结果说明,体重与肠道内的细菌组成结构有关。高脂饮食、高热量饮食打乱了肠道中正常的菌群平衡,因此,通过调节肠道菌群来治疗肥胖,从而改善肥胖带来的相应代谢类疾病,成为了目前医学研究的热点领域。
市面上可用于口服的益生菌产品组成主要有两大类,分别为双歧杆菌和乳杆菌。部分研究显示,服用益生菌可以让肥胖人群减肥,例如一种商品化益生菌产品VSL3#(Sigma-Tau Pharmaceuticals),其减肥原理在于益生菌可以提高肠道内短链脂肪酸和丁酸盐的含量,而这类物质可以刺激肠道L细胞释放GLP-1激素。GLP-1可以抑制胃肠道蠕动和胃液分泌,抑制食欲及摄食,延缓胃内容物排空;GLP-1还可作用于中枢神经系统(特别是下丘脑),从而使人体产生饱胀感和食欲下降,从而减少体重[10]。但同时也有报道显示益生菌并不能减肥,甚至还有增加体重和脂肪含量的作用[11-14];同时在一些肥胖伴随Ⅱ型糖尿病的病人肠道内还能检测到非常高含量的双歧杆菌[15]。因此,研究清楚不同的益生菌对身体的作用,寻找对肥胖等代谢类疾病合适有效的益生菌配方,是非常有必要的。本研究旨在探讨不同菌株、不同比例的益生菌混合物对于高脂饮食诱导小鼠肥胖和糖尿病的影响,从而确定具有自主知识产权的不同功效的益生菌配方。
1 材料和方法 1.1 材料
1.1.1 益生菌: 从网络和超市购入共计8种商品化益生菌产品,产品配方之间均存在较大差异,分别标记为配方A (科汉森品牌,含动物双歧杆菌BB-12,嗜酸乳杆菌LA-5),配方B (意大利某品牌,含瑞士乳杆菌,植物双歧杆菌,长双歧杆菌),配方C (法国某品牌,含鼠李糖乳杆菌,嗜酸乳杆菌),配方D (台湾某品牌,含鼠李糖乳杆菌,乳双歧杆菌,动物双歧杆菌),配方E (昂立品牌,含鼠李糖乳杆菌,乳双歧杆菌,植物乳杆菌,副干酪乳杆菌,干酪乳杆菌,短双歧杆菌,嗜酸乳杆菌,长双歧杆菌),配方F (菌拉丁品牌,含嗜酸乳杆菌,青春双歧杆菌,婴儿双歧杆菌,乳双歧杆菌,长双歧杆菌,植物乳杆菌),配方G (土耳其某品牌,含瑞士乳杆菌,两歧双歧杆菌,婴儿双歧杆菌),配方H (丹尼斯克品牌,含乳双歧杆菌Bi-07、嗜酸乳杆菌NCFM、乳双歧杆菌HN019)。
1.1.2 小鼠: C57BL/6J雄性小鼠购自上海灵畅实验动物有限公司,3周龄,体重(11±2) g,饲养于上海南方模式生物科技股份有限公司清洁级动物房。
1.1.3 主要试剂和仪器: ACCU-CHEK Active血糖试纸购自罗氏(Roche)公司,货号06656757;Research Diet D12492 60 kcal%高脂饲料,购自Research Diet公司,货号D12492;普通饲料购自上海普路腾生物科技有限公司,货号P1100;溶菌酶购自Sigma-Aldrich公司,货号62971;蛋白酶K购自MP公司,货号19504;Sysmex Chemix-180全自动生化分析仪;罗氏ACCU-CHEK Active血糖仪;Illumina Miseq PE300测序平台。
1.2 动物实验 将3周龄的C57BL/6J雄性小鼠经过3 d适应性饲养后,随机分成10组:正常饮食对照组(CON组,n=5),高脂饮食组(HFD组,n=5),高脂饮食加配方菌A组(HFD+A组,n=5),高脂饮食加配方菌B组(HFD+B组,n=5),高脂饮食加配方菌C组(HFD+C组,n=5),高脂饮食加配方菌D组(HFD+D组,n=5),高脂饮食加配方菌E组(HFD+E组,n=5),高脂饮食加配方菌F组(HFD+F组,n=5),高脂饮食加配方菌G组(HFD+G组,n=5),高脂饮食加配方菌H组(HFD+H组,n=5)。CON组给予正常小鼠饲料,HFD 9组均喂食高脂饲料。8组高脂饮食加配方益生菌组小鼠每天将冻干保存的对应益生菌混合物溶解在生理盐水中,灌胃体积按照100 μL/10 g小鼠体重计算,益生菌含量均调整为50亿CFU/只;CON组和HFD组用麦芽糊精代替益生菌,按照同样剂量灌注生理盐水。所有动物连续喂养9周,期间每周测定动物体重1次。
1.3 空腹血糖测定及葡萄糖耐量试验(glucose tolerance test,GTT) 第9周末所有动物禁食过夜后,小鼠剪尾取血测定空腹血糖;之后,每只小鼠按2 g/kg体重的剂量腹腔注射葡萄糖溶液(浓度为20%),在注射后的15、30、60、120 min分别测定血糖浓度。
1.4 血清血脂生化指标检测 小鼠测定GTT后恢复1周,乙醚麻醉小鼠,摘眼球取血1 mL,1500 r/min、4 ℃离心20 min分离出上层血清,用血液生化仪检测高密度脂蛋白(HDL-C)、低密度脂蛋白(LDL-C)、总胆固醇(TCHO)和甘油三酯(TG)的浓度。
1.5 组织称重检测 小鼠在取血后颈椎脱臼法处死,取盲肠、附睾脂肪、心脏、肾脏、脾脏、肝组织称重。
1.6 小鼠肠道菌群总DNA提取 取50–100 mg盲肠内容物,装在无菌EP管中,每管加入1 mL PBS将内容物充分打散重悬后,300 r/min、4 ℃离心5 min,取上清至新的EP管中,将上清12000 r/min、4 ℃离心1 min,弃上清,将沉淀用溶菌酶和蛋白酶K处理,之后用酚氯仿去除色素和蛋白等杂质,再用酒精沉淀,得到盲肠内容物中菌群总DNA,用Nano-100微量分光光度计测定浓度后,分装保存在–80 ℃冰箱,用于后续实验。
1.7 16S rDNA测序 将待测小鼠的DNA样本于冷藏条件下送至上海美吉生物医药科技有限公司进行测序及生物信息分析,具体流程包括16S rRNA V3–V4区域的PCR扩增、PCR产物纯化定量和均一化、Illumina MiSeq文库的制备和Illumina MiSeq PE300平台测序。
1.8 生物信息学分析 将测序得到的原始数据和Reads按照一定的原则进行处理得到clean data,对这些Reads进行Overlap拼接,形成目标序列tags,应用QIIME (version 1.8.0)工具包,按照97%相似性对非重复序列(不含单序列)进行OTU (operational taxonomic units)聚类注释,数据库使用GreenGene (version gg_13_8)。通过OTU分析,就可以知道样品中的微生物多样性和不同微生物的丰度,从门、目和种3个级别,我们重点关注和肥胖相关的一些菌的含量和指标,包括:厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)的含量和比例,双歧杆菌目(Bifidobacteriales),乳杆菌目(Lactobacillales)以及Akkermansia菌的含量等。
1.9 统计学方法 利用Graphpad Prism 5.0软件进行统计学分析,数据表示为均值±标准误,组间用双尾t检验进行处理,P < 0.05表示组间存在显著性差异,P < 0.01表示组间存在极其显著差异。
2 结果和分析 2.1 各组小鼠体重测定结果 各组小鼠的体重每周都有增加,但体重增长速度存在明显差异,和HFD组相比,总体上有3种趋势:配方B、G和H导致相应3组小鼠体重高于HFD组;配方A、D和E相应3组小鼠体重与HFD组接近;配方C和F则减缓了相应2组小鼠的体重增长,实验结束时相应2组小鼠体重介于CON组和HFD组之间,其中配方F使得小鼠在幼年至成年时期(3–8周龄),体重增加速度与CON组相比无显著性差异(以上体重测量结果未显示)。
我们重点选出2种配方菌F和H (F为所有益生菌组体重最低的,H为所有益生菌组体重最高的)的数据与两组对照(HFD组和CON组)进行比较分析,见图 1。体重增长速度依次为HFD+H组 > HFD组 > HFD+F组 > CON组,从第2周开始,HFD组和CON组相比体重就有极其显著差异(P < 0.01),HFD+H组和CON组相比体重有显著差异(P < 0.05);从第3周开始,HFD+H组体重超过HFD组,到第6周开始出现显著差异(P < 0.05),从第7周开始有极其显著差异(P < 0.01)。HFD+F组在第5周之前(小鼠3–8周龄)都和CON组体重接近,没有统计学差异;从第6周(小鼠第9周龄)开始,体重超过CON组,并且开始产生统计学差异;同HFD组相比较,HDF+F组体重比HFD组低,在第3周之前有极其显著差异(P < 0.01),在第3周至第9周,有显著差异(P < 0.05)。以上结果表明,高脂饮食可以诱发小鼠肥胖,而不同的益生菌配方在小鼠肥胖的发生过程中起到了不同的作用。配方H可以加速小鼠肥胖发生,最终小鼠的体重比HFD对照小鼠还要高;而配方F能抑制高脂饮食诱发的肥胖,特别是在第5周之前,即从小鼠断奶的第3周到小鼠完全成年的第8周,这种配方能完全消除高脂饮食对小鼠造成的额外体重增长,体重与进食低脂普通饮食的CON组保持一致;从实验第6周开始,这两组小鼠体重差异开始增加,部分原因可能是由于小鼠个体体重增加,益生菌给药量不足;也可能是由于成年后小鼠激素和代谢水平发生变化,补充的益生菌无法全部抵消高脂饮食带来的体重增长。
 |
| 图 1 各组小鼠体重生长曲线 Figure 1 The body weight growth curve of control group with normal diet (CON), high fat diet group (HFD), high fat diet group with probiotic F (HFD+F) and high fat diet group with probiotic H (HFD+H). Values presented here are mean±S.E. (n=5). Values indicated with asterisks are significantly different at the level of: *, P < 0.05; **, P < 0.01 from CON group; Values indicated with hash marks are significantly different at the level of: #, P < 0.05; ##, P < 0.01 from HFD group. Values of group HFD+H upon the curve, and values of group HFD+F below the curve. |
| 图选项 |
2.2 空腹血糖及葡萄糖耐量试验(glucose tolerance test,GTT)测定结果 本次实验同样是在CON组、HFD组、HFD+F组和HFD+H组这4组小鼠中进行,具体结果见图 2。CON组、HFD组和HFD+F组之间空腹血糖没有显著性差异,而HFD+H组空腹血糖极其显著高于其他3组(P < 0.01)。
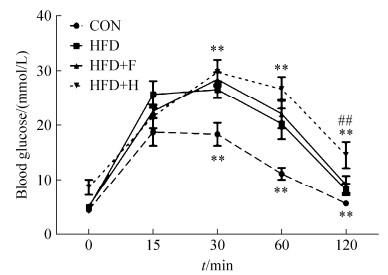 |
| 图 2 空腹血糖及gTT (glucose tolerance tests)测定结果 Figure 2 Fasting blood glucose and glucose tolerance tests results of control group with normal diet (CON), high fat diet group (HFD), high fat diet group with probiotic F (HFD+F) and high fat diet group with probiotic H (HFD+H). Values presented here are mean±S.E. (n=5). Values indicated with asterisks are significantly different at the level of: *, P < 0.05; **, P < 0.01 from CON group; Values indicated with hash marks are significantly different at the level of: #, P < 0.05; ##, P < 0.01 from HFD group. Values of group HFD+H upon the curve, and values of group HFD+F below the curve. |
| 图选项 |
CON组血糖峰值在15 min时形成,而各高脂饮食组血糖峰值都后移在30 min出现,并且高峰维持时间长;在30 min和60 min时,3组高脂饮食组血糖值均远高于CON组(P < 0.01),而3组高脂饮食组之间无显著性差异;在120 min时,CON组血糖回落至正常值,而其他3组高脂饮食组均不能回落至正常值,与CON组比较,都具有极其显著差异(P < 0.01);120 min时HFD+F组与HFD组之间没有统计学差异,而HFD+H组和HFD组相比,血糖值更高,并且具有极其显著差异(P < 0.01)。
一方面说明这几种益生菌配方均不能缓解由于高脂饮食引起的胰岛素抵抗;另一方面,益生菌配方H显著提高了空腹血糖和GTT终点血糖值,加重了高脂饮食诱发的糖尿病症状。
2.3 血清血脂生化指标检测结果 HDL-C、TCHO和TG的检测结果显示(图 3),3组高脂饮食组均高于CON组(P < 0.01),但HFD-F组显著低于HFD组(P < 0.05),而HFD-H组与HFD组之间保持一致;LDL-C方面,HFD+F与CON组相比没有显著差异,而HFD组和HFD+H组均显著高于CON组(P < 0.05)。这一结果表明高脂饮食能够提高小鼠血清中的HDL-C、LDL-C、TCHO和TG含量,F配方益生菌能够显著抑制高脂饮食带来的上述各项血脂指标升高,尤其能够将LDL-C降低至与低脂饮食一致的水平;而H配方益生菌未能改善上述指标。
 |
| 图 3 血清血脂生化指标检测结果 Figure 3 The blood lipid tests results of control group with normal diet (CON), high fat diet group (HFD), high fat diet group with probiotic F (HFD+F) and high fat diet group with probiotic H (HFD+H), which were tested by automatic biochemical analyzer. HDL-C means High-density lipoprotein cholesterol, LDL-C means Low-density lipoprotein cholesterol, TCHO means total cholesterol and TG means Triglyceride. Values presented here are mean±S.E. (n=5). Values indicated with asterisks are significantly different at the level of: *, P < 0.05; **, P < 0.01 from CON group; Values indicated with hash marks are significantly different at the level of: #, P < 0.05; ##, P < 0.01 from HFD group. |
| 图选项 |
2.4 组织称重检测结果 各主要内脏器官称重结果见表 1。HFD组相比CON组附睾脂肪及脾脏组织重量都有极其显著的增加(P < 0.01),而盲肠组织则有极其显著的降低(P < 0.01),其他脏器重量无变化;HFD+F组相比CON组附睾脂肪及脾脏组织重量有显著增加(P < 0.05),其他脏器重量无变化;HFD+H组相比CON组附睾脂肪及脾脏组织重量都有极其显著的增加(P < 0.01),肝脏组织重量有显著性的增加(P < 0.05),盲肠组织则有极其显著的降低(P < 0.01),其他脏器重量无变化;HFD+H组相比HFD组附睾脂肪及脾脏组织重量都有显著增加(P < 0.05),而盲肠组织则有显著降低(P < 0.05)。以上结果表明高脂饮食能够增加小鼠附睾脂肪和脾脏组织重量,同时降低盲肠组织重量;配方F能够缓解上述现象,而配方H则正好相反,在高脂饮食基础上进一步增加附睾脂肪和脾脏重量的同时,进一步降低了盲肠重量;同时配方H还显著增加了肝脏重量。
表 1. 高脂饮食+益生菌配方H和F组小鼠内脏重量和对照组比较表 Table 1. Organ weights of control group with normal diet (CON), high fat diet group (HFD), high fat diet group with probiotic F (HFD+F) and high fat diet group with probiotic H (HFD+H)
| Measures | Body weight gain/g | Organ weight/g | ||||||
| Cecum | Epididymal fat pad | Heart | Left kidney | Right kidney | Spleen | Liver | ||
| CON | 24.78±1.74 | 0.126±0.015 | 0.474±0.119 | 0.125±0.016 | 0.139±0.006 | 0.150±0.006 | 0.057±0.006 | 0.837±0.069 |
| HFD | 33.50±1.46 | 0.053±0.006** | 1.897±0.248** | 0.124±0.009 | 0.155±0.019 | 0.165±0.025 | 0.076±0.007** | 0.909±0.059 |
| HFD+F | 30.98±5.53 | 0.185±0.243 | 1.188±0.718* | 0.130±0.012 | 0.157±0.006 | 0.165±0.015 | 0.074±0.016* | 0.909±0.099 |
| HFD+H | 43.04±2.96 | 0.076±0.006** | 2.485±0.458** | 0.131±0.012 | 0.159±0.027 | 0.167±0.027 | 0.093±0.012** | 1.422±0.583* |
| Values indicated with asterisks are significantly different at the level of: *, P < 0.05; **, P < 0.01 from CON group; Values indicated with hash marks are significantly different at the level of: #, P < 0.05; ##, P < 0.01 from HFD group. Values presented here are mean±S.E. (n=5). | ||||||||
表选项
2.5 16S rDNA测序检测结果 通过OTU分析,我们将4组小鼠的厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes),双歧杆菌目(Bifidobacteriales),乳杆菌目(Lactobacillales)以及Akkermansia菌的含量重点筛选出来。在门级别分析,我们发现厚壁菌门和拟杆菌门是肠道里占据主要比例的两种菌,这两种菌的总和占肠道菌总量的90%左右;高脂饮食可以让厚壁菌门含量提高,而拟杆菌门含量降低,配方H极大强化了这一现象,具体分析如下(图 4)。与CON组相比,其他3组小鼠厚壁菌门和拟杆菌门的比值都有了一定比例的上调,其中HFD+H组上调最多,其比值是CON组的22.8倍(P < 0.01)该组小鼠的厚壁菌门含量最高,而拟杆菌门的含量最低;HFD组上调次之,比值是CON组的1.96倍(P < 0.01),而HFD+F组这2种菌的比值是CON组的1.41倍(P < 0.05),HFD组和HFD+F组的拟杆菌含量同CON组接近,但是HFD组的厚壁菌门含量更高。在目级别分析,我们挑选了目前市面上关注最多的双歧杆菌和乳杆菌,这两种菌的含量都有明显的变化,HFD+H组双歧杆菌含量是CON组的47.6倍(P < 0.01),而乳杆菌的含量是是CON组的4.85倍(P < 0.01);HFD组双歧杆菌含量是CON组的2.5倍(P < 0.01),而乳杆菌含量是CON组的3.25倍;而HFD+F组这两种菌和CON组比均没有差异。从种的级别分析,目前用于研究肠道菌和肥胖及糖尿病相关的明星菌Akkermansia菌我们也重点关注了一下,其含量比较结果显示,在CON组有1%的Akkermansia菌,HFD+F组有0.5%的含量,而HFD组和HFD+H组则几乎测不到Akkermansia菌,显示含量为0。以上结果表明,在高脂饮食中添加不同配方的益生菌对小鼠体重产生的效果截然相反,配方益生菌H极大地增加了肠道中双歧杆菌和乳杆菌的含量,增加了厚壁菌门的含量,降低了拟杆菌的含量,导致厚壁菌门和拟杆菌门的比例严重增加,而配方益生菌F能抵御由高脂饮食引起的厚壁菌门和拟杆菌门比例的上升,保护肠道中Akkermansia菌,从而改善了高脂饮食小鼠的能量吸收和代谢状况。
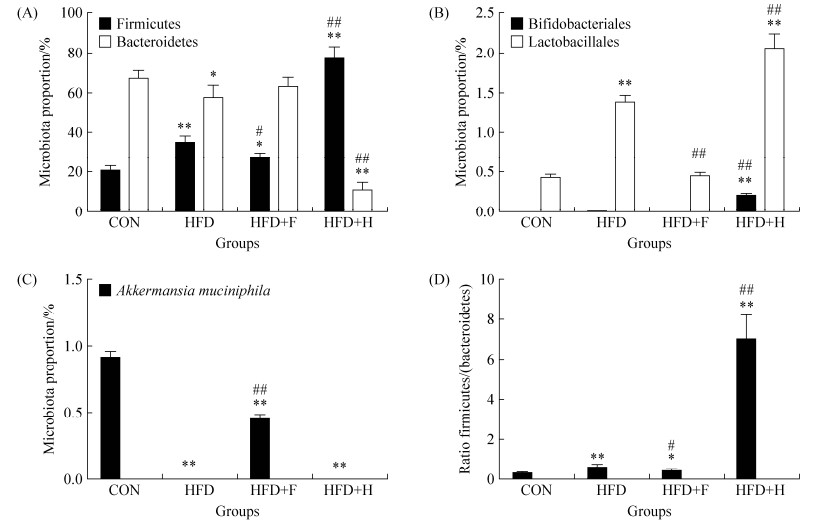 |
| 图 4 肥胖相关细菌含量16S rDNA测序分析结果 Figure 4 The abundance of bacteria associated with obesity analyzed by 16S rDNA sequencing. The four groups contain control group with normal diet (CON), high fat diet group (HFD), high fat diet group with probiotic F (HFD+F) and high fat diet group with probiotic H (HFD+H). A: The proportion of Firmicutes and Bacteroidetes. B: The proportion of Bifidobacteriales and Lactobacillales. C: The proportion of Akkermansia muciniphila. D: The ratio of Firmicutes and Bacteroidetes. Values presented here are mean±S.E. (n=5). Values indicated with asterisks are significantly different at the level of: *, P < 0.05; **, P < 0.01 from CON group; Values indicated with hash marks are significantly different at the level of: #, P < 0.05; ##, P < 0.01 from HFD group. |
| 图选项 |
3 讨论 大量实验和临床数据证实,肥胖和肠道菌群有着密切的关系,益生菌是指给予一定数量的、能够对宿主健康产生有益作用的活的微生物,主要包括双歧杆菌、乳酸杆菌、酵母菌、链球菌等。近年来大量研究表明,多种原因造成的肠道微生态环境的改变以及肠道内长期的弱炎症反应是引起肥胖及相关代谢性疾病的两个重要原因。
有研究报道,在肥胖人群的肠道中,厚壁菌门细菌比例比普通人高,而拟杆菌的比例却比普通人低,厚壁菌门细菌可以让人体有效吸收食物中更多的能量,导致肥胖[16]。本文中益生菌配方H组(丹尼斯克品牌)相比F组(菌拉丁品牌)导致了更高的小鼠肠道菌厚壁菌门/拟杆菌门比例,与其他研究结果吻合,但这一比例是肥胖的发生原因还是肥胖所造成的结果,包括本文及其他研究在内,暂时均未能给出明确的解释,需更进一步研究来证实。
目前市面上常见的益生菌产品中使用最多的是双歧杆菌和乳杆菌。双歧杆菌属于放线菌门,传统分类包括长双歧、短双歧、乳双歧、动物双歧等多个种。双歧杆菌属在婴幼儿肠道中居于主要优势地位,而在老年人群体中则通常仅有微量的双歧杆菌存在[17]。这一现象提示,高含量的双歧杆菌可能代表着旺盛的同化作用,即更多的营养和热量的吸收。事实上,本文前言中提到,将普通小鼠的肠道菌群移植至无菌小鼠肠道中,会导致小鼠在进食量下降的情况下,体重和脂肪含量反而大幅升高,这一现象说明肠道中的部分细菌能够将哺乳动物原本无法消化吸收的食物进行发酵分解,其产生的后续代谢产物或死亡菌体本身释放出的能量被肠道再次吸收[4]。本次研究发现,益生菌配方H造成了小鼠肠道中双歧杆菌的大量增殖,同时伴随其体重和脂肪含量大幅增长,表明双歧杆菌与体重增长和脂肪积累的关系极其密切,需进一步在分子生物学和微生物学的水平来研究双歧杆菌对代谢和能量产生的具体作用。
乳杆菌属于厚壁菌门,常见于发酵酸奶中,包括罗伊乳杆菌、保加利亚乳杆菌等多个种。部分研究表明,罗伊乳杆菌可能和肥胖呈现正相关[12-14]。本次研究中发现高脂饮食能增加小鼠肠道中的乳杆菌增加,相应小鼠的体重也比较高,与以上文献报道的结果一致,而配方F可以抑制这一效果,使该组小鼠的乳杆菌含量和普通饮食对照组小鼠保持在同一水平,体重增加也比单纯喂食高脂饮食组小鼠慢。
本次研究发现,高脂饮食可以导致小鼠肠道中Akkermansia菌下降,而配方F可以缓解这一过程,使得小鼠肠道中保留一定量的Akkermansia菌,从而降低了因高脂饮食引起的小鼠的体重增长、脂肪积累和血脂指标。前述文献报道称Akkermansia菌的作用包括降低体重、减少脂肪积累和改善血糖[7],本次研究同样观察到了小鼠肥胖的改善,但本次研究中未能观察到血糖的改善,部分可能是由于两次研究之间小鼠年龄和诱导时间的差异造成的;部分原因也可能在于,参考文献研究中是直接饲喂活的Akkermansia细菌,而本次研究中的益生菌配方不含有Akkermansia,是通过间接的环境自发繁殖的,二者之间的作用可能存在些微不同;同时,本次研究中配方F组的Akkermansia含量相对CON组未能达到很高的水平,也未达到参考文献中5%左右的水平,可能是血糖未能改善的原因之一。
本次研究的一大贡献在于,从肠道菌群组成变化的角度为益生菌改善代谢提供了直接而明确的证明,即通过良好的益生菌配比(F配方包含有共计6种双歧杆菌和乳杆菌),可将肥胖小鼠肠道中能够改善代谢的原本含量极低、甚至无法检测到的细菌提高数百倍至数千倍水平。Akkermansia作为研究中明确发现和改善肥胖等代谢疾病正相关的细菌,不一定需要直接摄入,而通过其他益生菌的合理搭配,同样能达到增殖这些对减肥有帮助的细菌的含量。
本次研究还提示,使用不同的菌株及不同菌株搭配下的配方,其生理作用完全不同,甚至可能完全相反。例如本次研究中食用的配方H和F,其配方中均含有嗜酸乳杆菌和乳双歧杆菌,其中配方H包含有乳双歧杆菌Bi-07、嗜酸乳杆菌NCFM、乳双歧杆菌HN019这3种益生菌,而配方F含有包括嗜酸乳杆菌和乳双歧杆菌在内的6种益生菌(另外还含有青春双歧杆菌、植物乳杆菌等),但配方H最终大幅增殖了双歧杆菌和乳杆菌,而配方F未能增殖这2种菌(双歧杆菌含量在F组中有略微下降),反而大幅增殖了高脂饮食肥胖小鼠中非直接相关的Akkermansia种细菌;在此基础上,配方F改善了肥胖和高脂血症症状,而配方H则造成了更为严重的肥胖,甚至造成了比HFD高脂对照组更严重的脂肪肝症状。这说明,尽管补充的益生菌在分类学上都属于双歧杆菌或乳杆菌,但有的配方能直接提高双歧杆菌和乳杆菌的含量,有的配方却并未提高所补充的这两种菌的含量(反而略有下降),却间接提高了其他细菌(例如Akkermansia)的含量。
另外,在小鼠从断奶(3周龄)到完全成年(8周龄)期间,配方F能够使得食用高脂饮食的小鼠体重始终与低脂饮食对照的小鼠(CON组)保持一致,显示了对于动物成长发育期间良好的代谢改善作用;小鼠成年后2组体重逐渐拉开差距,益生菌F的作用未能与在未成年小鼠身上的作用同样明显,但F组仍显著低于高脂对照HFD组。推测可能的原因包括益生菌的剂量,还有小鼠成年后的激素变化带来的较大的代谢差异。
综上所述,在给予幼鼠高脂饮食诱导肥胖的过程中,添加不同菌株、不同比例(但最终剂量相同)的益生菌配方组合物,可以对小鼠肥胖产生不同的效果,有的配方能够缓解高脂饮食带来的肥胖,而有的配方则会加重。未来,更多的研究工作应当集中于2个方向:一是益生菌菌株水平的深入研究,以及不同比例搭配后的益生菌混合物的筛选工作;另一方向在于,如何通过现有的、已被证实安全的益生菌和益生元,将研究中证实对代谢疾病有改善的细菌含量(如本文中的Akkermansia菌等),通过间接的方式进行提高。
References
| [1] | Mishra AK, Dubey V, Ghosh AR. Obesity:An overview of possible role(s) of gut hormones, lipid sensing and gut microbiota. Metabolism, 2016, 65(1): 48-65. DOI:10.1016/j.metabol.2015.10.008 |
| [2] | Prospective Studies Collaboration, Whitlock G, Lewington S, Sherliker P, Clarke R, Emberson J, Halsey J, Qizilbash N, Collins R, Peto R. Body-mass index and cause-specific mortality in 900000 adults:collaborative analyses of 57 prospective studies. The Lancet, 2009, 373(9669): 1083-1096. DOI:10.1016/S0140-6736(09)60318-4 |
| [3] | Yanovski SZ, Yanovski JA. Obesity. The New England Journal of Medicine, 2002, 346(8): 591-602. DOI:10.1056/NEJMra012586 |
| [4] | Backhed F, Ding H, Wang T, Hooper LV, Koh GY, Nagy A, Semenkovich CF, Gordon JI. The gut microbiota as an environmental factor that regulates fat storage. Proceedings of the National Academy of Sciences of the United States of America, 2004, 101(44): 15718-15723. DOI:10.1073/pnas.0407076101 |
| [5] | Ley RE, Backhed F, Turnbaugh P, Lozupone CA, Knight RD, Gordon JI. Obesity alters gut microbial ecology. Proceedings of the National Academy of Sciences of the United States of America, 2005, 102(31): 11070-11075. DOI:10.1073/pnas.0504978102 |
| [6] | Turnbaugh PJ, Ley RE, Mahowald MA, Magrini V, Mardis ER, Gordon JI. An obesity-associated gut microbiome with increased capacity for energy harvest. Nature, 2006, 444(7122): 1027-1031. DOI:10.1038/nature05414 |
| [7] | Everard A, Belzer C, Geurts L, Ouwerkerk JP, Druart C, Bindels LB, Guiot Y, Derrien M, Muccioli GG, Delzenne NM, de Vos WM, Cani PD. Cross-talk between akkermansia muciniphila and intestinal epithelium controls diet-induced obesity. Proceedings of the National Academy of Sciences of the United States of America, 2013, 110(22): 9066-9071. DOI:10.1073/pnas.1219451110 |
| [8] | Plovier H, Everard A, Druart C, Depommier C, van Hul M, Geurts L, Chilloux J, Ottman N, Duparc T, Lichtenstein L, Myridakis A, Delzenne NM, Klievink J, Bhattacharjee A, van der Ark KCH, Aalvink S, Martinez LO, Dumas ME, Maiter D, Loumaye A, Hermans MP, Thissen JP, Belzer C, de Vos WM, Cani PD. A purified membrane protein from Akkermansia muciniphila or the pasteurized bacterium improves metabolism in obese and diabetic mice. Nature Medicine, 2017, 23: 107-113. DOI:10.1038/nm.4236 |
| [9] | Greer RL, Dong XX, Moraes AC, Zielke RA, Fernandes GR, Peremyslova E, Vasquez-Perez S, Schoenborn AA, Gomes EP, Pereira AC, Ferreira SRG, Yao M, Fuss IJ, Strober W, Sikora AE, Taylor GA, Gulati AS, Morgun A, Shulzhenko N. Akkermansia muciniphila mediates negative effects of IFNγ on glucose metabolism. Nature Communications, 2016, 7: 13329. DOI:10.1038/ncomms13329 |
| [10] | Yadav H, Lee JH, Lloyd J, Walter P, Rane SG. Beneficial metabolic effects of a probiotic via butyrate-induced GLP-1 hormone secretion. The Journal of Biological Chemistry, 2013, 288(35): 25088-25097. DOI:10.1074/jbc.M113.452516 |
| [11] | Floch MH, Walker WA, Madsen K, Sanders ME, Macfarlane GT, Flint HJ, Dieleman LA, Ringel Y, Guandalini S, Kelly CP, Brandt LJ. Recommendations for probiotic use-2011 update. Journal of Clinical Gastroenterology, 2011, 45(Suppl): S168-S171. |
| [12] | Million M, Angelakis E, Paul M, Armougom F, Leibovici L, Raoult D. Comparative meta-analysis of the effect of Lactobacillus species on weight gain in humans and animals. Microbial Pathogenesis, 2012, 53(2): 100-108. DOI:10.1016/j.micpath.2012.05.007 |
| [13] | Million M, Maraninchi M, Henry M, Armougom F, Richet H, Carrieri P, Valero R, Raccah D, Vialettes B, Raoult D. Obesity-associated gut microbiota is enriched in Lactobacillus reuteri and depleted in Bifidobacterium animalis and Methanobrevibacter smithii. International Journal of Obesity, 2012, 36(6): 817-825. DOI:10.1038/ijo.2011.153 |
| [14] | ?t?epetova J, Sepp E, Kolk H, L?ivukene K, Songisepp E, Mikelsaar M. Diversity and metabolic impact of intestinal Lactobacillus species in healthy adults and the elderly. The British Journal of Nutrition, 2011, 105(8): 1235-1244. DOI:10.1017/S0007114510004770 |
| [15] | Zang WJ, Li YQ, Li BC, Guo JJ, Zhao YL. Quantitative analysis of important gut flora in diabetic patients. Food Science, 2015, 36(11): 208-214. (in Chinese) 臧文娟, 李艳琴, 李彬春, 郭俊杰, 赵玉立. 糖尿病患者肠道中4种重要菌群的定量分析. 食品科学, 2015, 36(11): 208-214. DOI:10.7506/spkx1002-6630-201511040 |
| [16] | Ley RE, Turnbaugh PJ, Klein S, Gordon JI. Microbial ecology:human gut microbes associated with obesity. Nature, 2006, 444(7122): 1022-1023. DOI:10.1038/4441022a |
| [17] | Arboleya S, Watkins C, Stanton C, Ross RP. Gut bifidobacteria populations in human health and aging. Frontiers in Microbiology, 2016, 7: 1204. |
