董怡华1, 2, 李鹏1

 , 何江海1, 李亮3, 胡筱敏3
, 何江海1, 李亮3, 胡筱敏31. 沈阳大学环境学院, 辽宁 沈阳 110044;
2. 沈阳大学, 污染环境治理与区域生态安全重点实验室, 辽宁 沈阳 110044;
3. 东北大学资源与土木工程学院, 辽宁 沈阳 110004
收稿日期: 2015-06-30; 修回日期: 2015-10-18; 网络出版日期: 2015-12-09
基金项目: 国家水体污染控制与治理重大专项(2012ZX07202-004);沈阳市科技计划项目(F13-316-1-66);辽宁省博士启动基金(2014010520-301);辽宁省教育厅科学研究一般项目(L2013453)
通讯作者: 李鹏,Tel:+86-24-62266991;E-mail:harvesttime@163.com
摘要: [目的] 系统研究吸附法和同时培养法对所形成混合菌丝球的外观形态、内部结构及其去除2-氯酚效果的影响。[方法] 采用吸附法和同时培养法将可降解2-氯酚的光合细菌PSB-1D固定在黄孢原毛平革菌(Phanerochaete chrysosporium) DH-1发酵而成的菌丝球上,形成混合菌丝球。以单一菌丝球为对照,利用光学显微镜、扫描电镜等仪器观察混合菌丝球的外观形态和内部结构,考察2种方法对混合菌丝球成球效果的影响;以无菌培养液为空白对照,考察游离光合细菌、单一菌丝球、2种方法形成混合菌丝球对2-氯酚的降解效能。[结果] 在吸附法形成的混合菌丝球上,光合细菌主要集中在过渡区;而同时培养法将光合细菌牢固地包埋在菌丝球内核区,并大量簇状附着生长在菌丝交联的空隙处和每根菌丝上。在接种等量孢子和光合细菌的前提下,同时培养法较吸附法操作时间更短,成球数量更多,形成菌丝球干湿比更大,单位菌丝干重上固定的细菌数量更多。菌丝球降解体系和游离光合细菌对2-氯酚的降解均符合一级动力学特征。同时培养法形成的混合菌丝球降解效果最好,7 d内对初始浓度为50 mg/L的2-氯酚降解率可达89%以上,降解速率常数为0.3286 mg/(L·d),2-氯酚半衰期t1/2为2.8 d。[结论] 首次报道黄孢原毛平革菌包埋固定化光合细菌形成混合菌丝球。该研究为生物质固定化材料的实际应用提供理论依据。
关键词: 混合菌丝球沼泽红假单胞菌黄孢原毛平革菌2-氯酚生物质载体生物降解
Comparison of two mycelial pellets formation methods to immobilize o-chlorophenol degradation bacteria
Yihua Dong1, 2, Peng Li1

 , Jianghai He1, Liang Li3, Xiaomin Hu3
, Jianghai He1, Liang Li3, Xiaomin Hu31. School of Environment, Shenyang University, Shenyang 110044, Liaoning Province, China;
2. Key Laboratory of Pollution Environment and Regional Ecological Security, Shenyang University, Shenyang 110044, Liaoning Province, China;
3. College of Resources and Civil Engineering, Northeastern University, Shenyang 110004, Liaoning Province, China
Received: 30 June 2015; Revised: 18 October 2015; Published online: 9 December 2015
Foundation Item: Supported by National Critical Patented Projects in the Control and Management of the Polluted Water Bodies (2012ZX07202-004), by the Science and Technology Plan of Shenyang (F13-316-1-66), by the PhD Start-up Fund of Natural Science Foundation of Liaoning Province (2014010520-301) and by the Foundation of Liaoning Educational Committee (L2013453)
Corresponding author. Tel: +86-24-62266991; E-mail: harvesttime@163.com
Abstract:[Objective] To find an efficient and fast method for microbial immobilization, we compared simultaneity culture method and adsorption method on morphology and intrastructure of combined mycelial pellets, as well as their o-chlorophenol biodegradation efficiency. [Methods] The o-chlorophenol degrading photosynthetic bacterium PSB-1D was immobilized onto mycelial pellets formed by Phanerochaete chrysosporium DH-1 to form combined mycelial pellets. The morphology and intrastructure of pellets formed by two immobilization methods were observed by optical microscope and scanning electron microscope. Then, their differences were analyzed. Using the sterile medium as control, o-chlorophenol removal efficiency of free photosynthetic bacteria, single mycelial pellets and combined mycelial pellets formed by two methods were studied. [Results] Photosynthetic bacteria were largely concentrated in the core region of pellets formed by simultaneity culture method and grew in clusters on each mycelium and their intersections. As compared with simultaneity culture method, photosynthetic bacteria mainly grew in the transition region of pellets formed by adsorption method. With the same inoculation amount of spores and photosynthetic bacteria, the simultaneity culture method could immobilize more bacteria with little time. Moreover, average diameter, dry weight and dry wet ratio of pellets formed by simultaneity culture method were bigger than that by adsorption method, and their desorption amount were less. The o-chlorophenol degradation followed a first-order kinetics model. The combined mycelial pellets formed by simultaneity culture method could degrade above 89% of o-chlorophenol in medium with an initial concentration of 50 mg/L after incubation for 7 days. And the half-life periods (t1/2) were shortened to 2.8 days. [Conclusion] The study provides the theoretical foundation for the practical application of the new biomass carrier to organic wastewater treatment.
Key words: combined mycelial pelletRhodopseudomonas palustrisPhanerochaete chrysosporiumo-chlorophenolbiomass carrierbiodegradation
氯酚类化合物(Chlorophenols,CPs)是一类难降解有机污染物,被广泛应用于杀菌剂、除草剂和防腐剂等农业产品的生产制造和造纸漂白工业[1],具有致癌、致畸、致突变效应[2]和遗传毒性[3],被美国、欧盟以及中国等诸多国家列入优先污染物名单[4],其污染治理受到了世界性的广泛关注。光合细菌(Photosynthetic bacteria,简称PSB)具有灵活的代谢方式,它们不仅能以低级脂肪酸等低分子有机物作为光合作用的电子供体进行光能异养生长,而且能以这些有机物为呼吸基质进行好氧异养生长,因此可以作为处理难降解有机废水的一种有效途径[5]。然而,将光合细菌直接投放到水处理系统中,由于菌体十分微小,常会出现细胞流失严重、易被原生动物吞噬、固液分离困难等一系列问题[6]。菌丝球作为固定化细菌的新型生物质载体,为这一难题的解决提供了全新的方法和思路[7]。菌丝球是由霉菌或放线菌在液体淹没条件下振荡培养、自动聚集形成的一种既具有生命性征,又有吸附和载体特性的球状颗粒物[8, 9, 10],具有沉降性能好,传质扩散阻力小,无二次污染,生产成本低等优点[11],能够有效提高功能降解菌的生物量密度、维护系统的稳定运行[12]。
目前,国内外对菌丝球的相关研究主要集中在形成过程分析、机理探讨等方面,工业废水处理应用也仅限于对重金属和印染废水的吸附[13, 14, 15, 16]。利用菌丝球作为生物质载体,固定化功能降解菌来处理难降解有机废水的相关研究甚少,国内仅哈尔滨工业大学的马放等[17]对曲霉与苯胺降解菌结合形成混合菌丝球的净化效能进行了研究。而利用菌丝球固定代谢方式灵活的光合细菌来处理氯酚废水的研究目前尚未见有报道。
混合菌丝球的形成方法主要有2种[18]:吸附法和同时培养法。其中,吸附法是通过吸附作用将功能降解细菌附着在菌丝球上;同时培养法是将霉菌孢子和功能降解细菌种子液同时培养,利用菌丝培养过程中缠绕形成具有一定形状、结构和层次的球状颗粒,将功能细菌缠绕包埋在其中。本文以可高效降解2-氯酚(o-chlorophenol,2-CP)的光合细菌作为研究对象,以不添加光合细菌的单一菌丝球为对照,分别采用上述2种方法将光合细菌固定在黄孢原毛平革菌发酵而成的菌丝球上,形成混合菌丝球,对比2种菌丝球的外观形态、内部结构及对2-CP的去除效果,由此确定混合菌丝球的最佳构建方法。通过上述研究,以期为开发固定化微生物技术的新型生物质载体材料,将其实际应用于难降解有机废水处理提供科学依据。
1 材料和方法 1.1 材料1.1.1供试菌株:(1)光合细菌:试验所用光合细菌PSB-1D为实验室保存菌种,由某农药厂排污口下游水体浅层底泥中分离、筛选得到,经鉴定为沼泽红假单胞菌(Rhodopseudomonas palustris),16S rDNA序列在GenBank中的登陆号为Accession No.HM 068966。该菌对2-CP具有良好的耐受和降解能力[19]。(2)白腐真菌:试验选用黄孢原毛平革菌(Phanerochaete chrysosporium),暂命名为DH-1,为白腐真菌中的一类担子真菌,购自中国普通微生物菌种保藏管理中心(CGMCC)。该真菌通过摇床培养可以形成菌丝球,对2-CP具有良好的耐受能力和一定的降解能力。初步降解试验表明,该菌丝球培养7 d后对2-CP的去除率为30%左右。经拮抗试验验证,该菌与光合细菌PSB-1D无拮抗作用。
1.1.2培养基:(1)光合细菌培养基(g/L):葡萄糖2,(NH4)2SO4 0.6,酵母膏0.2,KH2PO4 0.6,K2HPO4 0.4,CaSO4 0.2,MgSO4·7H2O 0.3。用10%的NaOH和10%的HCl调节pH至7.0。(2)白腐真菌培养基:马铃薯提取液1 L、葡萄糖20 g、KH2PO4 3 g、MgSO4·7H2O 1.5 g,维生素B1微量。用10%的NaOH和10%的HCl调节pH至7.0。(3)菌丝球培养基(g/L):葡萄糖10,酵母膏2,KH2PO4 0.6,K2HPO4 0.4,CaSO4 0.2,MgSO4·7H2O 0.3。用10%的NaOH和10%的HCl调节pH至7.0。各种培养基接种前1.0×105 Pa灭菌20 min。
1.1.3主要仪器与试剂:Motic Type102M电子显微镜(德国徕卡仪器有限公司),TM-1000台式扫描电子显微镜(日立Hitachi公司),L-2000高效液相色谱仪(日立Hitachi公司),SpectroFlex6600紫外-可见分光光度计(德国WTW公司),2-CP(纯度>99%,国药集团化学试剂有限公司),甲醇(色谱纯,Fisher Scientific公司)。
1.2 孢子悬液的制备在无菌操作台上,用无菌生理盐水冲洗长有白腐真菌DH-1的斜面固体培养基表面,用接种环轻刮斜面,直至孢子被完全冲洗下来。将其倒入250 mL无菌锥形瓶中,轻轻振荡,使悬液中的孢子呈均匀分散状态。用紫外-可见分光光度计测孢子悬液的吸光度值OD650,用无菌生理盐水调节OD650至0.8左右,此时用血球计数法计算孢子数量浓度约为1.0×108 CFU/mL。
1.3 光合细菌种子液的制备用接种环将保存于固体斜面培养基中的光合细菌PSB-1D挑取3环,接种至含2-CP质量浓度为50 mg/L的100 mL光合细菌培养基中,置于30 ℃、130 r/min摇床中培养3 d后用于后续光合细菌的接种培养。
1.4 光合细菌悬液的制备接种光合细菌种子液(1.3)10 mL于90 mL,含2-CP质量浓度为50 mg/L的光合细菌培养基中,置于30 ℃、130 r/min摇床中培养4 d。将培养液于8000 r/min离心5 min,弃去上清液,收集的菌体细胞重新悬浮于100 mL,含2-CP质量浓度为50 mg/L的无菌生理盐水中,振荡均匀,配制成OD560为2.0左右的菌悬液,此时用平板菌落计数法计算光合细菌数量浓度约为2.0×1010 CFU/mL。
1.5 单一菌丝球的制备在无菌操作台上,接种孢子悬液(1.2)10 mL于90 mL,含2-CP质量浓度为50 mg/L的菌丝球培养基中,置于30 ℃、130 r/min摇床中振荡培养4 d至形成菌丝球。
1.6 混合菌丝球的制备1.6.1混合菌丝球Ⅰ:采用吸附法形成混合菌丝球。用无菌生理盐水将单一菌丝球冲洗2次,置于光合细菌悬液(1.4)中,于30 ℃、130 r/min摇床中培养48 h,过滤即得混合菌丝球Ⅰ。
1.6.2混合菌丝球Ⅱ:采用同时培养法形成混合菌丝球。同时接种10 mL孢子悬液(1.2)和10 mL光合细菌种子液(1.3)于80 mL,含2-CP质量浓度为50 mg/L的菌丝球培养基中,置于30 ℃、130 r/min摇床中培养4 d至形成混合菌丝球Ⅱ。为了保证上述2种方法的平行比较,以及与单一菌丝球的对照比较,每种方法在培养初始所接种的光合细菌种子液和孢子悬液浓度平行一致。
1.7 石蜡切片与光学显微镜观察取不同方法培养得到的菌丝球数粒,用FAA固定液固定,石蜡切片,切片厚8-10 μm,乳酸石炭酸棉蓝染色,光学显微镜下观察菌丝球石蜡切片的形态结构[20]。
1.8 扫描电子显微镜样品制备取直径大小均匀的5-10个单一菌丝球/混合菌丝球,用蒸馏水冲洗2-3次,冰冻待用。首先,用冰冻包埋剂将待切样品于-20 ℃包埋速冻20 min。然后置于-20 ℃切片台上,切片厚度为150 μm。切片后,用预冻的载玻片沾取切片,置于室温中进行电镜扫描样品制备。其制备过程为:(1)固定:取单一菌丝球/混合菌丝球的切片各5片,加入2.5 %、pH 6.8的戊二醛固定液中,并置于冰箱4 ℃下固定1.5 h;之后换入新鲜戊二醛再次固定1.5 h;(2)脱水:用0.1 mol、pH 6.8的磷酸缓冲液冲洗3次,每次10 min;分别用30%、50%、70%、85%、95%的乙醇进行脱水,每次15 min;(3)置换:用100 %乙醇置换2次,每次20 min;用乙酸异戊酯置换2次,每次20 min;(4)干燥:用Quorum K850临界点干燥仪对菌丝球干燥处理;(5)喷金:用镊子轻轻地将干燥后的菌丝球切片内部观察面向上粘贴在扫描电镜样品台上,用Quorum Q150R离子溅射镀膜仪在菌丝球表面镀一层1500 nm厚度的金属膜;(6)观察:将制备好的菌丝球样品进行内部结构扫描电镜观察。
1.9 分析项目及测定方法1.9.1解吸量M的测定:将2种方法形成的混合菌丝球30粒投入100 mL的无菌生理盐水中,于30 ℃、130 r/min的摇床中振荡24 h后,用血球计数法计算混合菌丝球在生理盐水中溶出的光合细菌数量浓度(CFU/mL)。
1.9.22-CP去除率E的计算:测定不同降解系统中培养t时间后残留的2-CP质量浓度ρt,以同一培养时间无菌空白对照培养液的2-CP质量浓度ρck为对照,计算2-CP去除率E。
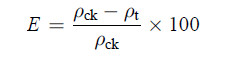
其中,2-CP质量浓度的测定:将培养液经0.22 μm微滤膜过滤后,利用高效液相色谱仪进行测定。分析条件为:C18反相柱(4.6 mm×200 mm),柱温30 ℃;紫外检测器检测波长273 nm;流动相为甲醇45%,高纯水55%;流速1.0 mL/min;进样量25 μL。
1.10 数据处理 采用SPSS 19.0和Microsoft Excel 2003软件进行数据处理和方差分析(one-way ANOVA),采用Duncan法进行差异显著性检验(α=0.05),采用Origin 7.5软件对数据作图。
2 结果和分析 2.1 不同方法形成菌丝球的外观形态及显微镜观察 由图 1-A可以看出,白腐真菌DH-1形成的单一菌丝球为纯白色,大小均匀、独立,直径在3 mm左右,边缘形状规则整齐、有短绒毛。对照图 1-B和图 1-C可以看出,吸附法形成的混合菌丝球Ⅰ呈淡黄色,球体结构饱满、致密,边缘规则、表面光滑,大小均匀,直径在4-5 mm左右;而同时培养法形成的混合菌丝球Ⅱ外观呈肉粉色,球体大小不均匀,边缘规则,有较长绒毛,球体直径在5-7 mm左右。
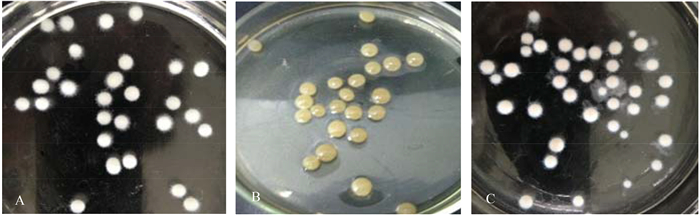 |
| 图 1. 不同方法形成菌丝球的外观形态 Figure 1. Morphology of mycelial pellets formed by different methods. A: Single mycelial pellets; B: Combined mycelial pellets Ⅰ formed by adsorption method; C: Combined mycelial pellets Ⅱ formed by simultaneity method. |
| 图选项 |
由40倍的光学显微镜照片(图 2)可以看出,不同方法形成的菌丝球由外至内均包括3个界限分明的区域:(1)外层菌毛区;(2)中间过渡区;(3)内核区。其中,各种方法形成菌丝球的外层菌毛区和过渡区菌丝分布均较为松散,由此可以保证菌丝体之间形成的孔通道能够良好的吸收与利用基质,使培养液中营养物质或降解基质能够有效传质和充分供应溶解氧,以及保证代谢产物能够很快分泌到球体外,从而使得菌丝球整体处于生长旺盛状态;内核区菌丝相对较为致密,可以起到包埋功能降解细菌的骨架作用。由图 2-B可以看出,吸附法形成混合菌丝球Ⅰ的过渡区颜色较单一菌丝球加深,推测可能是球体表面吸附了光合细菌PSB-1D细胞集中于此区域所致;由图 2-C可以看出,在显微镜下,透过同时培养法形成的混合菌丝球Ⅱ表面可以观察到中心区域有红色阴影,初步推测为被包埋的红色光合细菌。
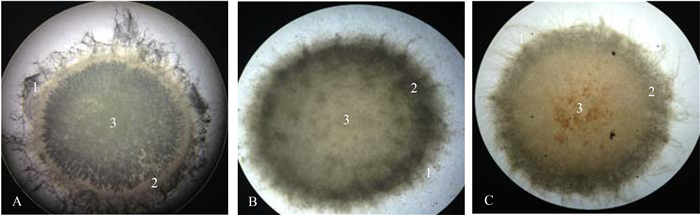 |
| 图 2. 不同方法形成菌丝球的外观形态显微镜照片 (40×) Figure 2. Microscopic observation of mycelial pellets formed by different methods (40×). A: Single mycelial pellets; B: Combined mycelial pellets Ⅰ formed by adsorption method; C: Combined mycelial pellets Ⅱ formed by simultaneity method. 1: fimbriae region; 2: transition region; 3: core region. |
| 图选项 |
2.2 不同方法形成菌丝球的石蜡切片照片 由图 3可以看出,单一菌丝球的菌丝整体分布较为松散,内核区菌丝生长旺盛、较浓密,菌丝围绕着内核呈放射性生长;吸附法形成的混合菌丝球Ⅰ过渡区颜色较深、密实度增加,而内核区颜色较浅,菌丝分布比较疏松;同时培养法形成的混合菌丝球Ⅱ的内核区和过渡区颜色均较深,推测被包埋固定化的光合细菌主要集中于这两个区域。
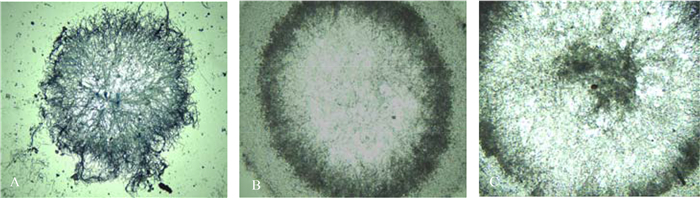 |
| 图 3. 不同方法形成菌丝球的石蜡切片照片 (40×) Figure 3. Microscopic observation of paraffin section (40×). A: Single mycelial pellets; B: Combined mycelial pellets Ⅰ formed by adsorption method; C: Combined mycelial pellets Ⅱ formed by simultaneity method. |
| 图选项 |
2.3 不同方法形成菌丝球的内部结构扫描电镜 由图 4-A可以观察到,菌丝球是由菌丝生长和缠绕而成的规则球体,菌丝多且表面光滑,菌丝之间充满空隙,孔隙率大且均匀,利于氧气和营养物质的传输,不易造成堵塞。菌丝为前后贯通的纤细管状体,无横隔膜,内有多个形成衍射亮点的细胞核。区别于其他化学材质载体的最大特点在于,菌丝球是有生命的生物质体,具有良好的生物相容性,其发达的菌丝结构为微生物细胞提供了巨大的吸附空间,具有很大的吸附容量,因此更利于微生物的附着固定。由电镜照片图 4-B、C可以看出,光合细菌被均匀地吸附排列在吸附法形成的混合菌丝球Ⅰ的每一根菌丝上;而同时培养法形成的混合菌丝球Ⅱ内部,无论是菌丝交联形成的空隙位置还是每根菌丝上,都簇状生长有大量的光合细菌,其单位菌丝上附着的光合细菌数量明显多于吸附法。
 |
| 图 4. 不同方法形成菌丝球内部结构的扫描电镜照片 (4000×) Figure 4. Intrastructure of mycelial pellets formed by different methods (4000×). A: Single mycelial pellets; B: Combined mycelial pellets Ⅰ formed by adsorption method; C: Combined mycelial pellets Ⅱ formed by simultaneity method. |
| 图选项 |
2.4 不同方法形成菌丝球的综合比较 分别取每种方法形成菌丝球100粒,对表征成球效果的各项指标进行测定,并进行综合比较,结果如表 1所示。由表 1可知,不同方法形成菌丝球的成球效果和固定化效果均存在一定差异。其中,吸附法须进行二次培养,因此该方法历时长,操作繁琐;相比而言,同时培养法历时短,操作过程简单,且形成的混合菌丝球干湿比较高。在平行接种等量的孢子和光合细菌的前提下,同时培养法形成的混合菌丝球培养4 d后对光合细菌的固定包埋量约为(4.9±0.7)×1010 CFU/g菌丝干重;而吸附法是在生理盐水中进行,菌体细胞不存在生长繁殖现象,菌悬液中光合细菌浓度从培养初始即迅速下降,之后逐渐趋于平稳,48 h后基本达到吸附平衡,此时菌丝球对光合细菌的包埋量约为(2.1±0.3)×1010 CFU/g菌丝干重。沉降试验表明,单一菌丝球在水中有少量悬浮,而其他2种混合菌丝球都快速沉降到水底,因此利于实际处理有机废水过程中的固液分离。解吸试验发现,将混合菌丝球重新投入无菌生理盐水中振荡24 h后,吸附法形成混合菌丝球的溶出光合细菌数量浓度约为(9.5±0.8)×105 CFU/mL左右,而同时培养法约为(4.7±0.6)×102 CFU/mL左右,说明吸附法形成的混合菌丝球在水力剪切力的作用下更易解吸。
表 1. 不同方法形成菌丝球效果的综合比较Table 1. Comparison of mycelial pellets formed by different methods
| Index | Pellets | ||
| Single mycelial pellets | Combined mycelial pellets Ⅰ | Combined mycelial pellets Ⅱ | |
| Average diameter/mm | 3.0±0.5 | 5.0±0.4 | 6.0±0.5 |
| Dry weight/(g/10 pellets) | 0.006±0.002 | 0.010±0.002 | 0.009±0.002 |
| Dry wet ratio/% | 3.0±0.2 | 5.0±0.5 | 7.0±0.6 |
| Photosynthetic bacteria amount embedded/(CFU/g mycelial dry weight) | – | (2.1±0.3)×1010 | (4.9±0.7)×1010 |
| Desorption amount/(CFU/mL) | – | (9.5±0.8)×105 | (4.7±0.6)×102 |
表选项
2.5 不同降解体系对2-CP降解效果的比较 分别接种最佳体积配比为10 mL:10 mL的孢子悬液和光合细菌种子液于含2-CP质量浓度为50 mg/L的菌丝球培养基中,在30 ℃、130 r/min条件下进行好氧培养。以无菌培养液作为空白对照,考察游离光合细菌、单一菌丝球、吸附法和同时培养法形成混合菌丝球对2-CP的降解效能,每天定时取样,测定不同降解体系中2-CP的质量浓度,并计算去除率,结果如图 5所示。
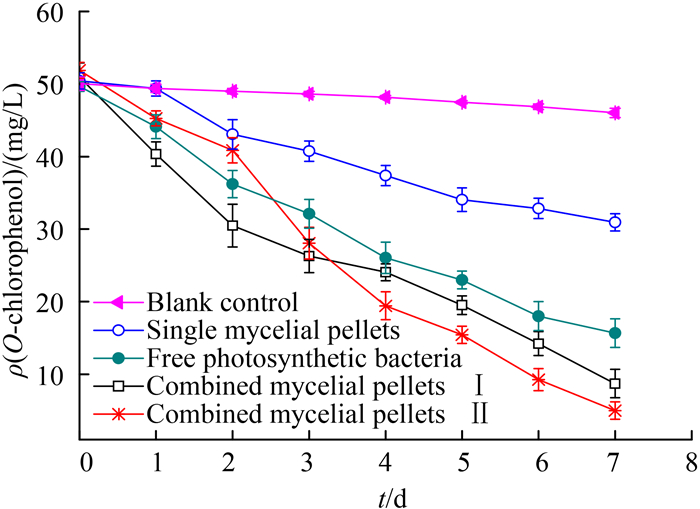 |
| 图 5. 不同降解体系下2-CP质量浓度变 Figure 5. 2-CP concentrations with different biodegradation systems. |
| 图选项 |
由图 5可知,将无菌对照培养液置于摇床中振荡培养,2-CP质量浓度有一定幅度下降,7 d后损失率为8.07%,表明2-CP的挥发性对其去除率的计算存在一定干扰。因此在后续试验中,以同一培养时间下无菌空白体系的2-CP质量浓度作为对照浓度来计算去除率。游离态光合细菌PSB-1D培养7 d后对2-CP的去除率为65.92%。无论吸附法还是同时培养法所形成的混合菌丝球对2-CP的去除率均高于游离态光合细菌,分别为81.08%和89.13%。在白腐真菌形成的单一菌丝球降解体系中,随着培养时间的延长,2-CP质量浓度持续下降,说明白腐真菌对2-CP除了有一定物理吸附作用外,也具备生物降解效能,培养7 d后,2-CP去除率为32.77%。
将不同降解体系中2-CP质量浓度随时间的变化按一级反应动力学方程进行线性拟合,即:lnρ=-kt+A,式中ρ(mg/L)是t时残留的2-CP质量浓度,k [mg/(L·d)]表示降解速率常数,t(d)是降解时间,A为常数。结果如表 2所示。
表 2. 不同降解体系降解2-CP的反应动力学分析Table 2. Degradation kinetic of 2-CP in different biodegradation systems
| Biodegradation systems | Kinetic equation | R | Degradation rate constant k/[mg/(L·d) ] | Half-life t1/2/d | Removal rate E/%* |
| Blank control | lnρ=3.91469 – 0.01136t | 0.9904 | 0.0114±0.0034 | 61.2±5.1 | – |
| Free photosynthetic bacteria | lnρ=3.93128 – 0.16539t | 0.9903 | 0.1654±0.0157 | 4.3±0.1 | 65.92±0.04a |
| Single mycelial pellets | lnρ=3.94889 – 0.07726t | 0.9841 | 0.0773±0.0049 | 9.3±0.5 | 32.77±0.02b |
| Combined mycelial pellets Ⅰ | lnρ=3.95269 – 0.22631t | 0.9788 | 0.2263±0.0271 | 3.2±0.3 | 81.08±0.04c |
| Combined mycelial pellets Ⅱ | lnρ=4.19314 – 0.32859t | 0.9754 | 0.3286±0.0115 | 2.8±0.05 | 89.13±0.03d |
| *P<0.05. | |||||
表选项
由表 2可见,不同降解体系对2-CP的去除均符合一级动力学特征,拟合结果显示各降解体系表现出良好的线性关系,相关系数R均高于0.95,所得一级动力学方程均能较好地反映不同降解体系对2-CP的降解效果与趋势,降解反应速率常数大小依次为k同时培养法>k吸附法>k游离光合细菌>k单一菌丝球,半衰期依次为t1/2同时培养法<t1/2吸附法<t1/2游离光合细菌<t1/2单一菌丝球,且各降解体系对2-CP的去除率存在显著差异(P<0.05)。其中,同时培养法形成混合菌丝球对2-CP的降解速率常数k为0.3286±0.0115 mg/(L·d),2-CP的半衰期为2.80±0.05 d,去除率为89.13±0.03%,较其他降解体系有显著优势。
3 讨论 开发高效、耐用、廉价的载体材料是微生物固定化技术得以推广应用的关键。与传统无机和有机化学材料相比,菌丝球作为生物质载体材料具有诸多优点:(1)菌丝球是由菌丝体缠绕形成的球体,其表面和内部布满了网状空隙,可有效包埋功能降解细菌,并且能够克服载体对基质以及代谢产物的扩散传递阻力,利于传质;(2)菌丝球具有多孔以及大的比表面积,有利于对功能降解细菌的吸附;(3)菌丝球有相对宽泛的成球和生长条件,沉降性能良好,具有一定的机械强度,能够抵抗较大的水流剪切力;(4)菌丝球营养需求简单,生长速度快、代时短,生产成本低,不造成二次污染,可多次重复利用,可以实现污泥的减量化和资源化,降低污泥处理成本。由此看来,如若把对有机废水具有特殊降解功能的细菌通过菌丝吸附或缠绕包埋作用固定在菌丝球上,进行难降解有机废水的高效处理,将有望解决微生物固定化技术推广应用的瓶颈[21],为生物处理有机废水提供一种新的、经济有效的方法。
菌丝球作为生物质载体固定化光合细菌的方式主要有吸附法和同时培养法。通过扫描电镜观察菌丝球内部结构,可以看出光合细菌PSB-1D细胞均匀地排列在吸附法形成菌丝球的每一个菌丝上,而同时培养法形成的混合菌丝球的内部,PSB-1D细胞主要聚集于每根菌丝上以及菌丝交联形成的空隙处。这一试验现象与马放等[18]研究有所不同。马放采用上述2种方法将高效苯胺降解细菌JH-9固定于黑曲霉菌Y3形成的菌丝球上,观察发现,同时培养法形成的菌丝球内部,发现细菌均匀地排列生长在每一根菌丝上,而吸附法形成的菌丝球上,细菌只存在于多条菌丝交叉处。分析其不同的原因,可能是由于生物质载体的真菌种类不同,形成混合菌丝球过程中的吸附机制不同所致。
此外,本研究对2种方法形成混合菌丝球效果的综合比较发现,在接种等量孢子和光合细菌的前提下,同时培养法较吸附法操作时间更短、更简便,成球数量更多,形成菌丝球干湿比更大,单位菌丝干重上固定的细菌数量更多。
研究表明,孢子的凝聚在菌丝球的形成过程中起了很重要的作用。孢子不能凝聚,就不能形成饱和晶核,进而无法形成菌丝球[22, 23]。由同时培养法形成菌丝球在不同培养阶段的镜检照片(图 6)可以看出,同时接种的光合细菌细胞参与了孢子的凝聚以及饱和晶核的形成,并在饱和晶核中占据了一定的空间,使得更多的孢子发生凝聚,形成了更多的饱和晶核。饱和晶核越多,发育形成的菌丝球数量就越多。饱和晶核中的孢子萌发长出菌丝,由于菌丝体生长过程中不断产生大量胞外聚合物(EPS),并且菌丝表面具有巨大的粘附力和静电引力[24],在振荡培养过程中,不断使PSB-1D细胞粘附在菌丝体中,在水流剪切力的作用下,菌丝围绕晶核缠绕形成菌丝球的同时,将PSB-1D细胞不断包埋于内核区,从而形成了混合菌丝球。当菌丝球形成后,球体表面对培养液中剩余的游离光合细菌同样也具有吸附作用,使得被包埋的光合细菌主要集中于内核区和过渡区。吸附法是将已成型的单一菌丝球重新置于光合细菌PSB-1D悬液中,在摇床的充分振荡搅拌下,菌丝缠绕的更加致密,并且细胞微小的光合细菌逐渐通过菌毛区的菌丝空隙进入到球体过渡区,不断集中、均匀分布,少量细胞渗入到球体内部。因此,相比而言,同时培养法较吸附法包埋的光合细菌数量更多。此外,光合细菌既可以在厌氧光照条件下光能异养生长,即使是微弱的光照也能进行,又可以好氧异养生长,且对氧存在的敏感度不高[25]。当光合细菌被包埋于球体的内核区时,由于氧气传输的限制,在球体内部形成溶解氧的浓度梯度,导致球体中心区域氧的缺乏,此时光合细菌可以在厌氧或缺氧条件下继续代谢营养物质和分解有机底质。并且,同时培养法形成的这种特有结构不会因为在形成和应用过程中,由于水力剪切力的作用而脱落解吸出大量光合细菌,由此可以更加牢固地将光合细菌包埋于菌丝球内部,从而较吸附法更有利于在有机废水处理中的实际应用。
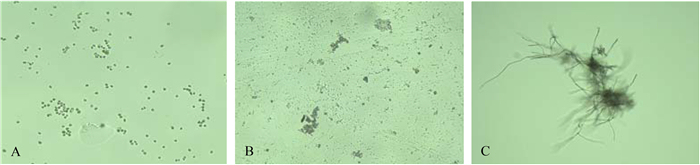 |
| 图 6. 混合菌丝球Ⅱ在不同培养阶段的形态(400×) Figure 6. Morphology of combined mycelial pellets Ⅱ in different culture stages (400×). A: Dispersed spores and PSB-1D cells (0 h); B: Formation of saturated crystal nucleus with PSB-1D (6 h); C: Growth of spores from saturated crystal nucleus (12 h). |
| 图选项 |
多项研究表明,白腐真菌因其特有的木质素降解酶系,能非特异性降解氯酚类、多氯联苯等难降解有机污染物,成为环境污染控制领域最受关注的微生物菌种[26, 27]。在本研究前期,曾经分离出1株烟曲霉菌(Aspergillus fumigatus,GenBank Accession No.KJ156821),也可作为生物质载体与光合细菌PSB-1D形成混合菌丝球。然而2-CP降解试验发现,培养3 d后,随着时间的延长,该菌形成的单一菌丝球对2-CP的去除率始终维持在12%左右,即达到吸附饱和,由此推测它对2-CP的去除主要是通过物理吸附而非生物降解。而试验发现,白腐真菌中的一类典型担子真菌——黄孢原毛平革菌(Phanerochaete chrysosporium),不但可以作为生物质载体与光合细菌形成混合菌丝球,而且其形成的单一菌丝球对2-氯酚也具有一定生物降解效果,培养7 d后,对2-CP去除率为32.77%。因此,本研究选择黄孢原毛平革菌形成的菌丝球作为生物质载体对光合细菌PSB-1D进行固定化。
以游离态光合细菌和单一菌丝球为对照,考察吸附法和同时培养法形成混合菌丝球对2-CP的降解效能,结果表明上述4个不同降解体系对2-CP的去除率存在显著差异(P<0.05),其中,同时培养法对2-CP的去除效果显著好于吸附法。这是由于吸附法是将生理盐水中形成的混合菌丝球直接投加到2-CP培养液中,培养过程中光合细菌逐渐出现老化、生长停滞、死亡等过程,最终导致混合菌丝球包埋的光合细菌数量逐渐减少;而同时培养法是在菌丝球培养基中由孢子和光合细菌种子细胞生长发育而形成混合菌丝球,无论白腐真菌DH-1还是光合细菌PSB-1D都始终长时间维持很高的活性,在培养过程中被包埋的光合细菌不断繁殖、更新,不断对2-CP进行协同代谢,因而2-CP的去除效果比较好。
综合上述试验,菌丝球作为新型生物质载体,通过同时培养法来包埋固定光合细菌,与吸附法相比,不仅缩短固定化时间,操作简便,而且固定化菌量大、固定化效果好、菌体细胞不易流失,并且对2-氯酚去除效果好,具有明显优势,将在有机废水处理工程应用上具有广阔的应用前景。
参考文献
| [1] | Huang LP, Shi YH, Wang N, Dong YS. Anaerobic/aerobic conditions and biostimulation for enhanced chlorophenols degradation in biocathode microbial fuel cells. Biodegradation, 2014, 25(4):615-632. |
| [2] | Li GW, Liu H, Zhang F, Du GC, Chen J. Real time PCR quantification of ammonia-oxidizing bacteria in aerobic granular sludge and activated sludge influenced by pentachlorophenol. Acta Microbiologica Sinica, 2007, 47(1):136-140. (in Chinese)李光伟, 刘和, 张峰, 堵国成, 陈坚. 荧光定量PCR监测五氯酚对好氧颗粒污泥和活性污泥中氨氧化细菌数量的影响. 微生物学报, 2007, 47(1):136-140. |
| [3] | Gao NY, Zhu SM, Ma Y, Rong WL, Zhou SD, Lu NX. UV/H2O2 photochemical degradation of 2,4,6-trichlorophenol. Journal of Central South University (Science and Technology), 2013, 44(3):1262-1268. (in Chinese)高乃云, 祝淑敏, 马艳, 戎文磊, 周圣东, 陆纳新. 2,4,6-三氯酚的UV/H2O2光化学降解. 中南大学学报(自然科学版), 2013, 44(3):1262-1268. |
| [4] | United States Environmental Protection Agency. National recommended water quality criteria. Report EPA 822-R-02-047. Washington. D C.:EPA, 2002. |
| [5] | Idi A, Hanif Md Nor M, Firdaus Abdul Wahab M, Ibrahim Z. Photosynthetic bacteria:an eco-friendly and cheap tool for bioremediation. Reviews in Environmental Science and Biotechnology, 2015, 14(2):271-285. |
| [6] | Meng JY, Feng FY, Ge RL. Study on degradation of naphthalene with immobilized photosynthetic bacteria. Journal of Inner Mongolia Agricultural University, 2012, 33(12):99-102. (in Chinese)孟建宇, 冯福应, 格日勒. 光合细菌固定化降解萘的研究. 内蒙古农业大学学报, 2012, 33(12):99-102. |
| [7] | Zhao LJ, Ma F, Shan D, Gao M. Immobilized effect of bacteria by mycelial pellet of Penicillum Y3. Journal of Jiangsu University (Natural Science Edition), 2007, 28(5):446-449. (in Chinese)赵立军, 马放, 山丹, 高敏. 曲霉菌丝球Y3对细菌的固定化效能. 江苏大学学报(自然科学版), 2007, 28(5):446-449. |
| [8] | Hamanaka T, Higashiyama K, Fujikawa S, Park E. Mycelial pellet intrastructure and visualization of mycelia and intracellular lipid in a culture of Mortierella alpina. Applied Microbiology and Biotechnology, 2001, 56(1):233-238. |
| [9] | Liu YS, Wu JY. Effects of Tween 80 and pH on mycelial pellets and exopolysaccharide production in liquid culture of a medicinal fungus. Journal of Industrial Microbiology & Biotechnology, 2012, 39(4):623-628. |
| [10] | Zhang HT, Huang Y, Fu YQ. Effects of pellet characteristics on L-lactic acid fermentation by Rhizopus oryzae. Acta Microbiologica Sinica, 2015, 55(3):372-378. (in Chinese)章华婷, 黄莹, 付永前. 米根霉菌球特性对乳酸发酵的影响. 微生物学报, 2015, 55(3):372-378. |
| [11] | Zhang S, Ma F, Shan D, Wei L. The aniline purifying efficiency of a combined mycelial pellet. Journal of Harbin Engineering University, 2010, 31(6):786-790. (in Chinese)张斯, 马放, 山丹, 魏利. 混合菌丝球苯胺净化效能研究. 哈尔滨工程大学学报, 2010, 31(6):786-790. |
| [12] | Wang HL, Li P, Jin QL, Qin G. Specific aerobic granules can be developed in a completely mixed tank reactor by bioaugmentation using micro-mycelial pellets of Phanerochaete chrysosporium. Applied Microbiology and Biotechnology, 2014, 98(6):2687-2697. |
| [13] | Luo J, Hu YY, Zhong HT. Removal of Cr(VI) in solution by Aspergillus fumisynnematus mycelia:reduction and biosorption. Acta Scientiae Circumstantiae, 2007, 27(10):1585-1592. (in Chinese)罗隽, 胡勇有, 仲海涛. 烟束曲霉菌丝球对Cr(VI)的去除-还原与吸附作用. 环境科学学报, 2007, 27(10):1585-1592. |
| [14] | Sathishkumar M, Murugesan GS, Ayyasamy PM, Swaminathan K, Lakshmanaperumalsamy P. Bioremediation of Arsenic contaminated groundwater by modified mycelial pellets of Aspergillus fumigatus. Bulletin of Environmental Contamination and Toxicology, 2004, 72(3):617-624. |
| [15] | Yesilada O, Yildirim SC, Birhanli E, Apohan E, Asma D, Kuru F. The evaluation of pre-grown mycelial pellets in decolorization of textile dyes during repeated batch process. World Journal of Microbiology and Biotechnology, 2010, 26(1):33-39. |
| [16] | Wu J, Zhong S, Li YC. Biosorption characteristics and mechanism of Pb2+ by Phanerochaete chrysosporium. Research of Environmental Sciences, 2010, 23(6):754-761. (in Chinese)吴涓, 钟升, 李玉成. 黄孢原毛平革菌(Phanerochaete chrysosporium)对Pb2+的生物吸附特性及吸附机理. 环境科学研究, 2010, 23(6):754-761. |
| [17] | Zhang S, Li A, Cui D, Yang JX, Ma F. Performance of enhanced biological SBR process for aniline treatment by mycelial pellet as biomass carrier. Bioresource Technology, 2011, 102(6):4360-4365. |
| [18] | Shan D, Ma F, Zhang S, Wang C. Comparative study of two immobilization technology-simultaneity culture and adsorption. Journal of Harbin Institute of Technology, 2012, 44(4):53-57. (in Chinese)山丹, 马放, 张斯, 王晨. 同时培养法与吸附法微生物固定化对比. 哈尔滨工业大学学报, 2012, 44(4):53-57. |
| [19] | Hu XM, Dong YH, Li L, Lu J, He YD, Gao Y. Biodegradation characteristics of o-chlorophenol with photosynthetic bacteria PSB-1D. Environmental Science, 2010, 31(7):1672-1678. (in Chinese)胡筱敏, 董怡华, 李亮, 卢娟, 和英滇, 高阳. 光合细菌PSB-1D对2-氯苯酚的降解特性研究. 环境科学, 2010, 31(7):1672-1678. |
| [20] | Lei DZ, Yu SJ. Morphology of mycelial pellets during the submerged culture of Grifola frondosa. Acta Edulis Fungi, 2003, 10(1):6-11. (in Chinese)雷德柱, 于淑娟. 灰树花深层发酵过程中菌丝球形态结构的研究. 食用菌学报, 2003, 10(1):6-11. |
| [21] | Ławniczak Ł, Kaczorek E, Olszanowski A. The influence of cell immobilization by biofilm forming on the biodegradation capabilities of bacterial consortia. World Journal of Microbiology and Biotechnology, 2011, 27(5):1183-1188. |
| [22] | Zhou Y, Du JX, Tsao GT. Mycelial pellet formation by Rhizopus oryzae ATCC 20344. Applied Biochemistry and Biotechnology, 2000, 84(1):779-789. |
| [23] | Grimm LH, Kelly S, Krull R, Hempel DC. Morphology and productivity of filamentous fungi. Applied Microbiology and Biotechnology, 2005, 69(4):375-384. |
| [24] | 朱虹. 菌丝球形成过程及其影响因素的研究. 哈尔滨工业大学硕士学位论文, 2007. |
| [25] | Rudolf C, Grammel H. Fructose metabolism of the purple non-sulfur bacterium Rhodospirillum rubrum:effect of carbon dioxide on growth, and production of bacteriochlorophyll and organic acids. Enzyme and Microbial Technology, 2012, 50(4/5):238-246. |
| [26] | Kamei I, Kogura R, Kondo R. Metabolism of 4,4'-dichlorobiphenyl by white-rot fungi Phanerochaete chrysosporium and Phanerochaete sp. MZ142. Applied Microbiology and Biotechnology, 2006, 72(3):566-575. |
| [27] | Teramoto H, Tanaka H, Wariishi H. Degradation of 4-nitrophenol by the lignin-degrading basidiomycete Phanerochaete chrysosporium. Applied Microbiology and Biotechnology, 2004, 66(3):312-317. |
