 , 吴云成2, 陈良强1, 刘明庆2, 杨帆1, 王蒙蒙2, 田伟2
, 吴云成2, 陈良强1, 刘明庆2, 杨帆1, 王蒙蒙2, 田伟2
 , 王莉1
, 王莉11. 贵州茅台酒股份有限公司, 仁怀 564501;
2. 生态环境部南京环境科学研究所, 南京 210042
收稿日期: 2021-01-04; 修回日期: 2021-03-22; 录用日期: 2021-03-22
基金项目: 中央级公益性科研院所基本科研业务专项(No.GYZX20022202)
作者简介: 吕锡斌(1989—), 男, E-mail: lvxibinhist@163.com
通讯作者(责任作者): 田伟, 男, 博士, 副研究员.主要从事良好土壤保持与污染修复、农业面源污染控制等相关研究, 发表论文40余篇.E-mail: tw79210@163.com
摘要:赤水河是茅台酒酿造用水的水源地,其环境承载能力和水质质量与该流域微生物的群落息息相关,而目前赤水河浮游细菌群落组成、功能及其与水质之间的关系研究开展较少.本研究以茅台酒厂采水点为中心,在其上中下游设置了W1~W6共6个采样点,采用16S rDNA Miseq高通量测序技术研究了赤水河浮游细菌群落的组成及其功能.结果表明浮游细菌群落主要由55门、167纲、415目、706科、1431属组成,假单胞菌属(Pseudomonas)和马赛菌属(Massilia)是相对优势种群.此外,W1和W3采样点样品与其他采样点样品相比,群落组成差异较大.冗余分析表明CODMn、COD和DO是影响群落组成的显著因素(p < 0.05),其与NH3-N、pH、TN、Novosphingobium、Stenotrophomona和Pontibacter等参数是该流域浮游细菌群落网络的重要节点.使用PICRUSt2软件对该水源地微生物群落的功能进行预测,结果显示其功能主要涉及代谢(metabolism)、环境信息处理(environmental information processing)、遗传信息处理(genetic information processing)等6类生物代谢通路和碳水化合物代谢(carbohydrate metabolism)、氨基酸代谢(amino acid metabolism)、能量代谢(energy metabolism)、辅助因子和维生素的代谢(metabolism of cofactors and vitamins)等46个子功能.本研究探明了赤水河浮游细菌群落组成和功能及其与环境因子的相互联系,丰富了赤水河地区的第一手研究资料,为改善其水域环境提供了参考.
关键词:赤水河浮游细菌高通量测序PICRUSt2功能预测
Characteristics of the bacterioplankton community and their relationships with water quality in Chishui River Basin
Lü Xibin1
 , WU Yuncheng2, CHEN Liangqing1, LIU Mingqing2, YANG Fan1, WANG Mengmeng2, TIAN Wei2
, WU Yuncheng2, CHEN Liangqing1, LIU Mingqing2, YANG Fan1, WANG Mengmeng2, TIAN Wei2
 , WANG Li1
, WANG Li11. Kweichow Moutai Company limited, Renhuai 564501;
2. Nanjing Institute of Environmental Sciences, Ministry of Ecology and Environment of the People's Republic of China, Nanjing 210042
Received 4 January 2021; received in revised from 22 March 2021; accepted 22 March 2021
Abstract: The Chishui River is the main water source for Moutai liquor, and its environmental carrying capacity and water quality are closely related to the microbial community. However, few studies have been carried out on the composition and function of the bacterioplanktonic community and their relationship with the water quality until now. Here, the Moutai distillery was taken for the center of the study, and six locations (W1~W6) distributed in the upper and down streams of the river were set for sample collection. 16S rDNA Miseq high-throughput sequencing technology was used to study the composition and function of the bacterioplanktonic community in Chishui River. The results showed that the bacterioplanktonic community was comprised of 55 phyla, 167 classes, 418 orders, 706 families, and 1431 genera, among which, Pseudomonas and Massilia were the dominant genera. Moreover, the community compositions of W1 and W3 samples were significantly different from those of the other samples (p < 0.05). Redundancy analysis (RDA) showed that water CODMn, COD and DO were the significant factors that could affect the composition of the bacterioplanktonic community. The three environmental factors and NH3-N, pH, TN, Novosphingobium, Stenotrophomonas, and Pontibacter were the key nodes of the bacterioplanktonic community network in the river. PICRUSt2 software was used to predict the function of the bacterioplankton communities, and the results revealed that these functions were primarily associated with six biological metabolic pathway categories (e.g., metabolism, environmental information processing, genetic information processing) and 46 subfunctions (e.g., carbohydrate metabolism, amino acid metabolism, energy metabolism, metabolism of cofactors and vitamins). The result will enrich the research data of Chishui River and provided reference for improving its water environment.
Keywords: Chishui Riverbacterioplanktonhigh-throughput sequencingPICRUSt2 prediction
1 引言(Introduction)微生物是水域生态系统的重要组成部分, 参与有机物的降解及营养物的循环过程.以微生物为研究对象, 了解水环境中微生物的组成、群落结构及其生物学功能, 对于整个水环境的生态维护以及生态效应具有重要的意义(谷阳, 2010;黄艺等, 2013).浮游细菌群落在水域生态系统中高度可变, 水体的物理化学特征、有机质的浓度和类型、食物网的组成以及物种间的相互作用等均能影响浮游细菌的群落组成(Newton et al., 2011; 任丽娟等, 2013).与此同时, 水体中的微生物群落反过来又能影响该水域营养盐和有机质的组成和浓度, 进而改变水质参数(唐静杰, 2009).因此, 研究和分析河流环境中微生物的群落分布和多样性对了解和改善河流生态环境具有十分重要的意义.
赤水河是茅台酒酿造用水的水源地, 其中上游地区的生态环境对茅台酒的品质具有十分重要的影响.由于酱香型白酒高温蒸馏的特点, 基本可以排除赤水河微生物对酿造过程的直接作用.然而赤水河的水体含有丰富的矿物质, 会对茅台酒的独特风味起到重要的影响.而这些矿物质与河流微生物的群落关系密切, 且赤水河作为优质的酿造水源也被视为酿造微生物的重要来源.目前, 赤水河茅台段浮游细菌群落组成、功能及其与水质之间的关系研究开展较少.现代分子生物学采用荧光定量PCR、16S rRNA/DNA文库、指纹技术等分子生物学技术, 具有操作便捷、实验周期短等优势, 能够不依赖于培养、快速准确地对环境样品微生物的多样性进行分析, 在湖泊、海洋微生物研究中得到良好的应用(Ward et al., 2017; Yi et al., 2018; 阴星望等, 2018).以这些技术为基础, 能更好地探究赤水河流域微生物群落的组成结构与功能, 为赤水河流域生态系统的维护提供理论依据.
2 材料与方法(Materials and methods)2.1 样品采集和理化因子测定于2019年10月对赤水河入茅台镇断面-出茅台镇断面上下游进行水样进行采集, 共采集6个位点的水样.位点信息如图 1所示, W1为赤水河入茅台镇断面上游3000 m, W2为赤水河入茅台镇断面, W3为赤水河茅台酒厂取水口断面, W4为赤水河与盐津河汇合断面下游500 m, W5为赤水河出茅台镇断面, W6为赤水河出茅台镇断面下游3000 m.根据当地地理条件选用船只采样法, 在河流断面的中垂线, 采集河心水面下0.2 m水样, 每个位点每次采样持续3 d采集3组平行样品, 每次采集水样10 L.将采集后的水样在常温下立即带回实验室, 分成两部分, 一部分置于4 ℃冰箱中保存用于理化性质检测, 一部分置于-20 ℃保存用于日后提取DNA进行微生物多样性分析.参照《地表水环境质量标准》(GB3838-2002)对水样pH值、溶解氧(DO)、化学需氧量(COD)、高锰酸盐指数(CODMn)、总氮(TN)、总磷(TP)、铵氮(NH3-N)进行监测.
图 1(Fig. 1)
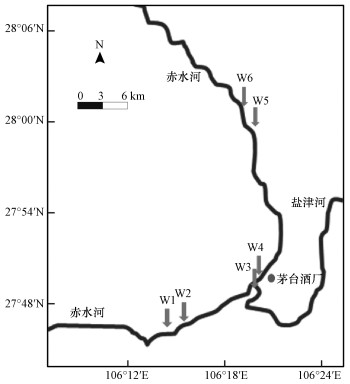 |
| 图 1 采样点分布 Fig. 1map of the sampling sites Location of Chishui River |
2.2 样品总DNA提取对每个水样, 取600 mL表层水样至灭菌烧杯中, 使用20 μm滤网过滤掉大型浮游植物和浮游动物, 然后用0.22 μm无菌滤膜过滤预处理过的水样以收集浮游细菌, 最后在超净工作台将滤膜取出、剪碎后放入50 mL预灭菌离心管(陈兆进等, 2017).用Omega Water DNA Kit(Omega, USA)试剂盒提取浮游细菌DNA.经微量紫外分光光度计(NanoDrop? ND-1000, Wilmington, DE, USA)测定收集到的浮游细菌DNA的浓度和纯度.
2.3 高通量测序和PCR扩增采用引物338F(5′-ACTCCTACGGGAGGCAGC AG-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)对浮游细菌V3~V4区扩增, 以获得目的基因片段.PCR反应体系为20 μL, 包含5× FastPfu缓冲液4 μL、2.5 mmol·L-1 dNTPs 2 μL、Forward Primer(5 μmol·L-1) 0.8 μL、Reverse Primer(5 μmol·L-1) 0.8 μL、FastPfu Polymerase 0.4 μL、BSA 0.2 μL和Template DNA 10 ng, 补充dH2O至20 μL.PCR反应条件为95 ℃预变性3 min, 35×(95 ℃变性30 s;55 ℃复性30 s;72 ℃延伸45 s);72 ℃延伸10 min, 10 ℃直到停止, 每个取样点做3个重复.将最终产物寄送上海美吉生物医药科技有限公司, 使用MiSeq PE300测序仪(Illumina Inc, San Diego, CA, USA)完成序列测定.
2.4 高通量数据分析将Illumina MiSeq测序得到的下机数据(raw data)经处理后得到有效数据(effective tags).采用QIIME软件进行生物信息学分析, 根据序列的相似度, 将序列归为多个OTUs(operational taxonomic units)(Caporaso et al., 2010a).采用RDP classifier贝叶斯算法对97%相似水平的OTU代表序列进行分类学分析, 并在各个分类水平下统计每个样品的群落组成.基于OTU计算稀释曲线、群落丰富度指数(Chao1、ACE)和群落多样性指数(Shannon、Simpson)等(Dhariwal et al., 2017).高通量测序结果采用PICRUSt2软件预测细菌功能并进行分类.
3 结果(Results)3.1 赤水河水体理化性质参照《水和废水监测分析方法》对6个采样点水体样品的TN、TP、DO等7项理化性质进行监测, 结果如表 1所示.茅台镇W3和W4断面的溶解氧含量分别为7.22 mg·L-1和7.24 mg·L-1, 显著低于较其他断面(p < 0.05).另外, W3、W4和W5断面氨氮含量分别为0.51、0.59和0.47 mg·L-1, 显著高于W1和W2断面(p < 0.05).CODMn除上游W1断面较低外, 其他断面之间无显著的差异, 说明其他断面水环境中有机物质的含量相对较高.COD和TN表现了类似的变化趋势, 均在W4断面监测到了最大值, 分别为19.1 mg·L-1和3.23 mg·L-1.
表 1(Table 1)
| 表 1 各样品水体主要理化参数 Table 1 Main physical and chemical properties of different samples | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 1 各样品水体主要理化参数 Table 1 Main physical and chemical properties of different samples
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
3.2 浮游细菌群落多样性评估评估报告显示各采样点的覆盖度指数均超过98%, 表明本次高通量测序数据合理可信.丰富度指数Chao1和ACE表明W1和W3样品的物种丰度最低, W2、W5和W6采样点的物种丰度最高.多样性指数Simpson和Shannon指数显示W1和W3采样点的物种多样性最低, W5和W6采样点的物种多样性最高.
表 2(Table 2)
| 表 2 不同样品浮游细菌多样性评估表 Table 2 Estimation of bacterioplankton community diversity in different sample | |||||||||||||||||||||||||||||||||||||||||||||||||
表 2 不同样品浮游细菌多样性评估表 Table 2 Estimation of bacterioplankton community diversity in different sample
| |||||||||||||||||||||||||||||||||||||||||||||||||
3.3 浮游细菌多样性的UPGMA和NMDS(non-metric multidimensional scaling)分析非度量多维尺度NMDS分析(图 2)和UPGMA聚类分析(图 3)均能描述不同样品间的群落组成差异.NMDS根据样品中包含的物种信息, 将样品以点的形式反映在多维空间上, 点与点间的距离可以体现样品之间的相似性(Rivas et al., 2013).在本实验中, 6个样品不规则分布于3个区域, 其中W2、W4、W5和W6 4个样品点距离较近, 表明其群落组成相似性较高;而W1和W3与其他样品距离较远, 相似度较低, 且W1与其他样品的相似度最低.UPGMA聚类分析结果与之类似, W1和W3样品与其他样品在聚类树上距离较远.
图 2(Fig. 2)
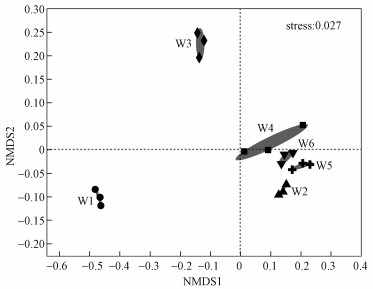 |
| 图 2 浮游细菌群落的NMDS分析 Fig. 2NMDS analysis of bacterioplankton community |
图 3(Fig. 3)
 |
| 图 3 不同样品相似性聚类树 Fig. 3Similarity clustering tree of different samples |
3.4 物种组成和差异分析高通量测序结果显示, 在本研究中赤水河流域的浮游细菌包含55门、167纲、415目、706科、1431属, 其中假单胞菌属(Pseudomonas, 丰度占比1.83%~28.51%)和马赛菌属(Massilia, 3.46%~20.49%)是优势种群, 总占比分别为16.99%和12.45%.W1和W3样品与其他样品的群落差异最大, 不动杆菌属(Acinetobacter, 22.21%)和黄杆菌属(Flavobacterium, 16.84%)是W1样品的优势种群, 假单胞菌属(Pseudomonas, 15.33%)和不动杆菌属(Acinetobacter, 14.99%)是W3样品的优势种群(图 4).
图 4(Fig. 4)
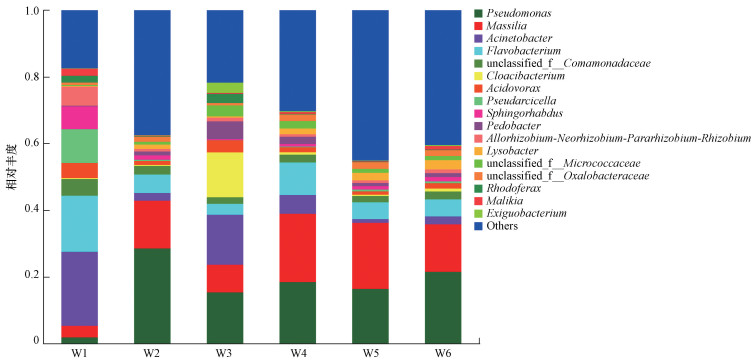 |
| 图 4 浮游细菌门属水平上相对丰度分布 Fig. 4Relative abundance of bacterioplankton sequences at the genus level |
LefSe(Linear discriminant analysis Effect Size)分析可以检测样品之间具有显著差异的物种类型, 在本研究中, W1样品中的Acinetobacter、Pseudarcicella、Sphingorhabdus、unclassified_Comamonadaceae、Acidovorax, W2样品中的Pseudomona, W3样品中的Cloacibacterium、Pedobacter、unclassified_Micrococcaceae、Exiguobacterium、Rhodoferax, W4样品中的Massilia和W6样品中的Lysobacter与其他样品存在显著差异(p < 0.05)(图 5).
图 5(Fig. 5)
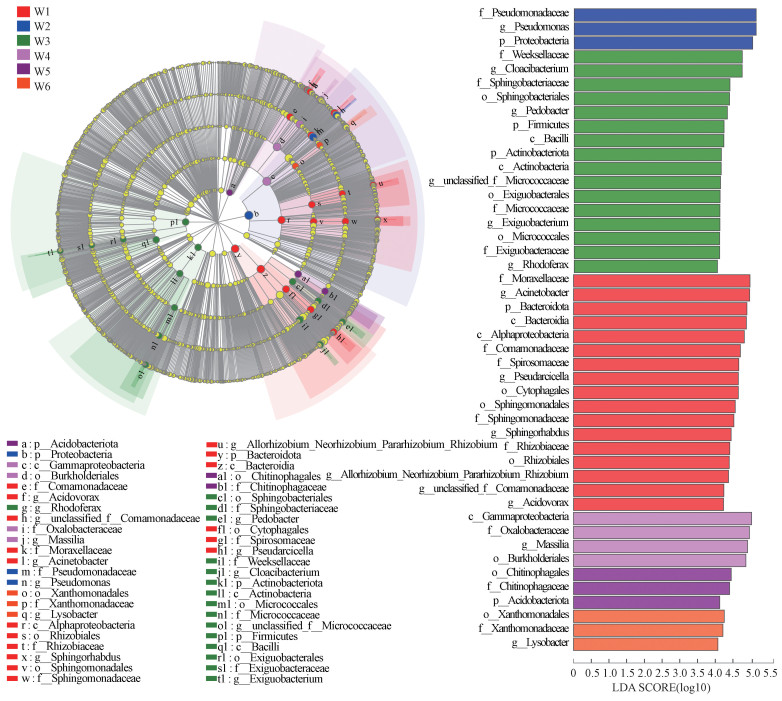 |
| 图 5 不同样品差异细菌分布 Fig. 5The distribution of the differential bacteria among different samples |
3.5 浮游细菌群落与环境因子分析采用VIF方差膨胀系数(variance inflation factor)进行环境因子筛选, 使用利用Canoco 5软件对属水平浮游细菌群落与环境因子进行DCA分析(图 6), 分析结果显示最大特征值为1.7921, 选择线性模型中RDA冗余分析(Redundancy Analysis)用以后续分析.理化因子对浮游细菌种群的贡献率为79.66%, 第一排序轴的解释度为64.45%, CODMn(R2=0.9181, p=0.001)、COD(R2=0.5238, p=0.004)和pH(R2=0.2917, p=0.065)与第一排序轴相关度较高;第二排序轴的解释度为15.21%, DO(R2=0.3609, p=0.041)和NH3-N(R2=0.0429, p=0.719)与第二排序轴相关度较高.其中CODMn、COD和DO是显著影响赤水河浮游细菌分布的理化因子(p < 0.05).CODMn、COD和pH对W2、W4、W5和W6样品浮游细菌的分布影响最大, DO对W1样品浮游细菌的分布影响最大, NH3-N对W3样品浮游细菌的分布影响最大.
图 6(Fig. 6)
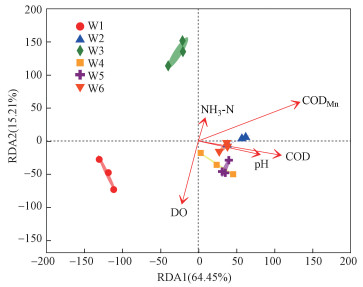 |
| 图 6 浮游细菌物种与环境因子的RDA分析 Fig. 6RDA analysis plot between bacterioplankton species and environmental factors |
将浮游细菌属分类单元与环境因子进行Spearman秩相关分析, 采用相关性热图进行展示(图 7)Brevundimonas、Acidovorax、Acinetobacter和Rhodoferax聚为一组, 这些物种和CODMn、COD、pH、NH3-N和TN负相关.unclassified_Comamonadaceae、Sphingorhabdus、Flavobacterium和Pseudarcicella聚为一组, 与CODMn、COD、pH、NH3-N、TN呈负相关的同时和DO呈显著正相关(p < 0.05).unclassified_Micrococcaceae、Cloacibacterium和Pedobacter聚为一组, 与CODMn、COD、pH、NH3-N、TN呈正相关, 和DO呈负相关.Pseudomonas与CODMn、COD、pH呈正相关, 和DO、NH3-N、TN呈负相关.Massilia、unclassified_Oxalobacteraceae、Pontibacter、Lysobacter和Brevibacillus聚为一支, 与CODMn、COD、pH、NH3-N、TN呈正相关, 和DO呈负相关.
图 7(Fig. 7)
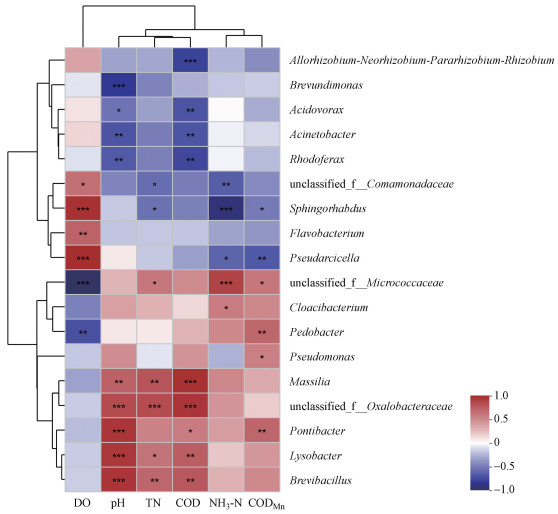 |
| 图 7 浮游细菌属分类单元与环境因子的Spearman相关分析热图 Fig. 7Heatmap showing the Spearman correlations between phytoplankton taxa and environment factors |
3.6 浮游细菌网络分析共现网络分析可以反映微生物群体物种间的联系及其与环境因子的相互作用.在本实验中, 计算物种之间的Spearman相关性, 筛选出相关系数绝对值大于0.5, p值小于0.05的物种, 并结合环境因子数据, 对赤水河6个采样位点18个样品的物种和环境因子构建共现网络(图 8), 网络分析共识别出50个网络节点, 平均最短路径长度2.692, 网络直径6, 分析结果表明赤水河物种和环境及物种与物种之间联通水平相对较高, 图中大致被分为两大部分, 左边网络的重要节点有CODMn、DO和NH3-N, 右边网络的重要节点包括COD和pH.TN、Novosphingobium、Stenotrophomonas和Pontibacter是左右两部分网络的重要节点.
图 8(Fig. 8)
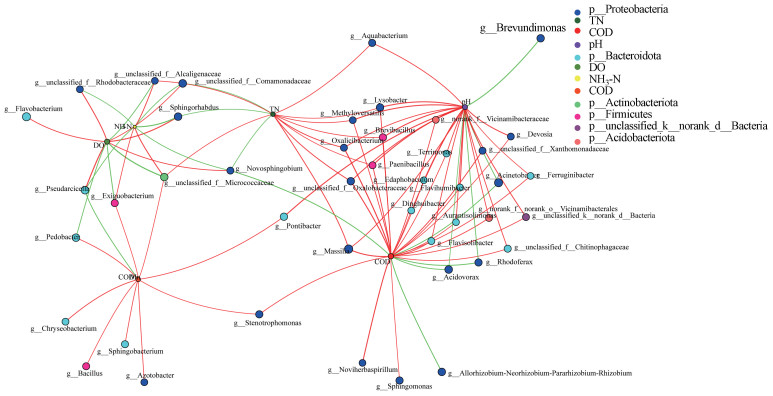 |
| 图 8 浮游细菌群落与环境因子的共现网络 Fig. 8Co-occurrence network of planktonic bacterial community and environmental factors |
3.7 PICRUSt2功能预测分析PICRUSt2可以针对16S扩增子测序结果样品中细菌群落的功能组成进行预测, 通过对KEGG数据库(Kyoto encyclopedia of genes and genomes)进行比对, 共获得6类生物代谢通路功能分析(一级功能层, 图 9a):代谢(metabolism)、环境信息处理(environmental information processing)、遗传信息处理(genetic information processing)、细胞过程(cellular processes)、人类疾病(human diseases)和有机系统(organismal systems).其中代谢、遗传信息处理和环境信息处理为其主要组成, 占比分别为66.01%~68.75%、8.39%~10.62%、7.82%~8.41%、6.66%~7.91%、5.34%~5.62%、2.22%~2.25%.不同浮游细菌群落功能预测比较表明, 代谢功能层预测基因拷贝数平均占比最高(66.55%), 依次为W1(68.75%)> W3(66.86%)> W4(66.28%)> W5(66.06%)> W6(66.01%)> W2(65.84%).同时对预测基因二级功能层进行分析(图 9b), 发现其由碳水化合物代谢(Carbohydrate metabolism)、氨基酸代谢(Amino acid metabolism)、能量代谢(Energy metabolism)、辅助因子和维生素的代谢(Metabolism of cofactors and vitamins)等46个二级功能组成.W1~W6的weighted NSTI值分别为0.12、0.13、0.08、0.11、0.15和0.14, 对6个样品的预测效果均较好.
图 9(Fig. 9)
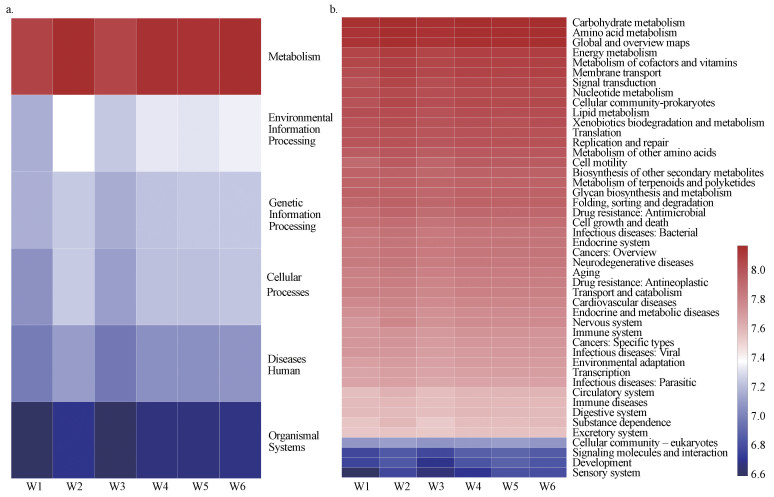 |
| 图 9 不同样品浮游细菌PICRUSt2功能预测 Fig. 9PICRUSt2 metabolic predictions of the bacterioplankton communities from different samples |
4 讨论(Discussion))4.1 赤水河浮游细菌群落结构赤水河系作为长江上游右岸一级支流, 也是长江上游目前唯一未被开发、被污染的一级支流, 对其浮游生物的研究已经逐渐展开(吴湘香等, 2014; 艾祖军等, 2015; 吴俣学等, 2020).与传统形态学检测浮游生物相比, 高通量测序技术极大地推动了浮游生物多样性的研究, 尤其是微型及微微型浮游生物(王丽平等, 2015;宋伦等, 2016).在本研究中, 高通量测序分析结果显示假单胞菌属(Pseudomonas, 丰度1.83%~28.51%)和马赛菌属(Massilia, 丰度3.46%~20.49%)是赤水河茅台镇的优势种群, 这与谭旭等(2014)在2014年对茅台地区赤水河水体浮游细菌群落中, 噬氢菌属(Acinetobacter)、Limnohabitans属为最优势菌属有所不同.说明随着时间的推移茅台地区赤水河浮游细菌群落结构发生了较大的变化, 环境条件及生物地理学差异对淡水生态系统浮游细菌群落组成产生影响(Callieri et al., 2008; Lepère et al., 2013).同时在不同采样点也存在较大的群落组成差异, 假单胞菌属(Pseudomonas)和马赛菌属(Massilia)是W2、W4、W5和W6的优势种群, 不动杆菌属(Acinetobacter)和黄杆菌属(Flavobacterium)是W1采样点的优势种群, 假单胞菌属(Pseudomonas)和不动杆菌属(Acinetobacter)是W3采样点的优势种群.LDA结果显示W1采样点的群落结构相较其他采样点差别较大, 如Acinetobacter、Pseudarcicella、Sphingorhabdus、Allorhizobium_Neorhizobium_Pararhizobium_Rhizobium、unclassified_Comamonadaceae、Acidovorax等属, 其含量远高于其他样本.这可能是因为W1采样点位于赤水河流域的上游, 其河水流速更为湍急, 生境较其它位点相差较大, 河水中含氧量更高, 促进了部分好氧细菌的扩繁;W5、W6采样点的微生物丰度变大, 其多样性也大大增加, 这可能是因为茅台镇人类的生产生活给河水中带来了有机物, 丰富了河水的物质组成, 导致下游微生物菌群丰富度升高.
4.2 浮游细菌落结构与理化因子的响应一般而言, 水体的理化性质对其浮游生物的物群落组成具有较大的影响(Cudowski et al., 2015; Reich et al., 2017).冗余分析结果显示CODMn、COD和DO是显著影响赤水河浮游细菌分布的理化因子(p < 0.05).这3个环境因子连同NH3-N、TN、Novosphingobium、Stenotrophomonas和Pontibacter共同构成了该地区群落结构网络的重要节点.TN超标是库区和流域重要环境问题(Lepère et al., 2013; Chen et al., 2015).TN曾被证明是影响河流生态系统细菌群落组成和功能的重要因素(Wu et al., 2017).在本研究中, 赤水河中下游W4、W5和W6处位点的TN含量显著高于上游W1、W2处的含量, 表明茅台镇人类行为改变了赤水河的TN含量, 加剧了水生环境中的氮负荷和富营养化水平, 因而造成了细菌群落结构多样性和丰度的显著变化(p < 0.05).该研究结果与长江三角洲秦淮河沉积物中细菌群落组成主要与TN含量有关(Cai et al., 2016).
CODMn常被作为地表水体受有机污染物和还原性无机物质污染程度的综合指标, 广泛应用于饮用水、水源水和地表水的测定(GB11892-89), COD和CODMn代表着样点受有机物污染的程度, 其对浮游微型生物群落结构有着显著的影响(Scholz et al., 1998; Jiang et al., 2007).在本研究中, CODMn、COD和pH对W2、W4、W5和W6样品浮游细菌的分布影响较大, 表明W2、W4、W5和W6这些地区受到有机污染物的影响较大.随着COD和CODMn浓度的升高, unclassified_Micrococcaceae、Cloacibacterium、Pedobacter、Pseudomonas、Massilia等微生物的相对丰度有所增加, 这些物种多为环境适应型微生物, 对流域生态中的有机物污染有较好的耐受性;而Brevundimonas、Acidovorax、Acinetobacter、Rhodoferax等微生物随着COD和CODMn浓度的增加, 其丰度有所下降, 这些细菌多数为环境敏感型微生物, 对淡水生境的有机污染物的耐受性较低.
DO通常可以用于衡量水质和水体受到的污染程度, 常作为有机物污染程度的重要指标(Diaz et al., 2008).赤水河茅台镇段水体中unclassified_Comamonadaceae、Sphingorhabdus、Flavobacterium和Pseudarcicella与DO呈显著正相关(p < 0.05), unclassified_Micrococcaceae和Pedobacter与DO呈显著负相关(p < 0.05).Spietz等(2015)研究发现美国Hood Canal浮游细菌群落多样性与DO呈显著负相关(p < 0.05), 浮游细菌组成主要受到DO的影响.本实验所有样品中W1样品浮游细菌的分布受DO影响最大.
微生物参与的氮循环是生态系统中氮循环的主要驱动力(王欢等, 2018).水生态环境中, 溶解性无机氮是异养细菌重要的氮源, 但是过量的氮素可能导致水体富营养化, 造成水质恶化.W3样品浮游细菌的分布受NH3-N的影响最大.肥料和生物的粪便通常是氨氮的主要来源, 氨氮对水生物起危害作用的主要是游离氨, 并随碱性的增强而增大, 所以对W3采样点加强NH3-N与pH的监测显得尤为重要.分析发现赤水河茅台镇段中浮游细菌unclassified_Micrococcaceae和Cloacibacterium与NH3-N呈显著正相关(p < 0.05), 表明环境中的无机氮也是影响微生物群落组成的重要因素.为控制水体中微生物的数量, 建议控制赤水河流域人类活动对水体中营养物质尤其是氮素的排放.
4.3 浮游细菌功能预测分析基于高通量测序的PICRUSt2功能预测分析方便快捷、成本低, 同时预测效果可靠性较高(Langille et al., 2013).目前该方法已在土壤、水体微生物等不同生境中得到良好地应用, 为探明微生物的功能提供了技术依据(Zarraonaindia et al., 2015; Sun et al., 2016; Zhu et al., 2016; 刘睿等, 2017; 吕明姬等, 2011; 赵君等, 2020).PICRUSt2功能预测在赤水河茅台镇段浮游细菌功能分析的研究还未展开.董志颖等(2018)采用PICRUSt功能预测分析过量氮输入对细菌群落代谢潜力的影响, 发现氮输入在一定程度上影响了微宇宙中的固氮、硝化、异化硝酸盐还原、反硝化、异化硝酸盐还原和同化硝酸盐还原等途径的关键基因.将PICRUSt2功能分析应用于赤水河茅台镇段的浮游细菌分析有助于了解其细菌功能和进行功能预测.分析显示赤水河茅台镇段的浮游细菌主要涉及代谢、环境信息处理等6类生物代谢通路, 其中代谢通路占主要地位.次生产物代谢的碳水化合物代谢、氨基酸代谢、能量代谢、辅助因子和维生素的代谢等46个子功能, 表现了功能上的丰富性.与Langille等(2013)研究的土壤样品的平均指数为0.17和孙峰等(2019)关于丹江口库区库滨带植被土壤细菌NSTI指数为0.17~0.23相比, 本实验NSTI平均值为0.12, 显示出了较好的预测效果和准确性.该结果基本探明了赤水河茅台镇段的浮游细菌功能的组成, 未来结合宏基因组分析和代谢等功能基因分析, 有利于准确掌握赤水河浮游细菌群落组成和氮、磷、有机物等循环过程中微生物群落的功能.
5 结论(Conclusions)高通量测结果表明赤水河茅台段浮游细菌主要由55门、167纲、415目、706科、1431属组成, 假单胞菌属(Pseudomonas)和马赛菌属(Massilia)是相对优势种群, COD、CODMn和DO显著影响浮游细菌群落的分布.CODMn、DO、NH3-N、COD、pH、TN、Novosphingobium、Stenotrophomonas和Pontibacter是浮游细菌群网络构建的关键节点.对细菌群落的功能组成进行PICRUSt2预测, 发现共由6类一级生物代谢通路和46个二级功能组成, 其中代谢、遗传信息处理和环境信息处理为其主要一级代谢通路, weight NSTI平均值为0.12, 表现出了较好的预测效果.
参考文献
| 艾祖军, 何滔, 刘建虎, 等. 2015. 赤水河妥泥河段浮游植物的群落结构及水质现状调查[J]. 淡水渔业, 45(1): 58-61. DOI:10.3969/j.issn.1000-6907.2015.01.011 |
| Cai W, Li Y, Wang P, et al. 2016. Revealing the relationship between microbial community structure in natural biofilms and the pollution level in urban rivers: A case study in the Qinhuai River basin, Yangtze River Delta[J]. Water Science & Technology, 74(5): 1163-1176. |
| Callieri, Cristiana. 2008. Picophytoplankton in freshwater ecosystems: the importance of small-sized phototrophs[J]. Freshwater Reviews, 1(1): 1-28. DOI:10.1608/FRJ-1.1.1 |
| Caporaso J G, Kuczynski J, Stombaugh J, et al. 2010. QIIME allows analysis of high-throughput community sequencing data[J]. Nature Methods, 7(5): 335-336. DOI:10.1038/nmeth.f.303 |
| 陈兆进, 陈海燕, 李玉英, 等. 2017. 南水北调中线干渠(河南段)浮游细菌群落组成及影响因素[J]. 中国环境科学, 37(4): 1505-1513. DOI:10.3969/j.issn.1000-6923.2017.04.038 |
| Chen P, Li L, Zhang H B. 2015. Spatio-temporal variations and source apportionment of water pollution in Danjiangkou Reservoir Basin, Central China[J]. Water, 7: 2591. DOI:10.3390/w7062591 |
| Cudowski A, Pietryczuk A, Hauschild. 2015. Aquatic fungi in relation to the physical and chemical parameters of water quality in the Augustów Canal[J]. Fungal Ecology, 13: 193-204. DOI:10.1016/j.funeco.2014.10.002 |
| Dhariwal A, Chong J, Habib S, et al. 2017. Microbiome analyst: A web-based tool for comprehensive statistical, visual and meta-analysis of microbiome data[J]. Nucleic Acids Research, 45(W1): W180-W188. DOI:10.1093/nar/gkx295 |
| Diaz R J, Rosenberg R. 2008. Spreading dead zones and consequences for marine ecosystems[J]. Science, 321: 926-929. DOI:10.1126/science.1156401 |
| Jiang J G, Shen Y F. 2007. Development of the microbial communities in Lake Donghu in relation to water quality[J]. Environmental Monitoring and Assessment, 127(1): 227-236. |
| 谷阳. 2010. 白山水库及周围水体浮游生物分布的季节性变化及影响因素研究[M]. 长春: 东北师范大学. |
| 国家环境保护总局. 2002. 水和废水监测分析方法-第4版[M]. 北京: 中国环境科学出版社. |
| 黄艺, 舒中亚. 2013. 基于浮游细菌生物完整性指数的河流生态系统健康评价-以滇池流域为例[J]. 环境科学, 34(8): 3010-3018. |
| Langille M G I, Zaneveld J, Caporaso J G, et al. 2013. Predictive functional profiling of microbial communities using 16S rRNA marker gene sequences[J]. Nature Biotechnology, 31(9): 814-821. DOI:10.1038/nbt.2676 |
| Lepère C, Domaizon I, Ta?b N, et al. 2013. Geographic distance and ecosystem sizedetermine the distribution of smallest protists in lacustrine ecosystems[J]. FEMS Microbiology Ecology, 85(1): 85-94. DOI:10.1111/1574-6941.12100 |
| 刘睿, 吴巍, 周孝德, 等. 2017. 渭河浮游细菌群落结构特征及其关键驱动因子[J]. 环境科学学报, 37(3): 934-44. |
| 吕明姬, 汪杰, 范铮, 等. 2011. 滇池浮游细菌群落组成的空间分布特征及其与环境因子的关系[J]. 环境科学学报, 31(2): 299-306. |
| Scholz M, Martin R J. 1998. Control of bio-regenerated granu-lar activated carbon by spreadsheet modelling[J]. Journal of Chemical Technology and Biotechnology, 71(3): 253-261. DOI:10.1002/(SICI)1097-4660(199803)71:3<253::AID-JCTB834>3.0.CO;2-Y |
| Newton R J, Jones S E, Eiler A, et al. 2011. A guide to the natural history of freshwater lake bacteria[J]. Microbiology & Molecular Biology Reviews Mmbr, 75(1): 14-49. |
| Reich M, Wichels A, Panzer K, et al. 2017. Impacts of a reduction in seawater pH mimicking ocean acidification on the structure and diversity of mycoplankton communities[J]. Aquatic Microbial Ecology, 79: 221-233. DOI:10.3354/ame01831 |
| 任丽娟, 何聃, 邢鹏, 等. 2013. 湖泊水体细菌多样性及其生态功能研究进展[J]. 生物多样性, 21(4): 421-432. |
| Spietz R L, Williams C M, Rocap G, et al. 2015. A dissolved oxygen threshold for shifts in bacterial community structure in a seasonally hypoxic estuary[J]. Plos One, 10: e0135731. DOI:10.1371/journal.pone.0135731 |
| Rivas M N, Burton O T, Wise P, et al. 2013. A microbiota signature associated with experimental food allergy promotes allergic sensitization and anaphylaxis[J]. J Allergy Clin Immunol, 131(1): 201-212. DOI:10.1016/j.jaci.2012.10.026 |
| 宋伦, 吴静, 刘卫东. 2016. 渤海长兴岛海域微型和微微型浮游植物多样性[J]. 环境科学研究, 29(11): 1635-1642. |
| 孙峰, 田伟, 张菲, 等. 2019. 丹江口库区库滨带植被土壤细菌群落多样性及PICRUSt功能预测分析[J]. 环境科学, 40(1): 421-429. |
| Sun D, Meng J, Xu E G, et al. 2016. Microbial community structure and predicted bacterial metabolic functions in biochar pellets aged in soil after 34 months[J]. Applied Soil Ecology, 100: 135-143. DOI:10.1016/j.apsoil.2015.12.012 |
| 谭旭. 2014. 茅台地区赤水河水体微生物多样性分析[M]. 北京: 北京化工大学. |
| 唐静杰. 2009. 水生植物-根际微生物系统净化水质的效应和机理及其应用研究[M]. 无锡: 江南大学. |
| Ward C S, Yung C M, Davis K M, et al. 2017. Annual community patterns are driven by seasonal switching between closely related marine bacteria[J]. The ISME Journal, 11(6): 1412-1422. DOI:10.1038/ismej.2017.4 |
| 王欢, 赵文, 谢在刚, 等. 2018. 碧流河水库细菌群落结构特征及其关键驱动因子[J]. 环境科学, 39(8): 3660-3669. |
| 王丽平, 林承刚, 许强. 2015. 秦皇岛褐潮爆发敏感海域细菌种群特征[J]. 环境科学研究, 28(6): 899-906. |
| Wu H, Li Y, Zhang J, et al. 2017. Sediment bacterial communities in a eutrophic lake influenced by multiple inflow-rivers[J]. Environmental Science and Pollution Research, 24: 19795-19806. DOI:10.1007/s11356-017-9602-4 |
| 吴湘香, 李云峰, 沈子伟, 等. 2014. 赤水河浮游植物群落结构特征及其与水环境因子的关系[J]. 中国水产科学, 21(2): 361-368. |
| 吴俣学, 李娟, 闵文武. 2020. 赤水河流域冬季浮游动物的群落结构特征[J]. 农技服务, 37(10): 109-110. |
| Yi Z, Jie L, Cheng X, et al. 2018. Community differentiation of bacterioplankton in the epipelagic layer in the South China Sea[J]. Ecology and Evolution, 8(10): 4932-4948. DOI:10.1002/ece3.4064 |
| 阴星望, 田伟, 丁一, 等. 2018. 丹江口库区表层沉积物细菌多样性及功能预测分析[J]. 湖泊科学, 30(4): 1052-1063. |
| Zarraonaindia I, Owens S M, Weisenhorn P, et al. 2015. The soil microbiome influences grapevine-associated microbiota[J]. MBio, 6(2): e02527-02514. |
| 赵君, 王鹏, 徐启渝, 等. 2020. 袁河流域不同土地利用方式下河流浮游细菌群落结构特征[J]. 环境科学学报, 40(3): 890-900. |
| 中华人民共和国国家标准. 水质高锰酸盐指数的测定, GB11892-89, 国家环境保护局, 1989-12-25批准 |
| Zhu S, Vivanco J M, Manter D K, et al. 2016. Nitrogen fertilizer rate affects root exudation, the rhizosphere microbiome and nitrogen-use-efficiency of maize[J]. Applied Soil Ecology, 107: 324-333. DOI:10.1016/j.apsoil.2016.07.009 |
