 , 骆阳1, 王志红1, 宋阳1, 刘立凡1, 李布林1, 李伟光2,3
, 骆阳1, 王志红1, 宋阳1, 刘立凡1, 李布林1, 李伟光2,3

1. 广东工业大学土木与交通工程学院, 广州 510006;
2. 哈尔滨工业大学环境学院, 哈尔滨 150090;
3. 城市水资源与水环境国家重点实验室(哈尔滨工业大学), 哈尔滨 150090
收稿日期: 2020-08-25; 修回日期: 2020-09-14; 录用日期: 2020-09-14
基金项目: 国家自然科学基金面上项目(No.51578178);广东省自然科学基金面上项目(No.2020A1515010719);国家自然科学基金青年基金项目(No.51908143);广东省教育厅创新强校项目-青年创新人才类项目(No.2018KQNCX194)
作者简介: 秦雯(1988-), 女, E-mail:qinwenhit@163.com
通讯作者(责任作者): 李伟光(1962—), 男, 教授, 博士生导师, 主要研究方向为:城镇饮用水水质安全保障技术, 污(废)水处理与资源化, 固体废弃物减量化、资源化与能源化, 发表论文70余篇.E-mail:hitlwg@126.com
摘要:为优化生物活性炭滤池活性炭上细菌数的流式细胞术定量分析的预处理方法,本研究考察了4种物理预处理方式(机械振荡、低能量超声、高能量超声、机械振荡耦合高能量超声)以及4种化学预处理方式(含10%的柠檬酸(Citric Acid,CA)和2.5%的羟基乙酸(Glycolic acid,GA)混合液(CA+GA)、溶菌酶、吐温20、乙二胺四乙酸)对流式细胞术测定活性炭滤料上细菌数的影响,结果表明,在无菌超纯水为提取液时,机械振荡耦合高能量超声预处理后测定的细菌数最高(9.7(±1.2)×107 cells·g-1(以WW活性炭计,下同)),是最佳的物理预处理方式.0.1% CA+GA为最优的化学分散剂,耦合机械振荡与1次高能量超声预处理后细胞累积回收率较空白组(无菌超纯水)提高了21%±17%,其活细菌数也最高(约1.0×107 cells·g-1);耦合机械振荡与3次高能量超声预处理后,分离的生物膜细菌量最高(1.5(±0.2)×108 cells·g-1),证明0.1% CA+GA耦合机械振荡与3次高能量超声是利用流式细胞术测定活性炭生物膜的细菌数的最佳预处理方式.
关键词:细菌数活性炭滤料流式细胞术超声处理化学分散剂
The optimized pretreatment method for flow-cytometric quantification of microbial cells on activated carbon from BAC filters
QIN Wen1
 , LUO Yang1, WANG Zhihong1, SONG Yang1, LIU Lifan1, LI Bulin1, LI Weiguang2,3
, LUO Yang1, WANG Zhihong1, SONG Yang1, LIU Lifan1, LI Bulin1, LI Weiguang2,3

1. School of Civil and Transportation Engineering, Guangdong University of Technology, Guangzhou 510006;
2. School of Environment, Harbin Institute of Technology, Harbin 150090;
3. State Key Laboratory of Urban Water Resource and Environment(Harbin Institute of Technology), Harbin 150090
Received 25 August 2020; received in revised from 14 September 2020; accepted 14 September 2020
Abstract: To optimize the pretreatment method of flow cytometric quantification of microbial cells on activated carbon from biological activated carbon filters,four physical pretreatment methods,including mechanical oscillation,low energy sonication,high energy sonication,mechanical oscillation and high energy sonication coupling,and four chemical pretreatments (four dispersants,i.e.,CA+GA,containing 10% citric acid (CA) and 2.5% glycolic acid (GA),lysozyme,Tween 20 and ethylenediaminetetraacetic acid) were investigated in this study. The results showed that mechanical oscillation and high energy sonication coupling pretreatment was the best physical pretreatment method,which obtained the highest biomass (9.7(±1.2)×107 cells·g-1 WW activated carbon) by flow cytometric quantification when the sterile ultrapure water was the extraction solution. 0.1% CA+GA was the best chemical dispersant because the cumulative recovery rate of cells after 1 cycle of mechanical oscillation and 1 cycle of high energy sonication pretreatment was 21%±17% higher than that of the blank group (sterile ultrapure water),and the intact bacteria count was also the highest (about 1.0×107 Cells·g-1). 0.1% CA+GA as the extraction solution,coupling with one cycle of mechanical oscillation and 3 cycles of high energy sonication pretreatment which performed the highest amount of bacteria (1.5(±0.2)×108 cells·g-1),was consequently the optimal pretreatment method for flow cytometric quantification of microbial cells on activated carbon from biological activated carbon filters in this study.
Keywords: Biomassactivated carbonflow cytometrysonicationchemical dispersants
1 引言(Introduction)生物活性炭(Biological Activated Carbon, BAC)工艺, 同时具有活性炭吸附和微生物降解的协同效能, 是一种经济高效且应用广泛的深度处理技术(黄晓婷等, 2011;Umar et al., 2016;Yang et al., 2016;Glover et al., 2018;Sun et al., 2018;张浩然等, 2018).大量研究表明, BAC工艺在长期运行过程中对水中污染物的去除主要依赖于活性炭载体表面富集的生物膜的生物降解作用(Hammes et al., 2008;Han et al., 2013;Pharand et al., 2015;Qin et al., 2017), 那么, 针对BAC载体上生物膜特性的研究具有重要意义.其中, 细菌数作为一个考察指标, 是研究微生物的生长速率、底物的利用速率以及质量守恒等机理的基础(Qin et al., 2016;Hammes et al., 2008), 因此, 对BAC工艺活性炭载体上细菌数进行准确地定量是十分必要的.
目前, 水处理中生物滤池中微生物的定量方法主要包括平板计数法(Heterotrophic Plate Counts, HPC)、挥发性固体(Volatile Solid, VS)定量法、三磷酸腺苷(Adenosine TriPhosphate, ATP)定量法、实时荧光定量核酸扩增(Quantitative Polymerase Chain Reaction, qPCR)定量法及流式细胞技术(Flow CytoMetry, FCM)定量法(Magic-Knezev et al., 2004;Hammes et al., 2008;Vignola et al., 2018).平板计数法、ATP和qPCR定量法均存在一定程度的局限性:平板计数法仅能对可人为培养的少部分细菌进行定量(通常 < 所有细菌的1%), 而且标准方法不统一, 培养基组成、培养温度及培养时间差异性大(Nevel et al., 2017);ATP定量法是间接定量法, 需基于每个细胞平均ATP含量相等的假设进行(王绍鑫等, 2014);qPCR定量方法的DNA提取效率差异大, 引物具有特异性(朱薇等, 2018).FCM定量法是对悬液中的单细胞或其他生物粒子, 通过检测标记的荧光信号, 实现高速、逐一的细胞定量分析和分选的技术, 可以对液体样品直接进行细胞定量分析, 能够克服上述3种方法的局限性, 实现全球范围内相关研究中所测定的细菌数的平行比较(林怡雯等, 2013;Nevel et al., 2017;Vignola et al., 2018), 因此, FCM逐渐被应用于在水处理过程中的细菌检测和研究.Nevel等(2017)的综述通过大量文献数据的支持, 对比了FCM与传统HPC及ATP定量法, 发现在FCM和HPC数据之间未发现良好的相关性(n= 3675);FCM和ATP数据之间具有良好的相关性(n=1441);且FCM测量值可再现, 相对标准偏差低于3%.Vignola等(2018)交叉比较了FCM定量法与VS定量法、ATP定量法及qPCR定量法对生物滤池中石英砂滤料上的微生物的定量效果, 在相同的预处理条件下, VS定量法获得VS含量与所有其他3种方法之间的相关性较弱(FCM的皮尔逊相关系数(ρ)= 0.005, ATP的ρ = 0.002和qPCR的ρ=0.005), 表明VS定量法在检测石英砂样品上生物量时是一种不准确的方法;FCM定量法与ATP定量法和qPCR定量法获得的数值具有高度相关性(ρ= 0.98和ρ= 0.91), 而且FCM定量法和ATP定量法的绝对计数之间具有最强的一致性, 相关斜率等于0.7;FCM定量法和qPCR定量法相比, qPCR定量法基本将细胞计数高估了10倍左右(相关斜率等于0.09).上述文献证实FCM定量方法可靠、可重复性高, 而且检测的结果可与其他替代量化方法的数据相媲美, 这使其非常适合常规定量检测生物滤池中滤料上的微生物细胞丰度.
BAC工艺活性炭载体上生物膜是附着于活性炭表面被细菌胞外聚合物包裹的细菌群体, 而FCM只能检测液体样品中细菌数量, 那么, 如何从活性炭载体表面将生物膜分离, 同时使生物膜内细菌释放至液相中, 并且在液相中保持单一且分散的状态, 是利用FCM检测BAC载体上细菌数量方法的关键.大量研究表明, 超声处理可以将固体样品表面生物膜进行有效地分离, 且不同强度的超声处理对细菌生物膜的作用机制不同:低能量超声处理(Low Energy Sonication, LES)可降低对细菌的运动和粘附能力(Erriu et al., 2014), 高能量超声处理(High Energy Sonication, HES)则通过破坏生物膜中胞外基质使细菌脱离分散(Pitt et al., 2010;王宜静等, 2019).Magic-Knezev等(2004)在检测BAC工艺载体上细菌数时, 发现HES预处理对活性炭载体效果最优.Vignola等(2018)在进行水处理中石英砂滤滤池载体上细菌数的检测条件优化研究时, 发现通过化学分散剂(吐温80和焦磷酸钠混合液)化学预处理, 并结合4个周期的HES物理预处理, 对石英砂样品上利用FCM技术的细菌数检测效果最优.然而, 关于针对FCM技术优化BAC工艺中活性炭样品上细菌数检测效果的预处理方法的研究鲜少报道.为此, 本研究针对FCM定量法, 考察了机械振荡(Treatment-0, T0)、低能量超声(LES)、高能量超声(HES)以及机械振荡和高能量超声耦合(T0-HES)4种物理预处理方式对BAC工艺活性炭载体上细菌数检测效果的影响, 优选了可作为提取液的化学表面活性剂/离子分散剂, 研究了化学和物理预处理耦合方式对生物膜细胞分离的优化效果, 并阐明了预处理方法的作用机理, 以期为水处理过程中生物滤池滤料上细菌数的测定提供技术参考.
2 材料与方法(Materials and methods)2.1 活性炭样品采集与保存优化实验所需的活性炭样品均来自一个实验室规模的上向流BAC滤柱.在取样前打开BAC滤柱的泄空阀, 使其完全地排水.采用无菌金属药匙提取活性炭样品, 在滤层的顶部处取样, 并将活性炭样品转移到无菌的50 mL离心管中, 样品检测前均放置在4 ℃的冰箱(黑暗环境)中储存.为避免样品储存时间在不同的优化实验之间存在差异, 因此, 对进行交互比较的生物膜分离的预处理优化实验, 均在同一天完成.
2.2 细菌数检测的预处理优化实验从1 g湿重(Wet Weight, WW)的活性炭样品中提取微生物, 首先, 将样品分别浸没在10 mL不同分散剂的提取溶液中进行化学预处理, 超纯水为空白对照实验;然后, 分别进行不同的物理预处理步骤:①在室温25 ℃、转速120 r · min-1条件下机械振荡1 h(T0);并/或②采用超声波水浴(Bandelin Sonorex)进行一次为期4 min的低能量超声(LES);并/或③采用超声波探针(Bandelin Sonopuls HD 2200)进行1次或多次高能量超声(HES), HES每次操作时间为30 s(每1 s间歇1 s), 在每次HES结束后立即将9 mL上清液转移至15 mL无菌的离心管中, 接着加入9 mL新鲜的提取溶液, 继续进行下一次HES.本文中, 预处理实验及空白实验每组均做3个平行实验.
2.2.1 物理预处理机械振荡vs低能量超声vs高能量超声vs振荡与超声耦合
(1) 机械振荡(T0)
将1g WW活性炭和10 mL提取液同时置于50 mL锥形瓶中, 并将其放置在转速为120 r · min-1的恒温摇床中机械振荡, 1 h后, 取锥形瓶中液体样品, 用无菌超纯水稀释10倍后, 通过FCM检测总细胞浓度(Total Cell Count, TCC)和完好细胞浓度(Intact Cell Count, ICC), 并计算单位质量活性炭样品上细菌量(单位:cells · g-1).
(2) 低能量超声(LES, 超声波水浴)
将1 g WW活性炭和10 mL提取液同时置于15 mL无菌离心管中, 将其淹没于超声波水浴(Bandelin Sonorex, 240 W)中, 进行一次时间为4 min的低能量超声步骤, 然后取离心管中上层清液, 用无菌超纯水稀释10倍后, 通过FCM检测TCC和ICC, 并计算单位质量活性炭样品上细菌量(单位:cells · g-1).
(3) 高能量超声(HES, 超声波探针)
将1 g WW活性炭和10 mL提取液同时置于15 mL无菌离心管中, 采用超声波探针(Bandelin Sonopuls HD 2200, 200W)进行一次或多次HES步骤, 每次HES的操作时间持续30 s(每1 s间歇1 s), 在每次HES结束后立即将9 mL上清液转移至一个新的15 mL无菌的离心管中, 接着在原离心管中加入9 mL新鲜的提取溶液, 继续进行下一次HES.完成所有HES步骤后, 分别取各个离心管中上层清液, 用无菌超纯水稀释10倍后, 通过FCM检测TCC和ICC, 并计算该样品的单位质量活性炭样品上细菌量(单位:cells · g-1).
(4) 机械振荡与高能量超声耦合方式(T0-HES)
首先, 按照2.2.1(1)中机械振荡步骤操作;然后, 将完成振荡步骤的活性炭样品转移至15 mL无菌离心管中, 并加入10 mL新的提取液;接着, 按照2.2.1(3)中高能量超声的操作步骤进行1次或多次HES;最后, 将各步骤中获得的上层清液, 用无菌超纯水稀释10倍后, 通过FCM检测TCC和ICC, 并计算该样品的单位质量活性炭样品上细菌量(单位:cells · g-1).
上述预处理后获得的菌液在2 h内进行细胞计数, 采用FCM检测每个液体样品的TTC和ICC.从1 g WW活性炭样品中提取的细胞总数为在每个预处理步骤中回收的细胞总和.
2.2.2 化学预处理:4种分散剂vs超纯水通过4种分散剂对滤料上生物膜的分离效果进行强化:①不同质量浓度(1%、0.1%、0.01%、0.001%)的BD AccuriTM浓缩清洗液, 其含有10%的柠檬酸(Citric Acid, CA)和2.5%的羟基乙酸(Glycolic acid, GA), 文中用CA+GA表示;②不同质量浓度(1%、0.1%、0.01%)的溶菌酶(lysozyme), 溶菌酶又称N-乙酰胞壁质聚糖水解酶(N-acetylmuramide glycanohydrlase), 是一种能水解细菌中黏多糖的碱性酶;③质量浓度为5%的吐温20溶液;④ 50 mmol · L-1的乙二胺四乙酸(EthyleneDiamineTetraacetic Acid, EDTA)溶液.超纯水作为化学预处理实验中的空白对照组.
在每个处理步骤中的细胞累积回收率, 用不同分散剂作为提取液时检测的细胞总数与整个预处理完成后的对照样品(超纯水为提取液)中细胞总数之比来表示, 用公式表示为:
 |
3 结果与讨论(Results and discussion)3.1 物理预处理方式对细菌数检测效果影响针对流式细胞技术对生物滤池滤料上微生物进行有效定量, 本研究首先采用了4种物理预处理方式(机械振荡(T0)、低能量超声(LES)、高能量超声(HES)及机械振荡耦合高能量超声(T0-HES))对活性炭载体进行预处理, 制备了细菌悬浮液后, 进而采用FCM法进行细菌定量.图 1表示以超纯水为提取液时, T0、LES、HES及T0-HES四种物理预处理方式对FCM测定活性炭载体上细菌总数的影响.
图 1(Fig. 1)
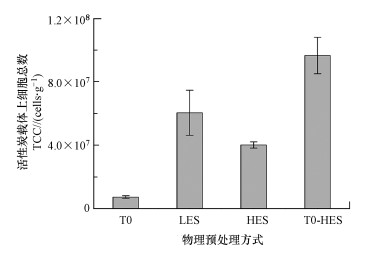 |
| 图 1 不同物理预处理(机械振荡(T0)、低能量超声(LES)、高能量超声(HES)及机械振荡与高能量超声耦合(T0-HES))对细菌数检测效果的影响 Fig. 1Effect of different physical pretreatments (T0, LES, HES and T0-HES) on biomass detection |
由图 1可知, 超纯水为提取液时, 不同物理预处理方式获得的细菌总数(cells · g-1)的排序为:T0-HES(9.7(±1.2)×107)> LES(6.1(±1.4)×107)> HES(4.0(±0.2)×107)> T0(7.3(±0.8)×106).T0-HES方式提取分离的细菌总数最高, 分别是T0、HES和LES的13.2倍、2.4倍和1.6倍, 这可能与物理预处理的振动强度与持续时间有密切关系:本研究中T0采用摇床振荡, 转速为120 r · min-1, 只能通过较低能量的振动, 将附着在活性炭载体表面的一部分细菌脱离;HES采用超声波探针进行, 虽然其振动强度最高, 高能量超声通过破坏生物膜中胞外基质进而使其脱离分散(Pitt et al., 2010;王宜静等, 2019), 但是1次HES的操作时间很短, 仅持续30 s(每1 s间歇1 s);LES是采用超声水浴方式进行, 其振动频率介于T0和HES之间, 可降低对细菌的运动和粘附能力(Erriu et al., 2014), 且每次持续时间(4 min)较HES长, 因此, T0、LES和HES的对比中, 持续时间为4 min的LES所分离的细菌量最大.然而, 部分研究表明, 在从活性炭滤料和石英砂滤料上分离生物膜的过程中, 高能超声处理的效果显著优于低能超声处理(Magic-Knezev et al., 2004;Vignola et al., 2018), 这与本研究中所获得的研究结果相反, 这是由于其研究结论是在HES预处理时长较长且连续作用的条件下获得的, 其中, Vignola等(2018)的研究中, LES采用120 W、40 kHz的超声水浴处理3 min, HES的具体条件是采用27 W超声波探头连续处理80 s;Magic-Knezev等(2004)研究中, LES的具体条件为180 W、43 kHz的超声水浴处理2 min, HES的具体条件是10~40 W、20 kHz的超声波探头连续处理2 min.
本研究中, 机械振荡耦合与高能量超声(T0-HES)方式获得最优的生物膜分离效果, 这是由于前期的机械振荡可通过低能量的振动, 将附着在活性炭载体表面的部分松散分布的细菌脱离, 并且使载体孔隙中生长的细菌暴露在表面, 随之对活性炭载体再次进行高能量的超声振荡, 破坏了载体大孔和中孔孔隙中附着生物膜中胞外基质进而使其脱离分散, 因而此耦合预处理方式获得了最佳的生物膜脱离与细胞分散效果.
3.2 化学-物理预处理耦合对细菌数检测效果的影响在最优的物理预处理(T0-HES)条件下, 研究了4种化学试剂(CA+GA、溶菌酶、吐温20、EDTA)作为提取液时对活性炭载体上累积细胞回收率以及细胞完整性的影响.
3.2.1 分散剂对累积细胞回收率的影响图 2为不同化学预处理实验组中累积细胞回收率的情况.由图 2a可知, 质量浓度为0.1% CA+GA作为提取液时, 在经历了1 h机械振荡与1次高能量超声(T0-HES)耦合预处理后, 获得了最高的细胞累积回收率, 即相比于空白组(无菌超纯水)从活性炭样品中多提取了21%±17%的细菌数.其次, 1% CA+GA为提取液时, 获得的细菌数量基本与空白组一致.而其他种类的分散剂(溶菌酶、吐温20和EDTA)作为提取液时, 细菌累积回收率均低于100%, 说明在对活性炭样品进行生物膜分离时, 其他种类分散剂的效果低于超纯水的效果.这一现象并非特例, 在Vignola等(2018)研究中, 与灭菌的自来水进行对比, 同样也发现氯化钠、氯化钙、焦磷酸钠及非离子表面活性剂Triton-X100在与HES联合使用进行固体样品的预处理时, 用FCM检测时获得的细菌累积回收率也仅达到50%~90%.这结论与Chen等(2000)的研究中氯化钠、氯化钙、非离子表面活性剂Triton-X100发挥最佳分散效果的结果相违背, 而此现象的原因也尚未明确.
图 2(Fig. 2)
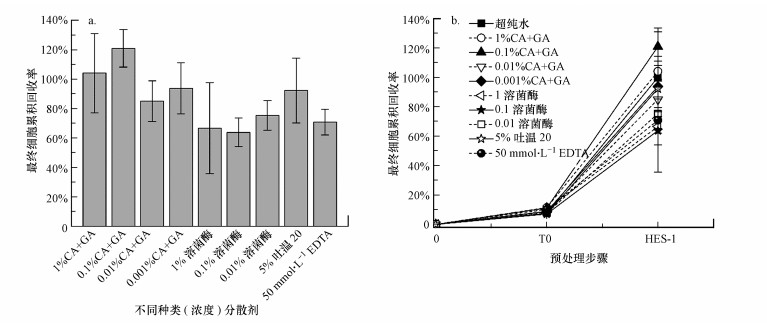 |
| 图 2 与空白组(超纯水)相比较时, (a)不同种类(浓度)分散剂对最终步骤累积细胞回收率的影响;(b)不同种类(浓度)分散剂对不同预处理步骤对应的累积细胞回收率的影响 Fig. 2Effect of different dispersants solutions on cell recovery compared to control samples (Nano-pure water) (a) at the end of the treatment, and (b) at each step: after 1 h physical shaking (T0) and after one step of High Energy Sonication (HES-1) |
图 2(b)表示不同种类(浓度)分散剂在不同预处理步骤(机械振荡(T0)和一次高能量超声(HES1))对应的累积细胞回收率情况.由图 2b可知, 不同分散剂和空白组(超纯水)作为提取液时, T0预处理后, 细菌累积回收率基本相同, 在7%~11%之间;但是, 在进一步经历HES-1后, 0.1% CA+GA和1% CA+GA对细菌的提取量超过了空白组, 其他分散剂则低于空白组.对于空白组, 经历T0后活性炭样品上的细菌仅释放了8%±1%, 约92%的细菌是在进一步经历HES-1后脱离载体而释放至提取液中;与空白组类似, 分散剂作为提取液时, 其在HES1步骤中细菌的释放比例远高于T0.
3.2.2 分散剂对细胞完整性的影响图 3表示不同分散剂在机械振荡(T0)预处理步骤中对提取的细菌细胞完整性的影响.由图 3a可知, 在经历了1 h的T0后, 质量浓度为1% CA+GA和0.1% CA+GA从活性炭载体上提取的细菌数最高, 达到约1.1×107 cells · g-1, 而且这两种分散剂提取得到的细菌中ICC也最高(2.5(±0.1)×106和2.3(±0.1)×106 cells · g-1), 分别占据TCC的22%±2%和22%±1%;而空白组从活性炭载体上提取的TCC仅为(7.3(±0.8)×106 cells · g-1, ICC为1.0(±0.4)×106 cells · g-1), ICC占据TCC的13%±5%.相较于空白组(超纯水), 1% CA+GA和0.1% CA+GA提取的TCC和ICC分别提高了47%~51%和133%~147%.然而, 其他分散剂作为提取液时, ICC占据TCC的比例在14% ~18%范围内, 基本与空白组的结果一致.以上结果表明, 在机械振荡这种极低能量的物理振荡条件下, 本实验选用的不同浓度的分散剂对活性炭载体上的细菌没有杀灭作用.此外, 一定浓度的柠檬酸和羟基乙酸的混合物(CA+GA)可以在不杀灭细菌的前提下促进机械振荡对细菌的分离效果.
图 3(Fig. 3)
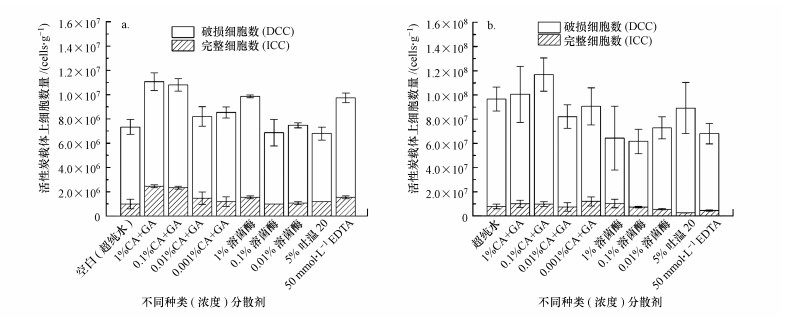 |
| 图 3 不同分散剂对(a)机械振荡(T0)和(b)机械振荡与高能量超声耦合(T0-HES)预处理时细胞完整性的影响 Fig. 3Effect of different dispersants solutions on cell integrality (a) after 1 h physical shaking (T0), and (b) at the end of the treatment at each step: after 1 h physical shaking and one step of High Energy Sonication (T0-HES) |
图 3b表示不同分散剂在机械振荡与高能量超声耦合预处理对提取的细菌细胞完整性的影响.在经历了1 h的机械振荡和1次30 s的高能量超声振荡(T0-HES)后, 空白组(超纯水)中分离的ICC为(8.0(±1.9)×106 cells · g-1, 较T0预处理时增加了7倍;但是, ICC占TCC的比例仅达到8%±1%, 较T0预处理下降了5%.1% CA+GA、0.1% CA+GA、0.001% CA+GA和1%溶菌酶作为提取液时, 从活性炭载体上提取的ICC最高, 约达到1.0×107 cells · g-1, 比空白组的ICC提高了27%.相反地, 5%吐温20作为提取液时, 分离的ICC最低, 仅为(2.6(±0.1)×106 cells · g-1, 占TCC的比例为3%±1%;0.01%溶菌酶和50 mmol · L-1EDTA作为提取液时, ICC占据TCC的比例在7%~8%范围内, 也显著低于空白组的结果.这表明在高能量超声振荡条件下, 本实验选用的分散剂CA+GA对活性炭载体上的细菌没有杀灭作用, 而5%吐温20、0.01%溶菌酶和50 mmol · L-1 EDTA作为提取液时却会导致更多的细菌破损死亡.同时, 在不同预处理条件下检测到的破损细胞占较大比例(图 3), 在未加任何化学药剂的条件下, 在室温25 ℃、转速120 r · min-1下机械振荡1 h(极低强度的物理振荡), 并不会对细菌造成任何化学伤害和强烈的物理伤害, 活性炭表面部分细菌由于剪切力和摩擦力的作用脱离载体进入水中, 立即对取得的细菌悬浮液进行荧光染色并通过流式细胞仪检测, 获得的数据是原始样品中可通过机械振荡获得的细菌数量(图 3(a)空白:TCC=7.3(± 0.8)×106 cells · g-1, ICC=1.0(±0.4)×106 cells · g-1), 此时破损细胞含量约占86%, 这表明原始样品本身的生物膜中死亡或破损的细菌占较大.而该活性炭样品继续被置于超纯水中, 进行一次30 s(每1 s间歇1 s)高能量超声, 活性炭表面剩余细菌在高能量超声振荡的作用下进一步脱落进入水中, 立即对取得的细菌悬浮液进行荧光染色并通过流式细胞仪检测, TCC为8.9(±1.1)×107 cells · g-1, ICC为7.0(±1.6)×106 cells · g-1(此时破损细胞含量约占92%), 说明高能量超声振荡条件可以使生长在活性炭介孔内细菌进一步脱落, 但是会破坏部分细胞的完整性(Vignola et al., 2018;余晓, 2015).上述结果表明, 原始样品本身的生物膜中死亡或破损的细菌占较大比例(86%), 而进一步进行高能量超声会在一定程度上破坏细胞完整性, 使破损的细菌比例增加至92%.与空白对照组相比较, 通过不同浓度的化学分散剂对机械振荡和高能量超声预处理条件下完整细菌和细菌总数的影响, 则可以优化化学预处理方式.
本研究中使用的每种解决方案均通过不同的机制促进生物膜的分离和扩散.水解酶可以直接降解生物膜基质聚合物, 从而实现生物膜的分离(Selan et al., 1993;Johansen et al., 1997).而溶菌酶又是一种专门作用于微生物细胞壁的水解酶, 称包胞壁质酶或N-乙酰胞壁质聚糖水解酶, 它专一地作用于肽多糖分子中N-乙酰胞壁酸与N-乙酰氨基葡萄糖之间的β-1, 4键, 从而破坏细菌的细胞壁, 使之松驰而失去对细胞的保护作用, 最终使细菌溶解死亡.吐温20为非离子表面活性剂, 通过破坏涉及生物膜基质交联的疏水相互作用来发挥作用, 这触发了构成生物膜的细胞外聚合物(Extracellular Polymeric Substances, EPS)的疏水分子的溶解, 例如细胞外脂质, 它们在生物膜的粘附中起着重要的作用(Chen et al., 2000), 而疏水性减弱导致其粘附性减弱(孙晓莹等, 2008).EDTA含有羧基和氨基的螯合剂, 具有螯合金属离子、抑制某些金属蛋白酶的活性的功能(荆昭, 2011;甘莉等, 2017), 其可以清除二价阳离子(如Ca2+和Mg2+), Ca2+和Mg2+使EPS成分表面上的带负电的基团交联(Ugolini et al., 2013).图 3所示也证实本研究中在高能量超声振荡条件下, 5%吐温20、0.01%溶菌酶和50 mmol · L-1 EDTA作为提取液时却会导致更多的细菌破损死亡.细菌的溶解有可能会导致检测的总细菌数降低, 这可能是导致溶菌酶、吐温20和EDTA处理效果低于超纯水的效果的原因.Chen等(2000)研究化学处理对反应器中生物膜的去除效果时, 发现吐温20(1000 mg · L-1)和EDTA(0.01 mol · L-1)作为化学试剂对生物膜的去除效率分别为27%和26%;其中, 吐温20杀灭31%的活细菌, 相反地, EDTA会促进活细菌生长, 使处理过的活细菌数量增加了49%.本研究中表面活性剂吐温20和螯合剂EDTA预处理后分离的细菌明显高于Chen等(2000)的研究结果, 这是由于本研究在加入化学分散剂的同时配合机械振荡和高能量超声, 促进了生物膜从载体表面的分离效果.分散剂CA+GA为10%的柠檬酸和2.5%的羟基乙酸的混合物, 为将生物膜从滤料表面分离并将其分散到单个细胞程度创造了最佳条件, 从而使流式细胞分析的计数最高.柠檬酸和羟基乙酸均为有机弱酸, 一般作为化学清洗剂(浓度2%~8%, 温度90~105 ℃), 应用于金属表面的除垢清洗(李长海, 2008;李卫锋等, 2018), 因而柠檬酸和羟基乙酸可以在一定程度上去除活性炭载体表面上与生物膜共存的碳酸盐和硫酸盐硬度, 削弱了EPS与活性炭载体的粘附作用.此外, 相关研究表明, 通过柠檬酸改性后活性炭载体表面会产生较多的酸性含氧官能团, 主要包括羧基—COO—、羰基—C O、羟基—C—OH(刘文宏等, 2007;杨辉等, 2012), 因此, 柠檬酸的加入会使活性炭载体表面带大量负电荷, 进而与同样表面带负电荷的细菌发生排斥作用, 促进了生物膜的脱离.
3.3 机械振荡与多次高能量超声耦合方式(T0-HESn)对细菌数检测效果影响CA+GA(柠檬酸和羟基乙酸的混合物)是最有效的分散剂.为了进一步优化利用FCM测定生物活性炭载体上细菌数的预处理条件, 本研究在最优的机械振荡与高能量超声耦合(T0-HES)方式基础上, 增加HES的操作次数, 考察了在不同浓度的分散剂CA+GA作为提取液时, 机械振荡与多次高能量超声耦合(T0-HESn)的生物膜预处理方式对细菌数检测效果的影响(图 4).
图 4(Fig. 4)
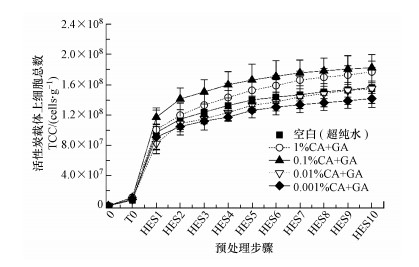 |
| 图 4 机械振荡与多次高能量超声耦合(T0-HESn)的生物膜预处理方式对细菌数检测效果的影响 Fig. 4Effect of biofilm detachment and dispersal after 1 h shaking, and ten high energy sonication steps (HES1; HES10) on biomass detection from 1g WW of granular activated carbon |
由图 4所示, 在连续的物理预处理步骤中, 超纯水和不同浓度分散剂CA+GA处理过的样品细菌总数的变化趋势基本一致.与高压灭菌的超纯水相比, 以1%和0.1% CA+GA作为分散剂进行物理预处理的样品显示出更高的TCC.在1次T0和10次HES处理步骤中, 添加不同提取液的5组样品在进行第1次HES处理(HES1)和第2次HES处理(HES2)中提取的细胞数量最高, HES1和HES2处理分离的细菌总数分别占据最终步骤完成后所获得的细菌总数的54%和13%.超纯水和不同浓度分散剂CA+GA处理过的样品中, HES2处理后的处理效果减弱.其中, 在以超纯水作为提取液时, 在整个预处理步骤结束时提取的细胞总数(1.6(±0.3)×108 cells · g-1)与在HES2中测得的细胞总数(1.1(±0.2)×108 cells · g-1)之间在统计学上无显著差异(单侧t检验, p=0.053), 这说明从第2次HES后细胞总数的累积量进入了平稳期;以0.1% CA+GA作为分散剂时, 在整个预处理步骤结束时提取的细胞总数(1.8(±0.2)×108 cells · g-1)与在HES3中测得的细胞总数(1.5(±0.2)×108 cells · g-1)之间在统计学上同样也无显著差异(单向t检验, p = 0.053), 表明从第3次HES后细胞总数的累积量进入了平稳期, 较空白组有所延后;以1% CA+GA作为分散剂时, 在整个预处理步骤结束时提取的细胞总数(1.8(±0.1)×108 cells · g-1)与在HES4中测得的细胞总数(1.4(±0.2)×108 cells · g-1)之间在统计学上同样无显著差异(单向t检验, p=0.063), 说明从第4次HES后细胞总数的累积量才进入了平稳期, 较空白组和0.1% CA+GA作为分散剂时均有延迟.那么, 在采用不同分散剂作为提取液, 对活性炭生物膜进行机械振荡与高能量超声耦合(T0-HES)方式预处理时, 高能量超声处理次数的排序为:超纯水(T0-HES2) < 0.1% CA+GA(T0-HES3) < 1% CA+GA(T0-HES4);而所分离的生物膜细菌量(cells · g-1)排序为:超纯水(1.1(± 0.2)×108) < 1% CA+GA(1.4(±0.2)×108) < 0.1% CA+GA(1.5(±0.2)×108).因此, 综合活性炭生物膜的细菌数检测效果以及预处理操作步骤的复杂性两方面考量, 采用0.1% CA+GA作为细菌提取液, 对活性炭样品进行1次1 h机械振荡耦合3次30 s(每1 s间歇1 s)高能量超声(即T0-HES3)预处理, 在使用流式细胞技术检测细菌数量时获得了最佳效果.
4 结论(Conclusions)1) 超纯水为提取液时, 不同物理预处理方式获得的细菌总数(cells · g-1)的排序为:T0-HES(9.7(±1.2)×107)> LES(6.1(±1.4)×107)> HES(4.0(±0.2)×107)> T0(7.3(±0.8)×106), 表明机械振荡与高能量超声耦合(T0-HES)的预处理方式是最佳的物理预处理方式.
2) 0.1% CA+GA(柠檬酸和羟基乙酸混合物)为细菌提取液时获得了最高的细胞累积回收率, 相比于空白组(无菌超纯水)提高了21%±17%的细菌数量, 且提取的完好细菌数量最高(约1.0×107 cells · g-1), 比空白组提高了27%, 说明0.1% CA+GA不仅可以促进生物膜的分离, 也不会破坏细菌完整性, 是最优的化学分散剂.
3) 机械振荡与多次高能量超声耦合预处理研究表明, 高能量超声处理次数的排序为:超纯水(2次) < 0.1% CA+GA(3次) < 1% CA+GA(4次), 分离的生物膜细菌量(cells · g-1)排序为:超纯水(1.1(±0.2)×108) < 1% CA+GA(1.4(±0.2)×108) < 0.1% CA+GA(1.5(±0.2)×108), 说明采用0.1% CA+GA作为化学提取液, 对活性炭样品进行T0-HES3预处理是利用流式细胞技术测定活性炭生物膜的细菌数量的最佳预处理方式.
参考文献
| Chen X, Stewart P S. 2000. Biofilm removal caused by chemical treatments[J]. Water Research, 34(17): 4229-4233. DOI:10.1016/S0043-1354(00)00187-1 |
| Erriu M, Blus C, Szmuklermoncler S, et al. 2014. Microbial biofilm modulation by ultrasound:current concepts and controversies[J]. Ultrasonics Sonochemistry, 21(1): 15-22. |
| 甘莉, 路则洋, 林加奖, 等. 2017. EDTA增强Cr(Ⅵ)共存时Burkholderia cepacia降解孔雀绿的效率[J]. 环境科学学报, 37(12): 4610-4616. |
| Glover C M, Oscar Q O, Dickenson E R V. 2018. Removal of perfluoroalkyl and polyfluoroalkyl substances in potable reuse systems[J]. Water Research, 144: 454-461. DOI:10.1016/j.watres.2018.07.018 |
| 黄晓婷, 张再利, 刘伟, 等. 2011. 生物活性炭处理循环水产养殖废水及其影响因子研究[J]. 环境科学学报, 31(11): 2380-2386. |
| Hammes F, Berney M, Wang Y, et al. 2008. Flow-cytometric total bacterial cell counts as a descriptive microbiological parameter for drinking water treatment processes[J]. Water Research, 42(1): 269-277. |
| Han L, Liu W, Chen M, et al. 2013. Comparison of NOM removal and microbial properties in up-flow/down-flow BAC filter[J]. Water Research, 47(14): 4861-4868. DOI:10.1016/j.watres.2013.05.022 |
| 荆昭. 2011.毛蚶(Scapharca kagoshimensis)血红蛋白的类酚氧化酶性质及其抗菌活性研究[D].青岛: 中国海洋大学. 1-117 |
| Johansen C, Falholt P, Gram L. 1997. Enzymatic removal and disinfection of bacterial biofilms[J]. Applied and Environmental Microbiology, 63(9): 3724-3728. DOI:10.1128/AEM.63.9.3724-3728.1997 |
| 李卫锋, 陈学安. 2018. 分阶段、分解质清洗锅炉过热器及再热器的新工艺[J]. 清洗世界, 34(08): 9-11. |
| 李长海. 2008. 锅炉清洗酸洗剂的选择及其应用[J]. 清洗世界, 24(1): 22-27. |
| 林怡雯, 杨天, 李丹, 等. 2013. 基于CTC-流式细胞仪活性细菌总数的快速检测技术研究[J]. 环境科学学报, 33(09): 2511-2515. |
| 刘文宏, 吕建平, 袁怀波. 2007. 通过柠檬酸改性提高载银活性炭的抗菌性能[J]. 应用化学, 24(12): 1414-1417. |
| Magic-Knezev A, van der Kooij D. 2004. Optimisation and significance of ATP analysis for measuring active biomass in granular activated carbon filters used in water treatment[J]. Water Research, 38(18): 3971-3979. DOI:10.1016/j.watres.2004.06.017 |
| Nescerecka A, Juhna T, Hammes F. 2018. Identifying the underlying causes of biological instability in a full-scale drinking water supply system[J]. Water Research, 135: 11-21. DOI:10.1016/j.watres.2018.02.006 |
| Nevel S V, Koetzsch S, Proctor C R, et al. 2017. Flow cytometric bacterial cell counts challenge conventional heterotrophic plate counts for routine microbiological drinking water monitoring[J]. Water Research, 113: 191-206. DOI:10.1016/j.watres.2017.01.065 |
| Pharand L, Van Dyke M I, Anderson W B, et al. 2015. Full-scale ozone-biofiltration:Seasonally related effects on NOM removal[J]. Journal AWWA, 107: 8. |
| Pitt W G, Ross S A. 2010. Ultrasound increases the rate of bacterial cell growth[J]. Biotechnology Progress, 19(3): 1038-1044. |
| Prest E I, Hammes F, K?tzsch S, et al. 2013. Monitoring microbiological changes in drinking water systems using a fast and reproducible flow cytometric method[J]. Water Research, 47(19): 7131-7142. DOI:10.1016/j.watres.2013.07.051 |
| Qin W, Li W, Gong X, et al. 2017. Seasonal-related effects on ammonium removal in activated carbon filter biologically enhanced by heterotrophic nitrifying bacteria for drinking water treatment[J]. Environmental Science and Pollution Research, 24(24): 19569-19582. DOI:10.1007/s11356-017-9522-3 |
| Qin W, Li W, Zhang D, et al. 2016. Ammonium reduction kinetics in drinking water by newly isolated Acinetobacter sp. HITLi 7 at low temperatures[J]. Desalination and Water Treatment, 57(24): 11275-11282. DOI:10.1080/19443994.2015.1043649 |
| 孙晓莹, 施汉昌, 全向春, 等. 2008. 细菌细胞表面疏水性及在活性污泥中粘附率影响因素研究[J]. 环境科学, 29(10): 2809-2814. |
| Selan L, Berlutti F, Passariello C, et al. 1993. Proteolytic enzymes:a new treatment strategy for prosthetic infections?[J]. Antimicrobial Agents & Chemotherapy, 37(12): 2618-2621. |
| Sun Y, Angelotti B, Brooks M, et al. 2018. A pilot-scale investigation of disinfection by-product precursors and trace organic removal mechanisms in ozone-biologically activated carbon treatment for potable reuse[J]. Chemosphere, 210: 539-549. DOI:10.1016/j.chemosphere.2018.06.162 |
| Ugolini F, Schroth M H, Bürgmann H, et al. 2013. Chemical extraction of microorganisms from water-saturated, packed sediment[J]. Water Environment Research, 85(6): 503-513. DOI:10.2175/106143012X13373575831475 |
| Umar M, Roddick F, Fan L. 2016. Impact of coagulation as a pre-treatment for UVC/H2O2-biological activated carbon treatment of a municipal wastewater reverse osmosis concentrate[J]. Water Research, 88: 12-19. DOI:10.1016/j.watres.2015.09.047 |
| Vignola M, Werner D, Hammes F, et al. 2018. Flow-cytometric quantification of microbial cells on sand from water biofilters[J]. Water Research, 143: 66-76. DOI:10.1016/j.watres.2018.05.053 |
| 王绍鑫, 周艳琴, 罗剑峰, 等. 2014. ATP荧光检测法与细菌定量检测法现场细菌污染检测相关性研究[J]. 中国消毒学杂志, 31(12): 1285-1287. |
| 王宜静, 毕良佳. 2019. 低频超声对细菌生物膜作用的研究进展[J]. 口腔医学, 39(04): 360-364. |
| 杨辉, 徐月, 张宇, 等. 2012. 柠檬酸改性颗粒活性炭吸附水中Cr6+的试验[J]. 沈阳建筑大学学报(自然科学版), 28(2): 313-318. |
| Yang K, Yu J, Guo Q, et al. 2016. Comparison of micropollutants' removal performance between pre-ozonation and post-ozonation using a pilot study[J]. Water Research, 111: 147-153. |
| 余晓. 2015.功率超声破碎酵母细胞的影响因素研究[D].南京: 南京农业大学. 1-43 |
| 张浩然, 丁慧羽, 贾瑞琦, 等. 2018. 利用厌氧生物活性炭实现厌氧生物滤池快速启动[J]. 中国给水排水, 34(17): 29-34. |
| 朱薇, 马亚龙. 2018. 极端嗜酸热古菌Acidianus manzaensis硫氧化模型构建[J]. 生物技术通报, 34(5): 179-186. |
