 , 付亮, 谢雨彤, 明皓, 周丹丹
, 付亮, 谢雨彤, 明皓, 周丹丹

东北师范大学环境学院, 吉林省水污染控制与资源化工程实验室, 长春 130024
收稿日期: 2020-09-01; 修回日期: 2020-09-27; 录用日期: 2020-09-27
基金项目: 国家自然科学基金(No.51722803,51708095);中央高校基本科研业务费专项(No.2412018ZD042,2412020FZ014)
作者简介: 闫阁(1994-), 男, E-mail:yang193@nenu.edu.cn
通讯作者(责任作者): 周丹丹, E-mail:zhoudandan415@163.com
摘要:蓝藻水华是淡水湖库普遍面临的水环境问题,目前水华形成机制研究大多关注外界环境因素而忽略了藻类自身及群体的关键调节作用.因此,本文以初始细胞密度为单一变量,考察了不同初始细胞密度条件下蓝藻生长、营养物质利用、叶绿素、藻毒素、胞外分泌物随时间的变化情况.结果发现,初始细胞密度会影响铜绿微囊藻的环境适应性和生长情况,当接种密度≥1×106 cell·mL-1,铜绿微囊藻适应期消失,初始细胞密度从1×105 cell·mL-1增加至1×107 cell·mL-1,最高细胞密度增加了68%,生长速率提高了21%,并且叶绿素变化趋势与生长情况一致.胞外分泌物随初始细胞密度增加而逐渐增加,有利于蓝藻细胞聚集成膜.当初始细胞密度较低(1×105 cell·mL-1)时,单细胞藻毒素分泌量反而增加,以提高蓝藻的环境适应能力.在高初始密度(1×107 cell·mL-1)条件下,铜绿微囊藻主要通过上调丙酮酸代谢和碳代谢,促进细胞生长增殖.因此,细胞密度是影响铜绿微囊藻生长代谢的重要因素,在蓝藻水华形成过程中可能发挥重要作用,水华防治应当在细胞密度较低的阶段进行.
关键词:水华铜绿微囊藻细胞密度生理特征藻毒素
The growth and metabolism of Microcystis aeruginosa depend on cell density and its molecular mechanism
YAN Ge
 , FU Liang, XIE Yutong, MING Hao, ZHOU Dandan
, FU Liang, XIE Yutong, MING Hao, ZHOU Dandan

Engineering Lab for Water Pollution Control and Resources Recovery in Jilin Province, School of Environment, Northeast Normal University, Changchun 130024
Received 1 September 2020; received in revised from 27 September 2020; accepted 27 September 2020
Abstract: Cyanobacteria bloom is a common water environment problem in freshwater lakes. Most of the mechanisms of bloom formation focus on external environmental factors but ignore the key regulatory role of algae itself and its population. In this study, the initial cell density serve as a single variable, the cell growth, nutrient utilization, chlorophyll, microcystin and extracellular secretion of cyanobacteria under different initial cell densities were investigated over time. It was found that the initial cell density affected the environmental adaptability and the cell growth. When the initial cell density was higher than 1×106 cell·mL-1, the adaptive phase was disappeared. The initial cell density increased from 1×105 cell·mL-1 to 1×107 cell·mL-1, the maximum cell density increased by 68% and the growth rate increased by 21%. The variation tendency of chlorophyll were consistent with the cell growth results. The extracellular secretion increased gradually with the increase of initial cell density, which was conducive to the aggregation of cyanobacteria cells and biofilm formation. When the initial cell density was 1×105 cell·mL-1, the secretion of single cell microcystin was higher to improve the environmental adaptability. The high initial cell density(1×107 cell·mL-1) promoted the growth and proliferation of Microcystis aeruginosa by up-regulating pyruvate metabolism and carbon metabolism. Therefore, cell density is an important factor for the growth and metabolism of Microcystis aeruginosa and it maybe play a crucial role in the cyanobacterial blooms. The prevention and control of blooms should be started at the initial stage with low cell density.
Keywords: bloomsMicrocystis aeruginosacell densityphysiological featuremicrocystin
1 引言(Introduction)随着气候变暖和面源污染的加剧, 蓝藻水华已然成为世界范围内的重大环境问题之一.我国有超过80%的湖泊面临着蓝藻水华带来的环境及社会问题, 以太湖为例, 目前太湖蓝藻大量繁殖, 几乎覆盖了整个湖面约2400 km2的面积(罗文齐等, 2020;Qin et al., 2015).研究表明, 水华可增加水体浊度, 降低水中溶解氧, 引起水生生物死亡, 严重影响水生生态系统, 造成饮用水安全隐患(Guo, 2015;操庆等, 2020).目前, 关于水华形成机制的研究大部分集中在环境影响因素方面, 普遍认为藻类水华的环境驱动因素主要是水体富营养化、二氧化碳浓度升高、全球气候变暖(Huisman et al., 2018), 却忽略了藻类细胞及群体在生长代谢中的调节作用.
铜绿微囊藻(Microcystis aeruginosa)是蓝藻水华中出现频率最高、影响范围最广的藻种(吴轩浩等, 2015;何德炬, 2020).铜绿微囊藻具有伪空胞、藻蓝蛋白和胶质鞘等特殊细胞组成与结构, 并具有在垂直方向自由移动、光谱吸收范围宽、生长速度快、释放藻毒素等特点, 从而保证了其在诸多水生微生物中的优势地位.目前, 人们普遍认为蓝藻生长代谢受到营养盐、温度、光照、水体pH值及水力条件等因素的影响(Tan et al., 2009;张达娟等, 2020;Ma et al., 2016).但另有研究表明, 细胞密度也影响着微生物的一系列生理活动, 例如, 在纽约的富营养化水体中, 当细胞密度变化时, 微囊藻中控制藻毒素合成酶的mcyE基因表达增加(Gobler et al., 2007);铜绿微囊藻细胞密度从7×104 cell·mL-1增加至4×106 cell·mL-1, 微囊藻毒素含量增加了27倍(Wood et al., 2011).然而, 目前有关细胞密度对蓝藻细胞生长、其他代谢活动的影响及作用机理尚不清楚, 细胞密度可能是蓝藻水华形成与控制的关键因素.
因此, 本研究以初始细胞密度为单一变量, 考察不同初始细胞密度条件下蓝藻自养生长、营养物质利用、叶绿素产量、藻毒素、胞外分泌物的情况, 解析不同初始细胞密度条件下蓝藻生长代谢的特征规律, 以及细胞密度依赖现象的分子机制, 以期为探索藻类水华成因提供新的思路, 并为水华防控提供理论支撑.
2 材料和方法(Materials and Methods)2.1 藻种与培养条件本实验选用铜绿微囊藻Microcystis aeruginosa HB 909作为蓝藻的典型代表进行研究, 藻种购买自中国科学院武汉水生生物研究所.采用BG11培养基进行培养, 条件设置为:温度(28±1) ℃, 转速150 r·min-1, 光照强度2000 lx, 光暗周期12 h:12 h.
2.2 分析测试方法2.2.1 细胞密度测定采用血球计数板法(25×16型)测定藻细胞密度, 计数重复3次, 取均值.
2.2.2 基质利用情况取10 mL蓝藻培养液离心(10610 g, 4 ℃, 10 min), 上清液过0.22 μm滤膜, 采用采用多参数水质分析仪(5B-3B, 连华科技, 中国)测定氮、磷浓度(Fu et al., 2019).
2.2.3 叶绿素测定叶绿素a采用甲醇法提取(Xue et al., 2020).取3 mL藻液离心(13500 r·min-1, 4 ℃, 5 min)获得藻泥, 将藻泥重悬于等体积的90%甲醇溶液中, 60 ℃水浴10 min, 再次离心并收集上清液.采用紫外可见分光光度计测定652 nm和665 nm处的吸光度, 将结果代入公式(1)计算色素含量.
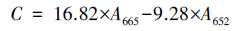 | (1) |
2.2.4 胞外分泌物测定胞外分泌物主要包括蛋白和多糖, 其中, 蛋白采用福林酚试剂盒(南京建成, 中国)测定, 多糖采用蒽酮-硫酸法测定, 具体操作为:取100 mL浓硫酸置于烧杯中, 加入0.2 g蒽酮试剂混匀制备成硫酸-蒽酮溶液;将1 mL样品加入到10 mL比色管中, 立即加入蒽酮试剂3.0 mL, 加瓶塞浸于沸水浴中10 min, 取出冷却至室温, 在波长620 nm处测吸光度.
2.2.5 藻毒素测定取10 mL藻液离心(8000 g, 4 ℃, 10 min), 反复冻融后再次离心(10610 g, 4 ℃, 10 min), 将上清液过0.45 μm滤膜, 然后采用酶联免疫试剂盒(江莱生物, 中国)测定藻毒素MC-LR.
2.2.6 铜绿微囊藻转录组测序分析取20 mL藻液离心获得藻细胞(10000 r·min-1, 5 min, 4 ℃), 随后立即放入到液氮中速冷, 并置于-80 ℃冰箱冻存.转录组测序由北京诺禾致源公司完成.采用Goseq软件进行GO富集分析, KOBAS软件检测KEGG通路中差异表达基因的统计富集.
3 结果与讨论(Results and discussion)3.1 初始细胞密度对细胞生长的影响由图 1可知, 初始细胞密度会影响铜绿微囊藻适应期、最大细胞密度、生长速率, 初始细胞密度为1×105 cell·mL-1的铜绿微囊藻经历8 d的适应期后开始生长, 当细胞密度增加至1×106 cell·mL-1和1×107 cell·mL-1时, 适应期消失, 细胞直接进入对数生长期;初始细胞密度为1×107 cell·mL-1的铜绿微囊藻的稳定期细胞密度最高, 与1×106 cell·mL-1和1×105 cell·mL-1组相比分别增加了38%和68%.初始细胞密度较高(1×106 cell·mL-1和1×107 cell·mL-1)的铜绿微囊藻, 其生长速率也较高, 分别达到4.3×105、4.4×105 cell·mL-1·d-1, 与1×105 cell·mL-1组相比提高了约20%.此外, 各实验组在生长末期氮、磷营养物质均有剩余, 溶解性无机氮为80~98 mg·L-1, 溶解性无机磷为0.9~1.7 mg·L-1, 表明铜绿微囊藻在整个培养过程营养物质充足, 排除了营养受限导致实验组间生长差异的可能性.
图 1(Fig. 1)
 |
| 图 1 不同初始细胞密度下铜绿微囊藻的生长情况 Fig. 1The growth of Microcystis aeruginosa at different initial cell densities |
初始细胞密度还会影响铜绿微囊藻的环境适应性和生长情况, 并且最高生物量随初始细胞密度的增加而增加.研究表明, 赤潮异弯藻Heterosigma akashiwo和中肋骨条藻Skeletonema costatum的适应期也随初始细胞密度增加而缩短, 在低于本研究的细胞密度范围(2.39×104~1.43×105 cell·mL-1)内, 也发现增加初始密度能够提高铜绿微囊藻的最大生物量(Dunn et al., 2016;蔡恒江等, 2005).因此, 细胞密度影响微藻生长这一现象具有普遍性.
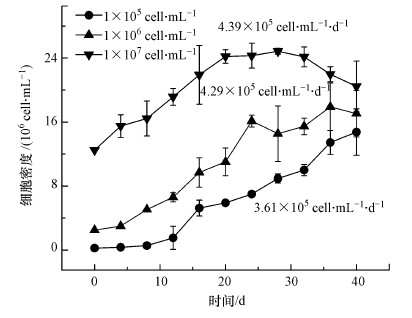
3.2 食微比对铜绿微囊藻生长的影响在相同培养条件下, 铜绿微囊藻的细胞密度不同会导致食微比(F/M)不同, 那么微藻不同的生长状况, 是否由食微比影响而非细胞密度还需要进一步确定.当食微比相同(F/M, 2.4×10-7 mg(N)·cell-1, 5.5×10-7 mg(P)·cell-1)而初始细胞密度不同时, 初始细胞密度为1×106 cell·mL-1实验组与1×105 cell·mL-1实验组相比, 适应期从8 d缩短至0 d, 且最高细胞密度增加了171%(图 2);当初始细胞密度相同(1×106 cell·mL-1)时, 食微比不同的铜绿微囊藻在0~22 d内生长无明显差异, 高F/M实验组(2.4×10-6 mg(N)·cell-1, 5.5×10-6 mg(P)·cell-1)最高细胞密度较低F/M实验组(2.4×10-7 mg(N)·cell-1, 5.5×10-7 mg(P)·cell-1)提升了34%.图 2结果显示, 低细胞密度实验组食微比最高, 而生长速率却较低, 故食微比不是影响铜绿微囊藻生长的主要因素.以上结果表明, 初始细胞密度仍是导致铜绿微囊藻生长差异的主要影响因素.
图 2(Fig. 2)
 |
| 图 2 食微比对铜绿微囊藻生长的影响 Fig. 2Effects of microfood ratio on the growth of Microcystis aeruginosa |
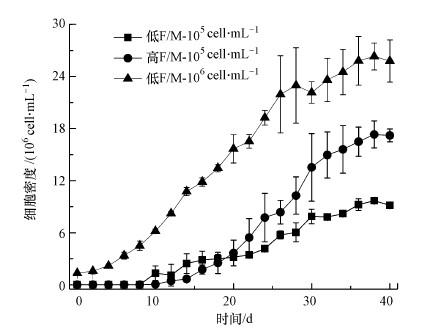
3.3 初始细胞密度对叶绿素含量的影响叶绿素a含量可以反映微藻的生长状态和光合作用情况.由图 3可知, 初始细胞密度会影响铜绿微囊藻叶绿素a含量, 第20 d初始细胞密度为1×107 cell·mL-1实验组的铜绿微囊藻叶绿素a含量为3.31 μg·L-1, 较其他密度条件增加了1倍;并且在第40 d该实验组的铜绿微囊藻叶绿素a含量仍高于其他两组, 1×105 cell·mL-1和1×106 cell·mL-1两种初始密度的铜绿微囊藻叶绿素a含量无明显差异.总体来说, 叶绿素含量随细胞密度增加呈增加趋势, 与细胞生长结果相符.
图 3(Fig. 3)
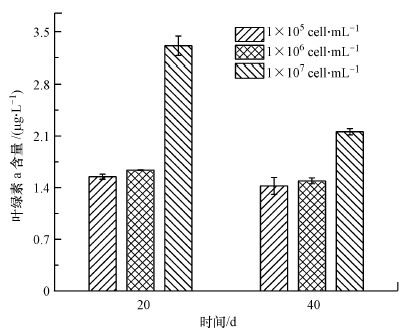 |
| 图 3 不同初始细胞密度下铜绿微囊藻叶绿素a含量 Fig. 3Chlorophyll a content of Microcystis aeruginosa at different initial cell densities |
3.4 初始细胞密度胞外分泌物的影响胞外分泌物是评价铜绿微囊藻生长代谢的重要指标, 其可以通过包裹作用使得铜绿微囊藻在水体中保持最佳生长状态(Hu, 2011).初始细胞密度会影响铜绿微囊藻胞外分泌物产生, 胞外分泌物产生量随初始细胞密度增加呈增加趋势(图 4a).第20 d, 初始细胞密度为1×107 cell·mL-1的铜绿微囊藻, 蛋白分泌量为0.14 pg·cell-1, 与1×105 cell·mL-1和1×106 cell·mL-1实验组相比分别提高了1.8倍和3.6倍(图 4b).第40 d, 各实验组蛋白分泌量与第20 d时相比增加了1~6倍, 其中, 1×106 cell·mL-1与1×107 cell·mL-1实验组的蛋白分泌量接近, 与1×105 cell·mL-1组相比提高了19%.不同初始细胞密度的铜绿微囊藻的胞外多糖含量相近, 且随培养时间延长而增加, 第20 d和第40 d胞外多糖含量分别为0.08 pg·cell-1和0.15 pg·cell-1(图 4c).铜绿微囊藻在生长过程中蛋白分泌量高于多糖, 蛋白与多糖的比值随初始细胞密度的增加而增大, 并且随培养时间延长而增加(图 4d).胞外分泌物可以促进细胞聚集, 在藻类聚集成膜进而形成水华过程中发挥着重要作用.
图 4(Fig. 4)
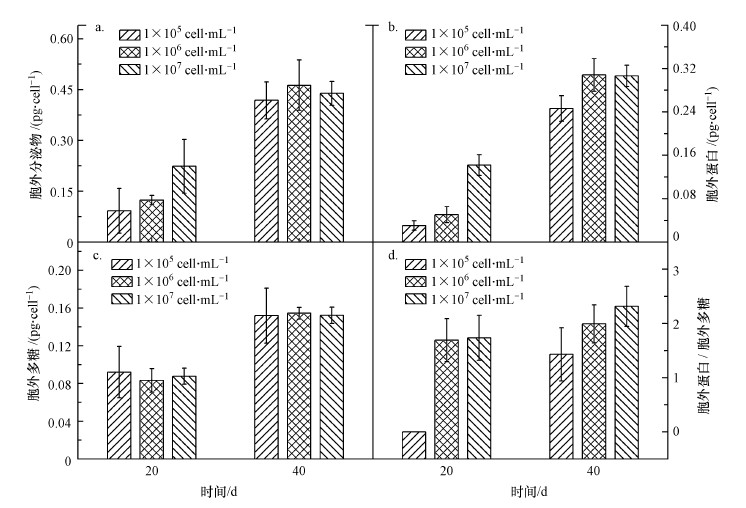 |
| 图 4 不同初始细胞密度下铜绿微囊藻的胞外分泌物(a.胞外分泌物总量;b.胞外蛋白含量;c.胞外多糖含量;d.蛋白与多糖比值) Fig. 4Extracellular secretion of Microcystis aeruginosa at different initial cell densities(a.Total extracellular secretion, b.Extracellular protein, c.Extracellular polysaccharide, d.The ratio of protein to polysaccharide) |
3.5 初始细胞密度对藻毒素的影响初始细胞密度会影响微囊藻毒素MC-LR合成.由图 5a可知, 初始细胞密度为1×107 cell·mL-1的铜绿微囊藻产生的藻毒素高于其他两组, 并且在整个生长阶段稳定在286 ng·mL-1左右, 1×105 cell·mL-1和1×106 cell·mL-1实验组的藻毒素含量逐渐升高然后趋于稳定, 与1×107 cell·mL-1实验组相比分别降低了44%和23%.然而, 单细胞微囊藻毒素产生量与之相反, 初始细胞密度为1×105 cell·mL-1的铜绿微囊藻的单细胞微囊藻毒素产生量最大, 可达21.55 fg·cell-1, 与1×106 cell·mL-1和1×107 cell·mL-1实验组相比分别增加了14%和3%(图 5b).另外, 不同初始细胞密度条件下单细胞微囊藻毒素合成量随细胞增殖先下降后趋于稳定, 大约降低了26%.
图 5(Fig. 5)
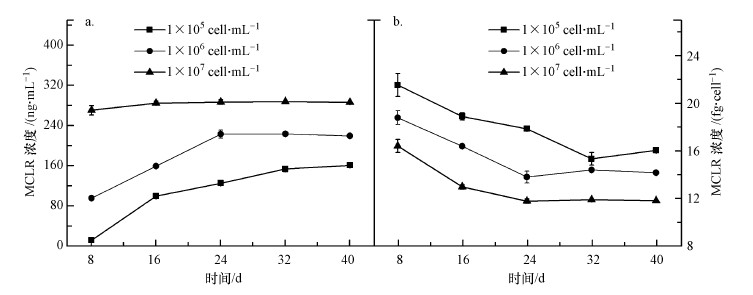 |
| 图 5 不同初始密度下铜绿微囊藻的藻毒素合成情况(a.藻液中微囊藻毒素浓度;b.单细胞微囊藻毒素合成量) Fig. 5Microcystin of Microcystis aeruginosa at different initial densities(a.Total concentration of microcystin; b.Microcystin in single cell) |
研究发现, 片状微囊藻Microcystis panniformis细胞密度较高时, 组成藻毒素的肽产量也相应增加(Pereira et al., 2014), 推测细胞密度可能通过肽的合成过程影响微囊藻毒素代谢.微囊藻毒素作为一种环境毒素, 同时还可以发挥“第二信使”的功能, 在铜绿微囊藻适应环境及缓解环境胁迫的过程中发挥重要作用(Zilliges et al., 2011).因此, 在初始接种细胞密度较低(1×105 cell·mL-1)时, 铜绿微囊藻合成更多的微囊藻毒素, 以提高其适应环境的能力.
3.6 差异基因GO功能及KEGG通路初始细胞密度为1×107 cell·mL-1与1×105 cell·mL-1的铜绿微囊藻相比, 共有587个差异表达基因, 样品间差异最为明显.通过GO功能富集分析发现其主要注释到8个二级生物过程(Biological Process)、18个二级细胞成分(Cellular Component)及4个二级分子功能(Molecular Function)(图 6), 初始细胞密度从1×105 cell·mL-1增加至1×107 cell·mL-1, 主要影响了细胞成分, 其中, 显著富集的基因包括生物过程中的细胞酰胺代谢过程(Cellular Amide Metabolic Process)、酰胺生物合成过程(Amide Biosynthetic Process)、转运(Translation)等, 细胞成分中的核糖体(Ribosome)、核糖核蛋白复合体(Ribonucleoprotein Complex)、胞内部分(Intracellular Part)等, 分子功能中的核糖体结构组成(Structural Constituent of Ribosome)及结构分子活性(Structural Molecule Activity).GO富集结果表明, 铜绿微囊藻初始密度升高主要影响核糖体、核糖蛋白复合体、肽生物合成过程、蛋白复合物等基因的转录过程.
图 6(Fig. 6)
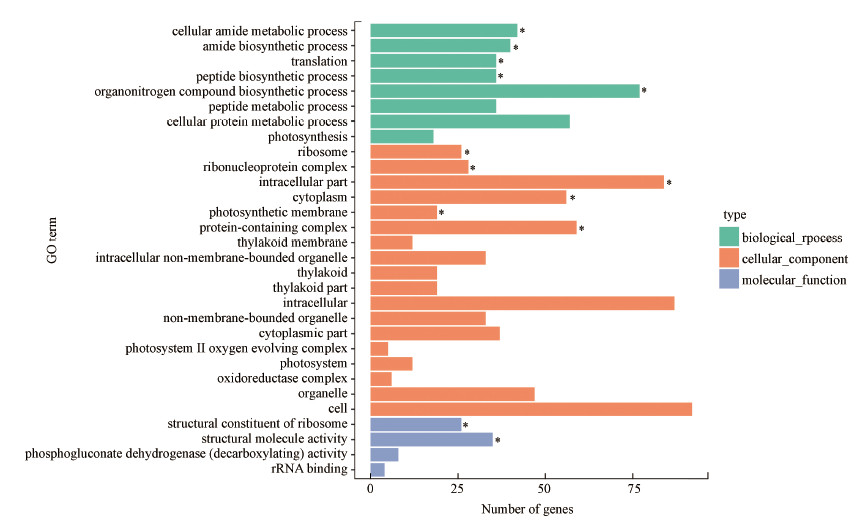 |
| 图 6 铜绿微囊藻高密度(1×107 cell·mL-1)与低密度(1×105 cell·mL-1)组差异表达基因GO富集柱状图 Fig. 6GO enrichment histogram of differentially expressed genes between Microcystis aeruginosa with high density and low density |
初始细胞密度为1×107 cell·mL-1与1×105 cell·mL-1的铜绿微囊藻相比, 上调差异表达基因主要集中在RNA降解(RNA Degradation)通路、丙酮酸代谢(Pyruvate Metabolism)通路、碳代谢(Carbon Metabolism)通路、微生物在不同环境中的代谢(Microbial Metabolism in Diverse Environments)通路、乙醛酸和二羧酸代谢(Glyoxylate and Dicarboxylate Metabolism)通路及糖酵解和糖质新生(Glycolysis/Gluconeogenesis)通路上(图 7).并且初始细胞密度为1×107 cell·mL-1的铜绿微囊藻的丙酮酸代谢通路和碳代谢通路显著上调, 推测初始细胞密度增加可能通过促进上述代谢过程促进细胞生长增殖.
图 7(Fig. 7)
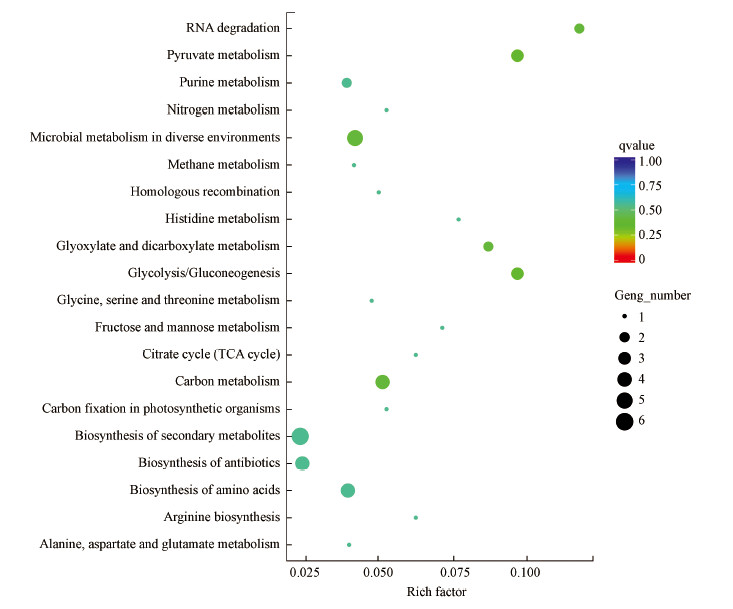 |
| 图 7 铜绿微囊藻高密度(1×107 cell·mL-1)与低密度(1×105 cell·mL-1)组上调差异基因KEGG富集散点图 Fig. 7Distribution of KEGG upregulated rich genes between Microcystis aeruginosa with high density and low density |
4 结论(Conclusions)初始细胞密度会影响铜绿微囊藻的环境适应性和生长情况, 当接种密度≥1×106 cell·mL-1时, 铜绿微囊藻的适应期消失, 细胞可直接进入对数生长期, 最高细胞密度及生长速率随初始细胞密度的增加而增加, 叶绿素变化趋势与生长情况一致.铜绿微囊藻的胞外分泌物随初始细胞密度的增加而增加, 并促进了藻细胞聚集成膜过程.微囊藻毒素总量随初始细胞密度的增加呈增加趋势, 但单细胞藻毒素分泌量反而下降, 这是由于初始细胞密度较低时, 铜绿微囊藻可通过合成更多的微囊藻毒素来提高环境适应能力.高(1×107 cell·mL-1)、低(1×105 cell·mL-1)初始细胞密度的铜绿微囊藻, 其基因表达差异显著.高初始密度条件下, 细胞通过上调丙酮酸代谢和碳代谢通路促进细胞生长增殖.综上, 细胞密度是影响铜绿微囊藻生长代谢的重要因素, 可能在蓝藻水华形成过程中的发挥重要作用, 水华防治应当在细胞密度较低的阶段进行控制.
参考文献
| 蔡恒江, 唐学玺, 张培玉, 等. 2005. 不同起始密度对3种赤潮微藻种群增长的影响[J]. 海洋环境科学, 24(3): 39-41. |
| 操庆, 刘伟京, 谢丽强, 等. 2020. 土壤添加不同粘土矿物对微囊藻毒素在生菜中生物富集的影响[J]. 环境科学学报, 40(8): 2986-2992. |
| Dunn R M, Manoylov K M. 2016. The effects of initial cell density on the growth and proliferation of the potentially toxic cyanobacterium Microcystis aeruginosa[J]. Journal of Environmental Protection, 7(9): 1210-1220. DOI:10.4236/jep.2016.79108 |
| Fu L, Li Q, Yan G, et al. 2019. Hormesis effects of phosphorus on the viability of Chlorella regularis cells under nitrogen limitation[J]. Biotechnology for Biofuels, 12(1): 121. |
| Gobler C J, Davis T W, Coyne K J, et al. 2007. Interactive influences of nutrient loading, zooplankton grazing, and microcystin synthetase gene expression on cyanobacterial bloom dynamics in a eutrophic New York lake[J]. Harmful Algae, 6: 119-133. DOI:10.1016/j.hal.2006.08.003 |
| Guo L. 2007. Doing battle with the green monster of Taihu lake[J]. Science, 317: 1166-1187. DOI:10.1126/science.317.5842.1166 |
| 何德炬. 2020. 低温、弱光、缺氧及恢复培养对铜绿微囊藻生理生长的影响[J]. 广东化工, 47(16): 53-60. |
| Hu H J. 2011. Cyanobacterial biology[M]. Beijing: Science Press, 128-132, 252-265. |
| Huisman J, Codd G A, Paerl H W, et al. 2018. Cyanobacterial blooms[J]. Nature Reviews Microbiology, 16(8): 471-83. DOI:10.1038/s41579-018-0040-1 |
| 罗文齐, 徐梦珊, 李丹丹, 等. 2020. 蓝藻暴发对太湖梅梁湾底泥中铁氨氧化速率的影响[J]. 环境科学学报, 40(8): 2828-2833. |
| Ma J, Qin B, Paerl H W, et al. 2016. The persistence of cyanobacterial (Microcystis spp.) blooms throughout winter in Lake Taihu, China[J]. Limnology & Oceanography, 61: 711-722. |
| Pereira D A, Giani A. 2014. Cell density-dependent oligopeptide production in cyanobacterial strains[J]. Fems Microbiology Ecology, 88: 175-183. DOI:10.1111/1574-6941.12281 |
| Qin B, Zhu G, Gao G, et al. 2010. A drinking water crisis in Lake Taihu, China:Linkage to climatic variability and lake management[J]. Environmental Management, 45(1): 105-112. DOI:10.1007/s00267-009-9393-6 |
| Tan X, Kong F, Zhang M, et al. 2009. Recruitment of phytoplankton from winter sediment of Lake Taihu:a laboratory simulation[J]. Journal of Freshwater Ecology, 24(2): 339-341. DOI:10.1080/02705060.2009.9664302 |
| Wood S A, Rueckert A, Hamilton D P, et al. 2011. Switching toxin production on and off:intermittent microcystin synthesis in a Microcystis bloom[J]. Environmental Microbiology Reports, 3: 118-124. DOI:10.1111/j.1758-2229.2010.00196.x |
| 吴轩浩, 高佳逸, 严杨蔚, 等. 2015. 无机氮和有机氮对铜绿微囊藻生长和产毒影响的比较[J]. 环境科学学报, 35(3): 677-683. |
| Xue R, Fu L, Dong S, et al. 2020. Promoting Chlorella photosynthesis and bioresource production using directionally prepared carbon dots with tunable emission[J]. Journal of Colloid and Interface Science, 569: 195-203. DOI:10.1016/j.jcis.2020.02.080 |
| 张达娟, 张树林, 王泽斌, 等. 2020. 两种有机碳源对铜绿微囊藻生长和叶绿素荧光特性的影响[J]. 水产科技情报, 47(4): 216-220. |
| Zilliges Y, Kehr J C, Meissner S, et al. 2011. The cyanobacterial hepatotoxin microcystin binds to proteins and Increases the fitness of Microcystis under oxidative stress conditions[J]. PLoS One, 6(3): e17615. DOI:10.1371/journal.pone.0017615 |
