 , 何宇哲1,2, 宋朝红1,2, 彭星星1,2, 贾晓珊1,2
, 何宇哲1,2, 宋朝红1,2, 彭星星1,2, 贾晓珊1,2

1. 中山大学环境科学与工程学院, 广州 510275;
2. 广东省环境污染控制与修复技术重点实验室, 广州 510275
收稿日期: 2020-02-13; 修回日期: 2020-03-24; 录用日期: 2020-03-24
基金项目: 国家自然科学基金(No.20183800041030649);广东省科技计划粤港联合创新项目(No.20163800042410510);广东省科技厅项目(No.20183800042050640)
作者简介: 钟云浩(1996-), 男, E-mail:SYSUzyh@163.com
通讯作者(责任作者): 贾晓珊, E-mail:eesjxs@mail.sysu.edu.cn
摘要:针对首次分离得到的一株具有同步脱氮除磷新功能的热带假丝酵母(Candida tropicalis) PNY 2013,通过生理及动力学特征,连续流运行操作及其在含糖类工业废水中的应用3个环节,探讨了不同碳源模式下PNY2013同步脱氮除磷的特性.结果表明:PNY2013以葡萄糖、乙醇及乙酸为唯一碳源时均生长良好,其最大比增长速率μmax分别为0.1327、0.1252及0.1115 h-1,其同步脱氮除磷率分别可达100%、80%、100%(NH4+-N)及93%、95%、98%(PO43--P).3种碳源下PNY2013同步脱氮除磷的最佳条件基本接近为:温度30℃,pH=8.0,溶解氧0~2 mg·L-1,C/N=200:5左右.PNY2013同步脱氮除磷的长期连续运行条件下的实验进一步表明,以葡萄糖为碳源条件下,进水NH4+-N及PO43--P浓度分别达400及80 mg·L-1时,两者去除率均接近100%.与这种超强能力相比,以乙醇及乙酸为碳源条件下,进水NH4+-N及PO43--P浓度分别达100及20 mg·L-1时,两者的去除率也可达60%~80%(NH4+-N)及40%(PO43--P),显示出相当的同步脱氮除磷能力.在以模拟制糖废水、淀粉加工废水、啤酒废水、味精废水这4种典型含糖工业废水为碳源条件下,除淀粉加工废水外PNY2013均能有效去除COD、NH4+-N和PO43--P,其中,制糖、啤酒、制药废水中的COD去除率分别可达40%、89%、96%,NH4+-N去除率分别为85%、94%、76%,PO43--P去除率均为90%.即使在40000 mg·L-1(制糖)及12500 mg·L-1(啤酒)的高COD条件下,PNY2013也均具有稳定的NH4+-N和PO43--P去除效果,显示出良好的同步脱氮除磷应用前景.
关键词:热带假丝酵母菌PNY2013同步脱氮除磷含糖工业废水食品废水
Application of simultaneous nitrogen and phosphorus removal by yeast PNY2013 under different carbon source modes
ZHONG Yunhao1,2
 , HE Yuzhe1,2, SONG Chaohong1,2, PENG Xingxing1,2, JIA Xiaoshan1,2
, HE Yuzhe1,2, SONG Chaohong1,2, PENG Xingxing1,2, JIA Xiaoshan1,2

1. School of Environmental Science and Engineering, Sun Yat-sen University, Guangzhou 510275;
2. Guangdong Provincial Key Laboratory of Environmental Pollution Control and Remediation Technology, Guangzhou 510275
Received 13 February 2020; received in revised from 24 March 2020; accepted 24 March 2020
Abstract: The present study reported a purified yeast strain of PNY2013, which is able to simultaneously remove the nitrogen and phosphorus for the first time. Based on the study of its physiological and dynamic characteristics under continuous flow reactor and its application on sugar-containing industrial wastewater,characteristics of PNY2013 simultaneous nitrogen and phosphorus removal under different carbon source modes were discussed. The results show that PNY2013 grows well with glucose,ethanol,and acetic acid as the sole carbon sources,and its maximum specific growth rates μmax are 0.1327,0.1252,and 0.1115 h-1,respectively. And the simultaneous removal rates of nitrogen and phosphorus with different carbon source are:100%,80%,100%(NH4+-N) and 93%,95%,98%(PO43--P),respectively. Under the three carbon sources,the optimal conditions for simultaneous nitrogen and phosphorus removal in PNY2013 are basically close to:temperature=30℃,pH=8.0,DO=0~2 mg·L-1,C/N=200:5. With glucose as the carbon source,the concentrations of influent NH4+-N and PO43--P are 400 and 80 mg·L-1,respectively,and the removal rates of both are close to 100%. Compared with this super capacity,when acetic acid was used as a carbon source,the removal rates of NH4+-N and PO43--P at 100 and 20 mg·L-1 can be 60%~80% (NH4+-N) and 40% (PO43--P),respectively. These results show considerable simultaneous nitrogen and phosphorus removal capabilities. With simulating sugar wastewater,starch wastewater,beer wastewater,monosodium glutamate wastewater as four carbon sources,PNY2013 can effectively remove COD,NH4+-N and PO43--P under all conditions except starch wastewater. The removal rates of sugar,beer,and MSG can reach 40%,89%,96% (COD); 85%,94%,76%(NH4+-N); 90%,90%,90% (PO43--P),respectively. Even under high COD value of 40000 mg·L-1 (sugar) and 12500 (beer) mg·L-1,PNY2013 has stable NH4+-N and PO43--P removal efficiency,showing good application prospects for simultaneous nitrogen and phosphorus removal.
Keywords: Candida tropicalisPNY2013simultaneous nitrogen and phosphorus removalsugar-containing industrial wastewaterfood wastewater
1 引言(Introduction)氮和磷是生物体结构组成和生化过程进行的重要物质基础, 其循环是生物地球化学中最重要的元素循环之一.自然生态系统中, 微生物是氮和磷元素循环的主要驱动者, 在其循环及平衡中扮演着极其重要的角色(Arrigo et al., 2005;鲍林林等, 2015;Liu et al., 2016).自然生态系统特别是水圈系统, 受人类活动干扰(含氮、磷废水的大量排放等), 原有的氮、磷循环失去平衡后水体中过量的氨氮及磷酸盐将引起富营养化并彻底破坏水体原有的生态系统.根据《2018年中国环境状况公报》(中华人民共和国生态环境部, 2019)及相关文献报道(Conley et al., 2009), 国内外水体富营养化至今仍然十分严重, 成为全球亟待解决的环境热点问题.因此, 通过脱氮除磷降低排放废水中的氮、磷浓度是防治水体富营养化的关键和基本策略.在众多脱氮除磷方法中利用微生物的脱氮除磷是目前最被广泛采用和最有发展前途的方法.
首先, 在脱氮领域, 脱氮理论主要是含氮化合物氨氮在微生物作用下, 通过硝化和反硝化过程被还原成气态氮而从水中逸出达到脱氮的目的(Staley et al., 1989;Treusch et al., 2005).尽管需要不同的好氧及厌氧微生物共同参与分阶段完成的硝化及反硝化过程存在反应空间庞大、动力消耗过大、运行管理繁琐等缺点, 但由于其是完全脱氮, 一直以来占据着生物脱氮技术的主导地位.人们为了解决现有生物脱氮技术的缺点不断努力, 先后开发了能够减少反应空间的同时硝化反硝化(SND)系统(Kuenen et al., 1994;Kshirsagar et al., 1995;Kuai et al., 1999)、能够节约能源和碳源的短程硝化反硝化系统(Bruce et al., 2001)和厌氧氨氧化(Anammox)系统(van de Graaf et al., 1995;Marcel et al., 2003;Tage et al., 2003).其次, 在除磷领域, 现有除磷理论主要包括聚磷菌(PAO)厌氧释磷、好氧吸磷理论(Seviour et al., 2003;Robert et al., 2003)和反硝化聚磷菌(DPB)缺氧环境下摄磷理论(Kuba et al., 1993;Kuba et al., 1997).尽管稍后PAO与DPB除磷理论在微生物分子生物学及工艺技术改良方面也取得了很大的进展(Tsuneda et al., 1996;Carvalho et al., 2007), 但这些现有的生物磷去除技术仅仅是将水中磷酸盐转化为细胞内聚磷化合物并通过排泥去除, 而并非完成了完全意义上的磷酸盐去除, 后续都面临着处置大量剩余污泥的问题.
2015年底Nature杂志报道了两个科学家团队几乎同时发现了将氨氮一步到位完全氧化为硝酸盐的新型硝化微生物(Daims et al., 2015; van Kessel Maartje et al., 2015), 再次改变了人们对传统脱氮理论的认知.而本课题组从一个以葡萄糖、氨氮及磷酸盐为培养液长期连续稳定运行的A/O生物反应器的混合微生物菌群中分离出来了一种属于Candida tropicalis的酵母PNY2013(骆玮诗, 2015;贾晓珊等, 2016; Luo et al., 2017).在典型有机物—葡萄糖、氨氮及磷酸盐共同存在的好氧及厌氧条件下, PNY2013均显示出了同步降解葡萄糖、氨氮及磷酸盐的能力.特别是其在同步降解氨氮的过程中均无亚硝酸及硝酸盐的产生仅产生了氮气, 同时其同步降解磷酸盐的过程中产生了气态磷化合物, 这种全新的氮磷同步气态化分解属首次发现.但PNY2013真正能应用于实际的脱氮除磷处理领域首先还需要明确不同碳源条件下同步脱氮除磷的应用特性.
综上所述, 现有的生物脱氮除磷理论及技术面临着当前水体氮、磷污染治理的持续压力, 进一步的过程优化及工艺改良之外寻找新型便捷的新菌株并开发相应的脱氮除磷工艺具有现实的必要性及紧迫感.鉴于此, 本文针对首次分离得到的一株具有同步脱氮除磷新功能的酵母菌PNY2013, 聚焦PNY2013同步脱氮除磷应用的碳源问题, 进行包括含糖类工业废水在内的不同碳源条件下的基本环境因素及连续运行实验, 在全面评价其脱氮除磷效果的基础上, 力争明确切实可行的不同碳源条件下的实际操作方法.
2 材料与方法(Materials and methods)2.1 实验材料2.1.1 实验菌种实验菌株是从一个以葡萄糖、氨氮及磷酸盐为培养液长期连续稳定运行的A/O生物反应器的混合微生物菌群中分离得到.经过GenBank数据库中进行同源性比对和分析, 发现其与热带假丝酵母(Candida tropicalis)的同源性高达99%, 将其命名为PNY2013(GeneBank No.KF569949).
2.1.2 培养基成分用于PNY2013富集培养的固体培养基配方如下(mg · L-1):细菌学蛋白胨20000、葡萄糖20000、营养琼脂20000、酵母浸膏10000.
2.1.3 实验试剂实验主要试剂为葡萄糖、乙醇、乙酸、碳酸氢钠、碳酸氢钾、氯化铵、磷酸二氢钾、微量元素等.其中, 葡萄糖、乙醇、乙酸分别提供碳源, 氯化铵提供氮源, 磷酸二氢钾提供磷源.微量元素配方(张刚, 2011)如下(mg · L-1):CaCl2 · 2H2O 0.222、MgCl2 · 6H2O 0.01、FeCl3 · 6H2O 0.003、MnCl2 · 4H2O 0.00025、CoCl2 · 6H2O 0.00006、ZnCl2 0.00025、CuCl2 · 2H2O 0.00006、H2BO3 0.000024、NiCl2 · 6H2O 0.00029、钼酸铵(四水合) 0.00005、NaCl 0.0005.
2.2 实验方法2.2.1 菌株的保存将酵母菌PNY2013接种到平板培养基中, 在30 ℃生化培养箱中培养至平板培养基上长出菌落后放入4 ℃冰箱储存.每隔1个月左右, 将菌株接到液体培养基中活化, 活化后再划到平板培养基上.每次实验前24 h, 将菌株划线培养富集.
2.2.2 取样与样品储存根据不同的实验, 定时定量进行取样.实验样品经过高速冷冻离心机离心后(7000 r · min-1, 10 min), 抽出上清液并用0.22 μm孔径水相滤头过滤后注入玻璃试管中封口, 放置在4 ℃冰箱储存待测.其中, 生物样品取样后直接放入-80 ℃冰箱储存待测.
2.2.3 唯一碳源为葡萄糖、乙醇和乙酸条件下PNY2013的基本生理特征实验首先, 将酵母菌PNY2013在平板培养基富集培养24 h, 并按照一定的生物浓度将其接种到新鲜的不同碳源液体培养基中进行标准血清瓶实验, 考察不同pH(3、4、5、6、7、8、9)、温度(10、20、30、40 ℃)、溶解氧(0~2、2~4、4~8 mg · L-1)、初始接菌量及C/N下菌株PNY2013同步脱氮除磷的效果, 并对其总氮、总磷去除效果进行研究, 每个批次分别做3次平行.
2.2.4 PNY2013的动力学特征实验在初始OD600=0.4条件下进行标准血清瓶实验, 每组做3个平行, 定期取样测定菌液的OD600与不同碳源的浓度.采用动力学模型及实验数据进行模拟研究.
2.2.5 连续流实验试验连续流反应器如图 1所示.反应器采用完全混合连续流反应器(CSTR), 有效容积为5.0 L, 根据3种不同的唯一碳源共设置3种CSTR反应器R1(葡萄糖)、R2(乙醇)和R3(乙酸).反应器下部设有磁力搅拌器, 通过连续搅拌保证反应器内混合均匀.反应器置于恒温室中, 恒温避光培养, 温度设置为30 ℃.试验过程中, 反应器上部敞口, 通过曝气泵间歇曝气维持微氧条件(0 mg · L-1 < DO < 2.0 mg · L-1).反应器利用蠕动泵从底部进水, 蠕动泵流速为2 r · min-1, 水力停留时间(HRT)维持在5.0 d, 进水桶保存在4 ℃冰柜内以防营养液变质.各CSTR反应器的运行均分PNY2013菌种富集启动、负荷增加、稳定运行3个阶段.菌种富集启动阶段采用间歇式培养方式, 负荷增加及稳定运行均采用连续运行方式.
图 1(Fig. 1)
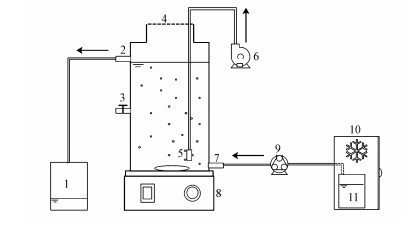 |
| 图 1 实验装置工艺流程图 (1.废水桶, 2.出水口, 3.取样口, 4.曝气封口膜, 5.曝气头, 6.曝气泵, 7.进水口, 8.搅拌器, 9.蠕动泵, 10.冰柜, 11.进水桶) Fig. 1The schematic diagram of the experimental process |
试验菌株PNY2013富集培养使用的营养液成分如表 1所示.反应器启动和负荷提升阶段采用人工合成模拟废水, 模拟废水中C、N、P浓度分别通过葡萄糖、乙醇、乙酸、NH4Cl、K2HPO4的投加量进行调节.
表 1(Table 1)
| 表 1 反应器富集营养液成分配比 Table 1 Nutrient solution composition ratio | |||||||||||||||||||||||||||||||||
表 1 反应器富集营养液成分配比 Table 1 Nutrient solution composition ratio
| |||||||||||||||||||||||||||||||||
2.2.6 PNY2013在含糖工业废水中的应用实验含糖工业废水为模拟废水, 水质和配方如表 2所示(张立秋等, 2004;Güray et al., 2009;卢玉凤, 2012), 采用4种典型含糖工业废水进行可行性研究.各废水使用前均进行灭菌处理, 以保持纯菌环境.采用标准血清实验方法, 初始接菌量OD600均控制在0.4左右, 初始pH均调节至7~8左右.定时定量取样并检测其COD、pH、OD600、氨氮和磷酸盐变化情况.其中, PNY2013在含糖工业废水中的生长实验设置4组批次实验, 在初始COD均为2000 mg · L-1条件下考察PNY2013分别处理4种不同废水时的生长情况.
高COD对PNY2013脱氮除磷能力的影响实验, 设置6组批次实验, 采用PNY2013分别处理啤酒和制糖废水, 初始COD分别设置为2500、4000、12500 mg · L-1(啤酒废水)和8000、15000、40000 mg · L-1(制糖废水).
表 2(Table 2)
| 表 2 模拟含糖工业废水配方 Table 2 Formula of simulated sugar-containing industrial wastewater | |||||||||||||||||||||||||||
表 2 模拟含糖工业废水配方 Table 2 Formula of simulated sugar-containing industrial wastewater
| |||||||||||||||||||||||||||
2.2.7 理化指标和生物指标分析方法实验中所有理化指标均测得3个平行样取平均值.本试验采用的主要常规分析项目和方法(Mino et al., 1998;Oehmen et al., 2007):氨氮(NH4+-N)、正磷酸盐(PO43--P)、总氮(TN)、总磷(TP)、COD、VSS均采用标准方法测定;葡萄糖采用蒽酮分光光度法测定(郭晓蕾等, 2010;张杰等, 2012);乙醇、乙酸采用气相色谱法测定(Gu et al., 2014;Liu et al., 2014;Ulah et al., 2014).
反应器中包括PNY2013在内的生物指标主要包括微生物量(以OD600为指标进行检测)和微生物形态(以SEM观察).所有生物指标的分析及检测均采用标准实验方法.
3 结果与讨论(Results and discussion)3.1 唯一碳源为葡萄糖、乙醇和乙酸条件下PNY2013的基本生理特征3.1.1 pH的影响不同pH条件下的血清瓶实验反应50 h后, 3种碳源条件下PNY2013对C、N、P的降解率结果如图 2所示.由图可知, 改变培养基的初始pH对PNY2013同步脱氮除磷效果有显著影响, 当pH为7.0~9.0时, 3种碳源条件下菌株同步脱氮除磷效果最好, 其碳源利用率均接近100%.以葡萄糖为唯一碳源情况下, pH=8时脱氮除磷效率最高, 分别达到了78%和72%.以乙醇为唯一碳源情况下, pH=7时脱氮效率最高, 达到了70%;pH=9时达到最大除磷效率为54%.以乙酸为唯一碳源情况下, pH=8时脱氮除磷效率最高, 分别达到了78%和68%;而当pH为4.0~6.0时, 菌株同步脱氮除磷效果下降明显, 50 h的脱氮和除磷效率均下降到50%以下.碳源利用率也相对较低, 这种现象表明PNY2013更适合在中性偏碱性条件下生存.因此, 本文选择pH=7和8作为后续批次实验的起始pH.
图 2(Fig. 2)
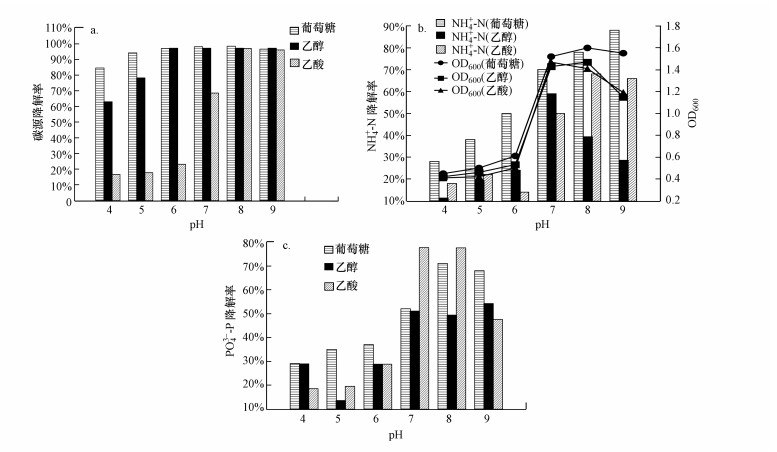 |
| 图 2 pH值对PNY2013降解碳(a)、氮(b)、磷(c)的影响 Fig. 2Influence of pH on C(a), N(b), P(c) biodegradation by PNY2013 |
3.1.2 温度的影响分别在10、20、30和40 ℃的条件下进行活性试验, 结果如图 3所示.可以看出, 温度对PNY2013同步脱氮除磷具有显著影响.以葡萄糖为唯一碳源, 温度为10 ℃时PNY2013的生长和N、P的降解均受到了明显抑制;在温度为30 ℃时NH4+-N和PO43--P去除率最高, 20 ℃时次之;然而, 继续提高培养温度到40 ℃, PNY2013的生物浓度反而下降, 脱氮除磷效率也大幅下降, 50 h时的脱氮除磷效率仅分别为50%和41%.这种脱氮除磷效率降低的现象可能是由于温度过高或过低影响了生物体内酶的活性(杨秀玲等, 2005;颜薇芝等, 2017).因此, 结合实际操作成本和结果, 后续试验采用30 ℃为最佳反应温度.
图 3(Fig. 3)
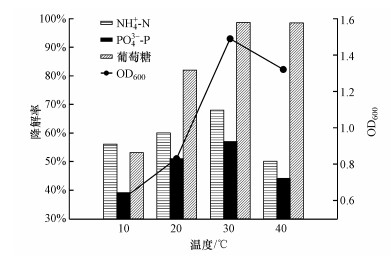 |
| 图 3 温度对PNY2013降解碳、氮、磷的影响 (以葡萄糖为碳源) Fig. 3Influence of temperature on C, N, P biodegradation by PNY2013 |
3.1.3 溶解氧的影响如图 4所示, 在溶解氧为0~2 mg · L-1情况下, 菌株的脱氮除磷效率最高, 分别达到71%和58%.随着溶解氧浓度的升高, 脱氮除磷效率逐渐降低.同时, 低溶解氧状态下, 葡萄糖的降解效率明显比中高溶解氧状态下更高, 生物量也相对较高.这种微氧环境就能获得较高的脱氮除磷效率进一步提高了PNY2013实际工程应用的价值.
图 4(Fig. 4)
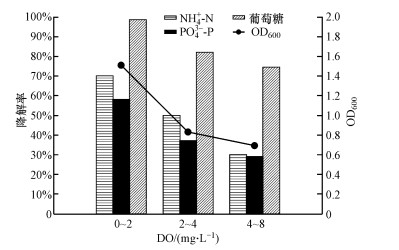 |
| 图 4 溶解氧对PNY2013降解碳、氮、磷的影响 (以葡萄糖为碳源) Fig. 4Influence of DO on C, N, P biodegradation by PNY2013 |
3.1.4 C/N的影响设置初始NH4+-N和PO43--P浓度分别为50 mg · L-1和10 mg · L-1, 调节3种碳源浓度分别进行血清瓶实验, 结果如图 5所示.由图 5可以看出, 以葡萄糖为唯一碳源情况下, 随着C/N比增大, 脱氮除磷效率逐渐增高, C/N=200 : 5~300 : 5时脱氮除磷效率最高, 当C/N增大到300 : 5时脱氮除磷效率没有明显变化.以乙醇为唯一碳源情况下, C/N=150 : 5时脱氮除磷效率最高, 当C/N比继续增大时, 其脱氮除磷效率明显下降.以乙酸为唯一碳源情况下, C/N=250 : 5左右时脱氮除磷效率达到最大值, 当继续增大C/N比时, 可以看出其效率也受到明显的抑制作用.因此, 3种碳源条件下的最佳C/N比分别为200 : 5、150 : 5和250 : 5.
图 5(Fig. 5)
 |
| 图 5 C/N对PNY2013降解NH4+-N (a)和PO43--P (b)的影响 Fig. 5Influence of C/N on NH4+-N(a) and PO43--P (b) biodegradation by PNY2013 |
3.1.5 总氮及总磷的去除以最优且好氧条件为典型条件, PNY2013以葡萄糖、乙醇、乙酸为唯一碳源时对总氮及总磷的降解情况如图 6所示.由图可知, 降解过程中NO2--N及NO3--N均未检出, 反应体系中NH4+-N和TN浓度基本一致(图 6a及6b), 不同碳源(葡萄糖、乙醇、乙酸)条件下NH4+-N去除率分别达100%、80%、100%, TN去除率分别达100%、76%、100%, 更进一步显示出PNY2013具有出众的总氮去除性能.同时, 反应体系中PO43--P和TP浓度也基本一致(图 6c及6d), PO43--P去除率分别达93%、95%、98%, TP去除率分别达86%、90%、89%, 同样显示出PNY2013具有出众的总磷去除性能.
图 6(Fig. 6)
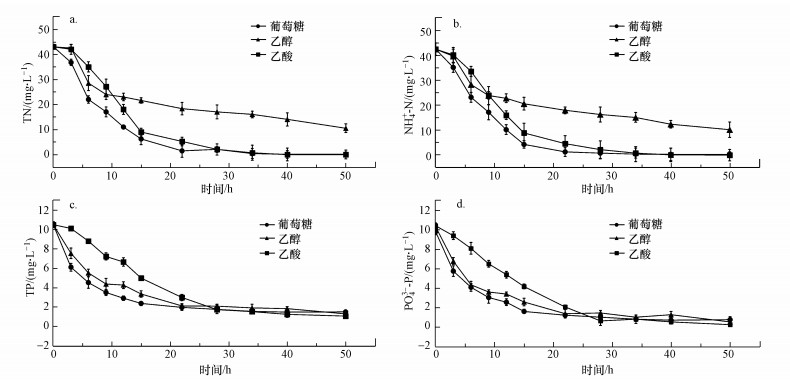 |
| 图 6 PNY2013对氮(a、b)和磷(c、d)的好氧降解特性 Fig. 6Biodegradation of nitrogen(a, b) and phosphorus(c, d) by PNY2013 Biodegradation of nitrogen(a, b) and phosphorus(c, d) by PNY2013 |
3.2 PNY2013的动力学特征目前, Monod方程和Logistic方程常被用来描述生物群体在限制条件下的生长, 但Monod方程无法准确描述延迟期和稳定期(张怀强等, 2005), 而Logistic方程对微生物的最大群体密度有限制, 因而不适用于延迟期(曲音波等, 2005).为了描述PNY2013完整的生长过程.本文采用改良Logistic模型(宋健等, 2007)来描述PNY2013的生长过程, 对不同碳源条件下其生长动力学模型进行模拟计算.
根据Logistic方程(式(1))拟合PNY2013随时间变化的生长曲线, 结果见图 7a.根据数据拟合, 以葡萄糖、乙醇、乙酸为唯一碳源时, 拟合曲线方程分别如式(2)~(3)所示.
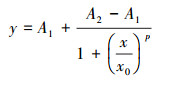 | (1) |
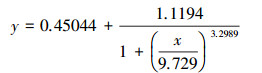 | (2) |
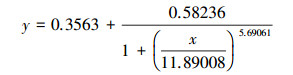 | (3) |
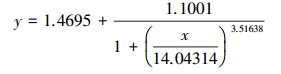 | (4) |
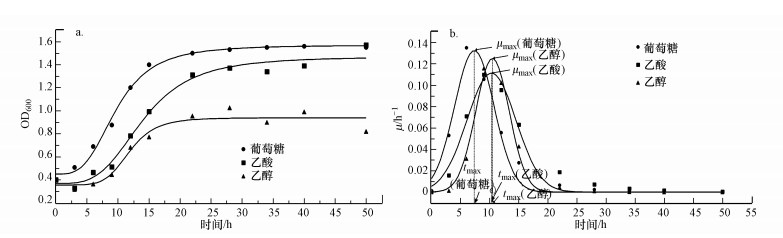 |
| 图 7 3种碳源条件下PNY2013的生长曲线(a)和比生长速率(μ)的拟合变化曲线(b) Fig. 7The growth curve(a) and the μ fitting curve(b) of PNY2013 under three carbon sources |
如图 7a所示, PNY2013以葡萄糖、乙醇、乙酸为碳源的延迟期在3 h左右, 然后进入长达10~15 h的对数增长期, PNY2013快速增殖, 最后进入稳定生长期, 其生长规律表现为S型.根据其OD600(菌体浓度X)变化计算不同时间点下底物增长速率dX/dt, 从而求出比增长速率μ, 结果如表 3所示.按照拟合方程(5)拟合μ随时间的变化, 以葡萄糖、乙醇、乙酸为唯一碳源时, 3条拟合曲线如图 7b所示, 拟合方程见式(6)~(8).
 | (5) |
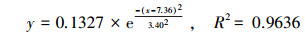 | (6) |
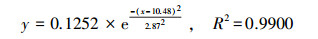 | (7) |
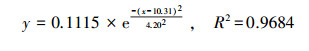 | (8) |
| 表 3 3种碳源条件下的动力学参数与比增长速率 Table 3 Kinetic parameters and specific growth rates under three carbon sources | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 3 3种碳源条件下的动力学参数与比增长速率 Table 3 Kinetic parameters and specific growth rates under three carbon sources
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
根据宋健等(2007)建立的以μ-t曲线为基础的生物群体生长数学模型, 比增长速度μ与时间t的模型方程如式(9)所示.其中, tmax为μ达到最大比增长速率μmax的时间, tL为延迟期的时长.
 | (9) |
3.3 连续流运行试验3.3.1 反应器中PNY2013形态观察菌种富集阶段由于相对严格的密封和灭菌操作, 反应器内的微生物可以认为都是纯酵母菌PNY2013.但随着连续流培养方式的运行和反应器的不断维护, 反应器已不再是严格的封闭系统, 因此, 确认反应器内是否还是主要由酵母菌PNY2013组成十分必要.本文采用扫描电镜观察反应器内的微生物形态, R1、R2、R3反应器运行初期和经过90 d培养后的菌群形态见图 8.由图可以看出, 运行初期, 菌群分布较为分散, 随着反应器的运行, 菌群多附着黏结成絮状体.另外, 反应器中尽管都有少量杆状杂菌混入其中, 但PNY2013(微椭球形)在数量上都还占据优势.
图 8(Fig. 8)
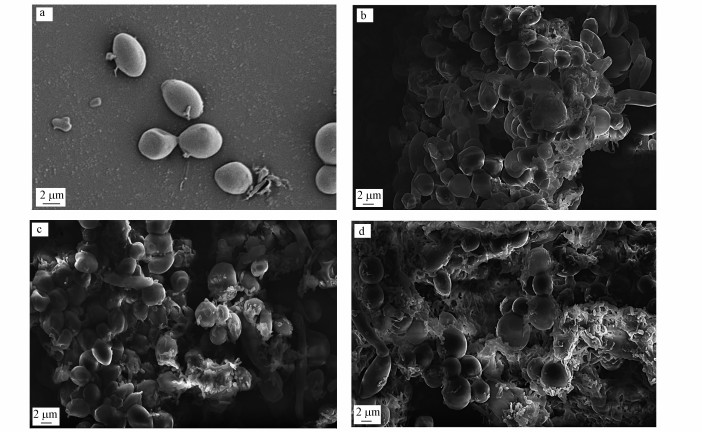 |
| 图 8 反应器运行初期(a)和90 d后(b.R1反应器, c. R2反应器, d.R3反应器)的菌群电镜扫描图 Fig. 8SEM figures of the reactor at the initial stage(a) and on the 90th day (b.R1 reactor, c.R2 reactor, d.R3 reactor) |
3.3.2 反应器中VSS浓度和pH的变化图 9为反应器中VSS浓度和pH的变化情况.如图 9a所示, R1反应器中VSS浓度远高于其他两个反应器, 该反应器中污泥呈黄褐色絮凝团状, 不易被水冲散, 故能较好地保留于反应器内, 而R2和R3反应器内的污泥较细碎, 容易随出水流失.随着反应器的运行, R1反应器中VSS浓度最终维持在800 mg · L-1左右, R2和R3反应器中VSS浓度最终维持在300 mg · L-1左右.由图 9b可知, 反应器内由于KHCO3和NaHCO3的缓冲作用, 使得pH变化不大, 基本在7~9的范围内波动.
图 9(Fig. 9)
 |
| 图 9 反应器中VSS浓度(a)和pH (b)的变化 Fig. 9Change of VSS concentration(a) and pH(b) in the reactors |
3.3.3 反应器中碳、氮、磷的去除效果对比R1、R2和R3反应器在连续流运行条件下分别对碳、氮、磷的去除情况如图 10所示, 其中, 反应器运行过程分为启动阶段和负荷提升两个阶段.首先, 在启动阶段, 3个反应器碳源浓度分别为800、500和2000 mg · L-1.其中, R1反应器在运行初期葡萄糖去除率高达80%左右, 7 d左右去除率稳定后达到了100%;启动阶段NH4+-N进水浓度维持在30 mg · L-1, 出水浓度一直呈不稳定状态;PO43--P降解率结果与NH4+-N类似, 呈波动上升趋势.R2反应器在第1 d碳源去除率仅有40%, 之后降解率逐渐提高, 7 d后稳定在60%左右;其NH4+-N和PO43--P出水浓度波动较大, 降解率均维持在20%左右.R3反应器经过略微的波动4 d后碳源降解率稳定在75%左右, NH4+-N和PO43--P降解率一直在稳定上升.可以看出, 3个反应器在启动阶段对C、N、P的降解均不稳定.
图 10(Fig. 10)
 |
| 图 10 R1(a)、R2(b)、R3(c)反应器启动(A)和负荷提升阶段(B)污染物去除情况 Fig. 10Removal of nutrition in R 1(a)、R2(b)、R3(c) reactor during the start-up phase(A) and improve load stage(B) |
其次, 在负荷提升阶段, R1反应器中葡萄糖进水负荷从1000 mg · L-1提升到8000 mg · L-1, 整个过程中碳源降解率都接近100%, 期间有少许波动, 但最后都趋于稳定;氨氮负荷从50 mg · L-1提升到400 mg · L-1, 在整个运行阶段NH4+-N降解率在负荷提升时有少许波动, 最终都稳定在95%以上;PO43--P的降解率总体表现为波动式上升的状态, 当PO43--P的进水浓度提升至80 mg · L-1时, 其降解率也稳定在95%以上.R1反应器的结果显示出PNY2013在以葡萄糖为碳源条件下具有很强的同步脱氮除磷能力.R2反应器中乙醇进水负荷从1500 mg · L-1提升到4000 mg · L-1, 当进水负荷为1500 mg · L-1时, 其碳源降解率维持在88%左右, 当负荷继续增加时, 其碳源利用率出现较大波动, 利用率最终下降至50%左右;NH4+-N的降解率经过缓慢的增加最终维持在75%左右, 在最后的负荷提升阶段, PO43--P的降解率由90%快速下降至40%左右.R3反应器中乙酸进水负荷从2000 mg · L-1提升到9000 mg · L-1, 其碳源降解率基本稳定在70%~80%, 当负荷提升至9000 mg · L-1时, 碳源降解率下降至52%左右;在负荷提升前期, NH4+-N和PO43--P的降解率分别稳定维持在76%和60%左右, 在负荷提升的最后一个阶段, 分别降至61%和39%左右.R2及R3反应器的结果也显示出PNY2013在以乙醇及乙酸为碳源条件下具有相当的同步脱氮除磷能力.
3.4 PNY2013在含糖工业废水中的应用研究3.4.1 PNY2013在含糖工业废水中的生长情况图 11为PNY2013在制糖废水、淀粉加工废水、啤酒废水及味精废水中的生长结果.由图可以看出, PNY2013在制糖废水中的生长情况最好, 其次是味精废水, 之后是啤酒废水, 在淀粉加工废水中基本不生长.其中, 制糖废水、淀粉加工废水、啤酒废水3种废水的pH都随着PNY2013的生长而下降, 最终都稳定在3.0左右.在味精废水中, pH经过短暂的下降后, 缓慢上升至9.0左右.
图 11(Fig. 11)
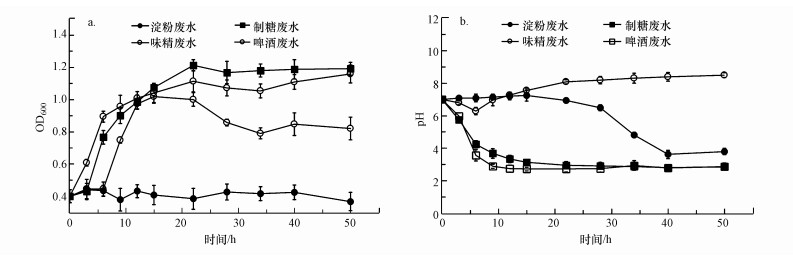 |
| 图 11 4种含糖工业废水对PNY2013生长(a)和pH (b)的影响 Fig. 11Effects of four kinds of sugar-containing industrial wastewater on the growth (a) and pH (b) of PNY2013 |
3.4.2 PNY2013对含糖工业废水处理的可行性研究PNY2013对淀粉加工废水、味精废水、制糖废水、啤酒废水的COD、NH4+-N和PO43--P的处理效果如图 12所示.由图可知, PNY2013对制糖废水、啤酒废水和味精废水的COD去除率分别达到了40%、89%和96%, 对淀粉加工废水的COD去除率较低.这是因为PNY2013能够利用多种碳源, 而啤酒和味精废水中含有多种还原糖类物质, PNY2013能够高效利用这些物质作为碳源, 获取能量和进行生长代谢.而淀粉加工废水中含有多种难溶大分子物质, PNY2013很难将其水解转化成小分子物质再利用.在脱氮性能上, 反应体系中NO2--N、NO3--N均未检出.对氨氮的去除效果对比中, PNY2013对啤酒废水中氨氮的去除率最高达到94%, 其次是制糖和味精废水, 分别达到85%和76%, 对淀粉加工废水中氨氮的去除率最低, 仅有28%.PNY2013在味精废水、制糖废水、啤酒废水中的除磷性能相近, 均在90%左右.实验结果表明, PNY2013对3种含糖工业废水(味精废水、制糖废水、啤酒废水)均具有良好的净化效果, 可见其在工程应用领域前景广阔.
图 12(Fig. 12)
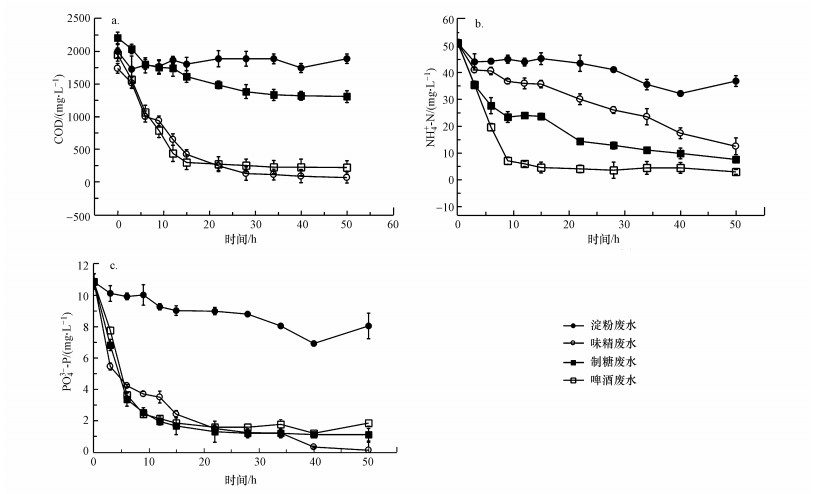 |
| 图 12 PNY2013对4种含糖工业废水中碳(a)、氮(b)、磷(c)的去除效果 Fig. 12Study on the removal effect of C(a), N(b), P(c) from four kinds of sugar-containing industrial wastewater by PNY2013 |
3.4.3 高COD对PNY2013脱氮除磷能力的影响由于实际含糖工业废水中的COD都较高, 为评价PNY2013在高COD废水中的脱氮除磷效果, 本研究大幅度提高废水中的初始COD, 其脱氮除磷效果如图 13所示.由图可知, 在制糖废水中, 提高初始COD, 脱氮除磷效率降低, 但并不明显, 脱氮效率最终稳定在40%左右, 除磷效率稳定在90%左右.而在啤酒废水中, 高COD提高了菌株的脱氮效率, 但除磷效率略有降低, 其脱氮和除磷效率均在95%以上, 其中反应体系中NO2--N、NO3--N均未检出, 表明PNY2013能够承受较高的COD负荷, 保持稳定的脱氮除磷性能.
图 13(Fig. 13)
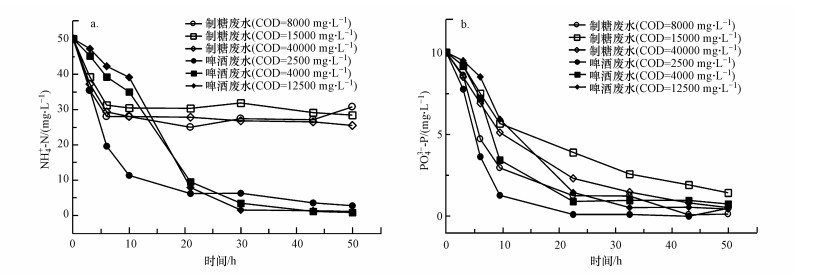 |
| 图 13 高COD条件下菌株脱氮(a)除磷(b)的效果 Fig. 13Effects of strains on nitrogen(a) and phosphorus(b) removal under high COD value |
4 结论(Conclusions)1) PNY2013以葡萄糖、乙醇及乙酸为唯一碳源时均生长良好, 其最大比增长速率μmax分别为0.1327、0.1252及0.1115 h-1, 其同步脱氮除磷率分别可达100%、80%、100% (NH4+-N)及93% 95%、98%(PO43--P).3种碳源下PNY2013同步脱氮除磷的最佳条件基本接近:温度30 ℃, pH=8.0, 溶解氧0~2 mg · L-1, C/N=200 : 5左右.
2) PNY2013长期连续运行条件下的实验结果进一步表明, 以葡萄糖为碳源条件下, 进水NH4+-N及PO43--P浓度分别达400及80 mg · L-1时, 两者去除率均接近100%.与之相比, 以乙醇及乙酸为碳源, 进水NH4+-N及PO43--P浓度分别达100及20 mg · L-1时, 两者的去除率也可分别达60%~80%及40%, 显示出相当的同步脱氮除磷能力.
3) 在以模拟制糖废水、淀粉加工废水、啤酒废水、味精废水这4种典型含糖工业废水为碳源条件下, 除淀粉加工废水外, PNY2013均能有效去除其他3种含糖工业废水中的COD、NH4+-N和PO43--P, 其中, 其中, 制糖、啤酒、制药废水中的COD去除率分别可达40%、89%、96%, NH4+-N去除率分别为85%、94%、76%, PO43--P去除率均为90%.即使在40000(制糖废水)及12500(啤酒废水)mg · L-1的高COD条件下, PNY2013也均具有稳定的NH4+-N和PO43--P去除效果, 显示出良好的同步脱氮除磷应用前景.
参考文献
| Arrigo R A. 2005. Marine microorganisms and global nutrient cycles[J]. Nature, 437: 349-355. DOI:10.1038/nature04159 |
| Bruce E R, Perry L M.2001.Environmental Biotechnology: Principles and Applications[M].NewYork: McGraw-Hill, Inc |
| 鲍林林, 陈永娟, 王晓燕. 2015. 河流沉积物氮循环主要微生物的生态特征[J]. 微生物学通报, 42(6): 1141-1150. |
| Carvalho G, Lemos P C, Oehmen A, et al. 2007. Denitrifying phosphorus removal:Linking the process performance with the microbial community structure[J]. Water Research, 41(19): 4348-4359. |
| Conley D J, Paerl H W, Howarth R W, et al. 2009. Ecology-controlling eutrophication:Nitrogen and phosphorus[J]. Science, 323(5917): 1014-1015. DOI:10.1126/science.1167755 |
| Daims H, Lebedeva E V, Pjevac P, et al. 2015. Complete nitrification by nitrospira bacteria[J]. Nature, 528(7583): 504-509. DOI:10.1038/nature16461 |
| Gu F Q, Xu H J, Liu Z F, et al. 2014. Content of 6 volatile fatty acids of waste water by gas chromatography[J]. Energy Environmental Protection, 28(3): 62-64. |
| Güray G, Altunay P, Abdurrahman T. 2009. Electrochemical treatment of simulated beet sugar factory wastewater[J]. Chemical Engineering Journal, 151(1): 149-159. |
| 郭晓蕾, 朱思潮, 翟旭峰, 等. 2010. 硫酸蒽酮法与硫酸苯酚法测定灵芝多糖含量比较[J]. 中华中医药学刊, 9(1): 210-212. |
| 郝春红, 张峰, 张鹏. 2011. 微量元素对活性污泥脱氮除磷效果影响的对比试验研究[J]. 青岛理工大学学报, (4): 78-83. |
| 贾晓珊, 彭星星, 骆玮诗, 等.2016.一种具有除磷脱氮功能的热带假丝酵母PNY2013及其应用[P].中国, 发明专利, CN105647823A. 2016-06-08 |
| 荆飞.2015.新型碳氮磷同步分解微生物PNY2013应用于不同反应器的去除性能研究[D].广州: 中山大学 |
| Kshirsagar M, Gupta A B, Gupta S K. 1995. Aerobic denitrification studies on activated sludge mixed with Thiosphaera pantotropha[J]. Envrionmental Technology, 16: 35-43. |
| Kuai L P, Verstraete W. 1999. Autotrophic denitrification with elemental sulphur in small-scale wastewater treatment facilities[J]. Environmental Technology, 20: 201-209. DOI:10.1080/09593332008616809 |
| Kuba T, Van Loosdrecht M C M, Brandse F A, et al. 1997. Occurrence of denitrifying phosphorus removing bacteria in modified UCT-type wastewater treatment plants[J]. Water Research, 31(4): 777-786. |
| Kuba T, Smolders G, van Loosdrecht M, et al. 1993. Biological phosphorus removal from waste-water by anaerobic-anoxic sequencing batch reactor[J]. Water Science and Technology, 27(5/6): 241-252. |
| Kuenen J Q, Robertson L A. 1994. Combined nitrification-denitrification process[J]. FEMS Microbialogy Review, 15(2): 109-117. |
| Kuypers M M M, Sliekers A O, Lavik G, et al.Anaerobic ammonium oxidation by anammox bacteria in the Black Sea[J].Pubmed, 422(6932): 608-11 |
| Liu Z X. 2014. Determination of volatile fatty acids produced in anaerobic digestion process of wastewater by gas chromatography[J]. China Water & Wastewater, 30(24): 144-146. |
| Luo W S, Peng X X, Jing F, et al. 2017. Simultaneous microbial removal of carbon, nitrogen, and phosphorus in a modified anaerobic/aerobic (A/O) bioreactor with no phosphorus release[J]. Water and Environment Journal, 31: 158-167. DOI:10.1111/wej.12229 |
| Liu X, Sheng H, Jiang S Y, Yuan Z W, et al. 2016. Intensification of phosphorus cycling in China since the 1600s[J]. PNAS, 113: 2609-2614. DOI:10.1073/pnas.1519554113 |
| 卢玉凤.2012.光合细菌处理食品加工废水试验研究[D].哈尔滨: 哈尔滨工业大学 |
| 骆玮诗.2015.一株新型同步除磷脱氮微生物PNY2013的分离鉴定、代谢特性及应用研究[D].广州: 中山大学 |
| Mino T, Van L M C M, Heijnen J J. 1998. Microbiology and biochemistry of the enhanced biological phosphate removal process[J]. Water Research, 32(11): 3193-3207. DOI:10.1016/S0043-1354(98)00129-8 |
| Oehmen A, Lemos P C, Carvalho G, et al. 2007. Advances in enhanced biological phosphorus removal:Frommicro to macro scale[J]. Water Research, 41(11): 2271-2300. DOI:10.1016/j.watres.2007.02.030 |
| 曲音波, 林建强, 肖敏. 2005. 现代微生物技术丛书-微生物技术开发原理[M]. 北京: 化学工业出版社, 142. |
| Robert J, Seviour T M, Motoharu O. 2003. The microbiology of biological phosphorus removal in activated sludge system[J]. Microbiology Review, 27: 99-127. |
| Seviour R J, Mino T, Onuki M. 2003. The microbiology of biological phosphorus removal in activated sludge systems[J]. FEMS Microbiology Review, 27: 99-127. DOI:10.1016/S0168-6445(03)00021-4 |
| Staley J T, Bryant M P, Pfenning N, et al.1989.Bergey'S Manual of Systematic Bacteriology[M].Philadelphia: Williams&Wikins |
| 宋健, 林建群, 金燕, 等. 2007. 以比生长速率时间曲线为基础的生物群体生长数学模型[J]. 生物学通报, 34(5): 836-838. |
| Tage D, Donald E C, Jan P, et al.Anaerobic ammonium oxidation by anammox bacteria in the Black Sea[J].Nature, 422: 606-608 |
| Treusch A H, Leininger S, Kletzin A, et al. 2005. Novel genes for nitrite reductase and Amo-related proteins indicate a role of uncultivated mesophilic crenarchaeota in nitrogen cycling[J]. Environ Microbiol, 7: 1985-1995. DOI:10.1111/j.1462-2920.2005.00906.x |
| Tsuneda S, Ohno T, Soejima K, et al. 1996. Simultatneous nirogen and phophorus removal using denitrifying phosphate-accumulating organisms in a sequencing batch reactor[J]. Biochemistry Engineering Journal, 27(3): 191-196. |
| 汤佳鑫.2008.啤酒酵母在不同碳源条件下中间代谢途径关键酶活性分析[D].大连: 大连工业大学 |
| Ulah M A, Kim K, Szulejko J E, et al. 2014. The gas chromatographic determination of volatile fatty acids in wastewater samples:evaluation of experimental biases in direct injection method against thermal desorption method[J]. Analytica Chimica Acta, 820(11): 159-167. |
| van Kessel Maartje A H J, Speth D R, Albertsen M, et al. 2015. Complete nitrification by a single microorganism[J]. Nature, 528(7583): 555-559. DOI:10.1038/nature16459 |
| van de Graaf A A, Mulder A, de Bruijin P, Jetten M S M, et al. 1995. Anaerobic oxidation of ammonia is biologically mediated process[J]. Applied& Environmental Microbiology, 61(4): 1246-1251. |
| 颜薇芝, 张汉强, 余从田, 等. 2017. 1株异养硝化好氧反硝化不动杆菌的分离及脱氮性能[J]. 环境工程学报, 11(7): 4419-4428. |
| 杨秀玲, 杨宗政, 庞金钊. 2005. 具有硝化作用的异养菌脱除氨氮的性能研究[J]. 天津科技大学学报, 20(1): 24-26, 48. |
| 张刚.2011.新型厌氧同时脱氮除磷微生物的培养、鉴定及其基质分解特性的研究[D].广州: 中山大学 |
| 张怀强, 金建玲, 刘波, 等. 2005. 构建限制性条件下微生物群体生长模型时的问题[J]. 应用与环境生物学报, (5): 77-81. |
| 张杰, 李春艳, 李劲平, 等. 2012. 蒽酮硫酸法与苯酚硫酸法测定竹节参多糖含量的比较研究[J]. 中南药学, 10(6): 421-424. |
| 张立秋, 封莉, 张晓菲, 等. 2004. 淹没式MBR处理啤酒废水的试验研究[J]. 中国给水排水, (5): 5961. |
| 张慧敏, 姚善泾, 彭立凤, 等. 2004. 在不同碳源培养条件下酿酒酵母的蛋白质组解析[J]. 生物工程学报, 2004(3): 398-402. |
| 中华人民共和国生态环境部. 2019. 2018年《中国生态环境状况公报》(摘录二)[J]. 环境保护, 47(12): 50-55. |
