 , 张雅庆1, 焦一滢3, 陈俊辰1, 包雲舟1, 赵丽娅1, 宋慧婷1, 李兆华1
, 张雅庆1, 焦一滢3, 陈俊辰1, 包雲舟1, 赵丽娅1, 宋慧婷1, 李兆华1

1. 湖北大学资源环境学院, 武汉 430062;
2. 湖泊与环境国家重点实验室, 南京 210008;
3. 河湖生态修复及藻类利用湖北省重点实验室, 湖北工业大学土木建筑与环境学院, 武汉 430068
收稿日期: 2019-05-30; 修回日期: 2019-07-16; 录用日期: 2019-07-16
基金项目: 国家自然科学基金项目(No.41807452);湖北省自然科学基金项目(No.2018CFB311);湖泊与环境国家重点实验室开放基金资助项目(No.2018SKL011)
作者简介: 陈默(1984-), 男, E-mail:chenmoccnu@163.com
通讯作者(责任作者): 李兆华, E-mail:zli@hubu.edu.cn
摘要:在富营养化淡水湖泊中,微生物对水生植物的厌氧分解会导致局部水域泛黑发臭,产生草源性"湖泛"现象,但是当前对上覆水中硫酸盐还原细菌(SRB)在水生植物残体分解中的作用还不甚了解.本研究通过室内模拟实验,分别向湖水(本底硫酸根浓度为40 mg·L-1)中添加不同浓度的硫酸根,研究了硫酸根浓度升高对上覆水中SRB参与水生植物菹草(P.crispus)残体分解的影响.结果表明,硫酸根浓度升高显著促进了上覆水中硫酸盐还原作用,实验第50 d时,添加了40 mg·L-1硫酸根实验组(40S)中可溶性硫化物(∑H2S)为(100.11±5.08)mg·L-1,远高于未添加硫酸根对照组(CK)的(46.83±3.79)mg·L-1.硫还原细菌如脱硫化弧菌属(Desulfovibrio)、脱硫肠状菌属(Desulfotomaculum)和脱硫微菌属(Desulfomicrobium)在40S中的相对丰度显著高于CK(p < 0.05),而脱硫化孢弯菌属(Desulfosporosinus)则在CK中的相对丰度更高,这说明硫酸根浓度升高促进了菹草残体厌氧分解过程中某些特定种属SRB的生长繁殖.此外,硫酸根浓度升高也影响了菹草厌氧分解过程中有色溶解有机物(CDOM)组分含量的变化,类腐殖质组分在第63 d的荧光强度显著高于第10 d(p < 0.05),这说明硫酸根浓度升高促进了菹草厌氧分解过程中类腐殖质的产生.本研究对于进一步认识淡水水体中硫酸盐还原的环境效应及生物学机制具有重要意义,也为富营养化水体生态系统修复提供理论依据.
关键词:富营养化淡水湖泊上覆水硫酸盐还原菹草有色溶解有机物
Sulfate reduction in the water column during anaerobic decomposition of Potamogeton crispus L. residue
CHEN Mo1,2
 , ZHANG Yaqing1, JIAO Yiying3, CHEN Junchen1, BAO Yunzhou1, ZHAO Liya1, SONG Huiting1, LI Zhaohua1
, ZHANG Yaqing1, JIAO Yiying3, CHEN Junchen1, BAO Yunzhou1, ZHAO Liya1, SONG Huiting1, LI Zhaohua1

1. School of Resources and Environmental Science, Hubei University, Wuhan 430062;
2. State Key Laboratory of Lake Science and Environment, Nanjing 210008;
3. Key Laboratory of Ecological Remediation of Lakes and Rivers and Algal Utilization of Hubei Province, School of Civil Engineering, Architecture and Environment, Hubei University of Technology, Wuhan 430068
Received 30 May 2019; received in revised from 16 July 2019; accepted 16 July 2019
Abstract: Anaerobic decomposition of macrophytes induces black and odorous bloom forming the phenomenon "colored zone" in eutrophic freshwater lakes. However, the role of sulfate reduction for the decomposition of macrophytes in overlying water has received little attention. In this study, the effects of sulfate concentrations on anaerobic decomposition of Potamogeton crispus L. (P. crispus) under sulfate reduction conditions were investigated by using the mesocosm experiments. The results indicate that an increase in sulfate concentrations stimulated sulfate reduction in the overlying water. On day 50, the concentration ((100.11±5.08) mg·L-1) of dissolved sulfide (∑H2S) in treatment amended with sulfate concentration of 40 mg·L-1 (40S) was obviously higher than control (sulfate un-amendment) ((46.83±3.79) mg·L-1). The relative abundance of typical SRB genera, like Desulfovibrio, Desulfotomaculum and Desulfomicrobium in 40S was significantly higher than in control on day 50 (p < 0.05), however, the average relative abundance of Desulfosporosinus was higher in control (3.53%) than in 40S (1.29%), indicating higher level of sulfate possibly favors some groups of SRB specifically and allows them to outcompete the others for substrate in the study. Additionally, the dynamics of chromophoric dissolved organic matter (CDOM) were influenced by increases in sulfate input. Results indicated that fluorescence intensities of humic-like component in 40S were significantly higher on day 63 than day 10 (p < 0.05), indicating that increases in sulfate input stimulated the production of humic-like substance during anaerobic decomposition of P. crispus in the overlying water. The study has important implication for further understanding of environmental effects of sulfate reduction and the microbial mechanism of sulfate reduction in freshwater lakes, and provides theoretical foundation for the remediation of ecosystems in eutrophic freshwater lakes.
Keywords: eutrophic freshwater lakesoverlying watersulfate reductionP. crispuschromophoric dissolved organic matter
1 引言(Introduction)我国是一个浅水湖泊众多的国家, 湖泊等内陆水体是支撑我国经济和社会发展的主要资源之一.目前局部湖湾区发生的“湖泛”现象导致局部水域水质严重恶化, 已受到广泛重视.“湖泛”是指湖泊水体中(包括沉积物)富含大量的有机物质, 在微生物的分解作用下, 大量消耗氧气, 进而出现厌氧分解, 在还原条件下快速、巨量地释放出许多致黑(或其它颜色)致臭物质, 进而影响水质和湖泊生态系统结构与功能乃至引发环境或者生态灾难(陆桂华等, 2009).在湖泊中, 除了由于蓝藻堆积死亡导致的藻源性“湖泛”外(陆桂华等, 2009;申秋实等, 2012;沈爱春等, 2012), 还有因水生植物衰亡分解而产生的草源性“湖泛”(Shen et al., 2014).水生植物本身是湖泊生态系统的重要组成部分, 随着湖泊富营养化、以及沼泽化过程湖床被抬高, 都在一定程度上刺激了水生植物的生长.相应地, 水生植物衰亡后分解造成的水体二次污染也不应忽视(潘慧云等, 2008;易文利等, 2011;唐金艳等, 2013).实际上, 草源性“湖泛”在我国浅水湖泊(如太湖和内蒙古的乌梁素海)水生植物生长密集区时常发生.2012年春夏季太湖巡测时, 在太湖贡湖湾南泉水厂的水源区附近发现了草源性“湖泛”污染现象, 更加剧了对该问题认识的迫切性.因此, 开展浅水湖泊草源性“湖泛”发生机理的研究, 在湖泊的科学管理和治理方面有明显的应用价值, 也有利于评估水生植物死亡后的环境效应及其致灾预测.
研究表明草源有机质的分解是多种异养微生物协同作用的结果(Song et al., 2013), 其中硫酸盐还原细菌(Sulfate-Reducing Bacteria, SRB)是主要参与者之一(Shen et al., 2014;Song et al., 2016), SRB能够在氧化有机物的同时将硫酸根还原为硫化氢等硫化物(即硫酸盐还原作用)(Holmer et al., 2001).目前对微生物硫酸盐还原的研究主要集中在海洋缺氧区(Lin et al., 2006)、河口海岸带(尹希杰等, 2010)与盐湖(杨渐等, 2013)环境中, 而淡水水体中硫酸盐还原过程的研究主要集中在沉积物中(Holmer et al., 2001;Feng et al., 2014;Chen et al., 2016a).有研究表明, 含有大量水生植物残体的东太湖沉积物中硫酸盐还原速率和硫酸盐还原菌丰度显著高于水生植物残体少的太湖其他湖湾(Chen et al., 2016a).蓝藻水华衰亡过程中沉积物中SRB相对丰度显著高于无蓝藻水华时期(Chen et al., 2016b).近六十年来, 煤炭消耗和二氧化硫的排放导致我国主要湖泊(如太湖)水体硫酸根浓度持续上升(Yu et al., 2013), 当前已达100 mg·L-1.另外, 由于外源输入和湖泊内生等原因, 使得我国淡水湖泊含有大量有机质, 在高温季节由于微生物耗氧作用使局部湖区底部形成了厌氧区(Zhu et al., 2008).这两个因素的叠加为富营养化水体上覆水中的硫酸盐还原提供了良好的条件.有研究表明, 目前太湖水体中的硫酸根浓度能够维持上覆水和沉积物中硫酸盐还原的持续发生, 导致上覆水中可溶性硫化物含量快速增加(浓度高达5.9 mg·L-1)(Chen et al., 2016b).目前虽然已有报道表明沉积物中SRB参与草源有机质分解, 且水生植物残体的分解促进了沉积物中的硫酸盐还原作用(Chen et al., 2016a), 但上覆水中硫酸盐还原在淡水湖泊草源有机质分解过程中的作用还有待研究, 特别是参与草源有机质分解的SRB群落结构也不清楚.
进一步的证据表明, 在有机质的厌氧分解过程中, 硫酸盐还原作用还与有色溶解有机物(Chromophoric Dissolved Organic Matter, CDOM)的代谢紧密相关.CDOM是水体溶解性有机物(Dissolved Organic Matter, DOM)的重要组分之一, 被认为是水环境中主要的溶解有机碳贮库(Zhang et al., 2011), 参与水生态系统乃至全球碳循环过程(Yamashita et al., 2008).在海洋沉积物中, 硫酸盐-甲烷转换区存在明显的SRB代谢DOM现象(Komada et al., 2016), 且沉积物间隙水中硫酸盐浓度与CDOM含量呈显著负相关, 说明SRB在氧化DOM的过程中产生了CDOM(Chen et al., 2017).最近的室内培养实验也表明海洋沉积物中SRB在代谢乙酸的过程中产生了大量的腐殖质类CDOM(Luek et al., 2017).目前已有关于水生植物残体分解过程产生CDOM的研究(张运林等, 2005;刘新等, 2017), 但对水生植物残体在硫酸盐还原分解条件下CDOM组分的变化特征有待进一步研究.
沙湖位于武汉市武昌区东北部, 水域面积3.197 km2, 于2013年通过人工挖掘的楚河与东湖连通, 是武汉市的第四大城中湖.近年来, 随着城市化的迅猛发展, 湖体水污染和富营养化程度加剧.本文选择沙湖中常见的水生植物菹草进行室内模拟实验, 研究水生植物残体在上覆水厌氧分解过程中硫酸盐还原特征, 探究上覆水水生植物残体在SRB分解条件下CDOM主要组分及其变化, 以期进一步认识淡水湖泊硫酸盐还原机制.
2 材料与方法(Materials and methods)2.1 样品的采集与处理在本研究中, 水生植物菹草(Potamogeton crispus L.)和湖水于2018年7月中旬采集自沙湖靠近湖北大学一侧沿岸(图 1).菹草样品用清水洗净, 吸水纸擦干后, 置于室温下自然风干至恒重, 然后用剪刀将菹草残体剪成长度约为3 cm的条状, 并混合均匀.按照5 g一袋的标准, 将菹草残体装于若干尼龙袋中, 扎紧待用.用若干50 L有盖塑料桶采集沙湖湖水, 置于室温, 黑暗条件下, 24 h内使用完毕.
图 1(Fig. 1)
 |
| 图 1 沙湖采样位点图(114°19′59.67″E, 30°34′26.57″N) Fig. 1The sampling site at Lake Shahu in this study |
模拟实验由15根一端密封的有机玻璃柱组成(150 cm高, 直径20 cm).将沙湖水混匀后, 分别倒入每个有机玻璃柱中, 直至水面高度为120 cm, 然后将Na2SO4溶解于湖水中, 并按照如下5个浓度梯度将硫酸根添加到不同有机玻璃柱中, 每个梯度3个平行, 使得各实验组有机玻璃柱上覆水中添加的硫酸根浓度分别为0 mg·L-1(CK), 40 mg·L-1(40S), 80 mg·L-1(80S), 100 mg·L-1(100S)和120 mg·L-1(120S).最后, 将10个均装有5 g风干菹草残体的尼龙袋从上至下均匀固定在一根尼龙绳上, 尼龙绳两端分别固定在每个有机玻璃柱的顶部和底部.有机玻璃柱用铝箔纸进行避光处理, 室温条件下运行63 d.实验过程中, 当发现任一有机玻璃柱中硫酸根浓度降低40%时, 及时添加硫酸根至初始设定浓度(图 2b).每1~4 d采集距有机玻璃柱顶端60 cm处上覆水样品, 4 ℃保存, 部分上覆水样保存于-20 ℃, 备用.
图 2(Fig. 2)
 |
| 图 2 ∑H2S浓度(a)和SO42-浓度(b)随时间的变化(其中图 2b中箭头表示添加硫酸根的时间点) Fig. 2Dynamics of concentrations of ∑H2S (a) and sulfate (b) during the incubation(arrows in Figure 2b represented the time point when sulfate was amended) |
2.2 水样的基础理化性质分析水样中可溶性硫化物(∑H2S)的测定方法参考《湖泊富营养化调查规范》.硫酸根(SO42-)通过离子色谱仪测定, 溶解性有机碳(DOC)含量利用总有机碳分析仪(岛津TOC-5000A)测定, 溶解氧(DO)和pH值分别用YSI550A便携式溶氧仪和台式pH计(Mettler-Toledo)测定.
2.3 CDOM测定采用三维荧光分光光度计(Hitachi F-4500)测定水样的三维荧光光谱(EEMs).激发波长(Ex)和发射波长(Em)的扫描区间分别为200~450 nm和250~600 nm, 步长分别为5 nm和1 nm, 扫描速率为2400 nm·min-1, 带宽裂缝均为5 nm, 光电倍增管电压设定为800 V.扫描光谱进行仪器自动校正, 以Milli-Q水作为空白, 并利用0.01 mg·L-1硫酸奎宁进行荧光定标.以355 nm处吸收系数α(355)表示CDOM相对浓度, 并利用平行因子模型(PARAFAC)确定CDOM的组分差异性(Zhou et al., 2015).
2.4 微生物群落结构分析为研究上覆水中微生物群落结构, 本文中选择CK和40S的初始水样和实验结束时的水样进行DNA提取.取100 mL水样过滤至孔径为0.2 μm的聚碳酸酯膜上(Millipore), 采用试剂盒(PowerSoil?DNA, MOBIO)进行DNA提取, DNA的浓度采用超微量分光光度计(Nanodrop 2000, Wilmington, USA)进行测定.DNA样品送商业测序公司进行illumina高通量测序, illumina测序平台产生的初始数据采用开放的软件包QIIME(http://qiime.org/)进行分析, 具体的分析方法详见参考文献(Chen et al., 2016b).
2.5 数据分析与处理运用SPSS11.0进行数据统计分析, p>0.05表示未达到显著检验水平;p < 0.05为显著水平.采用MATLAB中DOMFluor工具箱的PARAFAC法模型对样品的三维荧光数据进行分析.图 2、图 3和图 5中数值均以平均数±标准差形式表示.
图 3(Fig. 3)
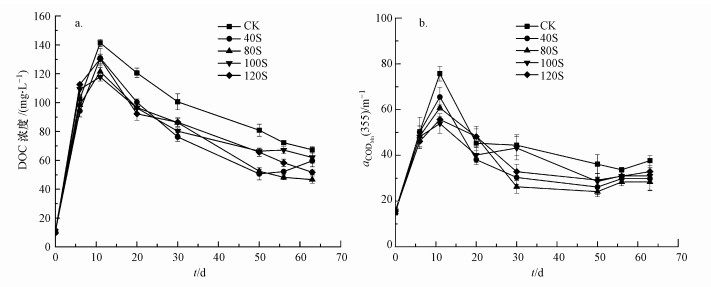 |
| 图 3 DOC浓度(a)和CDOM浓度(b)随时间的变化 Fig. 3Dynamics of concentrations of DOC (a) and CDOM (b) during the incubation |
图 5(Fig. 5)
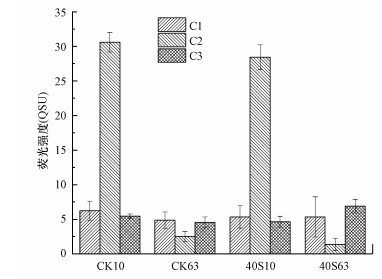 |
| 图 5 第10 d和63 d时CDOM的3个荧光组分的荧光强度(CK10、CK63、40S10和40S63分别表示对照组第10 d, 对照组第63 d, 40S第10 d和40S第63 d) Fig. 5Fluorescence intensity of the three fluorescent components of CDOM on day 10 and 63, respectively (CK10、CK63、40S10 and 40S 63 represent day 10 in the control, day 63 in the control, day 10 in the 40S and day 63 in the 40S, respectively) |
3 结果(Results)3.1 降解过程中DO、pH、∑H2S和SO42-的变化实验开始时DO浓度约为5.2 mg·L-1, 菹草在上覆水中的分解过程导致DO快速降低, 第4 d时DO浓度已低于0.15 mg·L-1, 直到实验结束DO均未高于0.20 mg·L-1(图未给出).菹草厌氧分解过程中pH呈现出先下降后缓慢上升的趋势.第1 d pH值约为8.1, 第6 d降至7.4左右, 后逐渐升高直至约7.8(图未给出).菹草残体的分解显著提高了上覆水中∑H2S浓度(图 2a), 上覆水中初始∑H2S浓度约为0.02 mg·L-1, 实验第50 d时, 不同实验组中∑H2S浓度分别为(46.83±3.79) mg·L-1(CK), (100.11±5.08) mg·L-1(40S), (95.17±4.73) mg·L-1(80S), (101.31±6.36) mg·L-1(100S), (93.78±4.33) mg·L-1(120S), 统计分析表明, 对照组(CK)与其他添加硫酸根实验组∑H2S浓度存在显著性差异(p < 0.05), 而添加不同浓度实验组之间没有显著性差异(p>0.05).第50 d后, 各实验组∑H2S浓度呈现出缓慢降低趋势(图 2a).图 2b表明了不同实验组中SO42-浓度随时间的变化情况和添加SO42-的时间点.
3.2 降解过程中DOC含量和CDOM浓度的变化上覆水中DOC含量呈现出先升高后降低的趋势(图 3a), 初始DOC含量约为10 mg·L-1, 实验第11 d时达到最高值, 其中对照组的DOC含量最高, 为(141.37±2.58) mg·L-1(CK), 其他实验组分别为(130.94±6.52) mg·L-1(40S), (121.53±4.51) mg·L-1(80S), (117.74±2.75) mg·L-1(100S)和(130.28±3.21) mg·L-1(120S).由于菹草分解产生的DOC逐渐被厌氧微生物代谢, 实验开始11 d后DOC含量逐渐降低, 实验结束时不同实验组中DOC含量分别为(67.33±2.21) mg·L-1(CK), (59.61±1.47) mg·L-1(40S), (46.64±2.54) mg·L-1(80S), (62.00±6.51) mg·L-1(100S)和(51.73±1.67) mg·L-1(120S).从图 3b可知, 用吸收系数α(355)表征的CDOM浓度也表现出先升高后降低的趋势, 第11 d各实验组CDOM浓度均最高, 其中对照组为(75.69±3.21) m-1, 其他添加硫酸根实验组CDOM浓度均低于对照组.
3.3 降解过程中CDOM荧光组分的变化三维荧光是复杂荧光团的集体表现, 不同来源的CDOM的荧光谱峰位置往往不同.本文利用PARAFAC模型对全部CDOM样品的EEMs进行分解.半检验分析结果显示, 激发和发射光谱高度重叠, 证实该模型有效(图 4).从图 4可知, 菹草厌氧分解过程中EEMs图谱主要由3大类荧光组分:组分1(C1)有两个激发波长, 分别位于230 nm和320 nm处, 发射波长最大值在420 nm处, 为类腐殖质荧光组分(Yu et al., 2010);组分2(C2)激发波长最大值位于280 nm处, 发射波长最大值位于330 nm, 为类酪氨酸荧光组分(Wang et al., 2013);组分3(C3)激发波长最大值在380 nm处, 发射波长最大值在460 nm处, 为类腐殖质荧光组分(Xu et al., 2013).
图 4(Fig. 4)
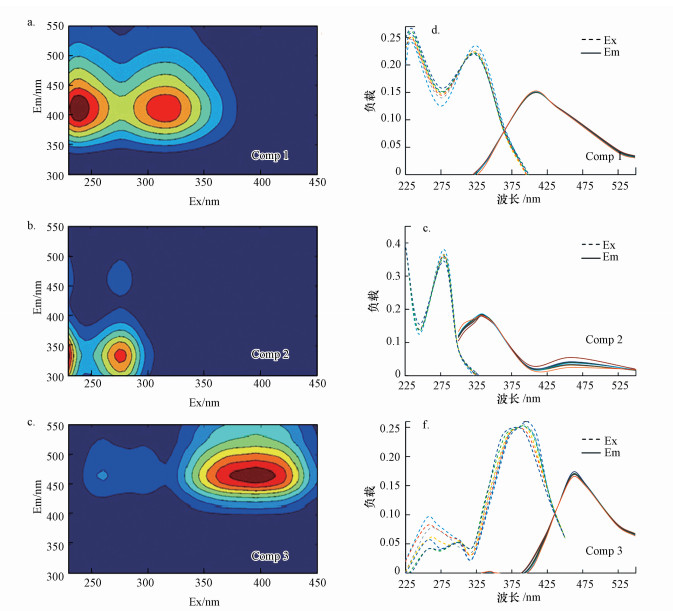 |
| 图 4 厌氧分解过程中CDOM的3个荧光组分C1、C2、C3所对应的EEMs谱图分别为(a)、(b)和(c), (d)、(e)、(f)依次对应荧光组分C1、C2、C3的半检验分析 Fig. 4The EEMs spectra of the three fluorescent components C1, C2 and C3 during anaerobic decomposition of P. crispus were (a), (b) and (c), respectively. (d), (e), (f) correspond to the PARAFAC of the fluorescent components C1, C2, C3 |
图 5呈现了菹草厌氧分解过程中CDOM的3种荧光组分荧光强度随降解时间的变化过程.实验开始第10 d, 荧光组分以类酪氨酸组分C2(图 5)占绝对优势, 对照组和40S实验组中C2的荧光强度没有显著性差异(p>0.05), 在实验过程中C2的荧光强度显著下降(p < 0.05).类腐殖质组分C1(图 5)的荧光强度在实验过程中没有显著性差异(p>0.05).对于40S实验组而言, 类腐殖质组分C3组分在第63 d的荧光强度显著高于第10 d(p < 0.05)(图 5), 这说明菹草厌氧分解过程中伴随着C3组分的产生.
3.4 降解过程中微生物群落结构变化菹草的厌氧分解显著改变了上覆水中微生物群落结构(图 6).作为典型的厌氧光合细菌, 绿菌门(Chlorobi)细菌在第1 d上覆水中的相对丰度约为1.6%, 到实验结束的第63 d, 绿菌门细菌在CK和40S实验组的相对丰度分别达到了62.57%±7.96%和59.34%±4.32%.变形菌门(Proteobacteria)细菌相对丰度则从第一天的22.25%±5.51%下降到第63 d的12.14%±3.92%(CK)和13.79%±1.95%(40S).作为典型的发酵菌, 拟杆菌门(Bacteroidetes)参与了草源有机质的分解过程, 导致实验第63 d时40S中拟杆菌门细菌相对丰度显著高于对照组(p < 0.05).此外, 菹草的厌氧分解抑制了放线菌门(Actinobacteria)细菌的生长, 却促进了厚壁菌门(Firmicutes)细菌的生长(图 6).
图 6(Fig. 6)
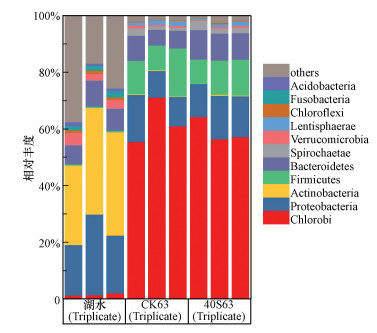 |
| 图 6 上覆水中细菌门的相对丰度(CK63和40S63分别表示对照组第63 d和40S第63 d) Fig. 6Relative abundances of microbial phylum in the water column(CK63 and 40S 63 represent day 63 in the control and day 63 in the 40S, respectively) |
图 7显示了实验结束时细菌在属水平上相对丰度前35的物种.绿棒菌属(Chlorobaculum)是优势物种, 占整个细菌序列的50%以上, 且在CK和40S实验组间没有显著性差异(p>0.05)(图 7).相比于CK, 40S实验组中硫还原细菌如脱硫化弧菌属(Desulfovibrio)、脱硫肠状菌属(Desulfotomaculum)和脱硫微菌属(Desulfomicrobium)的相对丰度显著升高(p < 0.05)(表 1).虽然脱硫化孢弯菌属(Desulfosporosinus)相对丰度在CK和40S实验组间没有显著性差异(p>0.05)(表 1), 但是脱硫化孢弯菌属(Desulfosporosinus)相对丰度在CK中均值(3.54%)高于40S实验组(1.30%).
图 7(Fig. 7)
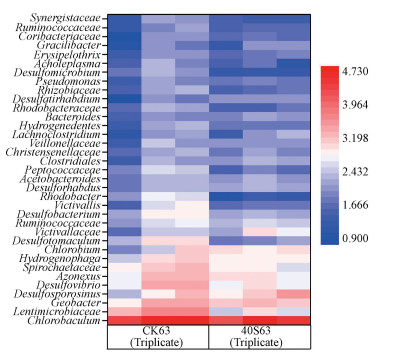 |
| 图 7 上覆水中OTU数量(取以10为底的对数处理)排在前35的已被确定的细菌属(CK63和40S63分别表示对照组第63 d和40S第63 d) Fig. 7Relative abundance (log 10 transformed) of OTUs of top 35 classified bacterial genera in the water column(CK63 and 40S63 represent day 63 in the control and day 63 in the 40S, respectively) |
表 1(Table 1)
| 表 1 实验第63 d时上覆水中主要硫还原细菌的相对丰度 Table 1 Relative abundance of the main SRB genera in the water column on day 63 | |||||||||||||||||||||||||||||
表 1 实验第63 d时上覆水中主要硫还原细菌的相对丰度 Table 1 Relative abundance of the main SRB genera in the water column on day 63
| |||||||||||||||||||||||||||||
4 讨论(Discussion)随着对硫酸盐还原环境效应的深入研究, 淡水湖泊中硫酸盐还原越来越受到关注(邢鹏等, 2015;Chen et al., 2016b;何天容等, 2016;荣楠等, 2018).本研究结果表明淡水湖泊上覆水中SRB参与了水生植物的厌氧分解过程, 且水体中硫酸根浓度在一定范围内的升高显著促进上覆水中硫酸盐还原过程, 加剧∑H2S的产生.
当水体中硫酸根浓度提高40 mg·L-1时, 明显促进了上覆水中硫酸盐还原作用, 相比于对照组产生了更多的∑H2S, 但硫酸根浓度进一步提高对硫酸盐还原却没有显著影响(图 2).微生物硫酸盐还原过程是酶促反应, 因此也遵循米氏方程, 从而导致只在一定硫酸根浓度范围内, 硫酸盐还原速率与硫酸根浓度呈正相关(图 2).由于不同水体中硫酸根浓度和硫酸盐还原微生物群落结构各异, 米氏常数(Km)在不同水体环境中也不尽相同(Pallud et al., 2006), Km值高说明环境中微生物群落对硫酸根的亲和性弱;反之则表明亲和性强.沙湖中硫酸根本底值(40 mg·L-1)与已有报道中淡水水体硫酸盐还原Km值接近(Li et al., 1996;Pallud et al., 2006), 却不到太湖硫酸根浓度(100 mg·L-1)的一半(Chen et al., 2016b), 因此沙湖中硫酸盐还原作用的Km值很可能小于太湖, 且沙湖中SRB对硫酸根亲和性更高, 最终导致本研究中硫酸根浓度进一步升高对硫酸盐还原作用影响不显著.
虽然在整个实验过程中SRB不是优势菌种, 但微生物硫酸盐还原产生了大量的∑H2S(图 2).脱硫化孢弯菌属(Desulfosporosinus)在CK中相对丰度均值高于40S实验组, 但是40S实验组中脱硫化弧菌属(Desulfovibrio)、脱硫肠状菌属(Desulfotomaculum)和脱硫微菌属(Desulfomicrobium)的相对丰度显著高于CK(p < 0.05)(表 1), 这说明淡水水体硫酸根浓度的升高会选择性地促进上覆水中某些种属的SRB生长与繁殖.另外, 值得注意的是, 在菹草的厌氧分解过程中上覆水中绿棒菌属(Chlorobaculum)相对丰度超过了50%(图 7), 绿棒菌属(Chlorobaculum)作为一类典型的厌氧硫氧化菌, 能够将硫化物氧化为硫酸根(Nielsen et al., 2016), 且相比于其他光合细菌更易适应弱光环境(Rodriguez et al., 2011).厌氧硫氧化菌在实验过程中大量出现说明硫氧化细菌可能在水生植物厌氧分解过程中完成了氧化硫化物的过程, 这个问题值得进一步研究.
有研究表明类酪氨酸荧光物质是水生植物分解过程中主要的CDOM组分之一(刘新等, 2017), 异养微生物对可溶性有机物的分解导致了类酪氨酸荧光物质含量逐渐降低(图 5)(张运林等, 2005).此外, 菹草厌氧分解过程中产生了难降解的类腐殖质荧光组分(图 5), 这些类腐殖质荧光物质也可能来源于微生物代谢过程中的副产物, 最近的研究表明沉积物中的微生物硫酸盐还原作用产生了类腐殖质荧光组分(Chen et al., 2017;Luek et al., 2017).本研究中添加了40 mg·L-1硫酸根实验组, 第63 d上覆水中类腐殖质荧光组C3分含量显著高于第10 d(图 5), 这表明在菹草厌氧分解过程中, 上覆水中SRB很可能与类腐殖质荧光物质的产生紧密相关.腐殖质由于其化学结构复杂且难以被微生物利用, 其形成过程通常被认为是沉积物储碳的重要机制之一(Prescott, 2010), 因此菹草厌氧分解过程中硫酸盐还原产生类腐殖质的过程值得进一步研究.
5 结论(Conclusions)当前, 淡水湖泊中硫酸根浓度持续升高, 水生植物的厌氧分解将导致湖泊缺氧, 甚至引发草源性“湖泛”.本研究结果表明上覆水SRB参与了水生植物的厌氧分解过程, 持续产生了大量的∑H2S.在一定浓度范围内, 淡水湖泊硫酸根含量的升高显著促进了上覆水中硫酸盐还原作用, 且硫酸根浓度的升高更有利于某些特定种属SRB的生长和繁殖.此外, 上覆水中硫酸盐还原作用可能与类腐殖质荧光物质的产生密切相关.因此, 今后对淡水湖泊管理过程中应该重视控制硫酸盐的输入, 特别是在水生植物腐败分解过程中.
参考文献
| Chen M, Jiang H L. 2016a. Relative contribution of iron reduction to sediments organic matter mineralization in contrasting habitats of a shallow eutrophic freshwater lake[J]. Environmental Pollution, 213: 904-912. DOI:10.1016/j.envpol.2016.03.061 |
| Chen M, Kim J H, Choi J, et al. 2017. Biological early diagenesis and insolation-paced paleoproductivity signified in deep core sediment organic matter[J]. Scientific Reports, 7(1): 1581. DOI:10.1038/s41598-017-01759-4 |
| Chen M, Li X H, He Y H, et al. 2016b. Increasing sulfate concentrations result in higher sulfide production and phosphorous mobilization in a shallow eutrophic freshwater lake[J]. Water Research, 96: 94-104. DOI:10.1016/j.watres.2016.03.030 |
| Feng Z Y, Fan C X, Huang W Y, et al. 2014. Microorganisms and typical organic matter responsible for lacustrine "black bloom"[J]. Science of the Total Environment, 470: 1-8. |
| 何天容, 高钊, 罗光俊, 等. 2016. 贵阳市水库中硫酸盐还原菌及铁还原菌对甲基汞分布的影响[J]. 环境科学学报, 36(1): 84-91. |
| Holmer M, Storkholm P. 2001. Sulphate reduction and sulphur cycling in lake sediments:a review[J]. Freshwater Biology, 46(4): 431-451. DOI:10.1046/j.1365-2427.2001.00687.x |
| Komada T, Burdige D J, Li H L, et al. 2016. Organic matter cycling across the sulfate-methane transition zone of the Santa Barbara Basin, California Borderland[J]. Geochimica et Cosmochimica Acta, 176: 259-278. DOI:10.1016/j.gca.2015.12.022 |
| Li J H, Takii S, Kotakemori R, et al. 1996. Sulfate reduction in profundal sediments in Lake Kizaki, Japan[J]. Hydrobiologia, 333(3): 201-208. DOI:10.1007/BF00013434 |
| Lin X S, Wakeham G, Putnam I, et al. 2006. Comparison of vertical distributions of prokaryotic assemblages in the anoxic Cariaco Basin and Black Sea by use of fluorescence in situ hybridization[J]. Applied and Environmental Microbiology, 72(4): 2679-2690. DOI:10.1128/AEM.72.4.2679-2690.2006 |
| 刘新, 王友权, 徐华成, 等. 2017. 富营养化湖泊藻型及草型区微生物群落对有色可溶有机物组成的影响[J]. 生态环境学报, 26(8): 1403-1409. |
| 陆桂华, 马倩. 2009. 太湖水域"湖泛"及其成因研究[J]. 水科学进展, 20(3): 438-442. DOI:10.3321/j.issn:1001-6791.2009.03.022 |
| Luek J L, Thompson K E, Larsen R K, et al. 2017. Sulfate reduction in sediments produces high levels of chromophoric dissolved organic matter[J]. Scientific Reports, 7(1): 8829. DOI:10.1038/s41598-017-09223-z |
| Nielsen J T, Kulminskaya N V, Bjerring M, et al. 2016. In situ high-resolution structure of the baseplate antenna complex in Chlorobaculum tepidum[J]. Nature communications, 7: 12454. DOI:10.1038/ncomms12454 |
| Pallud C, Cappellen P V. 2006. Kinetics of microbial sulfate reduction in estuarine sediments[J]. Geochimica et Cosmochimica Acta, 70(5): 1148-1162. DOI:10.1016/j.gca.2005.11.002 |
| 潘慧云, 徐小花, 高士祥. 2008. 沉水植物衰亡过程中营养盐的释放过程及规律[J]. 环境科学研究, 21(1): 64-68. |
| Prescott C E. 2010. Litter decomposition:what controls it and how can we alter it to sequester more carbon in forest soils?[J]. Biogeochemistry, 101(1/3): 133-149. |
| Rodriguez J, Hiras J, Hanson T E. 2011. Sulfite oxidation in Chlorobaculum tepidum[J]. Frontiers in Microbiology, 2: 112. |
| 荣楠, 朱家亮, 周道坤, 等. 2018. 黑臭河流沉积物磷、铁、硫的DGT同步分析研究[J]. 环境科学学报, 38(7): 2599-2606. |
| 申秋实, 邵世光, 王兆德, 等. 2012. 风浪条件下太湖藻源性"湖泛"的消退及其水体恢复进程[J]. 科学通报, 57(12): 1060-1066. |
| Shen Q S, Zhou Q L, Shang J G, et al. 2014. Beyond hypoxia:occurrence and characteristics of black blooms due to the decomposition of the submerged plant Potamogeton crispus in a shallow lake[J]. Journal of Environmental Sciences, 26(2): 281-288. DOI:10.1016/S1001-0742(13)60452-0 |
| 沈爱春, 徐兆安, 吴东浩. 2012. 蓝藻大量堆积、死亡与黑水团形成的关系[J]. 水生态学杂志, 33(3): 68-72. |
| Song N, He Y H, Jiang H L. 2016. Inferior adaptation of bay sediments in a eutrophic shallow lake to winter season for organic matter decomposition[J]. Environmental Pollution, 219: 794-803. DOI:10.1016/j.envpol.2016.07.057 |
| Song N, Yan Z S, Cai H Y, et al. 2013. Effect of temperature on submerged macrophyte litter decomposition within sediments from a large shallow and subtropical freshwater lake[J]. Hydrobiologia, 714(1): 131-144. DOI:10.1007/s10750-013-1529-2 |
| 唐金艳, 曹培培, 徐驰, 等. 2013. 水生植物腐烂分解对水质的影响[J]. 应用生态学报, 24(1): 83-89. |
| Wang K, Li W G, Gong X J, et al. 2013. Spectral study of dissolved organic matter in biosolid during the composting process using inorganic bulking agent:UV-vis, GPC, FTIR and EEM[J]. International Biodeterioration & Biodegradation, 85: 617-623. |
| 邢鹏, 胡万婷, 吴瑜凡, 等. 2015. 浅水湖泊湖泛(黑水团)中的微生物生态学研究进展[J]. 湖泊科学, 27(4): 567-574. |
| Xu H C, Yu G H, Yang L Y, et al. 2013. Combination of two-dimensional correlation spectroscopy and parallel factor analysis to characterize the binding of heavy metals with DOM in lake sediments[J]. Journal of Hazardous Materials, 263: 412-421. DOI:10.1016/j.jhazmat.2013.09.042 |
| Yamashita Y, Tanoue E. 2008. Production of bio-refractory fluorescent dissolved organic matter in the ocean interior[J]. Nature Geoscience, 1(9): 579-582. DOI:10.1038/ngeo279 |
| 杨渐, 蒋宏忱, 孙永娟, 等. 2013. 青藏高原湖泊沉积物硫酸盐还原菌种群分布[J]. 盐湖研究, 1: 7-13. |
| 易文利, 王圣瑞, 杨苏文, 等. 2011. 有机质腐解对穗花狐尾藻生长及生理的影响[J]. 中国环境科学, 31(10): 1718-1724. |
| 尹希杰, 周怀阳, 杨群慧, 等. 2010. 珠江口淇澳岛海岸带沉积物中硫酸盐还原和不同形态硫的分布[J]. 海洋学报, 32(3): 31-39. |
| Yu G H, Luo Y H, Wu M J, et al. 2010. PARAFAC modeling of fluorescence excitation-emission spectra for rapid assessment of compost maturity[J]. Bioresource Technology, 101(21): 8244-8251. DOI:10.1016/j.biortech.2010.06.007 |
| Yu T, Zhang Y, Wu F C, et al. 2013. Six-Decade Change in Water Chemistry of Large Freshwater Lake Taihu, China[J]. Environmental Science & Technology, 47(16): 9093-9101. |
| 张运林, 秦伯强, 马荣华, 等. 2005. 太湖典型草、藻型湖区有色可溶性有机物的吸收及荧光特性[J]. 环境科学, 26(2): 142-147. |
| Zhang Y L, Yin Y, Liu X H, et al. 2011. Spatial-seasonal dynamics of chromophoric dissolved organic matter in Lake Taihu, a large eutrophic, shallow lake in China[J]. Organic Geochemistry, 42(5): 510-519. DOI:10.1016/j.orggeochem.2011.03.007 |
| Zhou Y Q, Jeppesen E, Zhang Y L, et al. 2015. Chromophoric dissolved organic matter of black waters in a highly eutrophic Chinese lake:Freshly produced from algal scums?[J]. Journal of Hazardous Materials, 299: 222-230. DOI:10.1016/j.jhazmat.2015.06.024 |
| Zhu G W, Wang F, Zhang Y L, et al. 2008. Hypoxia and its environmental influences in large, shallow, and eutrophic Lake Taihu, China[J]. Internationale Vereinigung für theoretische und angewandte Limnologie:Verhandlungen, 30(3): 361-365. |
