 , 叶艳妹1,2
, 叶艳妹1,2
 , 吴次芳1,2, 胡一鸣1,2, 施昊坤1,2
, 吴次芳1,2, 胡一鸣1,2, 施昊坤1,21. 浙江大学土地与国家发展研究院, 杭州 310058;
2. 山东省土地生态修复工程技术研究中心, 滨州 256600
收稿日期: 2019-05-30; 修回日期: 2019-08-22; 录用日期: 2019-08-22
基金项目: 国家社会科学基金重大项目(No.14ZDA039);山东黄河三角洲土地利用和生态工程技术研究中心项目; 山东省盐碱地综合开发示范项目
作者简介: 林耀奔(1991-), 男, E-mail:linyaoben@zju.edu.cn
通讯作者(责任作者): 叶艳妹, E-mail:yeyanmei@zju.edu.cn
摘要:重金属污染问题长期存在于土壤环境中,并对土壤细菌群落结构造成了较大影响,从而引起了广泛的研究.本文选取水田土壤为测试样本,通过高通量测序技术和土壤性质化验对样本进行处理,采用Spearman相关性分析等统计分析方法对不同重金属污染水平下的水田土壤细菌群落进行结构和多样性分析.结果显示,研究区内土壤样点的重金属污染水平可被划分为4个等级,其中,轻度重金属污染水平(LL)区域土壤细菌群落的多样性指数总体上显著低于其他区域,即轻度污染的环境将降低该区域的细菌群落多样性.Nitrospira和Candidatus_Solibacter等菌属在重度重金属污染水平(SL)区域中显示出较强的重金属耐受性.Proteobacteria、Firmicutes和Gemmatimonadetes等菌门在不同等级重金属污染水平区域中表现出一定的耐受性.此外,土壤含水量(SWC)、酸碱度(pH)、速效磷(AP)、有效钾(AK)、总氮(TN)、有机质(OM)、铜(Cu)、铅(Pb)、砷(As)和锌(Zn)等土壤环境因子与细菌群落结构存在显著相关性(p < 0.05).因此,应该尽快开发利用这些具有重金属耐性和生物修复功能的微生物,为粮食作物的健康生长提供适宜的土壤环境.
关键词:水田土壤重金属细菌耐受性
Response analysis of soil bacterial community to different heavy metal pollution levels in paddy fields: A case study of A county
LIN Yaoben1,2
 , YE Yanmei1,2
, YE Yanmei1,2
 , WU Cifang1,2, HU Yiming1,2, SHI Haokun1,2
, WU Cifang1,2, HU Yiming1,2, SHI Haokun1,21. Land Academy for National Development(LAND), Zhejiang University, Hangzhou 310058;
2. Land Ecological Restoration Engineering Technology Research Center of Shandong Province, Binzhou 256600
Received 30 May 2019; received in revised from 22 August 2019; accepted 22 August 2019
Abstract: The problem of heavy metal pollution has long existed in the soil environment and has a great impact on the soil bacterial community structure, which has caused extensive research. The paddy soils were selected as the test samples, and samples were processed by high-throughput sequencing technology and soil property tests, and statistical analysis methods such as Spearman correlation analysis were adopted to analyze the structure and diversity of paddy soil bacterial communities at different levels of heavy metal pollution. The results showed that the levels of heavy metal pollution in soil samples from the study area could be divided into four grades, and the diversity indexes of soil bacterial community in the light heavy metal pollution level (LL) area were generally significantly lower than other areas, namely the slightly polluted environment would reduce the diversity of bacterial communities in this area. The genus Nitrospira and Candidatus_Solibacter showed strong heavy metal tolerance in the serious heavy metal pollution level (SL) region. The bacterial phyla such as Proteobacteria, Firmicutes and Gemmatimonadetes showed a certain extent of tolerance in different levels of heavy metal pollution. In addition, soil environmental factors such as SWC, pH, AP, AK, TN, OM, Cu, Pb, As and Zn were significantly correlated with bacterial community structure (p < 0.05). Therefore, the use of these microorganisms with heavy metal tolerance and bioremediation functions should be developed as soon as possible to provide a suitable soil environment for the healthy growth of food crops.
Keywords: paddy soilheavy metalsbacteriatolerance
1 引言(Introduction)目前, 我国水田仍存在土壤质量下降和污染严重化的问题, 导致粮食安全面临着较大的挑战(赵瑞等, 2019).由于农药、化肥、粪肥和除草剂的过量使用及部分地区金属矿藏的开采, 导致水田土壤重金属含量急剧增加(肖武等, 2018).现今, 重金属元素已成为主要的水田土壤污染物, 它不仅导致土壤环境恶化、生产力下降, 而且直接威胁着陆地生态环境安全和动植物的生长发育, 还会通过食物链危及人类健康(师碧玲等, 2019).土壤微生物具有促进土壤营养物循环及吸收和转移污染物的功能, 对缓解重金属毒性和帮助作物生长起到十分关键的作用(Xiao et al., 2019; Xu et al., 2019).根据以往的研究, 重金属(Cr、Cu、As、Pb等)在土壤中具有持久性, 对土壤微生物也具有一定的毒害作用(Jiang et al., 2019).重金属污染对土壤微生物群落多样性和结构具有明显的影响, 重金属耐受型微生物通常会随着污染程度的升高而逐渐成为主导型菌种, 如Proteobacteria、Candidatus_Solibacter和Nitrospira等菌属(Jayanthi et al., 2018; Luo et al., 2019).细菌作为土壤中数量最大的微生物, 对土壤环境的调节作用显著, 也是当前土壤污染生物修复研究的重点对象(Cui et al., 2018).然而, 由于细菌在土壤中的储量巨大且种类繁多, 其生存的环境条件也千差万别, 这使得特定环境中的重金属对细菌群落的影响难以得到全面的论证.因此.研究不同重金属污染环境下的土壤细菌群落结构, 从而识别出重金属耐受型菌种以研究其对重金属元素的吸收和转移作用, 对于土壤细菌功能的认识及土壤污染修复工作的开展均具有重要意义.
国内外****对土壤重金属污染程度的测算和等级划分进行了大量研究.刘春早等(2012)对我国湘江流域的土壤重金属含量进行化验测算, 发现该区域重金属内梅罗综合污染指数平均值为9.89, 重度重金属污染水平占比为18.38%.也有****对重庆、北京、贵州、湖北等地进行了土壤重金属的化验和测算, 结果显示, 土壤重金属污染问题较为严重(姜菲菲等, 2011; 龚杰等, 2014; 苟体忠等, 2019; 范俊楠等, 2019).此外, 如伊朗、印度、波兰、美国等国的部分地区土壤重金属污染程度也被证实处于较高的水平, 且研究人员主要是采用内梅罗综合污染指数进行重金属污染程度的测算, 将数值大于3的划分为较为严重的污染水平(Ciarkowska et al., 2019; Hunter et al., 2019; Kharkan et al., 2019).从重金属污染对土壤细菌影响的相关研究来看, 土壤微生物对重金属浓度的反应较为敏感, 重金属浓度的升高可能导致细菌功能障碍、蛋白质变性或细胞膜完整性破坏等(Leita et al., 1995).但也有研究表明, 重金属胁迫下会造成细菌群落多样性的增加, 因为在竞争物种众多的环境中, 金属胁迫减少了细菌种群固有的竞争排斥, 导致其它物种的富集(Giller et al., 1998).Desai等(2009)研究表明, 由于长期的Cr污染, 细菌群落的优势菌种会由Proteobacteria变为Firmicutes.Proteobacteria在Cd污染的环境中又会随着土壤环境的变化也呈现多种适应状态(Li et al., 2017).但总的来说, 土壤重金属污染对细菌群落结构和多样性都会产生显著影响(Chodak et al., 2013).
高通量测序技术现已在全球范围内成为研究微生物多样性和结构的主要技术手段, 具有速度快、精度高、成本低等优势, 在医学、生物学、环境科学、农学等领域得到了广泛运用(Langille et al., 2013).对于土壤微生物群落的研究, 高通量测序技术也正在逐渐替代磷脂脂肪酸分析法、T-RFLP技术及荧光定量分析技术等传统技术, 该方法通过DNA提取、PCR扩增、深度测序等步骤获取大量有效的生物信息, 以作为后续分析的基础数据(江玉梅等, 2016).近年来, 通过高通量测序技术的发展及在土壤微生态中的应用, 本课题组在森林、草地、湿地、耕地等各种自然或人为环境中识别了更为详细的土壤微生物群落, 并进行了更为细致的分析(张杰等, 2015; 韦应莉等, 2018; 郑裕雄等, 2018).这不仅拓展了高通量测序技术的应用范围, 同时也为研究土壤微生物群落结构提供了更为有效的手段.
本研究为了进一步了解不同等级重金属污染水平下的水田土壤细菌群落结构, 通过对A县56块水田土壤理化性质和重金属含量进行测定, 并用地质累积指数法和内梅罗综合污染指数法进行重金属污染等级划分.再采用Illumina平台高通量测序技术获得16S rRNA化验结果, 同时结合Spearman相关性分析等统计分析方法, 以研究A县56块水田土壤细菌群落多样性和结构对不同土壤重金属污染水平的响应情况.由此可以对复杂土壤生态系统中的土壤细菌群落结构与环境因子进行交互分析, 以寻找具有较强重金属适应能力的菌种进行重金属毒性降解、转移等功能分析, 这可为受重金属污染地区的土壤生物修复研究提供有力的参考依据.
2 材料与方法(Materials and methods)2.1 研究区和样品采集研究区为浙江省A县, 年平均气温为15.6 ℃, 年均降雨量为1155.7 mm, 属于东南亚季风区.该县具有数千年的水稻种植历史, 是一个重要的粮食生产县, 但近年来土壤退化和重金属污染的问题日益凸显, 严重制约了该县的农业可持续发展(Shao et al., 2016).因此, 选取该县作为研究区具有一定的代表性.
于2018年9月随机选取A县的56块水田, 每块水田作为一个样点, 并且这些水田都具有10 a以上的水稻种植历史.主要选择距离工业、交通道路和居民区至少200 m且尽量挑选集中连片的水田进行随机采样.运用五点法, 即用木铲从10 m×10 m的网格中采集5个独立的、深度为0~15 cm的表层土样作为子样本, 均匀混合后装入密封袋, 并存放于干冰中运回实验室(Lu et al., 2012).通过人工去除石子、根际等杂物后, 每个样本选取20 g土样存放于-80 ℃的冰箱中用于DNA提取和高通量测序, 并各选取500 g土样自然风干用于重金属和理化性质的化验(Zhao et al., 2019).本研究均对每个土样进行3次重复的土壤理化实验和DNA提取.
2.2 土壤理化性质测定土壤pH值采用pH计(PHS-3C, 上海)对水土质量比为2.5 : 1的悬浊液进行测定, 土壤含水量(SWC)是用电热恒温烘箱在(105±2) ℃的条件下烘12 h测定(Rodriguez et al., 2009), 土壤有机质(SOM)、速效钾(AK)、有效磷(AP)及总氮(TN)则分别由总有机碳分析仪(BOCS301, Shimadzu)、火焰光度计、分光光度计和全自动凯氏定氮仪(K9860)测定(Zhao et al., 2019).
2.3 土壤重金属污染水平所有风干后的土壤均用2 mm的聚乙烯网过筛, 然后储存于玻璃瓶中等待进一步测定.重金属Cu、Zn、Cd、Pb、Ni和Cr先经过HCl-HNO3-HF-HClO4消解后, 采用电感耦合等离子体质谱仪(Agilent7800)测定其含量.该仪器具有精度高、操作简单且能同时测定多种元素等优点, 现已得到广泛运用.其萃取液由0.5 mL 65%HClO4、6 mL 65%HF、1 mL 65%HNO3、3mL 37%HCl和20 mL纯水组成, 可用于100 mg的土样消解(Jiang et al., 2019).此外, 重金属Hg和As采用王水消化法, 运用原子荧光分光光度计(AF-630, BFRL)测定(唐志华等, 2019).
对每种重金属含量进行测验后, 还需测算每个样点的污染水平.地质累积指数法(Gi)和内梅罗综合污染指数法(Ni)都是广泛运用于土壤重金属污染水平的测算方法(刘春早等, 2012; Wang et al., 2018).计算公式如下:
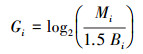 | (1) |
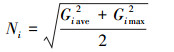 | (2) |
2.4 DNA提取、PCR扩增和测序采用FastDNA SPIN试剂盒(MP Biomedicals, USA)提取样品DNA, 并采用16S rRNA基因V3~V4区域引物(338F和806R)对基因组DNA进行PCR扩增.PCR正式试验采用TransGen AP221-02:TransStart Fastpfu DNA Polymerase, 20 μL反应体系为:2 μL 2.5 mmol·L-1 dNTPs、4 μL 5×FastPfu Buffer、0.4 μL FastPfu Polymerase、0.8 μL引物(5 μmol·L-1)、0.2 μL BSA、10 ng DNA模板, 加纯水至20 μL.PCR仪(ABI GeneAmp? 9700型)中的反应程序为:95 ℃下预变性3 min;10个循环(95 ℃变性30 s, 60 ℃退火30 s, 72 ℃延伸45 s);然后在72 ℃下延伸10 min.扩增产物经2%琼脂糖凝胶电泳验证后, 将PCR混合产物用凝胶提取试剂盒(Omega)回收.最后, 在Illumina HiSeq4000平台上进行测序和微生物群落分析(Jiang et al., 2019).此部分工作在浙江大学分析测试中心进行, 原始数据上传至NCBI数据库中(序列号:PRJNA523453).
2.5 数据处理和分析使用UPARSE软件(version 7.1)将16S rRNA基因序列以97%的相似性聚类成操作分类单元(OTU).利用mothur (version v.1.30.1)对Sobs、Shannon、Ace、Bootstrap、Chao 1、Simpsoneven、Boneh等微生物多样性指标进行测算, 这些都是反映微生物群落的丰富度和多样性的重要指标.使用R语言工具进行物种Venn图、Heatmap图和群落柱形图的制作, QIIME 2平台则用于Beta多样性分析.对于物种差异分析, 主要运用R的stats包进行测算(Zhao et al., 2019).16S功能预测是通过PICRUSt软件对OTU丰度表进行标准化, 然后通过每个OTU对应的Greengene ID, 获得OTU对应的COG家族信息和KO信息, 并计算各COG的丰度和KO丰度(Wong et al., 2016).
3 结果分析(Results and analysis)3.1 土壤重金属污染水平研究区中各样点土壤重金属的含量和相应的浙江省重金属背景值如图 1所示.由图可知, 各重金属含量按平均值由大到小依次为:Cr> Zn> Ni> Cu> Pb> As> Cd> Hg.其中, Cd的平均含量是背景值的15.7倍, 是该地区最严重的重金属污染物.并且所有样点中Cu、Cd、Cr、Hg、Zn和Ni的含量都基本高于背景值, 但As的含量却基本低于背景值.同时, 由公式(1)和(2)测算得出每个样点的N值, 并根据土壤重金属污染指数分级标准(刘春早等, 2012), 将N≤1的13个样点划分为低度污染水平(NL);将1<N≤2的15个样点划分为轻度污染水平(LL);将2<N≤3的15个样点划分为中度污染水平(ML), 此时水稻开始受到污染物的影响;将N>3的13个样点划分为重度污染水平(SL).如图 1所示, Cd具有最高的G值, 这证实了Cd污染在该地区的严重性.而As和Pb的G值为负数, 说明该地区未受这两种重金属的污染.此外, SL区域中Cd、Cr和Ni等重金属的污染程度要显著高于其他区域, 并且NL区域中的大部分重金属都具有较低的污染程度.
图 1(Fig. 1)
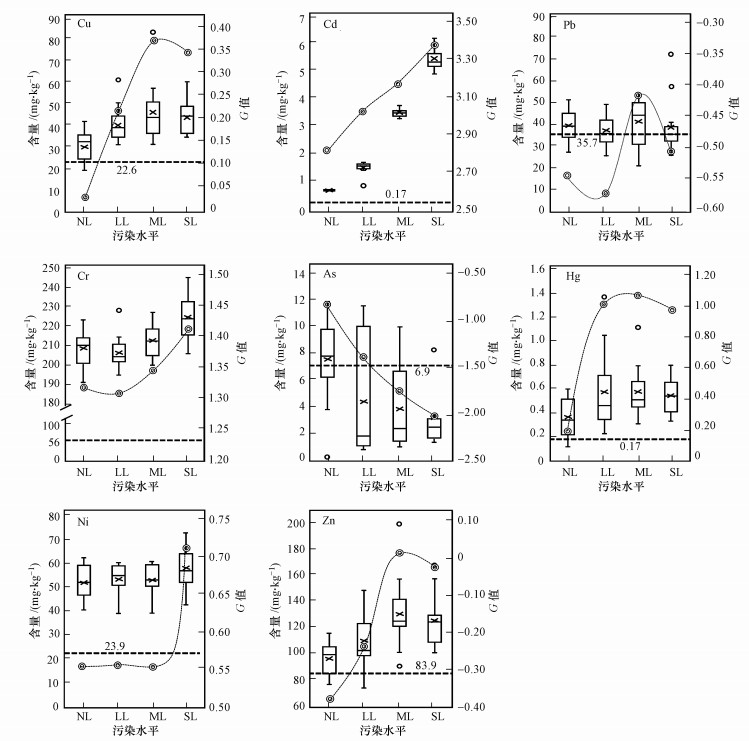 |
| 图 1 研究区土壤重金属含量和相应的G值(箱线图为重金属含量(主坐标轴), 双线圆为G值(次坐标轴), 虚线为背景值) Fig. 1Soil heavy metal concentration and corresponding G value |
3.2 土壤基本理化性质4种重金属污染水平下的土壤理化性质情况如表 1所示.所有土样的平均pH值略高于7, 说明研究区的土壤呈弱碱性.同时, 来自ML样点土壤的SWC、TN和OM的测试结果显著高于其他区域, 来自SL样点土壤的AP含量显著低于其他区域, 但所有区域中的AK含量未呈现显著差异.
表 1(Table 1)
| 表 1 不同重金属污染水平下的土壤基本理化性质 Table 1 Soil physical and chemical properties under different heavy metal pollution levels | ||||||||||||||||||||||||||||||||||||||||||
表 1 不同重金属污染水平下的土壤基本理化性质 Table 1 Soil physical and chemical properties under different heavy metal pollution levels
| ||||||||||||||||||||||||||||||||||||||||||
3.3 土壤细菌多样性分析研究区56个土样通过细菌16S rRNA高通量测序, 共获得2572593条有效序列, 经聚类后得到11334个细菌OTU, 并被归类为56个门类和1105个属类.但不同重金属污染水平下的OTU分布结构存在显著差异, 如韦恩图所示(图 2), 所有细菌OTUs中有8664个OTU为共有, 来自NL、LL、ML和SL的土样中分别拥有109、114、94和71个独有的OUT.根据α-多样性结果(表 2), LL区域土样的Sobs、Shannon、Ace、Bootstrap、Chao 1和Boneh等多样性指标显著低于其它区域.
图 2(Fig. 2)
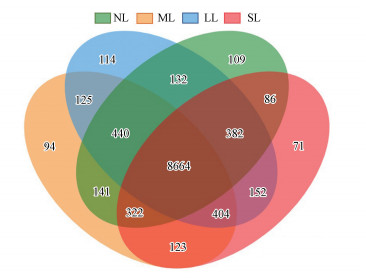 |
| 图 2 不同重金属污染水平下的细菌OTU结构差异 Fig. 2Structure differences of bacterial OTUs under different levels of heavy metal pollution |
表 2(Table 2)
| 表 2 土壤细菌群落的α-多样性情况 Table 2 α-diversity of soil bacterial communities | ||||||||||||||||||||||||||||||||||||||||
表 2 土壤细菌群落的α-多样性情况 Table 2 α-diversity of soil bacterial communities
| ||||||||||||||||||||||||||||||||||||||||
由图 3可知, 在门水平上, 优势菌种Proteobacteria在SL区域的相对丰度显著高于其他区域, 但这个区域Verrucomicrobia、Firmicutes和Chloroflexi的相对丰度却显著低于NL区域.在属水平上, Nitrospira是所有样点中丰度最高的菌属, 但来自LL区域的土样中的Nitrospira相对丰度比其它区域要低一些.此外, NL区域土样中的Geobacter、LL区域土样中的Sphingomonas及SL区域中的Thiobacillus和Bradyrhizobium与其它区域相比, 分别具有最高的相对丰度.Flavisolibacter、Lysobacter和Pseudarthrobacter仅在LL区域的优势菌种中出现.这是因为不同含量的重金属会对不同的菌种产生影响, 从而影响其细菌多样性.当重金属含量较高时, 会淘汰一部分重金属耐受型细菌, 但同时也会为具有较强重金属耐受性的菌种留下充足的养分, 促使它们快速繁殖.这是土壤菌种相对丰度的变化, 但不会很大程度地降低土壤细菌的多样性.
图 3(Fig. 3)
 |
| 图 3 不同重金属污染水平下的优势菌门(a)和菌属(b)相对丰度 Fig. 3Relative abundance of dominant phylum (a) and genus (b) at different levels of heavy metal pollution |
3.4 土壤环境因子与细菌群落相关性根据CCA分析(图 4), 研究区土壤环境因子中SWC(r=0.23, p=0.002)、pH(r=0.30, p=0.001)、AP(r=0.17, p=0.013)、AK(r=0.16, p=0.016)、TN(r=0.21, p=0.001)、OM(r=0.19, p=0.002)、Cu(r=0.10, p=0.038)、Pb(r=0.11, p=0.018)、As(r=0.43, p=0.028)和Zn(r=0.31, p=0.016)等与细菌群落结构存在显著相关性.根据Spearman相关性分析, pH、TN、OM、Cd、Pb、As、Hg和Zn对细菌门类结构具有较为显著的影响, 而SWC、pH、TN、OM、Pb、Cr和As与细菌属类结构显著相关(p < 0.05).
图 4(Fig. 4)
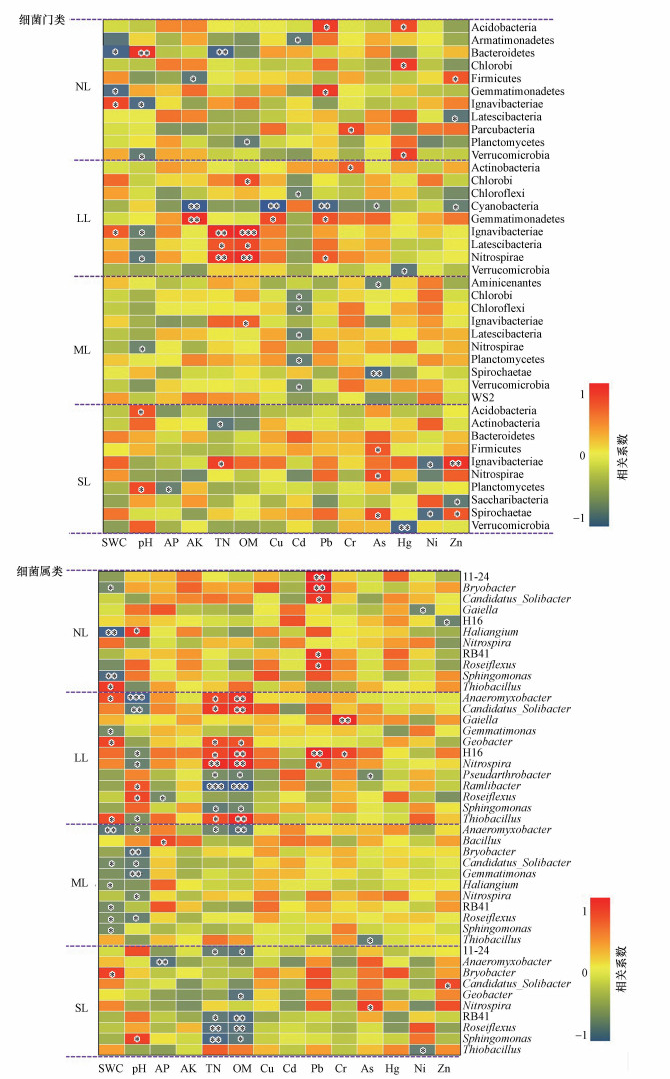 |
| 图 4 土壤环境因子与细菌群落的相关性(暖色调表示正相关, 冷色调表示负相关.*表示0.01<p≤0.05, **表示0.001<p≤0.01, ***表示p≤0.001) Fig. 4Correlation between soil environmental factors and bacterial communities |
在门水平上, 来自LL区域的土壤细菌丰度与土壤理化性质呈显著相关, 尤其是Ignavibacteriae、Latescibacteria和Nitrospirae与TN和OM呈显著相关性.ML区域中的土壤细菌主要与Cd和As呈显著负相关, 而LL中的Cyanobacteria则与Cu、Pb、As和Zn等多种重金属存在显著负相关.SL区域中的细菌门类结构主要受到As、Hg、Ni和Zn的影响, 尤其是Ignavibacteriae和Spirochaetae这两种细菌.
在属水平上, NL区域中的土壤细菌主要受SWC和Pb的影响, SWC和pH则是ML区域土壤细菌结构的主要影响因子.LL区域中的土壤细菌结构受到SWC、pH、TN、OM等土壤理化性质和Pb、Cr、As等重金属的显著影响.SL区域中的Anaeromyxobacter、Bryobacter、Candidatus_Solibacter、Geobacter和Nitrospira等菌属则与多种重金属呈显著相关.根据以往的文献, 这些菌属已被证实是可用于降低某种重金属毒性的有益菌种(Challacombe et al., 2011; Qian et al., 2016 Li et al., 2017; Hao et al., 2018; Arkhipova et al., 2019), 但研究所包含的重金属种类却不全面.本研究将这些菌种与多种重金属进行了较为系统的分析, 发现Anaeromyxobacter、Candidatus_Solibacter、Geobacter、Nitrospira与Pb、As和Zn呈正相关, 而Bryobacter则与Cu、Pb、As、Hg存在正相关, 并且可以在重度重金属污染水平的区域中快速繁殖, 这可在一定程度上加深了对这些菌属的认识.
4 讨论(Discussion)4.1 土壤基本理化性质对细菌群落结构的影响本研究发现, 土壤基本理化性质中SWC、pH、TN和OM的变化对细菌群落结构造成了较为显著的影响.在门水平上, NL区域中的SWC与Bacteroidetes、Gemmatimonadetes的丰度呈显著负相关, 而与Ignavibacteriae的丰度呈显著正相关.但在属水平上, SWC与多数菌属呈显著负相关, 尤其在ML区域.这是由于Bacteroidetes和Gemmatimonadetes都是耐干旱菌种, 在低污染土壤中较为充分地展现了它在高湿度环境中的不适反应.而中度重金属污染水平区域中的许多土壤细菌属类, 由于受到重金属和高湿度的共同胁迫作用, 也造成了一定的丰度下降.可见, 土壤水分对耐干旱菌种具有一定的筛选作用, 这与已有的成果相一致(Mickan et al., 2019).
此外, 由于酸碱度呈中性的土壤环境为细菌生长提供了适宜的条件, 但对于土壤pH平均值最接近7的ML区域而言, 当pH值在不同土样中发生波动时, 便会联合重金属胁迫作用对细菌结构造成较大影响.例如, ML区域中Bryobacter、Gemmatimonas与土壤pH呈现显著负相关, 并与多种重金属含量保持正相关.这是由于ML区域中较多土样的pH处于弱酸性, 这会降低部分菌种的活性, 同时也会使金属离子与土壤矿物质结合, 从而导致Bryobacter、Gemmatimonas等菌种丰度与多数重金属含量同时下降.已有文献中也有类似的研究结果(Xiao et al., 2019; Xu et al., 2019), 但未得出具体的结论, 这应在今后的研究中给予重视.
TN和OM作为土壤中重要的营养来源, 对细菌代谢和繁殖起着关键的作用.在LL区域中, 不论是在门类水平还是属类水平上, TN和OM都是影响细菌丰度的重要环境因子.这可以解释为:当土壤处于轻度污染水平时, 重金属耐性细菌需要更多的营养物质以进行重金属的转移和代谢作用, 所以此时TN和OM会成为影响细菌群落结构的关键环境因子(Rajapaksha, 2011).
由于本文的样点均取自水田, 土壤环境十分复杂, 虽然通过化验和统计手段得出了较为可靠的结果, 但缺少实验数据以增加说服力.今后的研究应将这两种试验结果相结合, 以获得更为科学可靠的结果.
4.2 土壤细菌对重金属污染的响应分析重金属污染会引起土壤细菌群落结构的明显变化, 其显著性远高于自然环境变化带来的影响(Yin et al., 2015).本研究结果也证实土壤细菌通过细菌群落结构的变化以适应不同重金属污染水平所带来的影响.细菌OTU结构和多样性指标的差异反映了不同重金属污染水平下都具有特定的适应性菌种.
Proteobacteria是该研究区中相对丰度最高的菌门, 并对不同重金属污染水平进行了响应.本研究结果中也显示具有较高重金属污染水平的SL区域中Proteobacteria的相对丰度显著高于其他区域, 并与Cu、Pb、As、Hg和Zn等重金属呈正相关.以往对Proteobacteria的研究主要集中于对不同重金属污染环境中的丰度分析(Gillan et al., 2005; Halter et al., 2011; Lorenz et al., 2006), 而未准确得出其对不同等级重金属污染水平的响应及对不同重金属种类的耐受性.Proteobacteria作为一种能在高污染水平环境中存活的重金属耐性细菌, 广泛分布于各类矿山沉积物和重金属污染的水土环境中(Go??biewski et al., 2014; Zhang et al., 2014), 具有较强的研究和开发利用价值.此外, 本研究还发现Proteobacteria门下丰度最高的菌属Thiobacillus也表现出与Cu、Pb、As、Hg和Zn等重金属呈正相关, 尤其是在SL区域, 说明该菌种为重金属耐受型细菌, 这与已有的研究相一致(Seidel et al., 2000; Li et al., 2017).Gemmatimonadetes在NL和LL区域表现出与Cu含量呈显著正相关, 但在较高重金属污染水平下则丰度下降, 说明该菌种仅适合在较低重金属污染水平下发挥重金属的转移和吸收作用(Zhao et al., 2019).本研究结果还发现Firmicutes、Ignavibacteriae、Nitrospirae和Spirochaetae等菌门在高重金属污染水平下仍能与As和Zn等重金属保持显著正相关, 证实了这些菌门具有较强的重金属耐受性.
在属水平上, 许多细菌在不同重金属污染水平下均表现出较强的耐受性.在低污染水平的土壤中, Pb是影响细菌群落结构的主要影响因子, 与11-24、Bryobacter、RB41、Roseiflexus和Candidatus_Solibacter等菌属都呈显著正相关.在轻度重金属污染的土壤中, Gaiella、H16、Nitrospira等菌属开始与Pb、Cr等重金属和TN、OM等营养物质呈显著的正相关, 这说明耐受型细菌需要借助相应的营养物质以提高重金属的生物利用功能, 这不仅与已有的研究相一致(Liang et al., 2018), 并且还得出这种机制的前提条件为轻度重金属污染水平的环境.在中度污染的土壤中, 多数菌属与重金属不存在显著相关, 这说明重金属正在逐渐降低不耐受型细菌, 却还未激发出具有较强重金属耐受性的菌属(Li et al., 2017).当污染水平提高至严重水平时, 多种优势菌属开始与重金属显现显著相关, 尤其是Candidatus_Solibacter和Nitrospira.在许多文献中也证实了Candidatus_Solibacter和Nitrospira是土壤重金属污染修复的主要菌属(Wang et al., 2018; Luo et al., 2019).这些结果都具有以往的研究成果作为支撑, 但本研究从不同等级重金属污染水平的角度进行了细致分析, 对具有重金属耐受性和修复能力的菌种的不同适宜环境进行了梳理, 可以为不同重金属污染环境下的生物修复菌种的选择提供参考.
5 结论(Conclusions)本研究发现, 中度重金属污染水平(LL)区域土样的大部分多样性指数显著低于其他区域, 可见轻度污染的环境将抑制一部分重金属不耐受型细菌, 从而降低该区域的细菌群落多样性.SWC、pH、AP、AK、TN、OM、Cu、Pb、As和Zn等土壤环境因子与细菌群落结构存在显著相关(p<0.05).在门水平上, Proteobacteria在本研究中表现出对Cd、Zn、Pb和As等重金属较强的耐受性, 尤其是在SL区域中, 可见Proteobacteria在重度重金属污染水平区域中更能有效发挥生物修复功能.在属水平上, Gaiella、H16和Nitrospira等菌属在轻度重金属污染水平的土壤中才能有效发挥重金属耐受性功能, 而Candidatus_Solibacter和Nitrospira则被证实在重度重金属污染水平区域中具有较强的土壤重金属污染修复能力.这些具有重金属耐受性的微生物应该被开发利用, 以用于不同重金属污染条件下的土壤生态修复, 为粮食作物的健康生长提供适宜的土壤环境.
参考文献
| Arkhipova O V, Biryukova E N, Abashina T N, et al. 2019. Methacrylate-reducing activity of anaerobic bacteria anaeromyxobacter dehalogenans and denitrovibrio acetiphilus[J]. Microbiology, 88(2): 137-145. |
| Challacombe J F, Eichorst S A, Hauser L, et al. 2011. Biological consequences of ancient gene acquisition and duplication in the large genome of Candidatus Solibacter usitatus Ellin6076[J]. Plos One, 6(9): 1-12. |
| Chodak M, Go??biewski M, Morawska-P?oskonka J, et al. 2013. Diversity of microorganisms from forest soils differently polluted with heavy metals[J]. Applied Soil Ecology, 64: 7-14. |
| Ciarkowska K, Gambus F, Antonkiewicz J, et al. 2019. Polycyclic aromatic hydrocarbon and heavy metal contents in the urban soils in southern Poland[J]. Chemosphere, 229: 214-226. |
| Cui H, Shi Y, Zhou D, et al. 2018. Effect of different grain sizes of hydroxyapatite on soil heavy metal bioavailability and microbial community composition[J]. Agriculture, Ecosystems and Environment, 267: 165-173. |
| Desai C, Parikh R Y, Vaishnav T, et al. 2009. Tracking the influence of long-term chromium pollution on soil bacterial community structures by comparative analyses of 16S rRNA gene phylotypes[J]. Research in Microbiology, 160: 1-9. |
| 范俊楠, 张钰, 贺小敏, 等. 2019. 基于BP神经网络的重点行业企业周边土壤重金属污染预测及评价[J]. 华中农业大学学报, 38(4): 55-62. |
| 范允慧, 王艳青. 2009. 浙江省四大平原区土壤元素背景值特征[J]. 物探与化探, 33(2): 132-134. |
| Gillan D C, Danis B, Pernet P, et al. 2005. Structure of sediment-associated microbial communities along a heavy-metal contamination gradient in the marine environment[J]. Applied and Environmental Microbiology, 71: 679-690. |
| Giller K E, Witter E, Mcgrath S P. 1998. Toxicity of heavy metals to microorganisms and microbial processes in agricultural soils:A review[J]. Soil Biology and Biochemistry, 30: 1389-1414. |
| Go??biewski M, Deja-Sikora E, Cichosz M, et al. 2014. 16S rDNA pyrosequencing analysis of bacterial community in heavy metals polluted soils[J]. Microbial Ecology, 67(3): 635-647. |
| 龚杰, 张敏, 雷林. 2014. 基于两种模型的城市土壤重金属污染等级研究[J]. 重庆交通大学学报(自然科学版), 33(2): 100-102. |
| 苟体忠, 张文华. 2019. 贵州省麻江县蓝莓基地土壤重金属污染及风险评价[J]. 地球与环境, 47(5): 680-688. |
| Halter D, Cordi A, Gribaldo S, et al. 2011. Taxonomic and functional prokaryote diversity in mildly arsenic-contaminated sediments[J]. Research in Microbiology, 162: 877-887. |
| Hao L, Zhang B, Feng C, et al. 2018. Microbial vanadium (Ⅴ) reduction in groundwater with different soils from vanadium ore mining areas[J]. Chemosphere, 202: 272-279. |
| Hunter C M, Williamson D H Z, Gribble M O, et al. 2019. Perspectives on heavy metal soil testing among community gardeners in the United States:A mixed methods approach[J]. International Journal of Environmental Research and Public Health, 16: 2350. |
| Jayanthi B, Agamuthu P, Fauziah S H, et al. 2018. Biotransformation and removal of heavy metals:A review of phytoremediation and microbial remediation assessment on contaminated soil[J]. Environmental Reviews, 26(2): 156-168. |
| Jiang B, Adebayo A, Jia J, et al. 2019. Impacts of heavy metals and soil properties at a Nigerian e-waste site on soil microbial community[J]. Journal of Hazardous Materials, 362: 187-195. |
| 姜菲菲, 孙丹峰, 李红, 等. 2011. 北京市农业土壤重金属污染环境风险等级评价[J]. 农业工程学报, 27(8): 330-337. |
| 江玉梅, 张晨, 黄小兰, 等. 2016. 重金属污染对鄱阳湖底泥微生物群落结构的影响[J]. 中国环境科学, 36(11): 3475-3486. |
| Kharkan J, Sayadi M H, Rezaei M R. 2019. Investigation of heavy metals accumulation in the soil and pine trees[J]. Environmental Health Engineering and Management, 6: 17-25. |
| Langille M G, Zaneveld J, Caporaso J G, et al. 2013. Predictive functional profiling of microbial communities using 16S rRNA marker gene sequences[J]. Nature Biotechnology, 31(9): 814-21. |
| Leita L, De Nobili M, Muhlbachova G, et al. 1995. Bioavailability and effects of heavy metals on soil microbial biomass survival during laboratory incubation[J]. Biology and Fertility of Soils, 19(2): 103-108. |
| Li X, Meng D, Li J, et al. 2017. Response of soil microbial communities and microbial interactions to long-term heavy metal contamination[J]. Environmental Pollution, 231: 908-917. |
| Liang X, Chen L, Liu Z, et al. 2018. Composition of microbial community in pig manure biochar-amended soils and the linkage to the heavy metals accumulation in rice at harvest[J]. Land Degradation & Development, 29(7): 2189-2198. |
| 刘春早, 黄益宗, 雷鸣, 等. 2012. 湘江流域土壤重金属污染及其生态环境风险评价[J]. 环境科学, 33(1): 260-265. |
| Lorenz N, Hintemann T, Kramarewa T, et al. 2006. Response of microbial activity and microbial community composition in soils to long-term arsenic and cadmium exposure[J]. Soil Biology and Biochemistry, 38(6): 1430-1437. |
| Lu A, Wang J, Qin X, et al. 2012. Multivariate and geostatistical analyses of the spatial distribution and origin of heavy metals in the agricultural soils in Shunyi, Beijing, China[J]. Science of the Total Environment, 425: 66-74. |
| Luo J, Liu Y, Tao Q, et al. 2019. Successive phytoextraction alters ammonia oxidation and associated microbial communities in heavy metal contaminated agricultural soils[J]. Science of the Total Environment, 664: 616-625. |
| Luo L Y, Xie L L, Jin D C, et al. 2019. Bacterial community response to cadmium contamination of agricultural paddy soil[J]. Applied Soil Ecology, 139: 100-106. |
| Mickan B S, Abbott L K, Solaiman Z M, et al. 2019. Soil disturbance and water stress interact to influence arbuscular mycorrhizal fungi, rhizosphere bacteria and potential for N and C cycling in an agricultural soil[J]. Biology and Fertility of Soils, 55(1): 53-66. |
| Qian C, Johs A, Chen H, et al. 2016. Global proteome response to deletion of genes related to mercury methylation and dissimilatory metal reduction reveals changes in respiratory metabolism in geobacter sulfurreducens PCA[J]. Journal of Proteome Research, 15(10): 3540-3549. |
| Rajapaksha R M C P. 2011. Heavy metal tolerance of culturable bacteria and fungi in a long-term cultivated tropical ultisol[J]. European Journal of Soil Biology, 47(1): 9-15. |
| Rodriguez L, Ruiz E, Alonso-Azcarate J, et al. 2009. Heavy metal distribution and chemical speciation in tailings and soils around a Pb-Zn mine in Spain[J]. Journal of Environmental Management, 90(2): 1106-1116. |
| Seidel H, Ondruschka J, Morgenstern P, et al. 2000. Bioleaching of heavy metal-contaminated sediments by indigenous Thiobacillus spp:metal solubilization and sulfur oxidation in the presence of surfactants[J]. Applied Microbiology and Biotechnology, 54(6): 854-857. |
| Shao D, Zhan Y, Zhou W, et al. 2016. Current status and temporal trend of heavy metals in farmland soil of the Yangtze River Delta Region:Field survey and meta-analysis[J]. Environmental Pollution, 219: 329-336. |
| 师碧玲, 陈建文, 刘勇, 等. 2019. 铜尾矿库区土壤重金属及微生物重金属抗性基因空间分异特征[J]. 环境科学学报, 39(8): 2654-2661. |
| 唐志华, 呼和涛力, 刘敏茹, 等. 2019. 生活垃圾重金属对环卫工人身体健康影响研究[J]. 中国环境科学, 39(3): 1278-1288. |
| Wang D, Bai J, Wang W, et al. 2018. Comprehensive assessment of soil quality for different wetlands in a Chinese delta[J]. Land Degradation & Development, 29: 3783-3794. |
| Wang H, Zeng Y, Guo C, et al. 2018. Bacterial, archaeal, and fungal community responses to acid mine drainage-laden pollution in a rice paddy soil ecosystem[J]. Science of the Total Environment, 616-617: 107-116. |
| 韦应莉, 曹文侠, 李建宏, 等. 2018. 不同放牧与围封高寒灌丛草地土壤微生物群落结构PLFA分析[J]. 生态学报, 38(13): 4897-4908. |
| Wong K, Shaw T I, Oladeinde A, et al. 2016. Rapid microbiome changes in freshly deposited cow feces under field conditions[J]. Frontiers in Microbiology, 7: 500. |
| Xiao R, Guo D, Ali A, et al. 2019. Accumulation, ecological-health risks assessment, and source apportionment of heavy metals in paddy soils:A case study in Hanzhong, Shaanxi, China[J]. Environmental Pollution, 248: 349-357. |
| 肖武, 隋涛, 王鑫, 等. 2018. 巢湖流域典型农田土壤重金属污染评价与地理探测分析[J]. 农业机械学报, 49(7): 144-152. |
| Xu Y, Seshadri B, Bolan N, et al. 2019. Microbial functional diversity and carbon use feedback in soils as affected by heavy metals[J]. Environment International, 125: 478-488. |
| Yin H, Niu J, Ren Y, et al. 2015. An integrated insight into the response of sedimentary microbial communities to heavy metal contamination[J]. Scientific Reports, 5: 14266. |
| Zhang Y, Cong J, Lu H, et al. 2014. An integrated study to analyze soil microbial community structure and metabolic potential in two forest types[J]. Plos One, 9: e93773. |
| 张杰, 胡维, 刘以珍, 等. 2015. 鄱阳湖湿地不同土地利用方式下土壤微生物群落功能多样性[J]. 生态学报, 35(4): 965-971. |
| Zhao X, Huang J, Lu J, et al. 2019. Study on the influence of soil microbial community on the long-term heavy metal pollution of different land use types and depth layers in mine[J]. Ecotoxicology and Environmental Safety, 170: 218-226. |
| 赵瑞, 吴克宁, 张小丹, 等. 2019. 粮食主产区耕地健康产能评价-以河南省温县为例[J]. 中国土地科学, 33(2): 67-75. |
| 郑裕雄, 曹际玲, 杨智杰, 等. 2018. 氮沉降对亚热带常绿阔叶天然林不同季节土壤微生物群落结构的影响[J]. 土壤学报, 55(6): 1534-1544. |
