 , 程荣2, 周晓峰1, 章晨璐1, 王伍1, 林虹1, 吕建新1
, 程荣2, 周晓峰1, 章晨璐1, 王伍1, 林虹1, 吕建新1

1. 温州医科大学, 检验医学院, 生命科学学院, 浙江省模式生物技术与应用重点实验室, 温州 325000;
2. 温州医科大学, 公共卫生与管理学院, 温州 325000
收稿日期: 2019-03-06; 修回日期: 2019-04-10; 录用日期: 2019-04-10
基金项目: 国家高技术研究发展计划(863计划)(No.2014AA06A514);温州市科技计划项目(No.S20170016);浙江省大学生科技创新活动计划(新苗人才计划)(No.2018R413180)
作者简介: 姜风英(1990-), 女, E-mail:jiangfeng525416@163.com
通讯作者(责任作者): 吕建新, E-mail:Ljx@wmu.edu.cn
摘要: 为构建一种能够高效、同时吸附水中多种重金属离子的大肠杆菌,利用融合蛋白表达技术,首先将大肠杆菌前脂蛋白信号肽Lpp、膜蛋白OmpA的N端部分氨基酸和铁硫簇组装蛋白IscA的编码基因序列进行融合,构建pET-Lpp-OmpA-IscA表达载体,将此载体导入大肠杆菌BL21菌株.在IPTG诱导下,IscA蛋白可表达于细胞膜表面.然后对IscA膜表面表达菌株对重金属的吸附能力进行评估,包括测定最大吸附容量、绘制吸附浓度依赖曲线和时间依赖曲线,以及对菌株清除工业污水中重金属的性能进行初步探索.研究结果表明,与本底对照菌株相比,IscA蛋白在细胞膜表面表达能够使菌株对水中的Cu2+、Ni2+、Cd2+、Pb2+、As3+、Co2+、Hg2+这7种重金属的吸附能力提高2~5倍不等,并且在pH为6~8范围内保持其吸附能力基本不变.此菌株能够在30 min内将各种重金属溶液中超标5倍的金属含量降低至最大允许排放浓度以下,并且对吸附的重金属具有不同程度的回收能力和菌株再生能力.此外,该菌株能够同时吸附工业污水中的多种重金属,有效降低各种重金属含量.因此,利用膜表面表达技术对大肠杆菌进行改造,成功提高了大肠杆菌对多种重金属的吸附能力,为利用微生物治理环境重金属污染提供了良好的应用前景.
关键词:IscA大肠杆菌生物吸附重金属膜表面表达
Application of IscA surface-displayed Escherichia coli in bioadsorption of heavy metals in water
JIANG Fengying1
 , CHENG Rong2, ZHOU Xiaofeng1, ZHANG Chenlu1, WANG Wu1, LIN Hong1, Lü Jianxin1
, CHENG Rong2, ZHOU Xiaofeng1, ZHANG Chenlu1, WANG Wu1, LIN Hong1, Lü Jianxin1

1. Zhejiang Provincial Key Laboratory for Technology and Application of Model Organisms, School of Laboratory Medicine and Life Science, Wenzhou Medical University, Wenzhou 325000;
2. School of Public Health and Management, Wenzhou Medical University, Wenzhou 325000
Received 6 March 2019; received in revised from 10 April 2019; accepted 10 April 2019
Abstract: To construct an Escherichia coli strain with high adsorption capacity for multiple heavy metals, a pET-Lpp-OmpA-IscA vector that can express a fusion protein containing the N-terminal of prelipoprotein Lpp, membrane protein OmpA, and an iron-sulfur assembly protein IscA was constructed and transformed into E. coli BL21 strain. The IscA could be produced on the cell surface upon induction with IPTG. The adsorption of heavy metals by the strain with surface-displayed IscA was evaluated with respect to the maximal adsorption capacity, concentration response and time dependence; the ability of the strain to remove heavy metals from industrial wastewater was also assessed. The results show that IscA surface-displayed E. coli could adsorb 2-to 5-fold higher amount of heavy metals (Cu2+, Ni2+, Cd2+, Pb2+, As3+, Co2+, Hg2+) compared to the control strain, and the adsorption capability did not significantly get attenuated within the pH range of 6~8. water samples with heavy metals in a concentration exceeding the standard by 5-fold could be reduced to normal levels due to bioadsorption within 30 min. Several heavy metals adsorbed by this strain could be released for recycling with concomitant regeneration of the strain. Furthermore, this strain was able to simultaneously adsorb multiple heavy metals in industrial waste water, resulting in an effective decrease in the total heavy metal content. Thus, we successfully engineered an E. coli strain with improved heavy metal adsorption capacity using the cell surface-display approach. This may provide useful strategies for the development and optimization of microorganisms for bioremediation of heavy metal pollutants.
Keywords: IscAEscherichia colibioadsorptionheavy metalssurface-display
1 引言(Introduction)随着工业化进程加快, 重金属废水排放量巨大, 重金属污染日益严重, 水体重金属污染已成为当今主要的环境问题之一, 因此对其进行有效处理已是当前亟待解决的工作.重金属废水的常规处理主要包括理化方法, 但这些方法费用昂贵、去除不彻底、易产生二次污染.近年来生物吸附法引起了广泛的重视, 成为重金属废水有效的处理方法之一.如利用细菌、真菌、藻类(Moreno-Sanchez et al., 2017)等生物材料的化学成分和结构特性吸附并积累废水中的重金属, 从而达到去除废水中重金属的目的(Hansda et al., 2016).目前报道的金属螯合肽或金属硫蛋白, 大多能吸附一种或几种重金属, 如Cd2+、Hg2+、Pb2+等(Bae et al., 2001;Sriprang et al., 2003;Wei et al., 2014).然而工业排放的重金属废水往往同时含有较多种重金属(Mitchell et al., 2011), 且有时严重超标, 这就需要依次采用多种金属螯合蛋白才能吸附干净, 效率不高.
大肠杆菌IscA蛋白是一种重要的铁硫簇组装蛋白, 除了能够结合铁硫簇(Vinella et al., 2009)外, 人们发现它还具有结合铁离子(Wang et al., 2010)和铜离子(Tan et al., 2014)的能力.本研究进一步利用基因工程技术, 将大肠杆菌IscA蛋白与大肠杆菌膜蛋白OmpA进行融合, 使其表达在细胞膜外的表面, 构建出能够高效吸附水中多种重金属的菌株.与对照菌株相比, IscA蛋白在膜表面表达能够使菌株对水中的Cu2+、Ni2+、Cd2+、Pb2+、As3+、Co2+、Hg2+ 7种重金属的吸附能力提高2~5倍不等, 且能够在30 min内将超标5倍的各种重金属溶液的金属含量基本降低至最大允许排放浓度以下.此外将此菌株初步应用于环境中的重金属废水处理, 结果表明其能够有效降低实际样品中的各类重金属含量, 具有较好的应用前景.
2 材料与方法(Material and methods)2.1 材料2.1.1 菌株E.coli BL21(DE3)[F-ompT hsdS(rB-mB-)gal dcm(DE3)], 以下简称BL21菌株, 由本实验室保存.
2.1.2 质粒pET-28b[Kanar], 含有His标签和T7终止子, 由本实验室保存.
2.1.3 M9培养基在M9基础培养基的基础上添加20种天然氨基酸混合水溶液(10 mg·L-1·种-1)、维生素B1水溶液(5 μg·mL-1).4 ℃保存备用.
2.1.4 主要试剂PCR扩增聚合酶2×phanta, 购于Vazyme公司;无缝克隆反应试剂盒购于和元生物技术(上海)有限公司;氯化钴(CoCl2)、硫酸镍(NiSO4)、硫酸镉(CdSO4)、氯化汞(HgCl2)、亚砷酸钠(NaAsO2)、重铬酸钾(K2Cr2O7)、硝酸铅(Pb(NO3)2)、硫酸铜(CuSO4)等金属试剂均购自Sigma公司, 溶于去离子水配成各种溶液;消解用硝酸购自Merck公司;其它试剂为国产分析纯.
2.2 方法2.2.1 大肠杆菌IscA膜表面表达载体和胞内表达载体的构建根据文献报道的大肠杆菌前脂蛋白信号肽Lpp和跨膜蛋白OmpA的融合序列(Wei et al., 2014)(即Lpp第1~9位氨基酸和OmpA第46~159位氨基酸进行融合), 由南京金斯瑞生物科技公司直接合成此融合序列的编码基因lpp-ompA, 此基因片段克隆在pUC50-lpp-ompA中.以此合成质粒为模板, 利用引物Lpp-ompA-F和Lpp-ompA-R, PCR扩增lpp-ompA基因;同时以大肠杆菌BL21菌株的基因组DNA为模板, 利用引物IscA-F和IscA-R, 扩增大肠杆菌iscA基因.PCR反应条件:95 ℃预变性5 min, 95 ℃变性40 s、50 ℃退火40 s、72 ℃延伸2 min, 共35个循环, 最后72 ℃延伸10 min.电泳验证片段扩增成功后, 将上述两个片段按摩尔比1:1加入新的PCR体系, 利用引物Lpp-ompA-F和IscA-R, 通过重组PCR方法将两片段连接起来, PCR反应条件同上.连接起来的lpp-ompA-IscA片段经电泳胶回收后, 按照无缝克隆试剂盒说明书的操作, 与经NcoI和HindⅢ双酶切后的pET-28b线性载体进行无缝克隆, 连接产物转化入感受态细胞, 经双酶切鉴定后挑取阳性克隆, 测序分析(上海桑尼生物科技有限公司), 最终构建得到大肠杆菌IscA膜表面表达载体pET-Lpp-OmpA-IscA.同时, 只表达Lpp-OmpA膜蛋白但不表达IscA蛋白的对照本底载体pET-Lpp-OmpA也按照上述相同方法进行构建, 区别在于PCR扩增时只需用引物Lpp-ompA-F和Lpp-ompA-R2即可, 无需进行重组PCR.
2.2.2 大肠杆菌IscA在细菌膜表面的诱导表达和胰蛋白酶酶解实验鉴定将pET-Lpp-OmpA-IscA和pET-Lpp-OmpA质粒分别转化入BL21感受态细胞, 得到pET-Lpp-OmpA-IscA/BL21菌株(大肠杆菌IscA膜表面表达菌株)和pET-Lpp-OmpA/BL21菌株(本底对照菌株).按照与步骤1.2.2节中相同的诱导条件对上述两种菌株进行诱导表达.将诱导前后的菌液分别离心, 弃去培养基, 用PBS缓冲液(pH 8.0)洗涤2次后再重悬到缓冲液, 使细菌密度OD600为10左右.每种菌液样品约吸取10 μL进行SDS-PAGE电泳鉴定蛋白表达情况.
此外, 分别吸取50 μL已重悬到PBS缓冲液中的诱导后菌液(OD600约为10), 加入终浓度为100 μg·mL-1的胰蛋白酶, 37 ℃消化3 h, 洗涤3次后再重悬到缓冲液中, 吸取相同的菌量与其余样品同时电泳鉴定.
2.2.3 IscA膜表达菌株对重金属吸附能力的浓度依赖实验将pET-Lpp-OmpA-IscA/BL21菌株和pET-Lpp-OmpA/BL21菌株分别在4 L的M9培养基中扩大培养至OD600约为0.8, 加入终浓度为200 μmol·L-1的IPTG, 25 ℃条件下诱导24 h.诱导后的菌液离心后弃去培养基, 用PBS溶液洗涤2次后再重悬, 调整菌体密度OD600约为50.菌液分装至5 mL EP管, 每管分装2 mL.每种菌液均分装56管以上.将分装后的菌液全部离心弃去上清, 然后分别加入2 mL终浓度为1、5、25、125、1000、5000、10000 μmol·L-1的8种重金属水溶液(CoCl2、NiSO4、CdSO4、HgCl2、NaAsO2、K2Cr2O7、Pb(NO3)2、CuSO4), 每种重金属溶液均设上述7个浓度梯度.
上述菌体用重金属溶液重悬, 置于25 ℃恒温摇床100 r·min-1混合振荡30 min后, 离心弃去上清液, 再用去离子水洗涤2次, 以洗去未与菌体结合的重金属离子.最后将每管中的全部菌体用2 mL浓硝酸重悬并转移到新的离心管中, 用去离子水定容至10 mL.每个样品置于微波消解仪中消解, 消解程序(温度、时间、压力)设置如下:120 ℃, 1 min, 10 apm;150 ℃, 1 min, 20 apm;180 ℃, 15 min, 30 apm.消解完毕待硝酸挥发干净后, 使用安捷伦公司的8800型电感耦合等离子体质谱仪(ICP-MS)对溶液中的各种重金属含量进行测定.此外, 准备一管等量的离心后菌体, 置于-80 ℃冰箱冷冻过夜, 并在真空干燥机中干燥36 h以上, 再用分析天平精确称量菌体干重.菌体对重金属的吸附能力可以用μmol·g-1衡量, 即每克干重菌体能够吸附的重金属摩尔数量.实验结果为3次独立实验的平均值±SD值, n=3.
表 1(Table 1)
| 表 1 基因扩增引物信息 Table 1 Primers of gene amplification | |||||||||||||||||||||
表 1 基因扩增引物信息 Table 1 Primers of gene amplification
| |||||||||||||||||||||
2.2.4 IscA膜表达菌株清除溶液中重金属离子的时间依赖实验将pET-Lpp-OmpA-IscA/BL21菌株和pET-Lpp-OmpA/BL21菌株按步骤2.2.3节所述进行诱导处理, 调整菌体密度OD600约为50.菌液分装至15 mL EP管, 每管分装15 mL, 每种菌液至少分装8管.将分装后的菌液全部离心弃去上清, 然后分别加入8种重金属溶液, 每种重金属溶液终浓度如下:Cu2+ (2.5 mg·L-1)、Ni2+ (5.0 mg·L-1)、Cd2+ (0.5 mg·L-1)、Pb2+ (5.0 mg·L-1)、As3+ (2.5 mg·L-1)、Co2+ (5.0 mg·L-1)、Hg2+ (0.25 mg·L-1)、Cr6+ (2.5 mg·L-1).加入溶液重悬后, 菌液置于25 ℃恒温摇床100 r·min-1混合振荡, 并在5、10、20、30、60 min时间点吸取每种菌液1.5 mL.吸取的菌液经高速离心后, 留取1.0 mL的上清溶液定容到10 mL, 用ICP-MS直接测定上清中剩余重金属离子的浓度.以初始重金属溶液浓度为0时刻浓度, 根据结果绘制经菌体吸附清除后的溶液重金属含量的时间依赖曲线.实验结果为3次独立实验的平均值±SD值, n=3.
2.2.5 酸碱度pH对IscA膜表达菌株的重金属离子吸附能力的影响实验将pET-Lpp-OmpA-IscA/BL21菌株按步骤2.2.3节所述进行诱导处理, 调整菌体密度OD600约为50.菌液分装至5 mL EP管, 每管分装2 mL, 菌液分装56管以上.将分装后的菌液全部离心弃去上清, 然后分别加入2 mL重金属终浓度为10000 μmol·L-1的7种重金属水溶液(CoCl2、NiSO4、CdSO4、HgCl2、NaAsO2、Pb(NO3)2、CuSO4), 每种重金属溶液均设pH分别为3、4、5、6、7、8、9、10的梯度.菌体用上述重金属溶液重悬, 置于25 ℃恒温摇床100 r·min-1混合振荡30 min后, 按步骤2.2.3节一样的方法对菌体在不同pH条件下的重金属吸附能力进行测定.
2.2.6 IscA膜表达菌株的重金属回收和再生实验将pET-Lpp-OmpA-IscA/BL21菌株按步骤2.2.3节所述进行诱导处理, 调整菌体密度OD600约为50.分装到15 mL管中, 每管分装5 mL, 至少分装8管.4000 r·min-1, 离心15 min后弃上清液, 然后每管分别加入终浓度为100 μmol·L-1的7种金属溶液(CoCl2、NiSO4、CdSO4、HgCl2、NaAsO2、Pb(NO3)2、CuSO4)至5 mL.菌体重悬充分后, 在25 ℃、150 r·min-1孵育15 min.8000 r·min-1, 离心10 min后, 留取各管上清(样品1).之后, 每管分别加入pH为4的ddH2O溶液至剩余菌液, 定容到5 mL.重悬后在室温条件下150 r·min-1振荡72 h.8000 r·min-1离心10 min后, 取适量上清(样品2).样品1和样品2分别用ICP-MS测定重金属浓度.IscA膜表达菌株吸附重金属后对该种金属的回收率=样品2浓度/(原始溶液浓度-样品1浓度)×100%, 即菌株释放的金属含量占其吸附的金属含量百分比.此外, 按照方法2.2.3节中的步骤, 对重金属释放后的菌株再次进行重金属离子的吸附实验, 以评价IscA膜表达菌株的再生能力.此外, 对同一样品进行多次的回收和再生实验, 以探索该菌株的可重复再生次数.
2.2.7 IscA膜表达菌株清除工业污水中重金属的实际应用实验对课题组前期采集的周边地区环境水样中的重金属含量进行初筛, 选取3个重金属污染相对严重的水样(采集自温州市龙湾区蓝田工业区)作为实验对象, 将水样离心备用, 以彻底除去泥沙颗粒.将pET-Lpp-OmpA-IscA/BL21和pET-Lpp-OmpA/BL21菌株按步骤1.2.3节所述进行诱导处理, 调整菌体密度OD600约为50.分别分装至3个15 mL离心管, 离心弃去上清.分别在每个管子中加入15 mL编号为1、2、3的上述水样.重悬菌体后, 置于25 ℃恒温摇床100 r·min-1混合振荡30 min后离心, 吸取10 mL经处理的上清液体, 直接用ICP-MS测定样品中的各种重金属含量.
3 结果与分析(Results and analysis)3.1 大肠杆菌IscA膜表面表达载体的构建平板上长出的单克隆菌落挑入液体培养基后, 提取质粒后经Nco I和Hind Ⅲ双酶切鉴定, 切下的片段大小与预期一致.经测序确证序列完全匹配, 成功构建得到大肠杆菌IscA膜表面表达载体pET-Lpp-OmpA-IscA、对照本底载体pET-Lpp-OmpA.
3.2 大肠杆菌IscA在细菌膜表面的诱导表达和胰蛋白酶酶解实验鉴定首先验证Lpp-OmpA-IscA融合蛋白是否能够在BL21菌株中表达, 用IPTG进行诱导.以未诱导的全细胞样品和诱导后的全细胞样品进行SDS-PAGE蛋白电泳鉴定.如图 1所示, 样品经IPTG诱导后, 在25 KDa偏上位置可见一条显著增粗的蛋白条带, 此蛋白条带大小与Lpp-OmpA-IscA融合蛋白预期大小27 KDa接近, 初步表明此融合蛋白已经成功表达.同样地, Lpp-OmpA表达菌株经IPTG诱导, 在16 kDa大小位置也显示有明显条带, 表明Lpp-OmpA蛋白也表达成功.
图 1(Fig. 1)
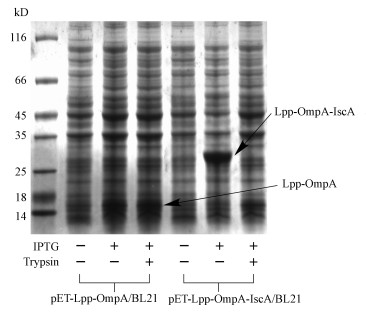 |
| 图 1 IscA膜表面表达菌株的诱导表达及胰蛋白酶消化实验的SDS-PAGE Fig. 1Identification of expression and display of IscA on cell surface by trypsin proteolysis and SDS-PAGE |
由于Lpp-OmpA是膜结合蛋白, 为了进一步鉴定Lpp-OmpA-IscA融合蛋白中的IscA肽段是暴露于膜外, 而不是位于膜上或者膜内, 本研究用胰蛋白酶对已经表达成功的菌株进行酶切消化.由于胰蛋白酶不能进入细胞膜内, 所以只能将膜外的蛋白或者肽段消化降解.如图 1所示, 表达有Lpp-OmpA-IscA蛋白的全细胞菌体和胰蛋白酶孵育后, 27 kDa位置的蛋白条带几乎消失, 而在16 kDa位置出现一蛋白条带, 此条带大小与Lpp-OmpA膜蛋白大小一致.这表明Lpp-OmpA-IscA融合蛋白中的IscA肽段是位于细胞膜外, 因此能够被胰蛋白酶降解, 而剩余的Lpp-OmpA肽段结合于膜上, 不能被胰蛋白酶继续消化.但是pET-Lpp-OmpA/BL21作为对照菌株, 膜上的Lpp-OmpA蛋白不能直接与胰蛋白酶接触, 所以Lpp-OmpA蛋白没有被降解(图 1).
3.3 IscA膜表达菌株对重金属吸附能力的浓度依赖实验图 1表明IscA已经成功表达于菌株pET-Lpp-OmpA-IscA/BL21的膜表面.由于细菌离子表面本身含有大量的膜结合蛋白、脂质等生物分子, 所以天然细菌能够吸附和累积一定量的金属.为扣除细菌本身对重金属的本底吸附, 本研究构建了仅表达Lpp-OmpA膜蛋白的对照菌株pET-Lpp-OmpA/BL21.用IPTG诱导两种菌株24 h后, 可以使蛋白的膜表达量达到最大饱和值(结果未显示).之后在相同实验条件下对两种菌株的最大重金属吸附能力分别进行测定.如图 2所示, 随着溶液中重金属离子浓度的增加, 其吸附的重金属含量均随之增多.此外, 与对照菌株相比, IscA在大肠杆菌膜表面表达能够使其对Cu2+、Ni2+、Cd2+、Pb2+、As3+、Co2+、Hg2+这7种离子的最大吸附量增加2~5倍不等, 而基本不能增加对Cr6+的吸附量.由于实验时加入的菌体数量和IscA蛋白数量是相同的, IscA膜表达菌株和对照菌株的重金属吸附含量比值越高, 表明IscA对这种重金属的结合量也越多, 这可能是IscA蛋白与不同重金属的结合亲和力存在差异导致的.
图 2(Fig. 2)
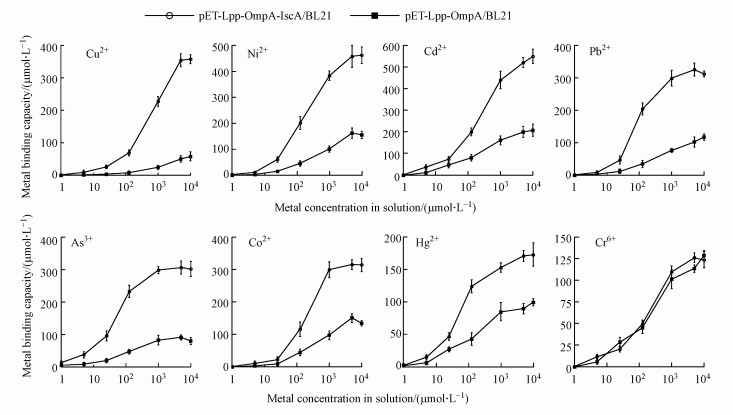 |
| 图 2 IscA膜表达菌株对重金属的最大吸附能力及浓度依赖实验 Fig. 2Determination of the maximal adsorption capacity and concentration response curve of heavy metals by IscA surface-displayed E. coli strain |
3.4 IscA膜表达菌株清除溶液中重金属离子的时间依赖实验如图 2所示, IscA蛋白在大肠杆菌膜表面表达能够显著增加细菌对上述7种重金属离子的吸附量.为进一步验证菌株吸附溶液中重金属离子后, 重金属在溶液中的含量是否会降低, 以及探索这种吸附作用与时间的关系, 我们进行了菌株清除溶液重金属离子的时间依赖实验.为更好模拟高重金属含量的工业废水, 我们将待清除溶液的初始重金属浓度设定为超出国家最高允许排放浓度5倍的水平(依据《污水综合排放标准》GB 8978—1996的规定, 实验中8种重金属的为:铜0.5 mg·L-1、镍1.0 mg·L-1、镉0.1 mg·L-1、铅1.0 mg·L-1、砷0.5 mg·L-1、钴1.0 mg·L-1、汞0.05 mg·L-1、铬0.5 mg·L-1), 以初步评价该菌株是否能够将重金属超标污水进行治理.如图 3所示, pET-Lpp-OmpA-IscA/BL21菌株和pET-Lpp-OmpA/BL21菌株均能够不同程度降低各种溶液中的重金属含量.而且与对照菌株相比, IscA膜表达菌株在相同的时间内可以使7种重金属溶液(Cu2+、Ni2+、Cd2+、Pb2+、As3+、Co2+、Hg2+)的浓度降低更多.经过30 min的吸附作用, 超标的重金属溶液基本上都可以降低到最高允许排放浓度以下, 尤其能够使Cu2+、Cd2+、Hg2+溶液的浓度减少至初始浓度的10%以下.但IscA膜表达菌株对含Cr6+溶液的清除能力与本底菌株接近.此数据与图 2结果一致, 表明IscA蛋白能够结合前面7种离子, 而不能结合Cr6+.此外从时间依赖曲线可以看出, IscA膜表达菌株对重金属溶液的清除作用在30 min左右基本上达到饱和, 这也说明此菌株能够在短时间内完成重金属的清除, 效率较高.
图 3(Fig. 3)
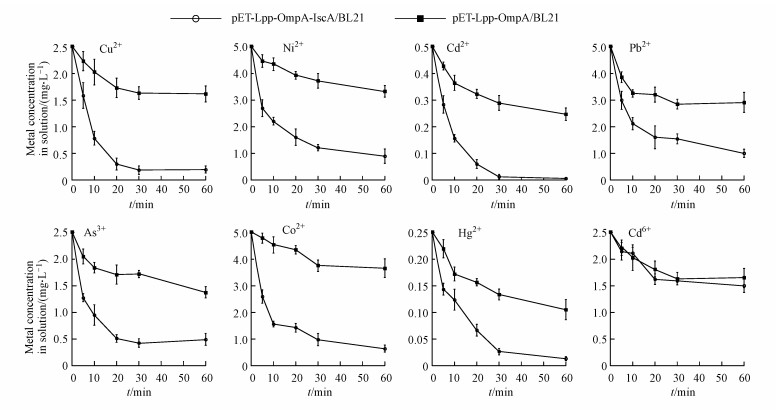 |
| 图 3 IscA膜表达菌株清除溶液中重金属离子的时间依赖实验 Fig. 3Time dependent curve of heavy metals removal by IscA surface-displayed E. coli strain. |
3.5 酸碱度pH对IscA膜表达菌株的重金属离子吸附能力的影响酸碱度pH对重金属的形态常有较大的影响, 进而有可能会改变菌株对重金属的吸附能力.所以我们尝试在不同的pH条件下探索IscA膜表达菌株对重金属离子的吸附容量.如图 4所示, 在重金属浓度为10000 μmol·L-1, pH分别为3、4、5、6、7、8、9、10的7种重金属水溶液(Co、Ni、Cd、Hg、As、Pb、Cu)中, IscA膜表达菌株在不同pH条件下具有不同的吸附能力.总体而言, 在pH为6~8的中性范围内, IscA膜表达菌株对各类重金属的吸附能力较高, 并且基本保持稳定.但是在酸性相对较强的环境下(pH < 4), 由于IscA蛋白可能会变性, 导致吸附能力显著下降.同时, 碱性环境(pH>9)会使重金属离子形成氢氧化物沉淀, 所以也会使其吸附容量降低.
图 4(Fig. 4)
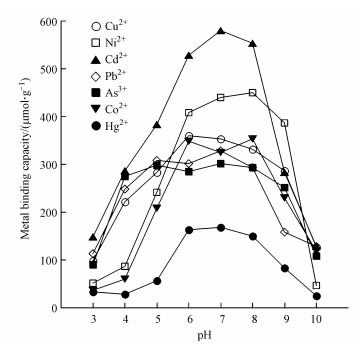 |
| 图 4 pH对IscA膜表达菌株的重金属离子吸附能力的影响 Fig. 4Effect of pH on the heavy metals adsorption capacity of IscA surface-displayed strain |
3.6 IscA膜表达菌株的金属回收能力和菌株再生情况利用微生物对环境中重金属进行吸附的一个重要优势便在于吸附后的重金属有可能重新从微生物菌体上解离, 重新进行回收利用.这尤其有利于一些用途广泛的贵重金属的循环利用, 具有较好的经济和环保效益.因此本研究尝试将吸附有各种重金属的IscA膜表达菌株在pH约为4(pH低于4会导致IscA蛋白变性)的酸性溶液中进行金属释放和回收实验.结果表明IscA膜表达菌株在不含金属离子的酸性溶液中, 对各种已被吸附的重金属的回收率(即释放百分比)如下:镍(93.6%)、钴(93.9%)、汞(60.1%)、砷(42.3%)、镉(28.1%)、铜(20.1%)、铅(18.6%).这表明此菌株对镍、钴、汞等离子具有较高的回收率, 对其他重金属离子的回收率相对较低, 这可能是因为IscA与这几种金属离子结合比较牢固, 不容易解离出来.另外, 当菌株吸附的镍、钴、汞离子大部分被释放回收后, 此菌株能够多次重复再生.与新制备的菌株相比, 经过3次重复回收和再生后, 菌株对镍、钴、汞仍具有较高的吸附能力(分别为初始的88.2%、85.7%、81.3%), 表明此菌株对镍、钴、汞离子具有较好的重复回收和再生能力.然而此菌株对砷、镉、铜、铅离子的回收率较低, 大部分离子仍结合于膜上的IscA蛋白, 所以此菌株吸附这几种离子后其再生能力相对较弱, 再次结合重金属的容量显著减少.
3.7 IscA膜表达菌株清除工业污水中重金属的实际应用实验由于环境水体成分复杂, 尤其工业排放的污水往往含有大量其他有害物质, 可能会对菌株的吸附活力产生影响, 所以需要进一步评价IscA膜表达菌株对工业污水的重金属清除能力.本研究选取了3份采集自金属冶炼厂周边水域的水样作为实验对象.如表 2所示, 这3份水样中多种重金属的初始含量均较高, 其中1号样品中的镍超标, 2号和3号样品中的铜、镍、铬超标, 其中铜、镍超标严重(大约分别超标3倍、13倍).经IscA膜表达菌株和本底菌株吸附处理30 min后, 样品中各种重金属含量均有降低, 并且经IscA膜表达菌株吸附后, 其重金属浓度下降幅度显著大于对照菌株.1号样品中的镍和2号、3号样品中的铜、铬经吸附后均低于最大允许排放浓度.但2号、3号样品中镍的含量仍高于最大允许排放浓度, 这可能是样品的初始镍浓度过高, 超过了菌体的最大吸附容量.所以我们将首次吸附后的剩余样品再次和未被重金属吸附的新制备菌体混合反应.如表 2“*”标注数据所示, 经过二次吸附, 2号、3号样品中镍的含量均下降至最大允许排放浓度以下.此外, 我们也对3份水样的其他常见金属进行了测定, 发现其镁、铁、锌等微量元素的含量也相当高, 均在5 mg·L-1以上.这说明IscA膜表达菌株可以耐受其他金属和复杂成分的干扰, 能够同时清除工业污水中的多种重金属, 具有良好的应用前景.
表 2(Table 2)
| 表 2 IscA膜表达菌株清除工业污水中重金属的浓度测定 Table 2 Determination of concentration of heavy metals in industrial waste water removed by IscA surface-displayed strain | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 2 IscA膜表达菌株清除工业污水中重金属的浓度测定 Table 2 Determination of concentration of heavy metals in industrial waste water removed by IscA surface-displayed strain
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
随着工农业的快速发展, 环境中重金属污染问题日趋严重, 因此如何有效、安全地清除重金属已成为亟待解决的问题.传统的理化方法其吸附物质本身可能会造成二次污染, 且成本高, 能耗大.生物吸附剂因其简便、安全、成本低等优点, 近年来得到快速发展.例如利用基因工程技术对大肠杆菌、酵母等模式生物进行改造, 使其具有良好的重金属吸附能力.
近年来, 越来越多能够有效吸附重金属的全细胞微生物菌株被研发出来(Ojuederie et al., 2017), 比如针对汞(Bae et al., 2003)、铅(Wei et al., 2014)、铜(Ravikumar et al., 2011)、镉(He et al., 2012)、砷(Singh et al., 2008)等的吸附工程菌株.不过大多数重金属吸附菌株表达的是金属特异吸附蛋白, 所以只能吸附某种特定重金属.然而环境水体尤其是工业污水中往往同时含有大量的多种重金属, 如果使用单一重金属吸附菌株, 需要依次对每种重金属进行清除, 耗时长、效率低.一些能够同时吸附多种重金属的工程菌株也有被报道, 如表达Pyrus calleryana金属螯合肽的大肠杆菌可以吸附并耐受高浓度的铜、镉、汞(Li et al., 2015).这些能够结合重金属的蛋白或多肽, 其一级结构中大多含有多个半胱氨酸残基(Poole 2015).然而每种金属结合蛋白的空间结构, 尤其是金属结合结构域的差异, 使得不同的金属结合蛋白具有结合不同金属的特性(Hartwig, 2001).大肠杆菌IscA是铁硫簇合成的重要组件之一, 是一个具有107个氨基酸残基的小分子蛋白.晶体学研究显示, 纯化的大肠杆菌IscA以二聚体或四聚体形式存在, 其中3个保守的半胱氨酸残基(Cys-35, Cys-99, Cys-101)伸出形成一个“半胱氨酸口袋”, 可以结合单个铁离子或者铁硫簇(Bilder et al., 2004;Cupp-Vickery et al., 2004).定点突变研究证明IscA中这3个保守的半胱氨酸残基对于它特异性的铁结合活性是必需的(Ding et al., 2004).同时IscA也被发现能够结合铜离子(Tan et al., 2014).本研究将IscA蛋白表达于大肠杆菌细胞膜外, 根据图 2、图 3结果可知IscA除了能够吸附已经报道的几种金属外, 还可以吸附Ni2+、Cd2+、Pb2+、As3+、Co2+、Hg2+这几种重金属离子, 这可能跟IscA 3个保守的半胱氨酸残基具有良好的“柔韧性”有关(Bilder et al., 2004), 可以与不同的金属离子进行键合.本研究首次证实了IscA的多种重金属离子结合活性, 并且利用这种特性将其锚定在大肠杆菌膜表面, 能够对环境水体和工业污水中的多种重金属同时起到有效的清除作用, 表明其具有较好的实用价值.
为了将重金属吸附菌株广泛推广并应用于大规模工业污水的治理, 还需要一系列工艺和方法上的优化和改进(Diep et al., 2018).在吸附菌株制备方面, 需要探索如何进一步提高菌株的吸附容量, 还要考虑菌株诱导培养基的选择.例如, LB培养基中含有含量较高的多种金属元素, 某些金属吸附蛋白表达出来之后会优先与培养基中金属元素结合, 结合位点被占据后便很难再与待清除的重金属结合, 不适合重金属吸附菌株的培养和表达.本研究选用M9培养基, 成分简单, 基本不含有铁、锌、铜这些微量元素及重金属, 所以能够保证表达在细胞膜表面的IscA具有较强的重金属吸附能力.针对污水处理流程方面, 需要考虑如何将菌株固定化, 如何将已吸附菌株重新再生, 如何将被吸附的重金属进行回收利用, 以实现污水的高效处理和资源的循环利用.
本研究构建的IscA膜表达菌株在吸附水中多种重金属方面具有较大的性能优势.后续还需深入探索和进一步优化, 比如将数个IscA蛋白进行串联融合, 或运用定点突变等方法扩大其重金属吸附, 从而进一步提高它对重金属的全面清除能力, 以推进其在环境污染治理上的应用.
4 结论(Conclusions)1) 大肠杆菌IscA蛋白在细胞膜表面表达能够使菌株对水中的Cu2+、Ni2+、Cd2+、Pb2+、As3+、Co2+、Hg2+ 7种重金属的吸附能力提高2~5倍.此菌株能够在30 min内将各种重金属溶液中超标5倍的金属含量降低至最大允许排放浓度以下.
2) 大肠杆菌IscA蛋白膜表达菌株对已被吸附的镍、钴、汞等离子具有较高的回收率:镍(93.6%)、钴(93.9%)、汞(60.1%).并且对这3种重金属离子可以进行多次重复回收和菌株再生利用.
3) 大肠杆菌IscA蛋白膜表达菌株可以耐受其他金属和复杂成分的干扰, 能够同时清除工业污水中的多种重金属, 具有良好的应用前景.
参考文献
| Bae W, Mehra R K, Mulchandani A, et al. 2001. Genetic engineering of Escherichia coli for enhanced uptake and bioaccumulation of mercury[J]. Applied and Environmental Microbiology, 67(11): 5335–5338.DOI:10.1128/AEM.67.11.5335-5338.2001 |
| Bae W, Wu C H, Kostal J, et al. 2003. Enhanced mercury biosorption by bacterial cells with surface-displayed MerR[J]. Applied and Environmental Microbiology, 69(6): 3176–3180.DOI:10.1128/AEM.69.6.3176-3180.2003 |
| Bilder P W, Ding H, Newcomer M E. 2004. Crystal structure of the ancient, Fe-S scaffold IscA reveals a novel protein fold[J]. Biochemistry, 43(1): 133–139. |
| Cupp-Vickery J R, Silberg J J, Ta D T, et al. 2004. Crystal structure of IscA, an iron-sulfur cluster assembly protein from Escherichia coli[J]. Journal of Molecular Biology, 338(1): 127–137. |
| Diep P, Mahadevan R, Yakunin A F. 2018. Heavy Metal Removal by Bioaccumulation Using Genetically Engineered Microorganisms[J]. Frontiers in Bioengineering and Biotechnology, 6: 157.DOI:10.3389/fbioe.2018.00157 |
| Ding H, Clark R J, Ding B. 2004. IscA mediates iron delivery for assembly of iron-sulfur clusters in IscU under the limited accessible free iron conditions[J]. The Journal of Biological Chemistry, 279(36): 37499–37504.DOI:10.1074/jbc.M404533200 |
| Hansda A, Kumar V, Anshumali. 2016. A comparative review towards potential of microbial cells for heavy metal removal with emphasis on biosorption and bioaccumulation[J]. World Journal of Microbiology and Biotechnology, 32(10): 170.DOI:10.1007/s11274-016-2117-1 |
| Hartwig A. 2001. Zinc finger proteins as potential targets for toxic metal ions: differential effects on structure and function[J]. Antioxidants and Redox Signaling, 3(4): 625–634.DOI:10.1089/15230860152542970 |
| He X, Chen W, Huang Q. 2012. Surface display of monkey metallothionein alpha tandem repeats and EGFP fusion protein on Pseudomonas putida X4 for biosorption and detection of cadmium[J]. Applied Microbiology and Biotechnology, 95(6): 1605–1613.DOI:10.1007/s00253-011-3768-3 |
| Li H, Cong Y, Lin J, et al. 2015. Enhanced tolerance and accumulation of heavy metal ions by engineered Escherichia coli expressing Pyrus calleryana phytochelatin synthase[J]. Journal of Basic Microbiology, 55(3): 398–405.DOI:10.1002/jobm.v55.3 |
| Mitchell E, Frisbie S, Sarkar B. 2011. Exposure to multiple metals from groundwater-a global crisis: geology, climate change, health effects, testing, and mitigation[J]. Metallomics, 3(9): 874–908.DOI:10.1039/c1mt00052g |
| Moreno-Sanchez R, Rodriguez-Enriquez S, Jasso-ChavezR, et al. 2017. Biochemistry and Physiology of Heavy Metal Resistance and Accumulation in Euglena[J]. Advances in Experimental Medicine and Biology, 979: 91–121.DOI:10.1007/978-3-319-54910-1 |
| Ojuederie O B, Babalola O O. 2017. Microbial and Plant-Assisted Bioremediation of Heavy Metal Polluted Environments: A Review[J]. International Journal of Environmental Research and Public Health, 14(12): 1504–1526.DOI:10.3390/ijerph14121504 |
| Poole L B. 2015. The basics of thiols and cysteines in redox biology and chemistry[J]. Free Radical Biology and Medicine, 80: 148–157.DOI:10.1016/j.freeradbiomed.2014.11.013 |
| Ravikumar S, Yoo I K, Lee S Y, et al. 2011. Construction of copper removing bacteria through the integration of two-component system and cell surface display[J]. Applied Biochemistry and Biotechnology, 165(7/8): 1674–1681. |
| Sauge-Merle S, Cuine S, Carrier P, et al. 2003. Enhanced toxic metal accumulation in engineered bacterial cells expressing Arabidopsis thaliana phytochelatin synthase[J]. Applied and Environmental Microbiology, 69(1): 490–494. |
| Singh N A. 2017. Biomolecules for Removal of Heavy Metal[J]. Recent Patents on Biotechnology, 11(3): 197–203. |
| Singh S, Mulchandani A, Chen W. 2008. Highly selective and rapid arsenic removal by metabolically engineered Escherichia coli cells expressing Fucus vesiculosus metallothionein[J]. Applied and Environmental Microbiology, 74(9): 2924–2927.DOI:10.1128/AEM.02871-07 |
| Sriprang R, Hayashi M, Ono H, et al. 2003. Enhanced accumulation of Cd2+ by a Mesorhizobium sp. transformed with a gene from Arabidopsis thaliana coding for phytochelatin synthase[J]. Applied and Environmental Microbiology, 69(3): 1791–1796. |
| Tan G, Cheng Z, Pang Y, et al. 2014. Copper binding in IscA inhibits iron-sulphur cluster assembly in Escherichia coli[J]. Molecular Microbiology, 93(4): 629–644.DOI:10.1111/mmi.2014.93.issue-4 |
| Vinella D, Brochier-Armanet C, Loiseau L, et al. 2009. Iron-sulfur (Fe/S) protein biogenesis: phylogenomic and genetic studies of A-type carriers[J]. PLOS Genetics, 5(5): e1000497.DOI:10.1371/journal.pgen.1000497 |
| Wang W, Huang H, Tan G, et al. 2010. In vivo evidence for the iron-binding activity of an iron-sulfur cluster assembly protein IscA in Escherichia coli[J]. Biochemical Journal, 432(3): 429–436. |
| Wei W, Liu X, Sun P, et al. 2014. Simple whole-cell biodetection and bioremediation of heavy metals based on an engineered lead-specific operon[J]. Environmental Science and Technology, 48(6): 3363–3371.DOI:10.1021/es4046567 |
