2021年10月12日,北京大学生命科学学院和北大-清华生命科学联合中心胡家志研究员课题组在Cell Reports发表了题为“RAG2 abolishes RAG1 aggregation to facilitate V(D)J recombination”的研究论文,系统性地阐述了在细胞周期中RAG2是如何调控RAG1的凝聚从而调控RAG1在细胞内的重排酶活性的,并且从进化的角度阐述了脊椎动物中RAG1和RAG2共进化的生物学意义。
该研究通过表达以及内源荧光标记方式在多种细胞系中利用共聚焦成像技术观察并证明了人RAG1蛋白而不是RAG2在细胞核内形成凝聚体的现象(图1a-b);进一步的研究发现,RAG2的存在可以破坏RAG1的凝聚状态(图1c)。研究人员接着利用实验室2019年开发的PEM-seq高通量测序方法,在整合了RSS序列的293T细胞中检测了凝聚状态和游离状态的RAG1活性。测序结果显示,凝聚态的RAG1几乎不能介导V(D)J重排,相反游离态的RAG1的重排酶活性增加了1154倍(图1d)。当利用RNA结合蛋白FUS迫使RAG1一直以凝聚体形式存在时,其重排酶活性也会被抑制。这表明细胞内RAG1的重排酶活性是受到自身凝聚体状态的调控的,这也能很好地阐述发育中的淋巴细胞在G1周期之外如何保护自身基因组的完整性。为了进一步研究RAG1凝聚体形成机制,研究人员进行了一系类氨基酸功能位点的突变(图1a),发现RAG1蛋白的催化活性中核心氨基酸DDE和位于蛋白质N端核定位信号对其产生凝聚作用发挥了重要的作用。此外,该研究还发现RAG2是通过与RAG1直接的相互作用来破坏RAG1自身的凝聚状态,而不依赖RAG2的PHD功能域(图1c)。
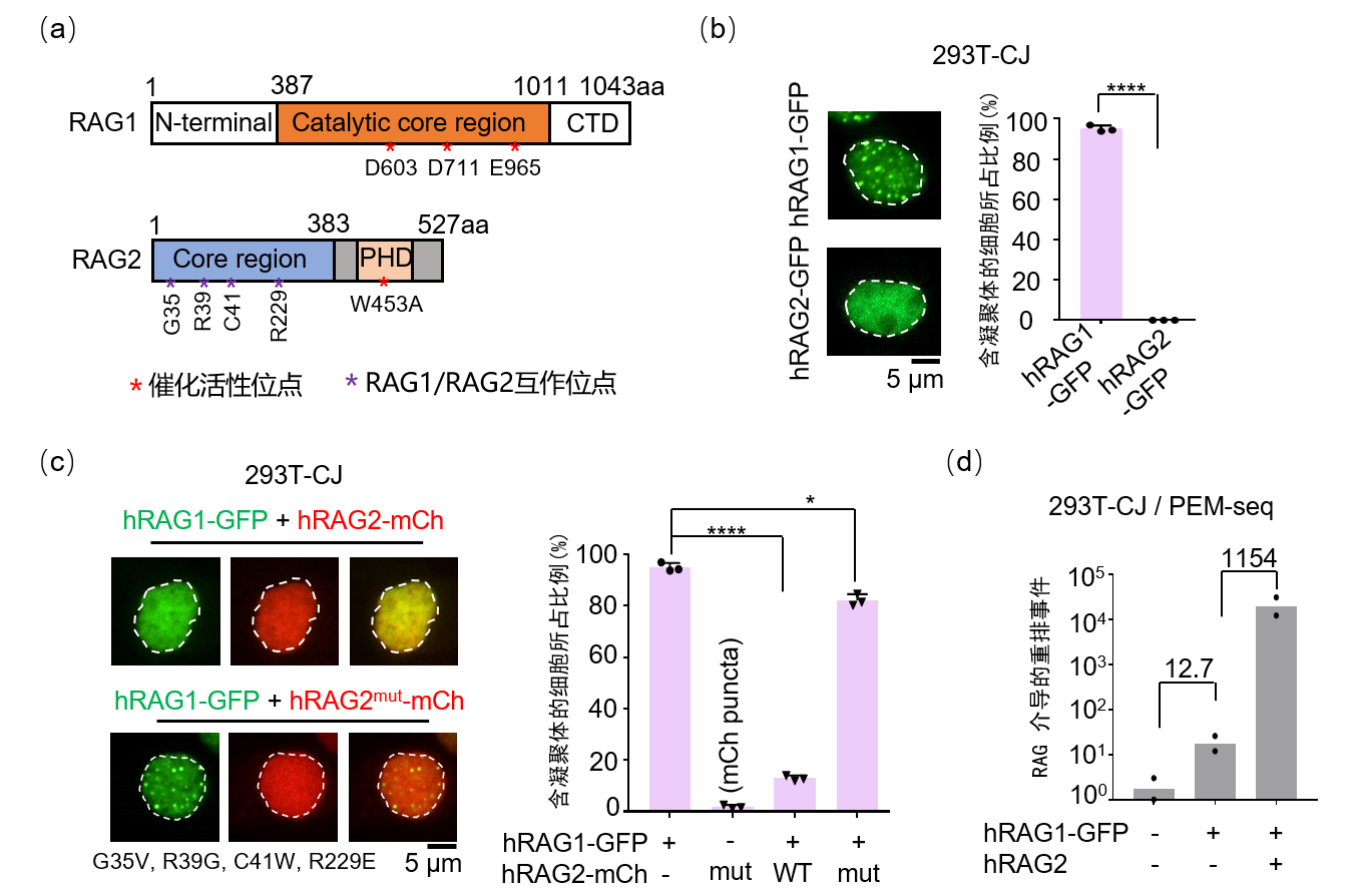
图1. RAG2调控RAG1在细胞核内的凝聚状态
研究人员还从进化角度探究了不同脊椎动物的RAG2蛋白对于人源RAG1凝聚体调控的普适性。结果发现只有人源的RAG2能够最大程度地破坏RAG1的凝聚状态从而起始VDJ重排活性,来自小鼠的RAG2只能恢复很弱的功能,而来自斑马鱼的RAG2则不能调控人源RAG1的凝聚状态(图2),表明了RAG2的起源可能跟RAG1一样早,两者共同进化,因此在物种之间表现出了一些不同的性质。
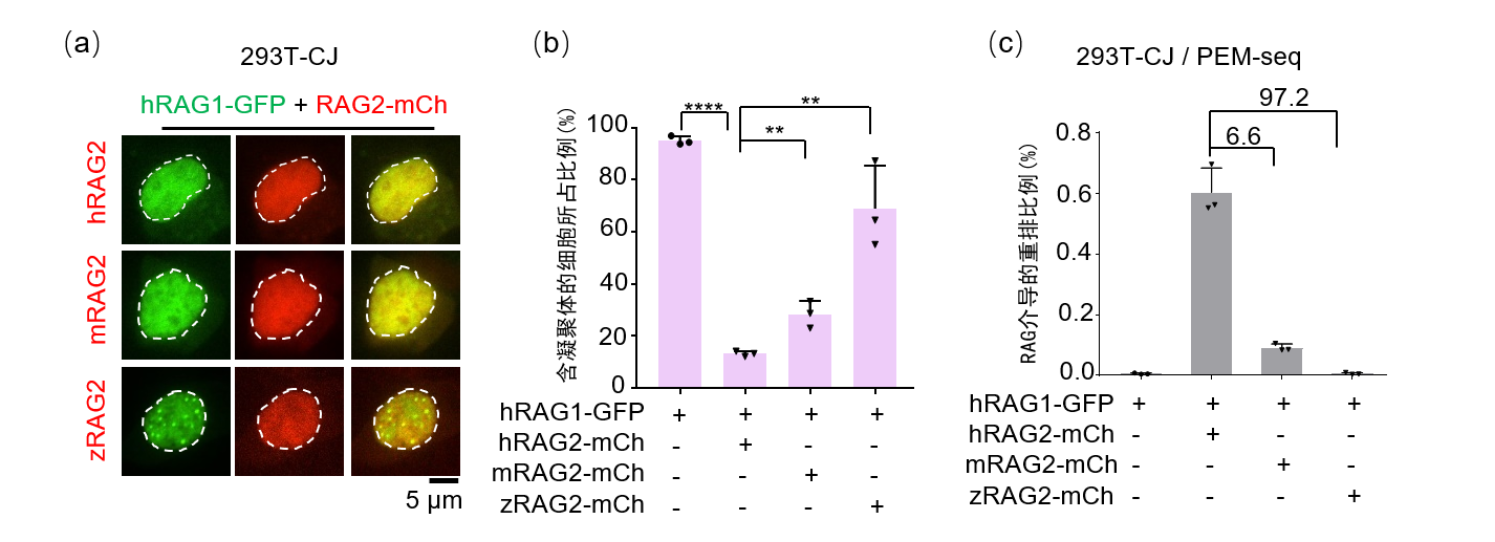
图2.不同物种RAG2对人RAG1凝聚状态的调控
综上所述,该研究发现了人淋巴细胞中RAG1的凝聚体现象以及RAG2参与RAG复合物活性调控的作用机制,论文最后使用“越狱”模型来对该作用机制进行更形象的描述,即在S/G2/M时期,细胞内的RAG1依赖于自身的结构特征或是在细胞核内无膜细胞器(如核仁)等的帮助下,在细胞核内以凝聚体的形式存在。该凝聚体像“监狱”一样,将重排酶RAG1与基因组上的RSS底物隔绝开来,而当细胞进入G1期,细胞内游离存在的RAG2通过直接结合到RAG1的表面,将RAG1从凝聚体“监狱”中释放出来,形成游离态的RAG复合体从而起始淋巴细胞内的V(D)J重排事件,维持了淋巴细胞的正常生理过程。
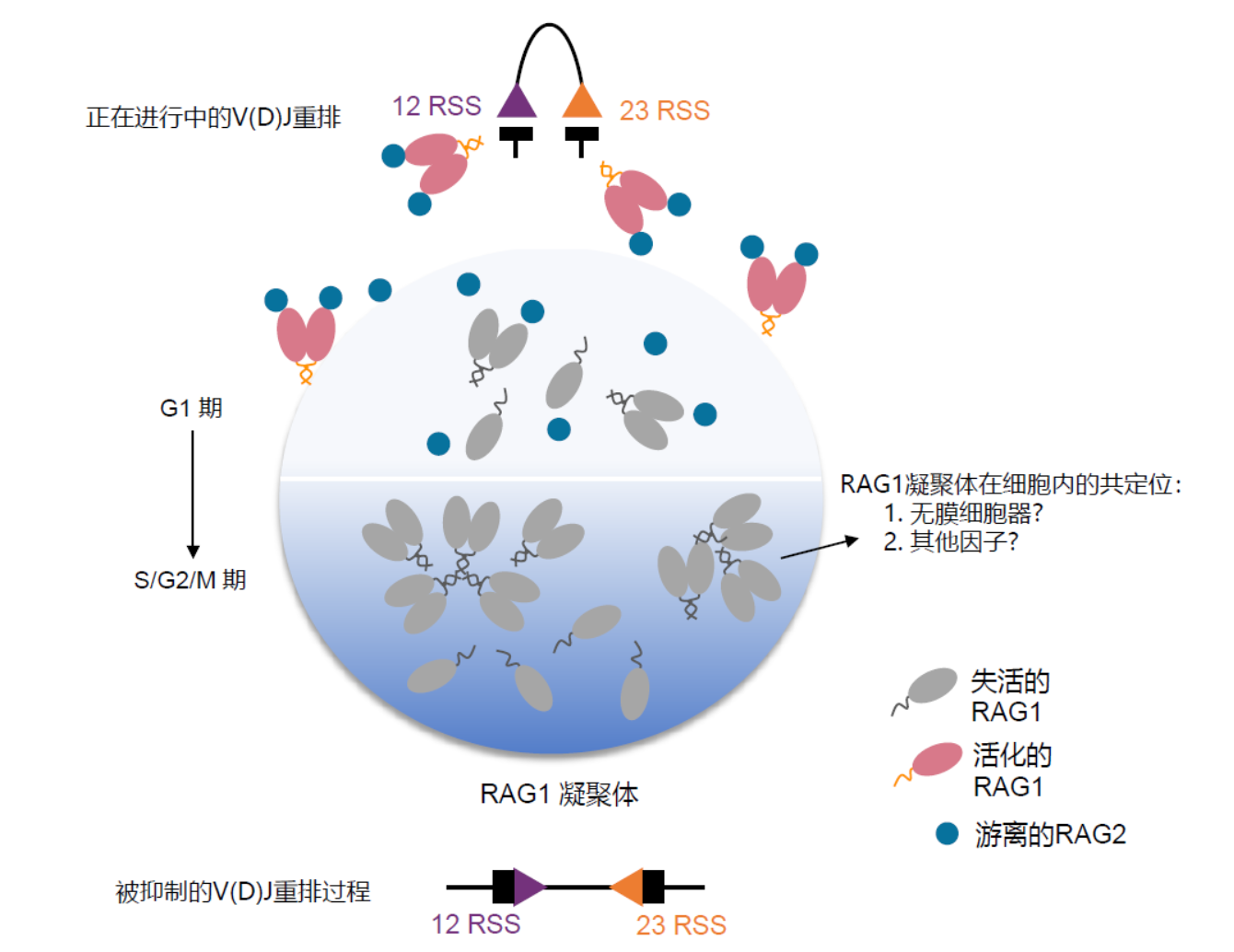
图3.淋巴细胞内重排酶RAG1活性调控的“越狱”模型
胡家志为该论文的通讯作者。博士研究生甘婷婷为论文的第一作者。博士研究生王渝鸿,博士后刘阳在该工作中亦有重要贡献。该论文还得到了耶鲁大学医学院David Schatz院士的支持和帮助。该工作得到了北大-清华生命科学联合中心、科技部国家重点研发计划、国家自然科学基金、细胞增殖与分化教育部重点实验室以及生命科学学院仪器中心(成像平台及流式平台)的大力支持。
参考文献:
1.Alt, F.W., Zhang, Y., Meng, F.L., Guo, C., and Schwer, B. (2013). Mechanisms of programmed DNA lesions and genomic instability in the immune system. Cell 152, 417–429.
2.Oettinger, M.A., Schatz, D.G., Gorka, C., and Baltimore, D. (1990). RAG-1 and RAG-2, adjacent genes that synergistically activate V(D)J recombination. Science 248, 1517—1523.
3.Schatz, D.G., Oettinger, M.A., and Baltimore, D. (1989). The V(D)J recombination activating gene, RAG-1. Cell 59, 1035–1048.
4.Lin, W.C., and Desiderio, S. (1993). Regulation of V(D)J recombination activator protein RAG-2 by phosphorylation. Science 260, 953–959.
5.Lin, W.C., and Desiderio, S. (1994). Cell cycle regulation of V(D)J recombination-activating protein RAG-2. Proc. Natl. Acad. Sci. U. S. A. 91, 2733–2737.
