用于基因组编辑的CRISPR-Cas9系统的发展改变了生命科学研究的方式,同时也为疾病的治疗以及生物技术的发展带来了巨大潜力。然而其脱靶活性一直制约着其在临床治疗上的进一步应用,同时在基因组编辑过程中产生的染色体异常结构,包括染色体大片段缺失和易位也是目前临床应用的一大障碍,近期也引起了许多实验室的关注。作者首先在2019年发表的PEM-seq实验方法的基础上,利用其新开发的生物信息分析工具PEM-Q对Cas9编辑后的产物,副产物进行了全面且定量的评估。PEM-Q检测到大量有害的DNA修复产物,以小鼠CH12F3细胞中c-Myc位点为例,有近3%的大片段缺失(>100bp)、近1%的载体整合和近3%的染色体易位。同时作者进一步探究了这些产物产生的机制,发现大片段缺失主要依赖于切割位点附近的微同源序列,载体整合则与载体的脆弱性相关,而脱靶或其他反复出现的DNA断裂则主导了染色体易位。以上发现为基因组编辑的安全性提供了除脱靶效应之外的另一个维度,为基因编辑工具的递送方式提供指导。

图1.PEM-Q全面揭示基因编辑产物规律。(A) PEM-Q检测基因编辑产物类型;(B) 不同DNA修复蛋白缺失背景下,在CH12F3细胞c-Myc位点Cas9编辑时各产物的定量。
为了减少SpCas9的脱靶活性及拓宽其靶向范围,该领域工作者开发出了多种SpCas9变体。作者进一步利用PEM-seq/PEM-Q方法,对现今常用的8种SpCas9高保真变体(eSpCas9, FeCas9, HF1, Hypa, evo, HiFi, LZ3, Sniper ) 以及4种靶向范围更广泛的广域编辑变体(xCas9, Cas9-NG, SpG, SpRY)的切割活性,脱靶情况和基因组不稳定性进行了系统且定量的评估。作者发现广域编辑变体具有更加严重脱靶活性和切割自身表达载体的现象(图2A,2C)。近乎无PAM序列限制的SpRY在靶向RAG1位点时,检测到了188个脱靶位点,其脱靶活性让人惊叹。此外,作者使用了一套深度学习的模型来预测SpRY脱靶情况,发现在所有脱靶位点中前15个和67/80个预测的位点都是真正的脱靶位点(图2B)。最后作者将SpRY与三个高保真SpCas9变体结合起来,产生了三个同时具有高保真和广泛编辑范围的新型变体(图2D)。
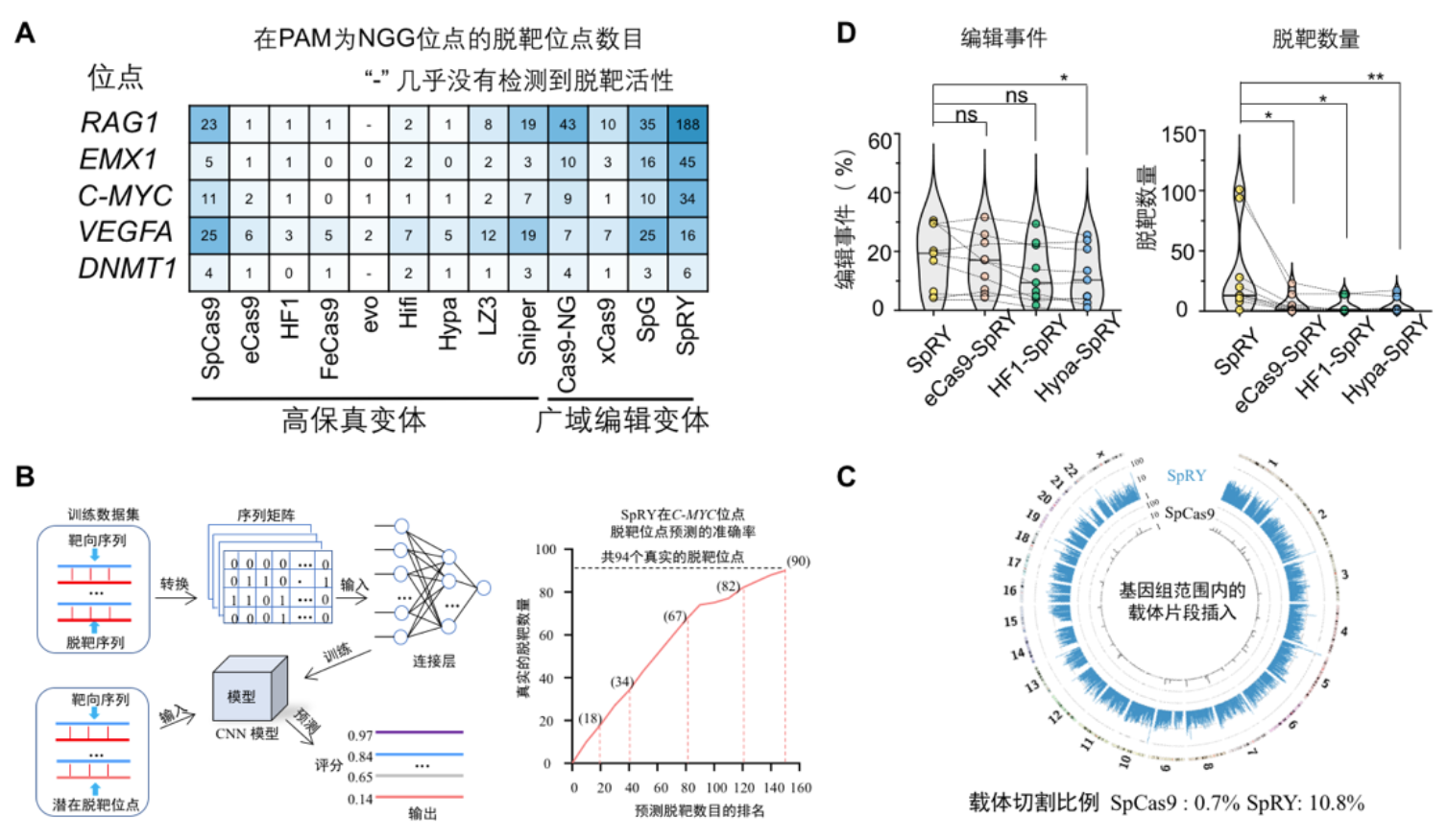
图2. 利用PEM-seq评估Cas9变体。(A) Cas9变体脱靶位点的数目;(B) 利用深度学习模型预测SpRY的脱靶位点;(C) SpRY切割自身表达质粒载体并造成大量外源片段插入基因组中;(D) SpRY与三个高保真SpCas9变体结合,降低脱靶活性。
总的来说,这两篇文章的工作系统地评估了CRISPR-Cas9编辑过程中的DNA修复产物并阐述其影响机制,提示我们基因编辑时抑制非同源末端连接(NHEJ)的潜在诱变危险。全面评估多种SpCas9变体的切割活性和特异性,促进这些变体在合适的基因编辑背景下的应用。同时,这两项工作的研究结果提示Cas9的安全性评估不应仅局限于脱靶效应,靶位点大片段的删除和染色体结构变异也应该得到重视。最后,研究结果提示染色体异常结构不能通过使用SpCas9高保真变体来减弱,而以往通过抑制DNA损伤修复通路来增强同源重组效率的方式也并不可取。所以目前亟需寻找一种既可以保持基因编辑工具编辑活性又能有效降低脱靶活性和染色质结构变异的基因编辑工具。这样,才能使基因编辑工具更广泛、更安全地应用于临床。
北京大学胡家志研究员为两篇文章的通讯作者。第一篇文章中,博士研究生刘孟竺、张微微、辛昌昌为共同第一作者。第二篇论文中,张微微为共同第一作者,尹健行为共同第一作者兼共同通讯作者。张丁峥嵘、尚雅芳、王渝鸿、艾晨、李嘉欣在这些工作中亦有重要贡献。该研究还得到了上海生化所孟飞龙研究员的支持与合作。该研究得到了北大-清华生命科学联合中心、科技部国家重大研发计划、国家自然科学基金、细胞增殖与分化教育部重点实验室以及生命科学学院仪器中心流式平台的大力支持。
